Introducción
Cucurbita pepo y Cucurbita moschata, se consideran las dos especies del género Cucurbita de mayor importancia agrícola y comercial en el mundo (OECD, 2016). Por su valor nutricional pueden ser incluidas en iniciativas de programas para la mejora de la salud pública a nivel mundial, considerándose una alternativa para afrontar los retos de la insuficiencia alimentaria y hacer frente a la creciente demanda de alimentos con altos aportes nutrimentales (Wan Shafiin et al., 2021).
En el mundo, se cosechan más de 23 millones de toneladas de calabazas por año (FAOSTAT, 2023). México, representa el 2.6% de la producción a nivel mundial (Alvarado-Camarillo, Aguilar, Cepeda, Rubí y Pineda, 2021). Un aspecto relevante en la producción de calabazas en el mundo es proponer prácticas eficientes en el manejo nutricional y agronómico del cultivo de Cucurbita pepo y Cucurbita moschata generando un mayor desarrollo, rendimiento y mejora en sus diversos aspectos agronómicos. Además, de contribuir con la reducción de insumos químicos (fertilizantes inorgánicos) (Sedano-Castro et al., 2011; Aguilar-Carpio, Cervantes, Sorza y Escalante, 2022). En estudios anteriores, autores como Soriano-Melgar, Izquierdo, Saucedo y Cárdenas (2020), mediante el uso de bioestimulantes y reguladores del creciente vegetal, mejoró la calidad del fruto (color, peso, diámetro, pH) y el contenido nutraceútico de la calabacita italiana “Grey Zucchini.” Asimismo, Golob et al. (2020), determinaron, que el manejo en la fertilización de C. moschata, influye en la traslocación de elementos minerales como Selenio y Yodo. Reflejándose en la acumulación en diferentes partes de la planta. En este contexto, mediante el manejo de la fertilización de cultivos para enriquecer el suelo, se puede mejorar la biodisponibilidad de minerales del suelo e incrementar la absorción y movilidad de minerales hacia el tejido vegetal para una mejor redistribución en la planta (Upadhayay, Singh, Khan, Lohani y Singh, 2019).
Los hongos micorrícicos arbusculares (HMA), constituyen un importante componente de los suelos y clave en los diferentes procesos bioquímicos que lo conforman (Tedersoo, Bahram y Zobel, 2020). Los HMA se han considerado como un potencial bioestimulante de la nutrición mineral y crecimiento vegetal de los cultivos agrícolas. Incrementando la eficiencia fisiológica y mejorando su respuesta a condiciones adversas (Berruti, Lumini, Balestrini y Bianciotto, 2016). Por lo tanto, pueden tomarse en cuenta como una alternativa para contribuir con la sostenibilidad agroalimentaria y la creciente demanda de alimentos de calidad (Upadhayay et al., 2019). Estudios previos, han reportado el efecto directo de la inoculación de HMA con el incremento en la productividad de hasta un 50% en peso y tamaño del fruto de tomate (Alvarado-Carrillo, Díaz y Peña del Río, 2014; Di Martino, Fioretto, Palmieri, Torino, y Palumbo, 2019) y chile pimiento (Díaz-Franco, Alvarado, Ortiz y Grageda, 2013). Asimismo, se han registrado mayor calidad nutracéutica en pepino (López-Morales, Leos, Alfaro y Morales, 2022). Además, de un incremento en la acumulación de minerales en la biomasa vegetal de diferentes hortalizas (Lehmann y Rillig, 2015).
Recientemente autores han registrado la afinidad micorrícica con el género Cucurbita, reportando un efecto estimulante en el cultivo e incremento en diversos rasgos agronómicos (crecimiento morfológico y rendimiento del fruto), comparándola con un manejo de fertilización convencional (Díaz-Franco, Alvarado, Alejandro y Ortiz, 2016; Alvarado-Carrillo, Díaz y Alejandro, 2018). Con lo anterior, el objetivo del estudio fue evaluar la influencia de la inoculación micorrícica arbuscular nativa y comercial en un cultivo de C. moschata y C. pepo, var. “Grey Zucchini”, sobre las variables de crecimiento morfológico (altura por ancho de la planta, grosor de tallo, número de brotes florales y flores), calidad de cosecha (número de frutos, peso, diámetro ecuatorial y polar) y postcosecha (atributos físicos y químicos) del fruto.
Materiales y Métodos
Localización del estudio
Las parcelas experimentales se establecieron en el área de producción agrícola del Tecnológico Nacional de México (TECNM), Campus Tizimín, Yucatán, México. Precedente al establecimiento de los cultivos experimentales se desarrolló una descripción físico-química del suelo (Cuadro 1). El sitio experimental presentó un previo manejo de barbecho (con antigüedad de 6 años). La vegetación se caracterizó por vegetación secundaria, predominando vegetación pionera (fabáceas, gramíneas, etc.) y un previo establecimiento de árboles de mamey (Mammea americana) y pasto brizantha (Brachiaria brizantha).
Table 1: Soil analysis preceding the establishment of the experimental plots.
| Da | Porosidad | Textura | M.O. | pH | CE |
|---|---|---|---|---|---|
| g cm-3 | % | % | ds m-1 | ||
| 0.88±0.10 | 68.56±1.10 | FL | 9.48±0.54 | 7.44±0.12 | 1.06±0.13 |
† Da = densidad aparente; M.O. = materia orgánica; pH = potencial de hidrogeno; CE = conductividad eléctrica; FL = franco Limoso. Medias ± Desviación estándar. ‡ La caracterización del suelo se realizó en el Laboratorio de Análisis, Suelo, Planta y Agua (LASPA) del TECNM, Campus Tizimín.
† Da = bulk density; M.O. = organic matter; pH = hydrogen potential; EC = electrical conductivity; FL = silt loam. Means ± standard deviation. ‡ Soil characterization was performed at the Laboratory of Analysis, Soil, Plant and Water (LASPA) of TECNM, Campus Tizimín.
Método de inoculación micorrícico
Se emplearon semillas criollas de Cucurbita pepo, var. “Grey Zucchini”, HYDRO ENVIROMENT® y semillas nativas de Cucurbita moschata, provenientes del banco de germoplasma nativo del TECNM, Campus Tizimín. Para la inoculación micorrícica se empleó el método de siembra de esporas en semillero (Sieverding, 1990). Se emplearon charolas de 77 cavidades (120 gramos) a una concentración de 60 esporas por tratamiento. Se usó sustrato orgánico como medio de cultivo sólido a una relación 60-40 v/v (suelo estéril-Peat Mose). La esterilización del sustrato (suelo y Peat Mose) se realizó por medio de autoclave a 120 °C por 90 minutos (Giampaoli, Brandan, Enrico, Coll y Lencina, 2014).
Diseño de las parcelas experimentales
Para el establecimiento de los cultivos se utilizó un diseño experimental de parcelas divididas con dos parcelas mayores (C. moschata y C. pepo) con seis grupos experimentales conformada con 14 repeticiones cada uno (Cuadro 2). Cada parcela experimental presentaba dimensiones de 300 metros cuadrados.
Table 2: Description of the experimental groups of the study.
| ID | Tratamiento | Composición |
|---|---|---|
| T1 | Cepa nativa de HMA (sistema agrícola) + 50 % de fertilización química (80N-50P-80K) | 60 esporas/33 g de suelo |
| T2 | Cepa nativa de HMA (sistema multiporpóposito) + 50 % de fertilización química (80N-50P-80K) | 60 esporas/25 g de suelo |
| T3 | Cepa nativa de HMA (vegetación secundaria) + 50 % de fertilización química (80N-50P-80K) | 60 esporas/17 g de suelo |
| T4 | Cepa comercial de HMA (GLUMIX, BIOKONEE®) + 50 % de fertilización química (80N-50P-80K) | 60 esporas/1.4 g de suelo del producto comercial |
| T5 | 100 % de fertilización química (160N-100P-160K) | ----- |
| CN | Sin inoculación-Sin fertilización | ----- |
T = tratamiento; CN = control negativo.
T = treatment; NC = negative control.
Manejo Agronómico del Cultivo
Los cultivos se establecieron en el ciclo octubre-diciembre y octubre-enero de 2022, a 14 y 16 días después de la siembra (DDS) para C. pepo, var. “Grey Zucchini” y C. moschata, respectivamente. Su trasplante se realizó en pocetas (20 cm de profundidad), a distancia de 1 m × 1 m (planta/surco). Trasplantando 84 plantas por especie (parcela). La aparición de los brotes florales de C. pepo y C. moschata, inicio a los 44 y 51 DDS, la floración a los 51 y 58 DDS, la etapa de fructificación y cuaje inicio a los 57 y 72 DDS, realizando cortes cada 5-7 días hasta el término del cultivo, 78 y 100 DDS. El manejo agronómico de los cultivos consistió en una fertilización inorgánica, 160N- 90P -160K (Alvarado-Carrillo et al., 2018), cada 20-30 días durante todas fases fenológicas de los cultivos, empleando el método drench (Pérez, 2021). Complementariamente, se aplicó en dosis de 250 mL, IONGRO-COMPLEX-zinc, 4.85%; hierro, 4.30%; azufre, 5.79%; magnesio, 1.30%; manganeso, 0.30%; cobre, 0.06%; boro, 0.88%; molibdeno, 0.02% y cobalto, 0.01% (p/v). Los micronutrientes se aplicaron a T1, T2, T3, T4 y CP, al momento de trasplante, desarrollo vegetativo, floración y fructificación. El riego se realizó por goteo (500 mL por planta-1) cada dos días. Se monitorearon las condiciones agroclimáticas por medio de un Termómetro Higrómetro KAMYSEN®, registrando una temperatura promedio máxima de 30.77, mínima de 21 °C, humedad relativa de 68.65%. La precipitación pluvial durante todo el ciclo del cultivo se registró de 96.7 milímetros (CONAGUA, 2022).
Variables del potencial micorrícico
Se desarrolló un muestreo destructivo previo al trasplante (semillero) y término del cultivo (campo) para ambas especies inoculadas con cepas de HMA. Seleccionando diez segmentos de raíces al azar y diez muestras de suelo rizosférico (100 g) por tratamiento. Se empleó un microscopio LEICA DM4000® a una visión de 40 × (0.10 mm E=0.01 m) para visualizar las estructuras fúngicas. Para la densidad de esporas se usó un protocolo de tamizado en húmedo y centrifugación en solución de sacarosa al 60% (Gerdemann y Nicolson, 1963), cuantificándolas por el método de cuadrantes (Sieverding, 1990). El porcentaje de colonización se calculó por el protocolo de aclarado y tinción de raíces propuesto por Phillips y Hayman, (1970), modificado por Koske y Gemma (1989). Para la determinación del porcentaje de colonización se utilizó el método de Newman (1966).
Variables del cultivo
Crecimiento morfológico: Se realizaron cada siete días mediciones morfológicas de los cultivos evaluados. Las variables morfológicas tomadas en planta fueron: altura de la planta (cm), grosor del tallo (cm), número de brotes florales (#) y flores masculinas/femeninas (#).
Calidad de cosecha del fruto: Se caracterizaron los frutos de acuerdo con la propuesta de Esquinas-Alcazar y Gulick (1983). Tomando en cuenta los siguientes datos: Número de frutos por planta (#), peso fresco del fruto por corte (g), diámetro polar (cm) y diámetro ecuatorial (cm). Adicionalmente, se clasificaron los frutos a nivel comercial. Para C. moschata: Rezaga (< 10 cm), pequeños (< 20 cm); mediano (20-39 cm) y grande (40-50 cm) (Gordillo-Manssur, Cos y Romero, 2018). Para C. pepo, “Grey Zucchini”: Calidad nacional (12-15 cm); calidad exportación (16-25 cm) y rezaga-pequeños (< 12 cm) (Sedano-Castro, et al., 2011; Ayala-Tafoya et al., 2020). El pesaje y diámetro de los frutos fueron cuantificados empleando una báscula digital GUTSTARK® y un vernier digital 6’’ DASSCUA®.
Variables de calidad postcosecha del fruto
Se seleccionaron por tratamiento 18 frutos al azar (n = 108 por especie), con madurez fisiológica, durante el primer corte de su cosecha.
Color. La colorimetría de la cáscara y pulpa se desarrolló por medio del modelo CIE L*a*b*, empleando un colorímetro espectral CR-30, determinando los parámetros de luminosidad (L*), coordenadas rojo/verde (a*) y coordenadas amarillo/azul (b*) (Soriano-Melgar et al., 2020).
Grosor de la cáscara. Para determinar el grosor de la cáscara se empleó un vernier digital 6” DASSCUA®. Tomando en cuenta sólo el endocarpio de la fruta (Esquinas-Alcazar y Gulick, 1983).
Textura (firmeza). Se empleó un texturimetro EZ TEST, SHIMADZU®, a una velocidad de ensayo de 10 cm min-1, profundidad de desplazamiento de 10 mm. Expresando su fuerza máxima en Newton (N) con escala total de 500 N. Los datos se colectaron con compresión hacia abajo, tomando los datos en la zona ecuatorial del fruto (Moreno et al., 2023).
Porcentaje de humedad. Se determinó por el método de estufa de vacío de la NMX-F-083-1986 (1986) el porcentaje de pérdida de humedad de las muestras. Se colocaron 5 g de muestra fresca en crisoles previamente a peso constante. Las muestras fueron colocadas en una estufa de secado OVEN® (OV-12) a 105 °C por 24 h. Se colocaron en un desecador hasta alcanzar temperatura ambiente. La fórmula para calcular el % de humedad:
Donde, P = crisol + muestra húmeda (g), P1 = crisol + muestra seca (g); P2 = peso de la muestra (g).
Porcentaje de cenizas. De acuerdo con la NMX-F-066-S-1978 (1978), se determinó el contenido mineral de las muestras, empleando el método de calcinación en mufla. El procedimiento para determinar cenizas se realizó por medio de una calcinación de la muestra a 540 °C × 30 minutos. Posteriormente, a incineración en una mufla FELISA® a 600 °C × 3 horas. La fórmula para calcular el % de ceniza:
Donde: P = crisol + cenizas (g), p = crisol vacío (g) y M = muestra (g).
Potencial de hidrógeno (pH). Se desarrollo el método de potenciometría empleando el protocolo de NMX-F-317-S-1978 (1978), El pH se determinó en 10 g de muestra macerada + 50 mL de agua destilada, empleando un potenciómetro digital RedLemon® para la toma de datos.
Acidez titulable (AT). El contenido de ácidos orgánicos se determinó por medio del método de titulación según la NMX-F-102-S-1978 (1978), expresándose en mg de ácido cítrico 100 g-1 de muestra. Se colocaron 100 g de muestra en 500 mL de agua destilada. Posteriormente, se filtra la solución sobrenadante, tomando una alícuota de 10 mL+0.3 mL de fenolftaleína al 1%, titulando la solución 0.01 N de NaOH. Se emplea la ecuación:
Sólidos solubles totales (SST). El contenido de azúcar se determinó por refractometría, empleando un refractómetro manual de precisión 0.05%, SELSE-043. Los datos se tomaron a partir de una gota de la pulpa según la NMX-F-103-1982 (1982), expresados en °Brix (g de azúcar por 100 g de muestra).
Resultados y Discusión
Potencial micorrícico
La calabaza Cucurbita moschata, fue el hospedero de HMA más infectivo en el estudio. En ambos cultivos, se observaron diferencias estadísticas con relación a la densidad de esporas y colonización micorrícica. Donde, el T4 (GLUMIX®), representó el grupo experimental con mayor presencia de esporas de HMA (>30 esporas de HMA/g-10 de suelo) y porcentaje de colonización micorrícica (> 70%) en grado 4 (Trouvelot, Fardeau, Plenchette, Gianinazzi y Gianinazzi, 1986). Aunque su tendencia en multiplicación fue menor al 5% en C. pepo y decreció un 12.8% en C. moschata. Por su parte, la colonización micorrícica incremento un 12.3% en C. pepo y 4.8% en C. moschata desde su inoculación en semillero (Cuadro 3). En contraste, la multiplicación de esporas de HMA nativas representó la de mayor tasa de multiplicación micorrícica. El T3 en calabacita, registró un incremento del 17.13% en colonización y 5.47% en densidad de esporas. Asimismo, en C. moschata, se incrementó un 5.47% la colonización micorrícica (Cuadro 3).
Cuadro 3: Número de esporas de micorrizas arbusculares (g-10) en suelo rizosférico de Cucurbita pepo, var. “Grey Zuchinni” y Cucurbita moschata, en semillero y en condiciones de campo.
Table 3: Number of arbuscular mycorrhizal spores (g-10) in rhizospheric soil of Cucurbita pepo, var. “Grey Zuchinni” and Cucurbita moschata, in seedbeds and in field conditions.
| ID | Colonización micorrícica (%) | Número de esporas (10g suelo-1) | ||
|---|---|---|---|---|
| Semillero | Campo | Semillero | Campo | |
| 14 DDS | 78 DDS | 16 DDS | 100 DDS | |
| Cucurbita moschata | ||||
| T1 | 35±9 b | 42.83±4.22 c | 18±7 c | 15.29±2.81 bc |
| T2 | 49.3±13 ab | 51.33±2.42 b | 21±8 b | 18.00±3.37 b |
| T3 | 50.7±10 ab | 56.17±5.98 b | 32±6 ab | 20.86±4.53 b |
| T4 | 72.7±5 a | 77.50±4.37 a | 50.3±8 a | 37.57±6.80 a |
| T5 | 31.50±5.65 d | 10.86±3.34 c | ||
| CN | 41.33±4.18 c | 10.43±3.60 c | ||
| Cucurbita pepo var. “Grey Zuchinni” | ||||
| T1 | 29.7±10 b | 36.50±3.21 cd | 16.7±8 b | 18.14±5.58 b |
| T2 | 34.7±9 ab | 39.17±3.92 c | 17.7±3 b | 24.57±4.89 b |
| T3 | 37.7±3 ab | 54.83±3.82 b | 19±4 b | 24.00±4.08 b |
| T4 | 58.7±14 a | 71.00±4.00 a | 38±2 a | 41.00±4.62 a |
| T5 | 29.83±6.65 d | 9.71±2.69 c | ||
| CN | 43.17±4.75 c | 10.57±3.51 c | ||
T1 = cepa nativa 1 de HMA (sistema agrícola) +50 % de fertilización química; T2 = cepa nativa 2 (sistema multipropósito) de HMA+50% de fertilización química; T3 = cepa nativa 3 (vegetación secundaria) de HMA+50% de fertilización química; T4 = cepa comercial (GLUMIX®) +50% de fertilización química; T5 = 100% de fertilización química (160 N-100 P- 160 K); CN = sin inoculación-fertilización. † Medias± desviación estándar. ‡ Letras comunes sin diferencias estadísticas. § La evaluación de la densidad de esporas de hongos micorrizícos arbusculares se realizó en el laboratorio de suelos del Instituto Politécnico Nacional, Centro Interdisciplinario de Investigación para el Desarrollo Integral regional (CIDIR), Unidad Oaxaca, Oaxaca de Juárez, Oaxaca, México.
T1 = native AMF strain 1 (agricultural system) +50% chemical fertilization; T2 = native strain 2 (multipurpose system) of AMF+50% chemical fertilization; T3 = native strain 3 (secondary vegetation) of AMF+50% chemical fertilization; T4 = commercial strain (GLUMIX®) +50% chemical fertilization; T5 = 100% chemical fertilization (160 N-100 P- 160 K); CN = without inoculation-fertilization. † Means± Standard deviation. ‡ Common letters without statistical differences. § The evaluation of the spore density of arbuscular mycorrhizal fungi was carried out in the soil laboratory of the National Polytechnic Institute, Interdisciplinary Research Center for Regional Integral Development (CIDIR), Oaxaca Unit, Oaxaca de Juárez, Oaxaca, Mexico.
La tendencia de propagación micorrícica nativa observadas en el estudio, concuerda con lo reportado por Esquivel-Quispe, Quispe y Hernández (2021), al determinar que los inóculos nativos de hongos micorrícicos arbusculares reflejan un mayor potencial de multiplicación y prevalencia en condiciones de campo abierto. Al estar previamente adaptados a un ambiente especifico y condiciones edáficas adversas.
Crecimiento vegetativo del cultivo
Las variables de crecimiento morfológico del cultivo nos indican una falta de diferencias significativas con relación a la altura de la planta, grosor del tallo, número de brotes florales y flores. No obstante, aritméticamente, el T5 (100% de fertilización química), registró los valores con mayor tasa de crecimiento cinético en los cultivos. Seguido de T4 (GLUMIX®) y T2 (cepa nativa de HMA) (Cuadro 4). La falta de variaciones estadísticas en el estudio nos permite inferir que el manejo agronómico de los tratamientos con inoculación micorrícica + 50% de fertilización química, representó el manejo agronómico más rentable, al reducir en un 50% la fertilización sintética. Sin afectar los índices y valores en su desarrollo fenológico y producción (Alvarado-Carillo et al., 2018; Aguilar-Carpio et al., 2022).
Cuadro 4: Variables de crecimiento del cultivo de Cucurbita moschata y Cucurbita pepo, var. Grey Zuchinni.
Table 4: Growth variables of the Cucurbita moschata and Cucurbita pepo, var. “Grey Zuchinni”.
| ID | Altura por ancho | Grosor | Brotes florales | Flores |
|---|---|---|---|---|
| cm | mm | # | # | |
| Cucurbita moschata | ||||
| T1 | 165.67±112.09 a | 10.05±4.07 a | 11.43±5.16 a | 8.86±5.05 a |
| T2 | 167.08±121.05 a | 10.64±4.56 a | 12.75±5.20 a | 8.38±4.90 a |
| T3 | 165.67±121.68 a | 10.13±4.31 a | 13.00±5.15 a | 9.00±4.41 a |
| T4 | 176.92±129.06 a | 10.38±3.99 a | 13.25±4.89 a | 9.25±4.53 a |
| T5 | 178.58±139.17 a | 10.43±5.13 a | 13.38±5.10 a | 9.88±4.61 a |
| CN | 160.42±119.27 a | 9.47±4.36 a | 12.-13±4.97 a | 6.88±4.19 a |
| Cucurbita pepo, var. “Grey Zuchinni” | ||||
| T1 | 75.33±38.62 a | 8.90±3.37 a | 8.67±3.93 a | 5.33±4.13 a |
| T2 | 79.22±46.27 a | 8.69±3.37 a | 12.00±4.00 a | 8.00±5.80 a |
| T3 | 79.78±46.27 a | 9.33±3.59 a | 11.00±3.95 a | 7.83±5.08 a |
| T4 | 86.88±53.95 a | 8.75±3.61 a | 11.20±3.35 a | 7.60±5.73 a |
| T5 | 88.56±60.13 a | 8.52±3.59 a | 11.17±3.49 a | 8.67±5.61 a |
| CN | 65.67±41.67 a | 8.34±3.46 a | 9.00±3.03 a | 7.33±4.68 a |
T1 = cepa nativa 1 de HMA (sistema agrícola) +50% de fertilización química; T2 = cepa nativa 2 (sistema multipropósito) de HMA+50% de fertilización química; T3 = cepa nativa 3 (vegetación secundaria) de HMA+50% de fertilización química; T4 = cepa comercial (GLUMIX®) +50% de fertilización química; T5 = 100% de fertilización química (160 N-100 P- 160 K); CN = Sin inoculación-fertilización. † Medias± desviación estándar. ‡ Letras comunes sin diferencias estadísticas.
T1 = native AMF strain 1 (agricultural system) +50% chemical fertilization; T2 = native strain 2 (multipurpose system) of AMF+50% chemical fertilization; T3 = native strain 3 (secondary vegetation) of AMF+50% chemical fertilization; T4 = commercial strain (GLUMIX®) +50% chemical fertilization; T5 = 100% chemical fertilization (160 N-100 P- 160 K); CN = Without inoculation-fertilization. † Means± Standard deviation. ‡ Common letters without statistical differences.
La misma aseveración es reportada por Sarhan, Mohammed y Teli, (2011) y Ayala-Tafoya et al., (2020), al determinar un efecto significativo en calabacita “Grey Zucchini” con fertilización orgánica (Azotobacter), bioestimulantes (Auxinas) y compostas, observando un mayor crecimiento vegetativo (longitud, grosor del tallo, clorofila foliar y biomasa seca en follaje), en comparación a grupos experimentales con fertilización sintética.
En otros cultivos, similares respuestas se han reportado en el desarrollo de la planta y rendimientos. Díaz-Franco, Gálvez y Ortiz (2015) y Alvarado-Carillo et al. (2018), en sorgo y pepino, respectivamente, indicaron que la inoculación micorrícica juega un papel clave en la biodisponibilidad de nutrientes en suelo, permitiendo aportes importantes de minerales hacia la planta, compensando la reducción en un 50% de su fertilización inorgánica. Sharma, Reddy y Adholeya (2011) en trigo, han reportado los efectos de la inoculación micorrícica, con una reducción del 75% de la fertilización inorgánica, con rendimientos similares en comparación a dosis convencionales de N-P-K. Lo que implicaría una competitividad entre el uso de biofertilizantes con la fertilización química, considerándose una alternativa de rentabilidad agrícola, al reducir el uso de fertilización convencional, altos costo y los riesgos medioambientales.
Calidad del fruto
Para las dos especies evaluadas se presentaron diferencias estadísticas en peso del fruto al corte, diámetro polar y ecuatorial, en C. pepo (< 0.0001, < 0.0002 y < 0.0001) y C. moschata (< 0.0001, < 0.0002 y < 0.0001). El T5, representa el tratamiento con mayor rendimiento (número de frutos, peso y tamaño del fruto), seguido de T4 (GLUMIX®) y T3 (inoculación de HMA nativa). Los tratamientos con inoculación micorrícica de HMA comerciales o nativos, registraron un peso promedio de 333.9 g por fruto en C. pepo y 555.6 g para C. moschata (Cuadro 5).
Cuadro 5: Rendimiento del cultivo del cultivo de Cucurbita moschata y Cucurbita pepo, var. “Grey Zuchinni”.
Table 5: Crop yield of Cucurbita moschata and Cucurbita pepo, var. “Grey Zuchinni”.
| ID | Números de fruto | Peso | Diámetro polar | Diámetro ecuatorial | |
|---|---|---|---|---|---|
| (#) | g | - - - - - - - - - - - cm - - - - - - - - - - - | |||
| Cucurbita moschata | |||||
| T1 | 11.25±3.59 a | 312.16±196.82 b | 10.10±3.06 c | 5.12±0.88 c | |
| T2 | 12.50±3.42 a | 493.42±317.52 b | 13.20±3.40 b | 5.74±0.83 bc | |
| T3 | 13.50±3.32 a | 524.09±317.12 b | 13.12±3.31 b | 6.06±1.32 ab | |
| T4 | 14.00±2.45 a | 836.95±581.68 a | 15.54±4.56 a | 6.54±1.50 a | |
| T5 | 14.50±3.11 a | 828.84±682.17 a | 15.18±5.14 ab | 6.55±1.32 a | |
| CN | 11.75±4.03 a | 507.87±301.77 b | 13.09±2.84 b | 5.72±0.91 bc | |
| Cucurbita pepo, var. “Grey Zuchinni” | |||||
| T1 | 8.00±3.00 a | 215.75±104.25 b | 14.10±1.81 a | 5.24±0.94 bc | |
| T2 | 8.67±2.31 a | 295.00±149.71 ab | 15.17±2.54 b | 5.85±1.35 abc | |
| T3 | 8.33±1.53 a | 392.32±246.31 a | 16.28±3.19 ab | 6.02±1.00 ab | |
| T4 | 10.00±2.00 a | 413.50±240.60 a | 17.92±2.87 a | 6.38±1.47 ab | |
| T5 | 9.67±1.15 a | 434.38±167.55 a | 16.41±4.16 ab | 6.17±0.49 a | |
| CN | 7.00±1.00 a | 229.33±49.44 b | 15.14±2.66 b | 5.10±0.41 c | |
T1 = cepa nativa 1 de HMA (sistema agrícola) +50% de fertilización química; T2 = cepa nativa 2 (sistema multipropósito) de HMA+50% de fertilización química; T3 = cepa nativa 3 (vegetación secundaria) de HMA+50% de fertilización química; T4 = cepa comercial (GLUMIX®) +50% de fertilización química; T5 = 100% de fertilización química (160 N-100 P- 160 K); CN = Sin inoculación-fertilización. † Medias± desviación estándar. ‡ Letras comunes sin diferencias estadísticas.
T1 = native AMF strain 1 (agricultural system) +50% chemical fertilization; T2 = native strain 2 (multipurpose system) of AMF+50% chemical fertilization; T3 = native strain 3 (secondary vegetation) of AMF+50% chemical fertilization; T4 = commercial strain (GLUMIX®) +50% chemical fertilization; T5 = 100% chemical fertilization (160 N-100 P- 160 K); CN = without inoculation-fertilization. † Means± Standard deviation. ‡ Common letters without statistical differences.
La respuesta agronómica de ambos cultivos presenta similitudes con lo reportado por otros autores. Díaz-Franco et al. (2016), determinaron en calabacita italiana asociada con HMA, una respuesta agronómica similar en altura de planta, calidad de fruto y rendimiento del cultivo, comparada a la respuesta de un cultivo con la fertilización inorgánica convencional de 120 N 90 P 0 K. Reportando un peso promedio de fruto al corte que osciló entre 160 a 230 gramos. Aguilar-Carpio et al. (2022), indicaron que la fertilización química al 50% + Rhizophagus irregularis, presentó similitud en rendimiento (peso, diámetro y largo del fruto) de calabacita italiana “Grey Zucchini” en comparación a la fertilización convencional al 100 por ciento.
Con base a la clasificación de los frutos para calidad comercial, C. moschata en cuatro cosechas registró un mayor número de frutos categorizados medianos (25-39 cm) y grandes (40-50 cm), constituyendo el 54.95% y 25.88%, respectivamente de la producción, seguido del 16.61 y 2.56% para frutos pequeños y rezaga. Por tratamiento no se presentaron diferencias significativas. No obstante, T5 (fertilización química al 100%), T3 y T4 (cepas nativas de HMA), registraron el mayor aporte de frutos de calidad comercial, clasificados como frutos medianos y grandes (Figura 1).
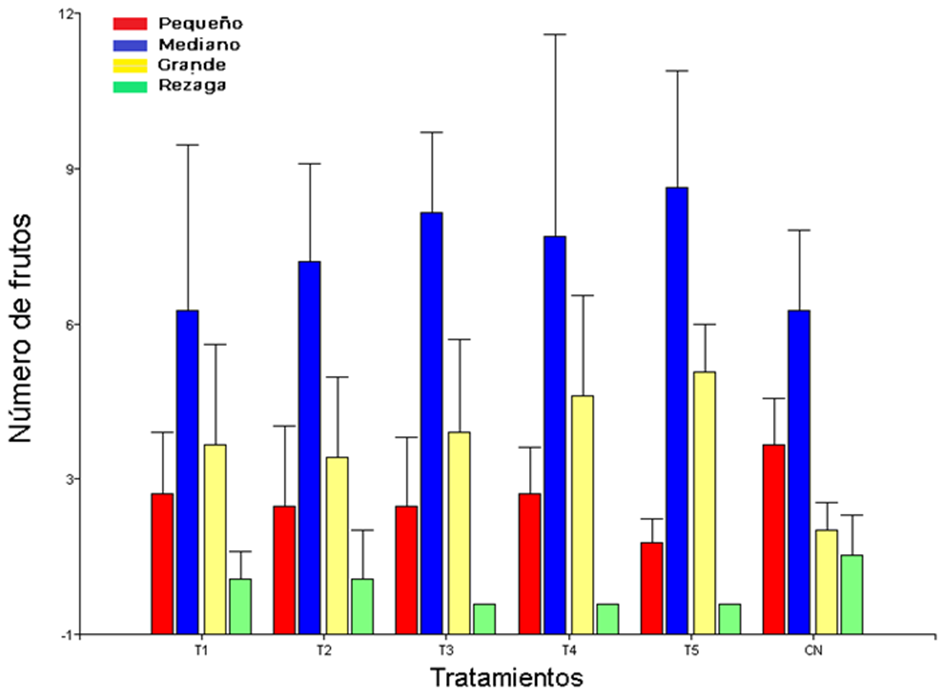
Figura 1: Clasificación comercial del fruto de Cucurbita moschata. T1 = cepa nativa 1 de HMA (sistema agrícola) +50% de fertilización química; T2 = cepa nativa 2 (sistema multipropósito) de HMA+50% de fertilización química; T3 = cepa nativa 3 (vegetación secundaria) de HMA+50% de fertilización química; T4 = cepa comercial (GLUMIX®) +50% de fertilización química; T5 = 100% de fertilización química (160 N-100 P- 160 K); CN = sin inoculación-fertilización.
Figure 1: Commercial classification of the fruit of Cucurbita moschata. T1 = native AMF strain 1 (agricultural system) +50% chemical fertilization; T2 = native strain 2 (multipurpose system) of AMF+50% chemical fertilization; T3 = native strain 3 (secondary vegetation) of AMF+50% chemical fertilization; T4 = commercial strain (GLUMIX®) +50% chemical fertilization; T5 = 100% chemical fertilization (160 N-100 P- 160 K); CN = without inoculation-fertilization.
Para C. pepo, en tres cosechas registradas, el 48.06% de frutos fue de calidad nacional (12-15 cm), 46.6% de calidad de exportación (16-25 cm) y 5.34% frutos rezaga. Asimismo, entre categorías se observaron diferencias estadísticas. Donde, el T5 y T2, representan los tratamientos con mayor aporte de frutos de calidad nacional. Asimismo, T4, registró el mayor número de calidad de exportación (Figura 2).
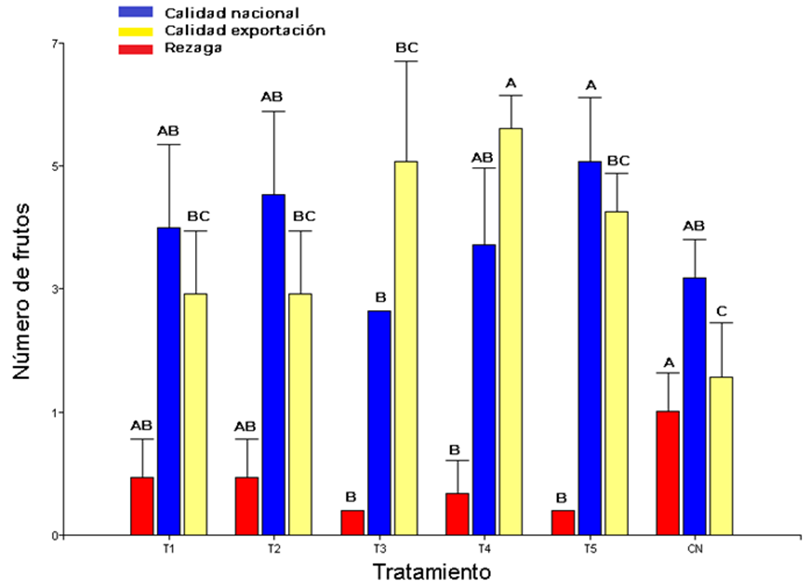
Figura 2: Clasificación comercial del fruto de Cucurbita pepo var. “Grey Zuchinni”. T1 = cepa nativa 1 de HMA (sistema agrícola) +50% de fertilización química; T2 = cepa nativa 2 (sistema multipropósito) de HMA+50% de fertilización química; T3 = cepa nativa 3 (vegetación secundaria) de HMA+50% de fertilización química; T4 = cepa comercial (GLUMIX®) +50% de fertilización química; T5 = 100% de fertilización química (160 N-100 P- 160 K); CN = sin inoculación-fertilización. † Letras comunes sin diferencias estadísticas.
Figure 2: Commercial classification of the fruit of Cucurbita pepo var. “Grey Zuchinni”. T1 = native AMF strain 1 (agricultural system) +50% chemical fertilization; T2 = native strain 2 (multipurpose system) of AMF+50% chemical fertilization; T3 = native strain 3 (secondary vegetation) of AMF+50% chemical fertilization; T4 = commercial strain (GLUMIX®) +50% chemical fertilization; T5 = 100% chemical fertilization (160 N-100 P- 160 K); CN = without inoculation-fertilization. † Common letters without statistical differences.
Para C. pepo, en tres cosechas registradas, el 48.06% de frutos fue de calidad nacional (12-15 cm), 46.6% de calidad de exportación (16-25 cm) y 5.34% frutos rezaga. Asimismo, entre categorías se observaron diferencias estadísticas. Donde, el T5 y T2, representan los tratamientos con mayor aporte de frutos de calidad nacional. Asimismo, T4, registró el mayor número de calidad de exportación (Figura 2).
De manera general, en calabacita italiana, los tratamientos con inoculación micorrícica, representaron el 31.06% de los frutos con calidad nacional y 33.98% calidad para exportación. Asimismo, en frutos de calabaza, los tratamientos con inoculación micorrícica presentaron el 54.31% de frutos con calidad comercial (frutos medianos-grandes). Por lo que se infiere un efecto directo de los beneficios de la interacción micorrícica nativa o comercial, al estimular la calidad de cosecha en relación a la longitud, ancho y peso de los frutos. Por lo contrario, el control negativo (sin inoculación, sin fertilización) presentó el mayor número de frutos en rezaga para ambas especies evaluadas. En otros cultivos, Díaz-Franco et al. (2013) y Alvarado-Carrillo et al. (2014), demostraron que la inoculación de Rhizophagus irregularis, influye en el crecimiento y engorde del fruto en tomate y chile pimiento. Ambos autores determinaron un incremento en un 30%, en relación con el grupo sin inoculación + fertilización química. Asimismo, Di Martino et al. (2019) y Arcidiacono, Pellegrino, Nuti y Ercoli (2023), han reportado un efecto positivo en la productividad en un cultivo de tomate + HMA, incrementando el peso y tamaño de los frutos hasta en un 50%, en comparación a tratamientos con un manejo convencional.
Propiedades físicas del fruto
De acuerdo con el modelo CIE L*a*b*, la cáscara y pulpa en C. moschata, solo presentan diferencias estadísticas en b* (amarillo/azul) en cascara en cáscara (P = 0.00011) y L* (luminosidad) en pulpa (P = 0001) (Cuadro 6). Con respecto a las tonalidades y matices en la colorimetría en cáscara se observan tonalidades verde-amarillo oscuro presente en los tratamientos con inoculación micorrícica y tonalidades más claras en los grupos control positivo y negativo. En relación a la pulpa, solo se registran variaciones en luminosidad con tonos más oscuros en el grupo control negativo (Figura 3). Lo anterior responde a una mayor homogeneidad entre frutos y su estado de madurez fisiológica. Las diferencias observadas se pueden relacionar al manejo agronómico de la nutrición, al observar variaciones en comparación al tratamiento sin aportaciones minerales en el suelo o aplicación de bioproductos que promuevan la fertilización o biodisponibilidad de nutrientes en el suelo (Hassan y Emam, 2015). Lo que implica que la relación de la colorimetría de un fruto está fuertemente ligada a los procesos bioquímicos de un fruto durante las etapas fisiológicas de pre- madurez, maduración y poscosecha de un fruto (Pathare, Opara y Al-Said, 2013). Canul-Ku, Ramírez, Castillo y Chávez (2005), en estudios de caracterización en Yucatán, han reportado tonalidades similares en especies nativas de C. moschata, relacionadas con la madurez fisiológica del fruto. Conforme avanza su estado de madurez fisiológica, los colores van de un amarillo oscuro hasta una coloración café-marrón. La pulpa, en su madurez presenta una tonalidad dominante de anaranjado intenso.
Table 6: Colorimetry of Cucurbita moschata and Cucurbita pepo, var. “Grey Zuchinni”.
| Cáscara | Pulpa | |||||
|---|---|---|---|---|---|---|
| ID | L* | a* | b* | L* | a* | b*. |
| Cucurbita moschata | ||||||
| T1 | 24.10±4.0 a | -2.43±0.72 a | 4.33±1.1 a | 83.30±5.1 ab | 3.77±2.20 a | 63.77±7.74 a |
| T2 | 21.27±2.7 a | -0.27±0.15 a | 0.87±0.9 bc | 80.73±3.41 b | 3.80±0.70 a | 65.30±2.95 a |
| T3 | 19.77±1.5 a | -0.6±0.50 a | 2.13±2.2 bc | 81.10±2.99 b | 2.70±0.51 a | 57.07±1.57 a |
| T4 | 22.03±0.9 a | -0.80±0.40 a | 2.23±0.15 b | 86.03±3.0 ab | 5.57±0.85 a | 64.77±3.54 a |
| T5 | 23.40±0.6 a | -1.10±0.61 a | 0.40±0.44 c | 87.53±0.8 ab | 2.27±1.36 a | 65.17±4.06 a |
| CN | 19.80±3.1 a | -0.27±0.21 a | 1.03±0.3 bc | 94.57±6.83 a | 3.57±1.98 a | 66.50±5.23 a |
| Cucurbita pepo, Var. Grey Zuchinni | ||||||
| T1 | 55.67±0.4 a | -6.03±0.75 ab | 22.03±1.8 a | 90.70±3.91 a | -1.67±0.15 b | 53.97±1.21 b |
| T2 | 39.23±2.6 c | -4.17±0.38 a | 12.57±0.6 c | 85.53±0.96 a | 0.60±0.26 a | 59.80±2.2 ab |
| T3 | 45.47±0.3 b | -4.40±0.53 a | 16.23±1.3 b | 86.90±1.90 a | 1.40±0.52 a | 61.77±1.88 a |
| T4 | 49.33±3.1 b | -5.63±1.37 ab | 16.67±0.8 b | 90.20±4.76 a | 1.33±0.91 a | 57-13±4.3 ab |
| T5 | 44.50±0.6 b | -7.23±0.45 b | 21.03±1.0 a | 91.73±3.06 a | 1.60±0.62 a | 59.83±2.30 ab |
| CN | 47.17±1.8 b | -6.60±0.42 b | 20.87±0.6 a | 91.00±1.80 a | 1.13±0.93 a | 56.60±0.7 ab |
L* = luminosidad; a* = rojo/verde; b* = amarillo/azul. T1 = cepa nativa de HMA (sistema agrícola) +50% de fertilización química; T2 = cepa nativa de HMA (sistema multipropósito) +50% de fertilización química; T3 = cepa nativa de HMA (vegetación secundaria) +50% de fertilización química; T4 = cepa comercial (GLUMIX®) +50% de fertilización química; T5 = 100% de fertilización química (160 N-100 P- 160 K). CN = sin inoculación-fertilización. † Medias± Desviación estándar. ‡ Letras comunes sin diferencias estadísticas. § La caracterización física y química de los frutos se desarrolló en el laboratorio de inocuidad y trazabilidad alimentaria del sureste, Centro de Investigación y Asistencia en Tecnología y Diseño del Estado de Jalisco (CIATEJ), Unidad sureste, Mérida, Yucatán, México.
L* = luminosity; a* = red/green; b* = yellow/blue; T1 = native AMF strain (agricultural system) +50% chemical fertilization. T2 = native AMF strain (multipurpose system) +50% chemical fertilization; T3 = native AMF strain (secondary vegetation) +50% chemical fertilization; T4 = commercial strain (GLUMIX®) +50% chemical fertilization; T5 = 100% chemical fertilization (160 N-100 P- 160 K). CN = without inoculation-fertilization. † Means± Standard deviation. ‡ Common letters without statistical differences. § The physical and chemical characterization of the fruits was developed in the Southeast Food Safety and Traceability Laboratory, Center for Research and Assistance in Technology and Design of the State of Jalisco (CIATEJ), Southeast Unit, Mérida, Yucatán, Mexico.
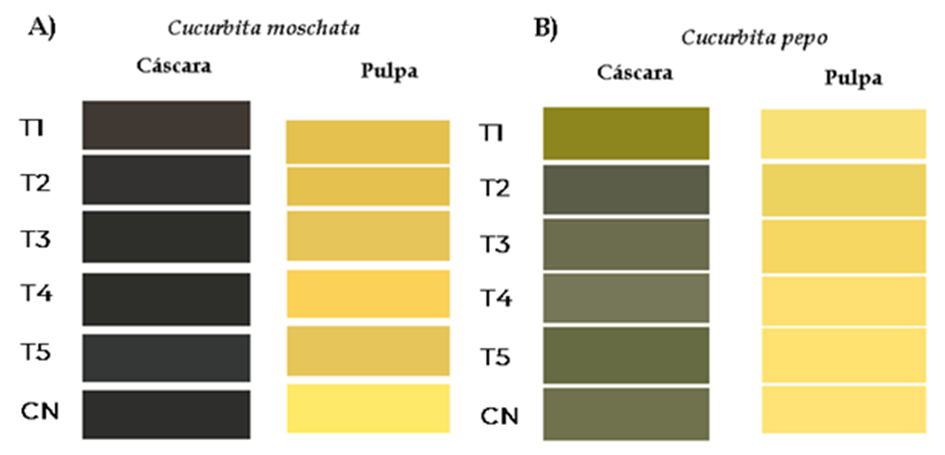
Figura 3: Representación del modelo CIE L*a*b* para la cáscara y pulpa: A) Cucurbita moschata y B) Cucurbita pepo var. “Grey Zuchinni”. T1 = cepa nativa 1 de HMA (sistema agrícola) +50% de fertilización química; T2 = cepa nativa 2 (sistema multipropósito) de HMA+50% de fertilización química; T3 = cepa nativa 3 (vegetación secundaria) de HMA+50% de fertilización química; T4 = cepa comercial (GLUMIX®) +50% de fertilización química; T5 = 100% de fertilización química (160 N-100 P- 160 K); CN = sin inoculación-fertilización.
Figure 3: Representation of the CIE L*a*b* model for the peel and pulp: A) Cucurbita moschata and B) Cucurbita pepo var. “Grey Zuchinni”. T1 = native AMF strain 1 (agricultural system) +50% chemical fertilization; T2 = Native strain 2 (multipurpose system) of AMF+50% chemical fertilization; T3 = native strain 3 (secondary vegetation) of AMF+50% chemical fertilization; T4 = commercial strain (GLUMIX®) +50% chemical fertilization; T5 = 100% chemical fertilization (160 N-100 P- 160 K); CN = without inoculation-fertilization.
En C. pepo, se observan variaciones estadísticas en los parámetros de grosor (P = 0.0126), textura de cáscara (P = 0.0465) tonalidades de L* (P = 0.0001), a* (P = 0.0029), b* (P = 0.0001) en cáscara y a* (P = 0.0004) y b* (P = 0.0204) en pulpa. En relación a la coloración del fruto, la heterogeneidad en C. pepo se observan en T1, T4, T5 y CN. Los cuales presentaron un matiz verde-amarillento con tonalidades más clara en cáscara y amarillentas oscuras en pulpa. Por lo contrario, T2 y T3, con un matiz más oscuro en relación a verde-amarillo en cáscara y pulpa (Cuadro 6), (Figura 3). En otros estudios se han reportado similitudes en coloración en cáscara y pulpa en especies de Cucurbita. Soriano-Melgar et al. (2020), registraron en calabacita italiana var. “Grey Zucchini”, diferencias en tonalidad y nitidez en colorimetría de la cáscara. Al determinar variaciones estadísticas en las tonalidades rojo/verde en la apariencia de la cascara en el grupo control al respecto a los grupos experimentales con presencia de inoculación con Azotobacter chroococcum + QUITOMAX®. La heterogeneidad reportada en calabacita var. “Grey Zucchini”, responde a los diferentes grados de madurez que influyen en la coloración de esta variedad. Las tonalidades en cáscara y en la pulpa reportadas en el estudio concuerdan con Canul-Ku et al. (2005), quienes reportan una coloración que va desde verde claro a oscuro en cáscara y una pulpa que van del blanco o amarillo.
Referente a los atributos físicos de grosor de cáscara, textura, humedad y ceniza en C. moschata no se presentaron variaciones estadísticas. Por lo que, este parámetro se encuentra homogeneizado en todos los valores registrados en los grupos experimentales. Asimismo, en C. pepo, se registraron diferencias estadísticas en el grosor de cáscara y firmeza (textura). Observando una heterogeneidad entre los tratamientos experimentales con relación a la dureza y firmeza en el fruto. Moreno et al. (2023), establecieron que los atributos texturales de pulpa y cáscara en especies de calabaza son determinadas por su diversidad genética, diversificando diferentes atributos como la dureza, firmeza, elasticidad, adhesividad y masticabilidad de un fruto. Otros autores como Adeeko et al., (2020), al determinar que una menor firmeza de un fruto, fue influenciada por factores de manejo y ambientales de un cultivo de calabacita italiana en condiciones de campo.
Referente a los valores de química proximal en C. moschata y C. pepo, indican un rango optimo en contenido de porcentaje de humedad y cenizas. Puesto que, los valores de humedad son > 90% y los valores de ceniza < 15%. (Cuadro 7). Estos resultados concuerdan con lo reportado por Bhattacharjee et al., (2023) en C. pepo var. Zuchinni, con valores entre el 93-96% de humedad y 0.5-0.8% de ceniza. Con respecto al grosor de cáscara, el estudio presenta concordancia con Chi-Sánchez, Alvarado, Cristobal y Reyes (2020). Los autores reportaron en accesiones de calabaza, diferencias significativas en grosor de cáscara, reportando una variabilidad morfo-fisiológica entre accesiones, al registrar entre 0.10 a 1.51 mm, hasta accesiones con 3.05-7.46 mm de grosor. En este contexto, los aportes minerales desde su desarrollo influyen directamente en el estado de madurez del fruto y otros parámetros propios de la calidad de una cosecha para su aceptación en el mercado (Hassan y Emam, 2015). Moreira-Salgado, de Sousa, Barbosa, Siqueira y Carbone (2016), mencionan a la absorción de elementos minerales como el nitrógeno (N) y calcio (Ca), nutrientes que se asocian a la textura y componentes integrales de la pared celular de la epidermis.
Table 7: Physical parameters of Cucurbita moschata and Cucurbita pepo, var. “Grey Zuchinni”.
| ID | Grosor de la cáscara | Textura | Humedad | Cenizas |
|---|---|---|---|---|
| mm | N | - - - - - - - - - - % - - - - - - - - - - | ||
| Cucurbita moschata | ||||
| T1 | 1.50±0.36 a | 49.16±4.22 a | 94.29±1.14 a | 0.55±0.02 a |
| T2 | 1.30±0.10 a | 45.28±6.01 a | 94.93±2.53 a | 0.50±0.05 a |
| T3 | 1.70±0.26 a | 51.51±16.65 a | 96.05±3.71 a | 0.59±0.34 a |
| T4 | 1.60±0.26 a | 43.82±4.96 a | 94.54±0.37 a | 0.49±0.04 a |
| T5 | 1.83±0.29 a | 52.42±14.18 a | 94.61±2.82 a | 0.53±0.09 a |
| CN | 1.87±0.12 a | 52.34±11.10 a | 95.66±1.31 a | 0.36±0.09 a |
| Cucurbita pepo, Var. Grey Zuchinni | ||||
| T1 | 1.77±0.06 a | 28.17±13.28 a | 95.23±5.43 a | 0.69±0.09 a |
| T2 | 1.13±0.12 b | 22.92±2.73 ab | 97.97±2.30 a | 0.74±0.03 a |
| T3 | 1.67±0.21 ab | 25.43±3.25 ab | 97.69±3.01 a | 0.74±0.04 a |
| T4 | 1.20±0.20 b | 23.74±1.24 ab | 96.95±2.08 a | 0.64±0.07 a |
| T5 | 1.53±0.35 ab | 21.94±2.82 ab | 95.35±6.74 a | 0.63±0.24 a |
| CN | 1.57±0.15 ab | 19.20±1.46 b | 92.17±12.23 a | 0.75±0.12 a |
T1 = cepa nativa de HMA (sistema agrícola) +50% de fertilización química; T2 = cepa nativa de HMA (sistema multipropósito) +50% de fertilización química; T3 = cepa nativa de HMA (vegetación secundaria) +50% de fertilización química; T4 = cepa comercial (GLUMIX®) +50% de fertilización química; CP = 100% de fertilización química (160 N-100 P- 160 K); CN = sin inoculación-fertilización. † Medias± Desviación estándar. ‡ Letras comunes sin diferencias estadísticas. § La caracterización física y química de los frutos se desarrolló en el laboratorio de inocuidad y trazabilidad alimentaria del sureste, Centro de Investigación y Asistencia en Tecnología y Diseño del Estado de Jalisco (CIATEJ), Unidad sureste, Mérida, Yucatán, México.
T1 = native AMF strain (agricultural system) +50% chemical fertilization; T2 = native AMF strain (multipurpose system) +50% chemical fertilization; T3 = native AMF strain (secondary vegetation) +50% chemical fertilization; T4 = commercial strain (GLUMIX®) +50% chemical fertilization; CP = 100% chemical fertilization (160 N-100 P- 160 K); CN = without inoculation-fertilization. † Means± Standard deviation. ‡ Common letters without statistical differences. § The physical and chemical characterization of the fruits was developed in the Southeast Food Safety and Traceability Laboratory, Center for Research and Assistance in Technology and Design of the State of Jalisco (CIATEJ), Southeast Unit, Mérida, Yucatán, Mexico.
Propiedades químicas del fruto
En relación con los parámetros químicos de ambas especies evaluadas, el pH oscilo entre 6.2 a 6.7, considerados ligeramente alcalinos. La acidez titulable (AT) registro valores entre 0.07 a 0.1 mg de ácido cítrico por 100 g muestra. C. moschata y C. pepo, registraron variaciones estadísticas (P = 0.0096 y 0.0051). Asimismo, el contenido de azucares (° Brix) solamente fue significativo en C. moschata (P = 0.0002), reportando entre especies valores de 4.3 a 7.3 para C. moschata y 3.6 a 5 para C. pepo (Cuadro 8). En ambas especies, los tratamientos con mayor relevancia estadística fueron los inoculados con HMA nativos y comercial, expresándose en una mayor concentración de azúcares, presencia de ácidos orgánicos y un pH característico de atributos con mayor preferencia en el mercado.
Table 8: Chemical parameters of Cucurbita moschata and Cucurbita pepo, var. “Grey Zuchinni”.
| ID | pH | Acidez titulable (%AT) | Total de solidos solubles (TSS) |
|---|---|---|---|
| Cucurbita moschata | |||
| T1 | 6.55±0.04 a | 0.09±0.01 a | 5.67±0.58 bc |
| T2 | 6.61±0.05 a | 0.094±0.006 ab | 5.7±0.60 bc |
| T3 | 6.63±0.12 a | 0.090±0.012 ab | 7.00±0.00 ab |
| T4 | 6.59±0.06 a | 0.090±0.012 ab | 7.33±0.58 a |
| T5 | 6.65±0.08 a | 0.10±0.01 ab | 6.33±0.58 ab |
| CN | 6.56±0.04 a | 0.08 ±0.01 b | 4.33±0.58 c |
| Cucurbita pepo, Var. Grey Zuchinni | |||
| T1 | 6.73±0.07 a | 0.08±0.01 b | 4.33±0.58 a |
| T2 | 6.63±0.11 a | 0.10±0.01 a | 3.67±0.58 a |
| T3 | 6.65±0.02 a | 0.08±0.01 b | 3.67±0.58 a |
| T4 | 6.64±0.03 a | 0.09±0.01 ab | 5.33±0.58 a |
| T5 | 6.25±0.53 a | 0.08±0.01 b | 5.00±0.01 a |
| CN | 6.57±0.03 a | 0.07± b | 4.00±1.00 a |
T1 = cepa nativa de HMA (sistema agrícola) +50% de fertilización química; T2 = cepa nativa de HMA (sistema multipropósito) +50% de fertilización química; T3 = cepa nativa de HMA (vegetación secundaria) +50% de fertilización química; T4 = cepa comercial (GLUMIX®) +50% de fertilización química; T5 = 100% de fertilización química (160 N-100 P- 160 K); CN = sin inoculación-fertilización. † Medias ± Desviación estándar. ‡ Letras comunes sin diferencias estadísticas. § La caracterización física y química de los frutos se desarrolló en el laboratorio de inocuidad y trazabilidad alimentaria del sureste, Centro de Investigación y Asistencia en Tecnología y Diseño del Estado de Jalisco (CIATEJ), Unidad sureste, Mérida, Yucatán, México.
T1 = native AMF strain (agricultural system) +50% chemical fertilization; T2 = native AMF strain (multipurpose system) +50% chemical fertilization; T3 = native AMF strain (secondary vegetation) +50% chemical fertilization; T4 = commercial strain (GLUMIX®) +50% chemical fertilization; T5 = 100% chemical fertilization (160 N-100 P- 160 K); CN = without inoculation-fertilization. † Means ± Standard deviation. ‡ Common letters without statistical differences. § The physical and chemical characterization of the fruits was developed in the Southeast Food Safety and Traceability Laboratory, Center for Research and Assistance in Technology and Design of the State of Jalisco (CIATEJ), Southeast Unit, Mérida, Yucatán, Mexico.
En estudios anteriores, se han reportado valores similares en C. moschata. En México, Jacobo-Valenzuela et al. (2011) reportaron valores de 6.77 en pH, 6.4 de ° Brix (TSS) y 0.04 mg de ácido cítrico. En otras zonas del mundo, Moreno et al. (2023), registraron valores inferiores en pH (< 6.0) e índices altos de contenido de azucares (> 9-10 ° Brix) y presencia de ácidos orgánicos con valores máximos de 0.28 y 1.73 mg de ácido málico y ácido ascórbico, respectivamente. Autores como Nawirska-Olszańska, Biesiada, Sokół y Kucharska (2014), han reportado en C. mochata un mayor contenido de ácido cítrico, ácido málico y ácido fumárico. En C. pepo, se han reportado contenidos inferiores en comparación a otras especies de Cucurbita, los cuales se relacionan con la maduración e intensidad del sabor del fruto. Así como en la presencia de compuestos orgánicos como aminoácidos, pectinas y ácidos orgánicos, directamente influenciados por el estado de madurez fisiológica de los frutos (Batista-Silva et al., 2018).
Las variaciones estadísticas entre los tratamientos, se relacionan directamente con al manejo de la nutrición del cultivo. Dado que, la eficiencia en la traslocación de minerales del suelo hacia la planta influye en diferentes procesos reguladores de su metabolismo. Por ejemplo, los procesos que se relaciona con la hidrolisis de azucares en los frutos (Sedano-Castro et al., 2011). Estas mismas aseveraciones la mencionan Díaz-Franco et al. (2016) en sorgo dulce, García-Castellanos et al. (2019) en un cultivo de fresa y López-Morales et al., (2022) en pepino. Los autores registraron una mayor tendencia de contenido de azucares en plantas micorrizadas en comparación a plantas con un manejo de fertilización convencional.
Conclusiones
La calidad de la cosecha y los principales atributos organolépticos en frutos de C. moschata y C. pepo, var. “Grey Zucchini” se relacionaron directamente con el manejo agronómico de la fertilización. Se observó un efecto estimulante en plantas asociadas con hongos micorrícicos arbusculares, principalmente en los factores productivos y de comercialización como el peso, largo y ancho del fruto. Asimismo, influyeron en diversos atributos físicos (grosor de cáscara, firmeza y color) y químicos (contenido de ácidos orgánicos y azucares), que impactan en importantes aspectos para el consumo humano y aceptación en el mercado.











 nueva página del texto (beta)
nueva página del texto (beta)



