Introducción
En los últimos años, la demanda de alimentos ha crecido de manera importante debido al crecimiento exponencial de la población a nivel mundial. El frijol común (Phaseolus vulgaris L.) es la leguminosa más importante a nivel mundial, donde más de 300 millones de personas consumen sus vainas o semillas secas (Palacio-Márquez et al., 2021; Vougeleka et al., 2023). Su alto valor nutricional, contenido de compuestos bioactivos, proteínas, vitaminas y elementos esenciales como el hierro y zinc lo hace especialmente importante para la canasta básica de los países en desarrollo (Uebersax et al., 2023). Sin embargo, para satisfacer la demanda de frijol a nivel mundial, se ha incrementado el uso de fertilizantes químicos para asegurar la producción del cultivo. (Mannino, Gentile, Ertani, Serio y Bertea, 2021). En consecuencia, el uso desmedido de fertilizantes provoca contaminación ambiental y la pérdida de la calidad de la producción (Di Mola et al., 2019).
Por tal razón, Los bioestimulantes ofrecen una solución alternativa para los sistemas productivos, ya que tienen el potencial de regular o modificar los procesos fisiológicos para incentivar el crecimiento, mitigar factores de estrés e incrementar el rendimiento (Brown y Saa, 2015). Para que un bioestimulante sea considerado como tal, debe funcionar a dosis bajas y tener efectos benéficos sobre los cultivos, por ejemplo, estimular la floración o aumentar el uso eficiente de nutrientes (La Bella et al., 2021; Navarro-León et al., 2022). Normalmente están compuestos de diversas sustancias como aminoácidos, oligosacáridos, hormonas vegetales y elementos minerales. Un ejemplo de esta última categoría es el producto comercial Codasil®, que contiene aminoácidos, Si y potasio (K), fue desarrollado para estimular el crecimiento y desarrollo vegetal, así como la tolerancia al estrés. Codasil® ha mostrado efectos benéficos en lechuga, un alimento donde la acumulación de biomasa verde es importante, como es el caso del frijol ejotero. Su aplicación mitigó los efectos negativos del estrés hídrico al reducir la peroxidación de lípidos, concentración de peróxido y proteger el aparato fotosintético (Hidalgo-Santiago et al., 2021). Además, Codasil® es un producto fácilmente disponible y de menor precio que otros compuestos, como las nanopartículas.
El silicio no es considerado un elemento esencial para la nutrición vegetal. No obstante, se han publicado evidencias que la absorción de silicio (Si) está relacionado con distintos beneficios como mayor acumulación de biomasa, facilitar la absorción de nutrientes, mayor tolerancia a la sequía, mitigación del daño por toxicidad de metales pesados y reducción del daño por estrés oxidativo (Azad et al., 2021; Koleva et al., 2022).
En consecuencia, la deficiencia de Si pudiera traer consecuencias negativas para el crecimiento de las plantas especialmente bajo condiciones de estrés debido a su capacidad para aminorar efectos negativos (Pavlovic et al., 2021). Existe un interés creciente para la utilización de Si en la producción de los cultivos, con distintas alternativas disponibles para su aplicación (Fraceto et al., 2016). En ese sentido, el uso de nanopartículas cada vez está ganando mayor importancia porque contribuye al desarrollo de nuevas estrategias sustentables para el crecimiento de los cultivos, gracias a su menor tamaño (10-100 nm), mayor solubilidad y reactividad de la superficie (Fraceto et al., 2016).
El empleo de nanopartículas de Si (NanoSi) ha sido documentado en distintos cultivos, como el trigo, tomate y arroz donde el abastecimiento de NanoSi potencia la acumulación de biomasa al mejorar la absorción mineral y regular hormonas vegetales como la auxina y ácido abscísico (Li et al., 2023). Además, aumenta la resistencia al estrés hídrico mediante el incremento de la turgencia celular y regulación de apertura de estomas (Ning et al., 2020), confiere mayor resistencia al estrés oxidativo al proteger a los cloroplastos de las especies reactivas de oxígeno mediante el refuerzo de la actividad de enzimas antioxidantes como la catalasa (CAT), superóxido dismutasa (SOD) y peroxidasa (POD) (Elshayb, Nada, Ibrahim, Amin y Atta, 2021). Dicho de otro modo, el Si tiene un papel importante al generar señales bioquímicas para provocar cambios en las rutas metabólicos y fisiológicas de las plantas en respuesta a las condiciones ambientales (Savvas y Ntatsi, 2015; Verma et al., 2022). En general, la información de los mecanismos de acción de la aplicación de NanoSi es limitada, ya que los efectos de NanoSi son dependientes de la especie vegetal y se desconocen ciertos aspectos de la interacción del silicio con la planta (Le et al., 2014).
Por lo tanto, el objetivo de la siguiente investigación fue evaluar estudiar la eficacia de la aplicación, y documentar los efectos de NanoSi y Codasil®, como potenciales bioestimulantes que mejoran en la acumulación de biomasa, rendimiento, actividad fotosintética y tasa de transpiración en el cultivo del frijol ejotero cv. Strike.
Materiales y Métodos
Manejo del cultivo
El experimento fue establecido bajo condiciones de malla sombra en Cd. Delicias, Chihuahua, México (28° 11’ 36” N, 105° 28’ 16” O) durante el periodo de agosto - octubre del 2022. Las semillas utilizadas fueron de frijol ejotero (Phaseolus vulgaris L.) cv. Strike, las cuales se sembraron en macetas de plástico de 13.4 L de capacidad rellenas con mezcla de sustrato de vermiculita y perlita en una proporción de 2:1 (dos plantas por maceta). La solución nutritiva utilizada fue la de Hoagland, modificada por Sánchez, Rivero, Ruiz y Romero (2004) para la irrigación de las plantas compuesta por 6 mM NH4NO3, 1.6 mM K2HPO4, 0.3 mM K2SO4, 4 mM CaCl2, 1.4 mM MgSO4, 5 µM Fe-EDDHA, 2 µM MnSO4, 0.25 µM CuSO4 y 0.5 µM H3BO3 preparada con agua destilada con un pH de 6.0-6.1 y con conductividad eléctrica de 2 dS m-1. Esta solución fue aplicada a un volumen de 0.5 L por maceta cada tercer día hasta los 30 días después de la germinación del cultivo, donde posteriormente se aplicó un L de solución cada tercer día hasta la cosecha (60 días después de la germinación del cultivo). Los siete tratamientos descritos más abajo fueron asperjados foliarmente a partir de la aparición de las primeras hojas verdaderas, cada siete días para un total de 5 aplicaciones en horario vespertino durante un periodo de dos meses.
Diseño experimental y tratamientos
Se utilizó un diseño completamente al azar con 7 tratamientos que consistieron en la aplicación de las dosis del formulado de NanoSiO2 + 1 mM KNO3 (NanoSi) y Codasil® al 0, 1, 2 y 4 mM. (Cuadro 1). Las nanopartículas fueron proporcionadas por la empresa Investigación y Desarrollo de Nanomateriales (Figura 1). Dado que el Codasil® contiene K y N en forma de aminoácidos, se añadió KNO3 en cantidad equivalente de N al NanoSi. Todos los tratamientos tuvieron 6 repeticiones y fueron aplicados foliarmente.
Características de los productos de silicio utilizados
A continuación, se presentan las composiciones químicas de los tratamientos empleados en la presente investigación (Cuadro 2).
Cuadro 2: Composición química de las nanopartículas de SiO2 y el producto Codasil® aplicadas en las plantas de frijol ejotero cv. Strike.
Table 2: Chemical composition of SiO2 nanoparticles and Codasil® product applied on green bean plants cv. Strike.
| Producto de Silicio utilizado | Composición química |
|---|---|
| 1, 2 y 4 mM Nanopartículas de SiO2 + 1mM de KNO3 | Tamaño promedio de 70-90 nm Peso Molecular de 60.08 g mol-1 Densidad: 2.648 g cm-3 Pureza: 99.9% |
| Producto Codasil® | SiO2 (26.1% p/v) K2O (14.6% p/v). Aminoácidos libres (5.2% p/v). |
Muestreo vegetal
Análisis vegetal. Las plantas fueron cosechadas para análisis a los 60 días después de la germinación (a madurez fisiológica), y lavadas con agua de la llave y agua destilada dos veces. Luego las muestras fueron secadas para cuantificar su peso.
Biomasa total. La biomasa incluyó el peso seco de todos los órganos, expresando por separado el peso seco y fresco de las vainas. El material cosechado fue secado en un horno (Shell Lab Forced Air Laboratory Oven SMO14-108 2, Baltimore, USA) a 70 °C por 72 h (Hernández-Figueroa et al., 2024). Posteriormente se utilizó una balanza analítica (AND HR-120, San José, California, USA) para cuantificar el peso y se expresó en gramos planta de peso seco (g planta-1 p.s.).
Rendimiento. El rendimiento de la planta se expresó como el promedio del peso de los frutos por planta (Ponce-García et al., 2019) y se cuantificó en gramos planta peso fresco (g planta -1 p.f.).
Actividad fotosintética y tasa de transpiración. La actividad fotosintética y la tasa de transpiración se midieron en las hojas cuando la planta alcanzó su madurez fisiológica (Kocal, Sonnewald y Sonnewald, 2008). Las lecturas fueron realizadas con un medidor portátil LI-COR 6400 (Lincoln, Nebraska, USA) en cada planta, escogiendo hojas sanas y libres de daño. Una concentración 400 µmol mol-1 de CO2 fue utilizada para la celda de referencia, mientras que una concentración de 380 µmol mol-1 de CO2 fue usada para la celda de muestra. El déficit de presión de vapor del aire en la cámara de muestreo era menor a 1.5 kPa y la temperatura del bloque que almacena la hoja era de 30 °C. La actividad fotosintética se expresó como µmol de CO2 m2 s-1 y la tasa de transpiración en mmol H2O metros-2 segundo-1.
Análisis estadístico
A los datos obtenidos se les realizó un análisis de varianza y una prueba de separación medias mediante el método de LSD (95%), usando el sof tware estadístico SAS versión 9.0 (SAS Institute, 2004). Los datos presentados son los valores medios ± error estándar (e.s.).
Resultados y Discusión
Biomasa total
La acumulación de biomasa es el producto final de la fotosíntesis de la planta, donde la distribución de biomasa a los órganos reproductivos es esencial para obtener mayores rendimientos (Gao et al., 2009). El análisis de varianza para esta variable mostró diferencias significativas entre los tratamientos, con un nivel de confianza del 95%. Posteriormente, la prueba de separación de medias por LSD (P ≤ 0.05) mostró que los tratamientos NanoSi4, NanoSi1, Codasil1 y Codasil4 presentaron mayor acumulación de biomasa total en comparación con el control (sin aplicación de Si), con un incremento del 16% en el caso del NanoSi4 (Figura 2).
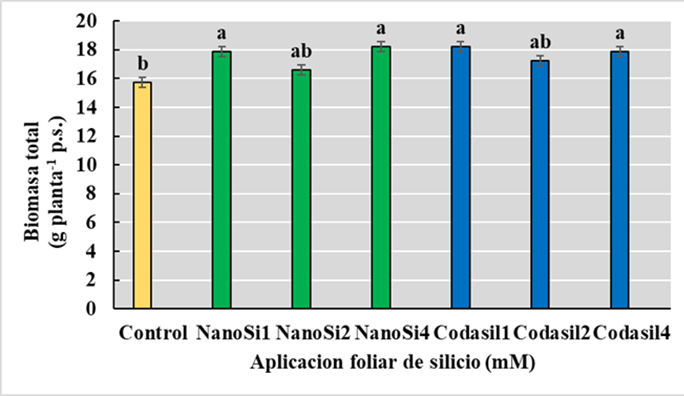
(El-Saadony et al., 2021) encontró que la aplicación de NanoSi en frijol con toxicidad de metales pesados incrementó la actividad fotosintética, conductancia estomática y el sistema antioxidante. La mejora de estos procesos podría incrementar la acumulación de biomasa.
Debe observarse que el Codasil contiene no solamente Si, sino aminoácidos que son fuente de N. En trabajos previos con bioestimulantes de composición heterogénea, los aminoácidos y elementos minerales impulsaron el crecimiento al aportar compuestos orgánicos, mejorar el balance hídrico y facilitar la absorción de macro y micronutrientes (Kocira et al., 2020). Aunque las concentraciones de hormonas vegetales no se midieron, otros autores han documentado que la aplicación de aminoácidos incrementa el contenido de giberelinas, citoquininas y auxinas o bien muestran comportamientos similares a estas fitohormonas (Colla, Rouphael, Canaguier, Svecova y Cardarelli, 2014; El-Gamal, Abd El-Aal, El-Desouky, Khedr y Abo Shady, 2016). En nuestro trabajo se aportó KNO3 a otros tratamientos (NanoSi) con el fin de compensar la carga de N y K de Codasil, aunque considerando que son fuentes de N mineral y orgánico respectivamente.
Rendimiento
El rendimiento de los cultivos es determinado por múltiples factores como el genotipo, medio ambiente y sus interacciones (Khaki y Wang, 2019). En el presente estudio, la aplicación de las distintas dosis NanoSi y Codasil4 mejoraron los rendimientos, a diferencia de los tratamientos Codasil1 y Codasil2. Dentro de los tratamientos de NanoSi, la dosis de 2 mM presento los mayores rendimientos, con un aumento del 36% comparado con el control (Figura 3), aunque estas diferencias no fueron significativas con las demás dosis de NanoSi. Respecto a estas diferencias, es posible que el menor tamaño de partícula sea el factor fundamental que facilita la absorción de Si dentro de la planta (Wang, Xie, Wang y Yin, 2023). Además, se ha reportado que NanoSi podría ayudar con el transporte de sustancias capaces de modular el metabolismo vegetal y varios procesos fisiológicos (Souri, Khanna, Karimi y Ahmad, 2021). En su trabajo con habas, Desoky et al., (2021) reportaron que la aplicación de NanoSi mejoró el intercambio gaseoso, en especial la fotosíntesis además de otras actividades fisiológicas. La regulación de dichos procesos por acción del NanoSi podría explicar los mayores rendimientos encontrados en estos tratamientos.
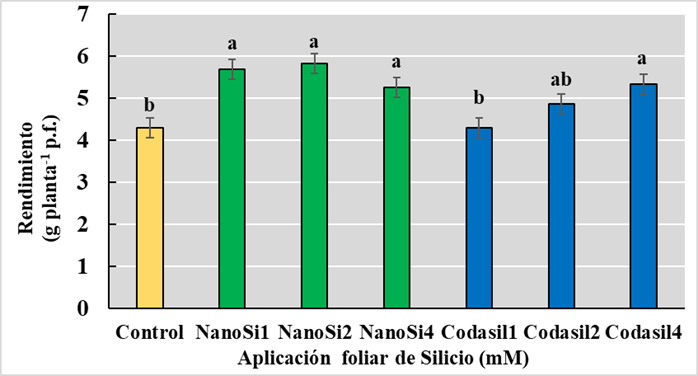
En el caso de Codasil, Codasil4 mostró el mayor rendimiento sin diferencias significativas con Codasil2. De manera similar a NanoSi, los distintos componentes de Codasil (aminoácidos, K2O y Si) influyen en distintos procesos fisiológicos dentro de la planta (Hidalgo-Santiago et al., 2021). Si bien no se midió la concentración de aminoácidos en este estudio, otros trabajos han reportado que los aminoácidos son esenciales para el crecimiento vegetal al actuar como parte de las proteínas, como moléculas señalizadoras e influenciar la turgencia celular y el balance osmótico dentro de la planta (Kauffman, Kneivel y Watschke, 2007). Otro efecto documentado por Shahrajabian, Cheng y Sun (2022) es la regulación de la apertura estomática, activación de enzimas y regulación de transporte de sustancias. De manera similar se ha determinado el efecto del K en el mantenimiento de la turgencia celular y la regulación de la apertura estomática. En el caso de Codasil4, es posible que las mayores dosis incrementen la concentración de aminoácidos y K2O, potenciando su efecto en la turgencia celular, tasa de transpiración y balance osmótico, mejorando el balance hídrico de la planta (Figura 2).
Actividad fotosintética
La fotosíntesis es el proceso por el cual la energía solar, dióxido de carbono y agua se transforman en energía química y biomasa, que son esenciales para el crecimiento y desarrollo de las plantas (Simkin, Faralli, Ramamoorthy y Lawson, 2020). Es por ello, que cualquier alteración del funcionamiento normal del proceso fotosintético afecta la disponibilidad de carbono, así como, la acumulación de especies reactivas de oxígeno (Jalil, Ahmad y Ansari, 2017; Hasanuzzaman et al., 2018b). En el presente estudio, la aplicación foliar de silicio fue benéfica para la actividad fotosintética, donde el tratamiento de NanoSi1 mostró la mayor actividad comparada con el control, con un aumento del 50% (Figura 4). Este incremento podría ser debido a la acción reguladora del Si sobre la conductancia estomática, el refuerzo del sistema antioxidante y enzimas que participan en la fijación de CO2 durante la fase oscura de la fotosíntesis, como la Rubisco (Hao et al., 2023). Mahmoud et al., (2022) reportaron que la aplicación de NanoSi en papas mejoró la conductancia estomática, el contenido de clorofila en las hojas, la concentración de CO2 intracelular y la cantidad de luz absorbida optimizando la fotosíntesis.
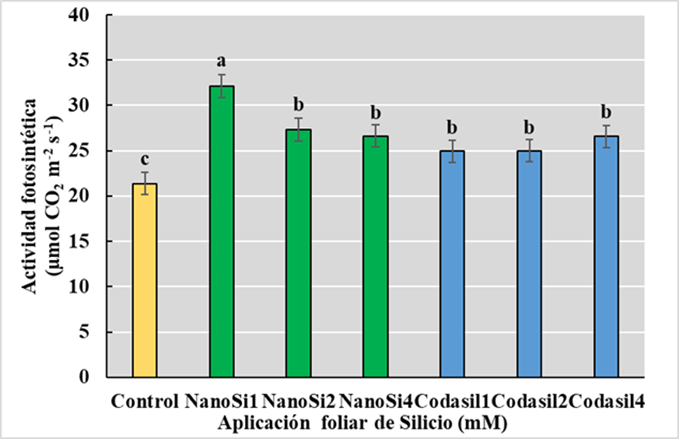
Además, se ha reportado que el sistema antioxidante de soya es fortalecido al acelerar la actividad antioxidante enzimática (SOD, POD y CAT) y no enzimáticas (ácido ascórbico y GSH), limitando el daño celular por peroxidación de lípidos hidrico, protegiendo el aparato fotosintético de las especies reactivas de oxígeno (Iqbal et al., 2019). Un aspecto importante durante la actividad fotosintética es la fijación de CO2, realizado por varias enzimas, entre ellas la Rubisco. La aplicación de distintas dosis de NanoSi en hojas de maíz demostró una tendencia donde las dosis bajas (150 mg L-1) aceleraron la actividad de la Rubisco y la dosis más alta (2500 mg L-1) disminuyo tal actividad. Por la tanto la dosis adecuada de NanoSi podría eficientizar la apertura estomática, optimizar la fotosíntesis y estimular enzimas fotosintéticas para impulsar el crecimiento del maíz (Hao et al., 2023) Todos estos efectos serian una posible explicación del porque el mejor desempeño de NanoSi1 en este parámetro y su disminución conforme aumentan las dosis. Xie, Song, Xu, Shao y Song (2014) sugirieron que el aumento del tamaño de los cloroplastos y el incremento del número de grana en las hojas podría optimizar la actividad fotosintética.
Tasa de transpiración
La transpiración se refiere al movimiento del agua a través de plantas vivas. Las tasas de transpiración están controladas por los efectos combinados de impulsores biofísicos (temperatura, déficit de presión de vapor de agua y radiación neta) y la conductancia estomática (Kirschbaum y McMillan, 2018). En el presente estudio, el tratamiento Codasil1 mostró las menores tasas de transpiración comparados con el resto de los tratamientos, reduciendo en un 32% la tasa de transpiración que el control (Figura 5).
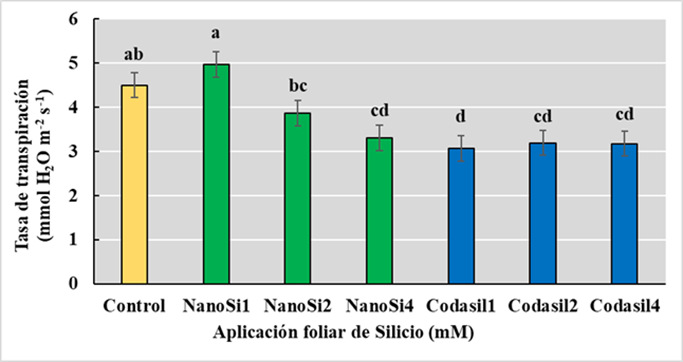
Esto es posible debido a que Si pudiera elevar el contenido de agua al reducir la transpiración por los estomas al mismo tiempo que incrementa la turgencia celular y la absorción de K+ (Tahir, Aziz, Farooq y Sarwar, 2012). Además, la presencia adicional de K+ en la composición de Codasil también podría auxiliar en la regulación de la apertura y cierre estomático, eficientizando el uso del agua (Kumar et al., 2020). Ciertamente, el K+ está involucrado en la regulación osmótica, en el funcionamiento de las acuaporinas y el mantenimiento de la turgencia celular (Hasanuzzaman et al., 2018a). Es por ello que un movimiento más eficiente del agua junto con una mejor absorción de nutrientes mejora el desempeño en todas las actividades fisiológicas de las células vegetales (Desoky et al., 2021). La elevada tasa de transpiración de NanoSi1 sugiere una mayor actividad fotosintética, ya que a mayor entrada de CO2 se incrementa la perdida de agua de las hojas. Al-Selwey, Alsadon, Ibrahim, Labis y Seleiman (2023) reportaron que la optimización de la conductancia estomática incremento la actividad fotosintética y la tasa de transpiración en papa bajo estrés hídrico, lo que incrementó el rendimiento.
Conclusiones
Se tuvo la mayor tasa fotosintética en frijol ejotero con la aplicación de NanoSi1, si bien este tratamiento presentó una de las mayores tasas de transpiración comparable a la del testigo. Esta mayor actividad fotosintética demostrada por la aplicación de NanoSi1 podría equipar la acumulación de biomasa y rendimiento de NanoSi2 y NanoSi4 con una menor dosis. Con respecto a la tasa de transpiración, el tratamiento Codasil1 mostró la menor la tasa de transpiración, si bien no presento diferencias significativas con Codasil2, Codasil4 y NanoSi4. Estas menores tasas de transpiración posiblemente incrementaron la biomasa del frijol ejotero. Sin embargo, la acumulación de biomasa en Codasil1 no se reflejó en mayores rendimientos comparado con Codasil2 y Codasil4. La fuente y dosis de Si afectaron la actividad fotosintética y las tasas de transpiración para incrementar la biomasa y rendimiento. Finalmente, tanto el NanoSi (1 mM) como Codasil (4mM) funcionan como bioestimulantes y son alternativas innovadoras para mejorar el crecimiento y la producción de frijol ejotero.











 nueva página del texto (beta)
nueva página del texto (beta)




