ANTECEDENTES
Hoy en día los tratamientos de reproducción asistida son objeto de investigación en muy diferentes frentes y la inquietud clínica por llevarlos a la práctica no está a la zaga. Las mejoras en los laboratorios de fertilización in vitro han avanzado tecnológicamente al punto en que la evaluación del embrión es un componente decisivo y cotidiano necesario para la toma de decisiones durante la transferencia.1,2 El momento óptimo en que debe transferencia un embrión es motivo de controversia porque deben tomarse en cuenta los procesos cronológicos de desarrollo embrionario y estimulación ovárica controlada con exposición a concentraciones suprafisiológicas de hormonas para el endometrio durante un tratamiento de fertilización in vitro.
En muchos centros especializados en reproducción asistida de México y el mundo se utiliza la transferencia de embriones en día 3.3,4 Para determinar los parámetros de división celular se han desarrollado nuevos métodos que graban la evolución de los embriones para determinar su potencial de implantación. El precursor es Embryoscope (VitroLife) y a su estela han aparecido otros sistemas, como Eeva (Auxogyn).5 Sin embargo, en las últimas dos décadas en otros centros se ha implementado la práctica del cultivo extendido, en el que el medio de cultivo se complementa con las necesidades metabólicas y nutricionales necesarias para los embriones, lo que permite avanzar a su desarrollo en etapa de blastocisto.6,7
La transferencia de embriones a la cavidad uterina en el día 5 postaspiración folicular, a diferencia del día 3, permite mejor sincronía entre el endometrio y el embrión y, por lo tanto, mejores posibilidades de implantación puesto que se asemeja a la secuencia de eventos que ocurren en una concepción natural. Otra razón para apoyar el cultivo de los embriones el día 5 es la posibilidad de tomar la biopsia para el tamizaje cromosómico, después de superar la activación del genoma que se lleva a cabo en el inicio de los procesos de compactación embrionaria.8 Por lo anterior, el cultivo extendido de embriones al estado de blastocito es la estrategia preferida en muchas clínicas y su popularidad ha crecido exponencialmente en los últimos años.9,10 Desde su inicio, se han desarrollado y aplicado diferentes técnicas de diagnóstico genético preimplantacional (DGP). Fluorescence in Situ Hybridization (FISH) fue la primera en aplicarse. En la actualidad no se recomienda porque no mejora las tasas de embarazo, tiene una tasa de error grande y está limitada a análisis de solo 9 cromosomas.11,12 Las otras técnicas avaladas son: hibridación genómica comparativa (CGH), que posteriormente se reemplazó por la hibridación genómica comparativa con base en microarreglos. Esta técnica consiste en la detección de diferencias en el número de copias de material genético expresable entre dos genomas (el que se analiza y uno conocido), mediante chips con microarreglos y sondas de ADN específicas para ciertas regiones estandarizadas de los cromosomas analizados.13 También está la técnica de los polimorfismos de un solo nucleótido (SNPs), que son variaciones en pares de bases comunes a través del genoma, heredadas en forma de alelos. Las muestras analizadas de trofoectodermo se hibridizan en oligonucleótidos y se ordenan en un chip, que puede detectar material extra o pérdidas de material genético.14 Estas dos últimas técnicas se basan, por completo, en una amplificación de todo el genoma (Whole Genome Amplification).
Otras técnicas más modernas, como la reacción en cadena de la polimerasa cuantitativa en tiempo real (PCRq), no requieren amplificación de todo el genoma: utilizan “cebadores” conocidos para segmentos de ADN en cada uno de los 24 cromosomas, que se amplifican y cuantifican, y permiten detectar aneuploidias, pero no duplicaciones, pérdidas, o triploidias, con la ventaja que puede realizarse rápidamente (alrededor de 4 horas) y a menor costo.15
La PCRq más reciente es la next-generation sequencing (NGS), o secuenciación de nueva generación. Esta técnica requiere amplificación de todo el genoma, seguido de la creación de una biblioteca donde todo el ADN es fragmentado y codificado con secuencias previamente reconocidas. El secuenciador es un sistema que efectúa pequeñas lecturas de estas secuencias de manera masiva y cubre todo el genoma muchas veces. Posteriormente, un programa de cómputo compara el genoma analizado con uno ya conocido y calcula los números de copias de cada segmento, detecta las ganancias o pérdidas de material genético, desde cromosomas completos hasta segmentos más pequeños, pérdidas, duplicaciones y mosaicisismos.16,17,18
Esta ultraselección de embriones basada en la composición cromosómica favorece, además, la transferencia electiva de un solo embrión con material genético euploide (SET),19 lo que mejora las tasas de implantación y embarazo clínico, reduce las tasas de embarazo múltiple, los abortos tempranos y las potenciales complicaciones maternas y fetales que implican.19,20,21
En la práctica clínica actual, las dos estrategias para la transferencia de embriones euploides consisten en la transferencia de embriones vitrificados o embriones frescos. La estrategia de congelar todos los embriones incluye la vitrificación después de realizar la biopsia, esperar los resultados del análisis genético, realizar un ciclo de preparación sintética o natural del endometrio y, posteriormente, efectuar la transferencia de uno o varios embriones desvitrificados.
La estrategia de transferir embriones analizados en fresco, que evita la vitrificación embrionaria, incluye la toma de una biopsia de blastocistos expandidos antes de las 10 de la mañana en el día 5 y cultivarlos durante la noche para esperar los resultados del diagnóstico genético preimplantacional para hacer el análisis genético, mediante la técnica de PCRq, que tiene la ventaja de emitir los resultados genéticos en cuestión de horas, a diferencia de otras técnicas como el NextGen secquencing. Cuando se tienen los resultados puede efectuarse la transferencia el día 6 de desarrollo del embrión con las mejores características morfológicas y evidencia de una composición cromosómica equilibrada.22,23,24
El objetivo de este estudio es: analizar las tasas de implantación y embarazo en ciclos de fertilización in vitro con transferencia electiva de un solo blastocisto, con control del factor embriónico mediante transferencia de embriones euploides mediante PCRq en ciclos homólogos con transferencia de embriones frescos y compararlo con ciclos con embriones biopsiados-vitrificados y transferidos en un ciclo posterior de preparación endometrial sintética o natural. Como objetivo secundario: analizar si el proceso de estimulación ovárica controlada tiene algún efecto perjudicial en la receptividad endometrial.
MATERIALES Y MÉTODOS
Estudio retrospectivo, de cohortes, al que se incluyeron las pacientes en quienes se efectuó un ciclo de fertilización in vitro con previo tamizaje cromosómico mediante la técnica de PCRq y que se obtuviera más de un embrión euploide elegible para transferencia. Los protocolos de estimulación, cultivo embrionario, criopreservación y desvitrificación de nuestro centro ya se describieron.25 Se incluyeron todos los casos de pacientes atendidas entre los meses de septiembre de 2010 a marzo de 2015. Todos los embriones fueron biopsiados en estado de blastocisto con la técnica mencionada. Se efectuó la transferencia electiva de un solo embrión euploide. Para el análisis las pacientes se dividieron en dos grupos: 1) transferencia de embriones frescos y 2) embriones desvitrificados en ciclo posterior con preparación endometrial sintética. Como resultado primario se analizó la tasa de embarazo, y como resultados secundarios la tasa de embarazo clínico, embarazo múltiple, pérdidas gestacionales o abortos. Las variables categóricas se analizaron con χ2 y prueba de Fisher para muestras pequeñas, las variables continuas con t de Student y la significación estadística se estableció con un valor de p < 0.05. Para el análisis estadístico se utilizó SAS-STAT versión 9.4 (2017, SAS Institute Inc., Cary, NC, USA)
RESULTADOS
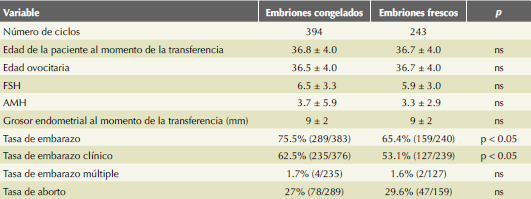
Se identificaron 637 ciclos con transferencia electiva de un solo embrión, de los que 243 fueron de transferencia de embriones frescos (n = 243) y 394 congelados (n = 394). Las diferencias entre las variables descriptivas de la población analizada en el estudio, como: edad de la paciente, edad ovocitaria definida como la edad de la paciente en la que se realizó la aspiración ovocitaria, concentraciones de FSH basal, y hormona antimülleriana (AMH) basal, así como el grosor endometrial, fueron estadísticamente no significativas en ambos grupos. (Cuadro 1) La tasa de embarazo definida como la presencia de una fracción beta cuantitativa de la hormona gonadotropina coriónica humana positiva (> 5 mUI/mL) fue de 65.4% con embriones frescos (n = 159) versus 75.5% con embriones congelados (n = 289). La tasa de embarazo clínico, definida como la existencia de un polo fetal con frecuencia cardiaca positiva y normal (53.1% con embriones frescos (n=235) vs 62.5% (n = 127)). Las diferencias en estas tasas de embarazo y embarazo clínico fueron significativamente mayores con transferencia de embriones congelados. La tasa de embarazo múltiple encontrada en ambos grupos fue de 1.6% con embriones frescos (n = 2) y 1.7% con embriones congelados (n = 4). Se encontró 29.6% de abortos o pérdidas gestacionales (n = 47) para los ciclos en fresco vs 27% (n = 78) para los ciclos congelados; sin significación estadística en estas dos últimas variables.
DISCUSIÓN
Las técnicas actuales para la toma de biopsias a embriones y análisis genético permiten definir la selección de embriones euploides y determinar con mayor precisión el papel de los ciclos de estimulación ovárica en las técnicas de reproducción asistida y así entender su repercusión en las tasas de embarazo.1
Rodríguez-Purata y su grupo llevaron a cabo un estudio que comparó la transferencia de embriones únicos frescos en ciclos con estimulación hormonal mediante gonadotropinas con la transferencia de embriones congelados. Encontraron que los embriones frescos tuvieron menor tasa de implantación (59.5 vs 50.6%, p < 0.01) y de nacidos vivos que el grupo en fresco (57.6 vs 46.5%, p < 0.005).25 A pesar de que el proceso de criopreservación de los embriones se utilizaba de manera más frecuente para el estudio genético de los embriones restantes de un ciclo en fresco, en la actualidad y con el refinamiento de las técnicas de vitrificación, muchos estudios han reportado mejores resultados después de transferir embriones congelados en comparación con embriones frescos.26,27
La implantación del embrión es uno de los pasos críticos para el éxito de las técnicas de reproducción. En dos tercios de las fallas en la implantación, el principal problema radica en el deterioro de la receptividad endometrial, mientras que las características del embrión constituyen el tercio restante.28 Se ha sugerido que la hiperestimulación ovárica controlada tiene efectos adversos en el endometrio. Esta interacción está mediada por las concentraciones suprafisiológicas de estradiol y progesterona durante la fase folicular, que alteran la morfología y bioquímica del endometrio. Estas alteraciones hormonales pueden resultar en una asincronía entre el endometrio y los embriones transferidos, haciendo que el endometrio pueda ser el responsable de las fallas en la implantación. Así, pues, la receptividad uterina se consigue de manera más satisfactoria en ciclos naturales o con el uso de hormonas exógenas, como estradiol y progesterona sintética.29,30 Esta ventaja de transferir embriones a un endometrio sincrónicamente preparado se apoya en diversos razonamientos. La transferencia de embriones congelados ofrece la posibilidad de controlar la ventana de implantación 31,32,33 que puede alterarse ante la exposición prematura a concentraciones elevadas de progesterona, que modifican su sincronización y duración y es perjudicial para la implantación embrionaria.32,34 El riesgo de elevación prematura de las concentraciones de progesterona parece asociarse con el número y tamaño de los folículos y la intensidad de la estimulación con hormona folículo estimulante,33,34 aunque los mecanismos exactos por los que esta elevación de progesterona reduce las tasas de implantación no se han estudiado lo suficiente y aún no se comprenden del todo.
En este estudio, los embriones se estudiaron genéticamente mediante tamizaje cromosómico; es decir, se obtuvieron embriones de una calidad y características morfológicas similares para ambos grupos. La edad de las pacientes de ambos grupos también fue similar. En nuestros resultados encontramos mejores tasas de embarazo y embarazo clínico de 75.5% (n = 289) y 62.5% (n = 235), respectivamente en la transferencia de embriones congelados versus 65.4% (n = 159) y 53.1% (n = 127), respectivamente con transferencia de embriones frescos; ambos resultados con un valor significativo de p < 0.05. Está debidamente documentado que uno de los principales factores para las tasas más bajas de embarazo con ciclos frescos, es la asincronía entre el embrión en desarrollo y el patrón secretor del endometrio.35,36,37
El grosor endometrial fue mayor en el grupo de ciclos de transferencia de embriones frescos (9 mm vs 9 mm de los ciclos de embriones congelados). Esta falta de relación entre el grosor endometrial y las tasas de embarazo significativamente más bajas, en comparación con los ciclos congelados, sugiere que la receptividad endometrial disminuida no resulta de un grosor endometrial deficiente.38
Se ha sugerido que entre más natural sea el ambiente uterino, que principalmente sucede en la transferencia de embriones congelados, más favorable será para una placentación temprana y embriogénesis. Por el contrario, la estimulación ovárica de los ciclos frescos puede alterar la angiogénesis en el endometrio y la implantación.39
En nuestro análisis no se encontró diferencia significativa entre los porcentajes de abortos (27%; n = 78) en embriones congelados vs 29.6% (n = 47) en embriones frescos y embarazos múltiples (1.7%; n = 4) en embriones congelados vs 1.6% (n = 2) en embriones frescos. Por lo que se refiere a estas dos variables, se sabe que al transferir de manera electiva un solo embrión, el número de ciclos de transferencia necesarios puede ser mayor, aunque con ello disminuye significativamente el número de embarazos múltiples y la morbilidad y mortalidad materna y perinatal de estos.20 Esta transferencia electiva de un solo embrión, previamente conocido como euploide, también ayuda a disminuir el costo, tiempo y angustia que implica el proceso de un aborto.40
Un metanálisis que incluyó tres estudios con 633 mujeres no encontró diferencia significativa en las pérdidas tempranas de embarazo, pero sí incremento en las tasas de embarazo clínico y viable en el grupo de embriones congelados,28 lo que es consistente con nuestros resultados (tasa de aborto de 27% (n = 78) en ciclos congelados y 29.6% (n = 47) en ciclos en fresco). Sin embargo, y a pesar de transferir embriones euploides, la cantidad de mujeres que sufre una pérdida prematura del embarazo es relevante, a veces sin causa o anomalía identificable, o bien condiciones genéticas, como mosaicismo, aneuploidías segmentarias o micropérdidas.41 La transferencia de embriones congelados ofrece muchas ventajas. Previamente existía la preocupación por las consecuencias a largo plazo resultantes de una transferencia de un ciclo “sintético”. Muchos investigadores han documentado esta variable que coincide con que los recién nacidos obtenidos después de una transferencia de embriones congelados, han demostrado resultados similares o, en ocasiones, mejores que los que nacen después de la transferencia en ciclos frescos.25,42 Este efecto perjudicial de la estimulación ovárica en la receptividad endometrial de los ciclos de fecundación in vitro en fresco, acompañado de mayores tasas de bajo peso al nacer, parto pretérmino y otros resultados adversos perinatales, hace que la transferencia de embriones congelados en un endometrio más receptor, sea la estrategia de elección en las técnicas de reproducción asistida.43
Como debilidades de este estudio está la circunstancia de que se trata de un análisis retrospectivo, modelo que favorece la fuga de información y el sesgo de memoria, lo que generalmente dificulta definir una asociación clara entre variables. Otra debilidad es el modelo utilizado para el análisis en ciclos en fresco, que es un modelo favorable, pero no perfecto porque existe la posibilidad de que tomar las biopsias en día 5 y transferir embriones en día 6 por la mañana los resultados sean falsos negativos o positivos en el diagnóstico mediante la técnica PCRq. Además, puede favorecerse una ventana de implantación no óptima. Por esto, en nuestro centro se ha abandonado esta práctica y ahora se realiza el análisis cromosómico comprensivo mediante Next Gen Sequencing, con el que se obtienen los resultados del análisis de un día para otro. En ciclos de análisis genético preimplantacional nosotros adoptamos la modalidad freeze all o vitrificación de todos los embriones. Como fortaleza del estudio está el número de casos, que es representativo y es uno de los ensayos efectuado, hasta donde sabemos, con más pacientes.
CONCLUSIÓN
Durante un tratamiento de fertilización in vitro la transferencia de un blastocisto único, genéticamente equilibrado en un ciclo de preparación endometrial sintética o natural, ha demostrado mejores tasas de implantación y embarazo clínico en comparación con la transferencia de un embrión con las mismas características en fresco. La transferencia de un embrión único disminuye, significativamente, la incidencia de embarazos múltiples y la morbilidad materna y neonatal.











 nueva página del texto (beta)
nueva página del texto (beta)