ANTECEDENTES
El síndrome de ovario poliquístico es el padecimiento endocrino más común en mujeres en edad reproductiva; se caracteriza por disfunción ovárica e hiperandrogenismo. Se diagnostica con la coexistencia de 2 de 3 de los siguientes criterios: oligo o anovulación, signos clínicos o bioquímicos de hiperandrogenismo y ovarios de apariencia ecográfica poliquística (12 o más folículos de 2 a 9 mm de diámetro y volumen ovárico superior a 10 cm3). Con base en estos criterios se han descrito cuatro fenotipos diferentes para establecer el diagnóstico correcto.1,2,3)
Es una patología determinada genéticamente. La mayoría de las pacientes con síndrome de ovario poliquístico tiene resistencia a la insulina, disfunciones endoteliales y vasculares. Se estima que 50% de las pacientes son obesas1,2,4,5 y, de éstas de 62 a 75% son resistentes a la insulina. Independientemente de la obesidad, las pacientes con este síndrome pueden cursar con resistencia a la insulina incluso hasta en 31% de los casos; este hecho contribuye a la infertilidad.5,6,7
La resistencia a la insulina se relaciona con el hiperandrogenismo y la anovulación mediante la estimulación de la síntesis ovárica y suprarrenal de andrógenos. De esta manera se incrementan los andrógenos libres circulantes, lo que altera la secreción de gonadotrofinas a favor de la hormona luteinizante. La evidencia sugiere que la resistencia a la insulina y su hiperinsulinemia compensatoria juegan un papel importante en la patogénesis de la enfermedad.2,4
Para evaluar la resistencia a la insulina en cualquier paciente, independientemente de padecer o no síndrome de ovario poliquístico, se utiliza el valor del índice de HOMA en población de riesgo de síndrome metabólico.4,8 Este parámetro ha resultado de utilidad para evaluar los tratamientos indicados para disminuir la resistencia a la insulina, sobre todo en pacientes con esa resistencia asociada con este síndrome. A estas pacientes se les indican fármacos sensibilizadores de insulina, como la metformina y, más recientemente, mioinositol, que ha demostrado buenos resultados en términos metabólicos y reproductivos.2,4,5,6,9
A este respecto, la metformina ha demostrado sus ventajas, incluidas la pérdida de peso, disminución de la insulina plasmática, del índice de HOMA (en un valor promedio de menos 0.4), de las concentraciones de lípidos, de las circulantes de andrógenos y en la restauración del ciclo menstrual y la ovulación. Sin embargo, su indicación está limitada por los efectos adversos y reacciones secundarias (síntomas gastrointestinales). También se han reportado efectos relacionados con la deficiencia de vitamina B12 con la administración crónica de insulina.2,5
Recientemente se agregaron nuevos sensibilizadores de insulina, como el inositol, al tratamiento de pacientes con síndrome de ovario poliquístico, obesas y no obesas.5,10,11 El mioinositol es un derivado de la vitamina B; su función es promover la síntesis de glucógeno, la conversión de glucosa intracelular a glucógeno, aumentar el transporte de glucosa al interior de la célula, mediante la estimulación de GLUT4, lo que reduce la glucosa e insulina plasmáticas. A su vez, en el ovario regula la síntesis de insulina inducida por los andrógenos, regulando la glucosa y la señalización de FSH.12,13 Simultáneamente, algunos reportes demuestran una disminución mayor en el índice de HOMA que con metformina, con reducciones promedio, incluso de 1.0 con mioinositol.9,14-17
Al mioinositol en polvo se le adjudicaron efectos secundarios gastrointestinales, motivo de su abandono. En 2011, Carlomagno y su grupo18 demostraron que con la ingestión de mioinositol en cápsula de gelatina blanda (soft-gel), indicado a pacientes con trastorno disfórico premenstrual, disminuyeron significativamente aquellos efectos gastrointestinales del anterior mioinositol.
El objetivo de este estudio fue: evaluar el efecto de las cápsulas de soft-gel de mioinositol en la reducción del índice de HOMA, el control metabólico y hormonal en pacientes con síndrome de ovario poliquístico versus metformina y la tolerabilidad gastrointestinal de ambos.
MATERIALES Y MÉTODOS
Estudio clínico prospectivo, de etiqueta abierta, controlado no aleatorizado vs activo de referencia, con diseño de grupos paralelos efectuado en el servicio de Biología de la Reproducción Humana de la Unidad Médica de Alta Especialidad 23, IMSS, Monterrey NL, de agosto 2019 a octubre 2020, en pacientes con resistencia a la insulina asociada con síndrome de ovario poliquístico e infertilidad. El protocolo fue aceptado por el comité de investigación de la unidad.
Criterios de inclusión: pacientes con resistencia a la insulina asociada con síndrome de ovario poliquístico e infertilidad por anovulación, con límites de edad de 20 y 38 años, con IMC más o menos menor de 30 kg/m2 y alteración en el índice de HOMA.
Criterios de exclusión: pacientes con hiperprolactinemia, hipo o hipertiroidismo, hiperplasia suprarrenal congénita, síndrome de Cushing, tumores secretores de andrógenos y diabetes mellitus tipos 1 y 2.
Criterios de eliminación: pacientes que desertaron por problemas médicos, personales o efectos secundarios de la medicación.
Se registraron las variables demográficas (edad e IMC) y químicas (glucosa en mg/dL, insulina en mUI/ml), índice HOMA, FSH (mUI/mL), LH (mUI/mL), estradiol (pg/mL), 17-OH progesterona (ng/mL), androstenediona (ng/dL), dehidroepiandrosterona sulfatada (SDEAH) (µg/dL), testosterona libre (ng/dL), TSH (mUI/mL), T4 libre (ng/dL) y prolactina (ng/mL). Trascurridas 12 semanas de tratamiento, se repitieron las pruebas.
Definición operativa de las principales variables. El diagnóstico de “síndrome de ovario poliquístico” se definió en pacientes que cumplieron con los criterios diagnósticos de Rotterdam, 19 incluidos los cuatro fenotipos y como resistencia a la insulina no tratada con anterioridad por índice HOMA mayor de 2.5. El diagnóstico de infertilidad se definió en pacientes con búsqueda de embarazo sin método de planificación familiar durante seis meses, siempre y cuando cumplieran con el diagnóstico de síndrome de ovario poliquístico.
El análisis estadístico se llevó a cabo en forma descriptiva para las variables basales. Para las variables categóricas se utilizaron medidas de frecuencia en porcentajes y para las cuantitativas medidas de tendencia central y de dispersión. En el análisis comparativo para variables categóricas se empleó riesgo relativo con IC95%, χ2 de Pearson para frecuencias o, en su caso, prueba exacta de Fisher según las frecuencias de los valores en celdas y al número de categorías. Para las variables cuantitativas se prefirieron las pruebas estadísticas de t de Student o U de Mann-Whitney conforme a los modelos de distribución de datos (normal o libre distribución). Para las diferencias intergrupales se aplicó la prueba de t para dos medias independientes con varianzas heterogéneas (test de Welch). Se utilizó el programa SPSS v21.0 para Mac.
RESULTADOS
Se incluyeron 83 pacientes pero solo 73 permanecieron hasta el final. Se excluyeron 3 pacientes del grupo de mioinositol que abandonaron el estudio por razones médicas (infección por COVID-19) y 2 por razones personales. En el grupo que recibió metformina se excluyeron 5 pacientes que abandonaron el estudio por mala tolerancia al medicamento, sobre todo por síntomas gastrointestinales. Cuadro 1
Cuadro 1 Causas de abandono de estudio
|
Mioinositol (n = 3) 9%* |
Metformina (n = 5) 10%** |
|
| COVID-19 | 1 (30%) | 0 |
| Motivos personales | 2 (70%) | 0 |
| Síntomas gastrointestinales | 0 | 5 (100%) |
Desenlaces expresados en n y porcentaje.
*Grupo de mioinositol 9% del total de pacientes.
**Grupo metformina 10% del total, de éstas 100% por síntomas gastrointestinales.
En la comparación de características sociodemográficas y bioquímicas obtenidas del expediente clínico, previas a la medición basal de la población de estudio, no hubo diferencias estadísticas; ambos grupos fueron homogéneos y comparables. Cuadro 2
Cuadro 2 Características sociodemográficas y bioquímicas obtenidas del expediente clínico previas a la medición basal de la población de estudio
| Mioinositol (n = 30) | Metformina (n = 45) | p | |
| Edad (años) | 31.64 ñ 2.95 | 32.5 ± 3.82 | 0.23 |
| IMC (kg/m 2) | 28.59 ± 0.70 | 28 ± 0.994 | 0.004* |
| Glucosa (mg/dL) | 111.9 ± 9.97 | 113 ± 10.8 | 0.72 |
| Insulina (mUI/ mL) | 13.97 ± 3.48 | 14.8 ± 4.42 | 0.50 |
| Índice HOMA | 3.87 ± 1.079 | 4.12 ± 1.2 | 0.39 |
| FSH (mUI/ mL) | 6.024 ± 1.34 | 5.72 ± 1.72 | 0.41 |
| LH (mUI/ mL) | 7.357 ± 3.326 | 7.79 ± 3.05 | 0.23 |
| Estradiol (pg/ mL) | 41.47 ± 10.3 | 49.1 ± 9.35 | <0.0001** |
| 17-OH progesterona (ng/ mL) | 1.49 ± 0.1706 | 1.23 ± 0.105 | 0.64 |
| Androstenediona (ng/ dL) | 1.493 ± 0.1706 | 1.61 ± 0.229 | 0.02 |
| SDEAH*** (±g/dL) | 123.4 ± 18.95 | 124 ± 25.1 | 0.92 |
| Testosterona libre (ng/ dL) | 0.09 ± 0.03 | 0.128 ± 0.06 | 0.07 |
| TSH (mUI/ mL) | 2.064 ± 0.1947 | 1.95 ± 0.348 | 0.12 |
| T4 libre (ng/dL) | 1.016 ± 0.1175 | 1.1 ± 0.261 | 0.09 |
| Prolactina (ng/mL) | 15.6 ± 2.27 | 15.1 ± 2.94 | 0.54 |
Resultados expresados en media ± desviación estándar.
* Ambos grupos con IMC en límites de sobrepeso.
** Ambos grupos en límites normales de estradiol.
*** Dehidroepiandrosterona sulfatada.
Con respecto a las diferencias intergrupo, se observó mejoría en el desenlace principal y en las demás variables con mioinositol, porque se obtuvo mejor respuesta en el índice de HOMA que con metformina, con un valor de p altamente significativo porque el delta de cambio fue de 1.49 ± 1.05 versus el grupo tratado con metformina, que experimentó menor reducción del índice HOMA con delta de cambio de 0.42 ± 0.40; (p = 0.0001). Cuadro 3
Cuadro 3 Comparación de variables basal y 12 semanas después de haber recibido mioinositol y metformina
|
Diferencias intragrupo mioinositol (n = 30) |
Diferencias intragrupo metformina (n = 45) |
Diferencias intergrupo | |||||
| Variables | Basal | Semana 12 | Basal | Semana 12 | Grupo mioinositol | Grupo metformina | p |
| IMC (kg/m2) | 28 ± 0.9 | 27.57 ± 1.06 | 28.59 ± 0.7 | 28.54 ± 0.75 | 0.55 (0.00-0.82) | 0.10 (-0.20-0.35) | < 0.003 |
| Glucosa (mg/dL) | 113 ± 10.8 | 99.84 ± 8.6 | 111.9 ± 9.97 | 108.7 ± 10.17 | 12.5 (4.50-20) | 2 (0.00- 4.50) | < 0.0001 |
| Insulina (mUI/mL) | 14.8 ± 4.42 | 10.84 ± 2.19 | 13.97 ± 3.48 | 12.77 ± 2.93 | 2.02 (1.17-5.44) | 1 (0-2) | < 0.0005 |
| Índice de HOMA | 4.12 ± 1.2 | 2.687 ± 0.67 | 3.87 ± 1.07 | 3.44 ± 0.95 | 1.49 ± 1.05 | 0.42 ± 0.40 | < 0.0001 ** |
| FSH (mUI/mL) | 5.55 ± 1.72 | 6.29 ± 1.10 | 6.02 ± 1.34 | 5.86 ± 1.08 | -0.51 (-1.92-0.82) | 0.1 (0-0.45) | < 0.08 |
| LH (mUI/mL) | 7.7 ± 3.0 | 4.9 ± 1.17 | 7.35 ± 3.32 | 6.79 ± 2.75 | 2.6 (0.62-4.05) | 0 (0-0.8) | < 0.0001 |
| 17-OH progesterona (ng/mL) | 1.23 ± 0.10 | 1.18 ± 0.03 | 1.22 ± 0.07 | 1.31 ± 0.13 | 0 (-0-01-0-07) | -0.02 (-0.17-0.01) | < 0.0007 |
| Androstenediona (ng/mL) | 1.61 ± 0.22 | 1.19 ± 0.09 | 1.49 ± 0.17 | 1.46 ± 0.13 | 0.43(0.3-0.54) | 0 (-0.07-0.11) | < 0.0001 |
| SDEAH (±g/dL) | 124 ± 25.1 | 114.4 ± 18.95 | 123.4 ± 18.9 | 121.9 ± 18.81 | 10.13 ± 20.40 | 1.46 ± 23.58 | < 0.095 ** |
| Testosterona libre (ng/dL) | 0.12 ± 0.06 | 0.07 ± 0.03 | 0.09 ± 0.03 | 0.09 ± 0.03 | 0.05 (0-0.85) | 0 (0-0) | < 0.0001 |
Diferencias intragrupo expresadas en media ± desviación estándar (valor mínimo y valor máximo).
Diferencias intergrupo expresados en riesgo relativo (IC95%).
**Prueba de Welch.
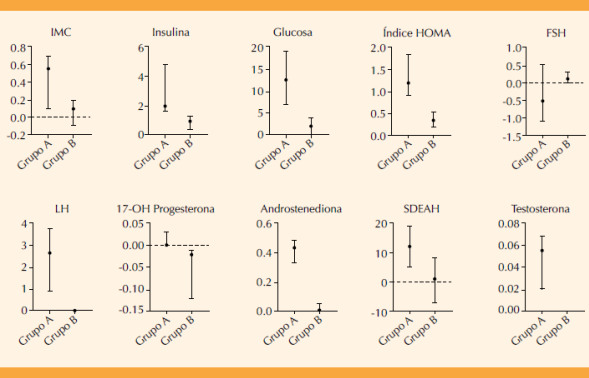
Se observa una clara tendencia hacia mayores disminuciones en las variables evaluadas del Grupo A. El ligero aumento de las concentraciones de FSH aunado a la clara disminución de la LH contribuyeron a corregir la disociación de las gonadotropinas en el grupo de mioinositol.
Figura 1 Magnitud de la reducción de los parámetros clínicos y bioquímicos de la población de estudio (Grupo A: mioinositol. Grupo B: metformina):
La magnitud en la reducción de los parámetros clínicos y bioquímicos de la población de estudio tratada con mioinositol mostró, además, disminuciones más significativas en las otras variables evaluadas versus la metformina: mayor magnitud en la disminución del IMC, de las concentraciones de insulina y glucosa en el grupo que recibió mioinositol.
De igual manera, los parámetros hormonales (LH, 17-OH progesterona, androstenediona, testosterona libre) disminuyeron con mayor eficiencia en el grupo que recibió mioinositol versus el de metformina con un valor de p estadísticamente significativa (Cuadro 3). La FSH y SDEAH no tuvieron diferencias significativas; el ligero aumento en las concentraciones de FSH (no significativo) aunado a la clara disminución de la LH contribuyeron a corregir la disociación de las gonadotropinas en el grupo de mioinositol característico de síndrome de ovario poliquístico.
DISCUSIÓN
Los datos de este estudio muestran que el mioinositol, a dosis de 600 mg cada 12 h en la forma farmacéutica de cápsulas de soft-gel mejoró dos veces más el índice de HOMA que la metformina al cabo de 12 semanas de tratamiento en pacientes con resistencia a la insulina e infertilidad asociadas con síndrome de ovario poliquístico. Al no existir estudios previos con esta presentación farmacéutica se hizo una comparación con los estudios reportados. Fue así como los datos clínicos del estudio coinciden con lo demostrado en la bibliografía previa con mioinositol en polvo a razón de 2000 mg cada 12 horas, lo que se correlaciona con el reporte publicado de farmacocinética comparativa entre ambas formas farmacéuticas que confirma su bioequivalencia. 20
Shokpour y colaboradores21 efectuaron un ensayo clínico con asignación al azar en 53 pacientes de 18 a 40 años con síndrome de ovario poliquístico. Compararon mioinositol vs metformina y sus efectos en los parámetros glucémicos, perfil de lípidos, expresión del gen relacionado con la insulina y metabolismo lipídico en un lapso de 12 semanas. Al igual que en el estudio aquí reportado, hubo una disminución significativa en el grupo de mioinositol versus metformina en las concentraciones de glucosa plasmática -5.12 (-8.09,-2.16), insulina -1.49 (-2.28,-0.70) e índice de HOMA -0.36 (-0.55,-0.17). Estos autores, además, analizaron el comportamiento del perfil de lípidos y la expresión del gen relacionado con la insulina y encontraron una diferencia significativa con mioinositol. Su modelo de regresión múltiple lineal para comparar las diferencias mostró valores similares a los del estudio. La fortaleza del estudio motivo de esta publicación radica en que se evaluó mayor cantidad de pacientes, de un grupo más homogéneo de mexicanas con síndrome de ovario poliquístico que recibieron cápsulas soft-gel que permite administrar dosis menores que en la formulación en polvo.
Contrario a nuestro estudio, Fruzzetti y coautores5 evaluaron a un grupo de 50 pacientes con síndrome de ovario poliquístico diagnosticadas conforme a los criterios de Rotterdam en tratamiento con mioinositol y metformina: 25 pacientes en cada grupo por un lapso de 6 meses versus un grupo control de 30 pacientes sanas; los desenlaces fueron similares en ambos grupos. De manera análoga al estudio aquí publicado tres pacientes del grupo de metformina abandonaron el estudio por molestias gastrointestinales y solo una paciente del grupo de mioinositol lo hizo por motivos personales. Al igual que en este estudio, en el artículo mencionado evaluaron el índice de HOMA como desenlace principal, de la misma forma que el IMC y las concentraciones de glucosa e insulina. También evaluaron la disminución en los datos clínicos de hiperandrogenismo y los periodos de amenorrea; a los seis meses de tratamiento reportaron la normalización del ciclo en 44% de las pacientes con mioinositol y en 53% de las tratadas con metformina. Contrario a los desenlaces nuestros, ellos encontraron diferencia estadística limítrofe en el índice de HOMA en ambos grupos: 2.1 ± 0.5 a 1.5 ± 0.4 (p < 0.05) en el grupo de mioinositol y de 2.4 ± 0.3 a 2.0 ± 0.3 (p < 0.01) en el grupo de metformina. En el estudio aquí comunicado hubo una disminución significativa en el índice HOMA de -1.49 ± 0.3 en el grupo de mioinositol y de -0.42 ± 0.40 en el grupo de metformina a las 12 semanas de tratamiento, con diferencia intergrupo muy significativa (p < 0.0001). A pesar de que el seguimiento del estudio de nuestro grupo fue más corto, los grupos de estudio fueron más homogéneos y los hábitos dietéticos y estilos de vida de las pacientes estandarizados, lo que puede explicar estas diferencias. Al igual que en este estudio y otros reportados no se encontraron diferencias en los valores de FSH, 17-OH progesterona y SDEAH.
Özay y su grupo14 llevaron a cabo un estudio en 196 pacientes con infertilidad y síndrome de ovario poliquístico cuyo desenlace principal fue el efecto de mioinositol en las tasas de embarazo. A pesar de ser este un estudio con un enfoque diferente al aquí comunicado, también compararon los valores del índice de HOMA en el grupo de pacientes con mioinositol versus un grupo placebo, con diferencia significativa en los valores de glucosa, insulina e índice de HOMA posterior a 12 semanas de tratamiento con mioinositol. Al igual que este ensayo existen otros que ofrecen algunas ventajas extras del tratamiento con mioinositol en desenlaces de fertilidad. En nuestro estudio no hicimos el seguimiento para informar la repercusión en tasas de embarazo porque estas variables no se consideraron al planear el ensayo.
Facchinetti y su grupo, 22 luego de una exhaustiva búsqueda, construyeron un cuadro donde resumen los 18 trabajos publicados hasta esa fecha en relación con la eficacia del tratamiento con mioinositol o de la combinación con D-chiro-inositol para mejorar los parámetros metabólicos y hormonales en pacientes con resistencia a la insulina asociada con síndrome de ovario poliquístico. De esos estudios, 16 indicaron la preparación de mioinositol en polvo (4000 mg); solo dos de las investigaciones citadas utilizaron cápsulas de soft-gel de la combinación de mioinositol (550 mg) más D-chiro inositol (13.8 mg) en razón de 40:1. El seguimiento fue de 12 y 24 semanas. Nuestro ensayo es el primero que investigó al mioinositol solo en cápsulas de soft-gel (600 mg) y que demostró mejoría en los parámetros metabólicos y hormonales después de 12 semanas de seguimiento en población mexicana, con buena tolerancia gastrointestinal. Lo aquí encontrado soporta que, a menor dosis de mioinositol se mantiene adecuada biodisponibilidad con esta nueva forma farmacéutica. Quedó claro que el mioinositol solo, en ausencia de su isómero, es capaz de lograr la meta terapéutica en pacientes con este padecimiento tan frecuente en México.
En relación con las diferencias en biodisponibilidad del mioinositol en polvo versus cápsulas de soft-gel Carlomagno y su grupo20 llevaron a cabo un estudio farmacocinético para comparar las concentraciones máximas observadas, el tiempo máximo para obtenerlas y el área bajo la curva de mioinositol versus ambas presentaciones. La administración de mioinositol en polvo y en cápsulas de gelatina blanda dio como resultado una equivalencia entre ambas formas farmacéuticas. Es decir, que la forma de cápsula de gelatina blanda mostró parámetros farmacocinéticos similares en comparación con dosis tres veces más altas de mioinositol en su forma de polvo. Los autores concluyen que las cápsulas de gelatina blanda mostraron mejor biodisponibilidad, lo que permite reducir sustancialmente la dosis administrada y minimizar los efectos secundarios dependientes de la dosis.
Este estudio es el primero que evalúa la forma farmacéutica de cápsulas de soft-gel a dosis tres veces menores de mioinositol que demostró mejoría en el índice HOMA, reconocido como el parámetro metabólico más importante para evaluar la resistencia a la insulina, además de los parámetros clínicos y bioquímicos.











 nueva página del texto (beta)
nueva página del texto (beta)


