Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Therya
versión On-line ISSN 2007-3364
Therya vol.4 no.3 La Paz dic. 2013
https://doi.org/10.12933/therya-13-155
Artículos
Análisis filogenético del linaje evolutivo del oso negro (Ursus americanus) de México
Phylogenetic analysis of the evolutionary lineage of Mexican black bears (Ursus americanus)
Luis Antonio Juárez-Casillas1*, Cora Varas2 y Fernando A. Cervantes1
1 Departamento de Zoología, Instituto de Biología, Universidad Nacional Autónoma de México; Apartado Postal 70-153, Ciudad Universitaria, Distrito Federal 45410, México. E-mail: ljuarez@st.ib.unam.mx (LAJ-C), fac@ib.unam.mx (FAC). * Corresponding autor.
2 School of Natural Resources, Arizona Fish and Wildlife Research Unit. University of Arizona; Tucson, Arizona, 85721, USA. E-mail: cora@email.arizona.edu (CV).
Sometido: 20 de agosto de 2013.
Revisado: 27 de octubre de 2013.
Aceptado: 10 de noviembre de 2013.
Resumen
El oso negro americano (Ursus americanus) ha estado presente en Norteamérica durante al menos 3 millones de años. Las fluctuaciones climáticas que se suscitaron durante la última glaciación forzaron a los osos negros a refugiarse en dos áreas geográficas específicas tanto en el Pacífico como en el Atlántico, lo cual influyó en la estructura demográfica genética actual de este úrsido. Estudios que han intentado confirmar esta hipótesis no han incluido muestras de México. Por lo que este estudio presenta un estudio filogenético del oso negro a lo largo de toda su distribución geográfica, y así determinar si las poblaciones mexicanas del oso negro pertenecen al linaje filogenético del clado del Océano Pacífico o a el clado del Atlántico. Las secuencias de la región control del DNA mitocondrial fueron obtenidas de muestras de excrementos recolectadas en el norte de México y de datos descargados de GenBank. El análisis filogenético confirmó la presencia de un clado al oeste de las Montañas Rocallosas y un segundo clado que incluyen a las montañas Rocallosas y al este de estas. En adición, nuestros resultados sugieren que las poblaciones mexicanas de oso negro se encuentran inmersas dentro del linaje del Atlántico. Esta investigación soporta la hipótesis de que la estructura genética del oso negro mexicano fue influenciada por los cambios climáticos suscitados en la última glaciación. Futuras investigaciones son necesarias para tener un mejor entendimiento de las distancias genéticas presente entre las poblaciones de oso negro del este y del oeste de México. Los esfuerzos de conservación para proteger las poblaciones de oso negro en México deben considerar su origen y sus relaciones filogenéticas.
Palabras clave: Carnívora, Conservación, Diversidad genética, Norteamérica, Refugios pleistocénicos, Ursidae.
Abstract
The black bear (Ursus americanus) has been present in North America at least during 3 million years ago. Climatic changes from last glaciation drove black bears to seek refuge in two regions of North America, one in the Pacific side and other in the Atlantic side, shaping the present genetic structure of this ursid. Literature reports attempting to confirm these hypotheses have not included samples from Mexico. Therefore, this research examined the genetic variation of black bear populations from all over its range, to find out if Mexican populations of the black bear belong to the phylogenetic branch of the Pacific clade or to that of the Atlantic clade. DNA sequences of the mitochondrial control region were obtained from scat samples collected in northern Mexico and from data downloaded from GenBank. Phylogenetic analyses confirmed the existence of one clade west of the Rocky Mountains and a second clade to the east of the same mountains, including the mountains themselves. In addition, our data also showed that Mexican populations of the black bear are nested into the phylogenetic branch of the Atlantic side. This research thus supports that genetic structure of Mexican black bears may have been influenced by climatic changes of the last glaciation period. Further research is needed to better understand genetic distances between eastern and western populations of Mexican black bears. Conservation efforts to protect black bears in Mexico must consider their origin and phylogenetic relationships.
Keywords: Carinivore, Conservation, Genetic diversity, North America, Pleistocene refugia, Ursidae.
Introducción
El oso negro americano (Ursus americanus) es el úrsido con mayor distribución en el Continente Americano y es el carnívoro terrestre de mayor tamaño que se encuentra en México. Infortunadamente, esta especie sufrió una dramática disminución en el número y tamaño de sus poblaciones originales a mediados del siglo XX como consecuencia de las actividades antropogénicas (Servheen et al. 1999). Gracias a la protección por parte de las leyes mexicanas, de algunos rancheros y a un cambio general en la actitud de la gente hacia este mamífero, en años recientes se ha observado un fenómeno de incremento y expansión de sus poblaciones hacia áreas de distribución histórica (Onorato et al. 2004). Para asegurar la viabilidad y la permanencia de las poblaciones de esta especie en territorio mexicano, se requiere promover proyectos de conservación y mantenimiento a largo plazo para lo cual es necesario considerar el conocimiento de su diversidad genética y entender los procesos históricos que influyeron en la estructura genética de sus poblaciones actuales.
La variabilidad genética es la materia prima de la evolución, de la cual depende la adaptación y la formación de nuevas especies. La fragmentación del hábitat es un factor que disminuye dicha variabilidad ya que en las poblaciones pequeñas y fragmentadas presentan muy poco o nulo flujo génico (Amos y Harwood 1998). El oso negro, al igual que los demás carnívoros grandes, es más susceptible a la pérdida de variación genética, a causa de la fragmentación del hábitat, debido a su amplio ámbito hogareño y amplio intervalo generacional (Paetkau y Strobeck 1994). Sin duda este aspecto es relevante para el tema de la genética de la conservación de este úrsido, ya que la erosión del material genético y del potencial evolutivo que esto puede representar, pone a esta especie en peligro, volviéndola potencialmente incapaz a adaptarse a los cambios ambientales (Hartl y Clark 1989). El mantenimiento de la variación genética incrementa la calidad de los individuos en una población. Por lo tanto, si se conocen los problemas derivados de la fragmentación del hábitat y la estructura genética del oso negro en México, se podrá contar con mayor información para diseñar acciones que ayuden a su conservación.
Infortunadamente, se desconoce la situación actual de la diversidad genética de este carnívoro, particularmente en México. Escasos estudios han utilizado marcadores moleculares para estimar su variación genética en poblaciones más norteñas. Se ha propuesto por ejemplo, que existen dos linajes de esta especie en el noroeste americano (Wooding y Ward 1997). Un linaje se distribuye desde el sur de los estados canadienses de Alberta y la Columbia Británica hasta el norte de California y el segundo se extiende desde el interior de Alaska hacia el sur en Oregon y Nuevo México y del este de Terranova a Florida (Fig. 1; Cronin et al. 1991; Paetkau y Strobeck 1996; Byun et al. 1997; Wooding y Ward 1997; Stone y Cook 2000).
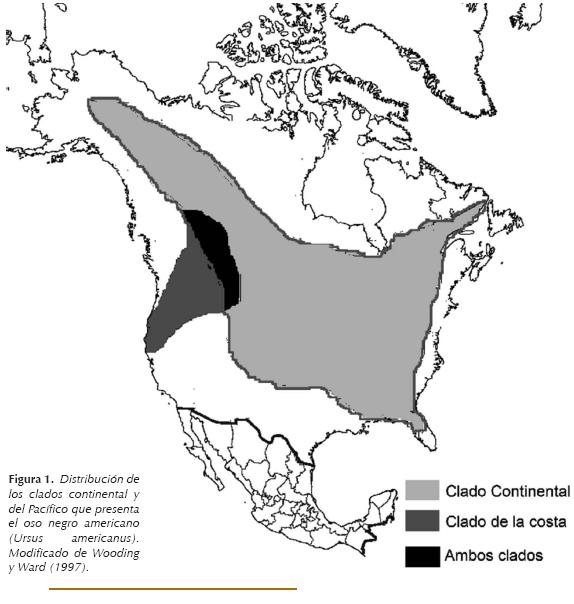
Se piensa que estos linajes pudieron haber sido el resultado de los cambios climáticos presentes durante el Pleistoceno cuando Canadá estuvo prácticamente cubierto en su totalidad por hielo y las tierras colindantes más al sur presentaron un clima muy árido. Esto trajo como consecuencia la contracción de los bosques a dos regiones específicas, una en el Océano Pacífico y otra en el Océano Atlántico que pudieron haber fungido como centros de refugio para el oso negro (Wooding y Ward 1997). Una vez reducidos dichos glaciares hubo una importante reorganización en la vegetación, dándose una substitución de las áreas abiertas por bosques templados, lo que favoreció la expansión demográfica de varias especies, entre ellas el oso negro americano (Lessa et al. 2003). Por desgracia, estos reportes no incluyeron las poblaciones que se distribuyen en territorio mexicano, por lo que la historia evolutiva de este mamífero es aún desconocida. El objetivo del presente trabajo es evaluar a qué linaje evolutivo pertenecen las poblaciones de oso negro mexicanas mediante la estimación de la diversidad genética y su análisis filogenético.
Material y Métodos
Obtención de muestras. Se colectaron 291 excrementos frescos de oso negro durante recorridos a pie por veredas, caminos y cañadas en los sitios en donde se ha evidenciado su presencia en los estados mexicanos de Coahuila y Nuevo León. Por otro lado, se obtuvo hueso turbinal de la nariz de dos ejemplares custodiados en colecciones científicas, uno en el Laboratorio de Ecología de Poblaciones de la Universidad Autónoma de Hidalgo (CIB-CM-335, ejemplar recolectado del estado de Hidalgo), y otro (no. 1244) en la Colección Nacional de Mamíferos (CNMA), Instituto de Biología, Universidad Nacional Autónoma de México, proveniente del, estado de Chihuahua. Asimismo se obtuvieron 10 dientes de individuos provenientes de Serranías del Burro en el Norte de Coahuila, y dos muestras de tejido fresco, una de un oso atropellado en el Municipio de Monterrey, Nuevo León (cedidas por la Secretaría de Medio Ambiente y Recursos Naturales, México), y otra de un ejemplar de la CNMA (44498).
Extracción y amplificación del DNA. El DNA de los excrementos se obtuvo empleando el kit comercial QiAamp DNA Stool Mini Kit (Qiagen). En el caso del hueso, se pulverizaron 25 mg que fueron descalcificados con EDTA (0.5M, pH 8.0) por cinco días antes de extraer el DNA con el kit comercial Qiagen DNeasy tissue extraction kit (Qiagen). La amplificación del gen de la Región Control del DNA mitocondrial se realizó usando la técnica de Reacción en Cadena de la Polimerasa (PCR) a partir de 9 ml de Green taq, 0.2 ml de albúmina sérica bovina al 7.5%, 0.2 ml de ClMg2, 0.3 ml de cada primer (F-CTCCACTATCAGCACCCAAAG y R-GGAGCGAGAGGTACACGT; Varas et al. 2006), y 5 ml de DNA en un volumen final de 15 ml. El perfil térmico tuvo una desnaturalización inicial de 94ºC por tres minutos, 40 ciclos de 94ºC durante 30 s, 30 s de temperatura de alineación (50º C), 72°C durante 30 s, seguido por una extensión de 72°C por 7 min.
Secuenciación del DNA. Los productos de PCR fueron purificados y sus secuencias elaboradas utilizando un secuenciador (BI PRISM 3100, ADN Sequencher, Applied Biosystems), las cuales se editaron utilizando el software Sequencher 4.6 (Gene Codes Corporation 2006). Además, se efectuó un análisis Blast en la página Web de la NCBI (http://www.ncbi.nlm.nih.gov) para confirmar que nuestras muestras correspondían a las de oso negro, y posteriormente se alinearon (forward y reverse) usando el programa BioEdit (Hall 1999).
Adicionalmente, se obtuvieron nueve secuencias de la región norte del estado de Sonora, México, y 10 secuencias de Arizona, EE.UU. Finalmente se descargaron de GenBank 32 secuencias del gen Región Control de oso negro correspondientes a los haplotipos 1-19 (número de acceso de GenBank AF012305-AF012323) descritos por Wooding y Ward (1997), a los haplotipos A-E (número de acceso de GenBank AY334363-AY334367) descritos por Onorato et al. (2004) y a los haplotipos F-M (número de acceso de GenBank FJ619652-FJ619659) descritos por Van Den Bussche et al. (2009; Fig. 2).

Diversidad y estructura genética. Para detectar el polimorfismo entre las poblaciones mexicanas de oso negro, se utilizó el software DnaSP versión 5 (Librado y Rozas 2009) con el cual se detectaron los niveles de diversidad nucleotídica (π) y diversidad haplotípica mitocondrial (h) para cada grupo (excluyendo indels). Los niveles de diferenciación poblacional (pairwise FST) y en general la diferenciación genética, se calcularon utilizando el software Arlequín versión 2.000 (Excoffier et al. 2005). Para estimar las relaciones genealógicas entre las secuencias del gen mitocondrial de la Región Control se construyó una red de haplotipos usando el programa TCS (Clement et al. 2000).
Para determinar la estructura genética y la diferenciación de las poblaciones mexicanas de oso negro, se realizó una prueba de varianza molecular (AMOVA). La relación entre la distancia genética y la distancia geográfica se analizó utilizando una prueba de Mantel con 10,000 permutaciones. Ambas pruebas se realizaron con Arlequin v.3.4.1.3 (Excoffier y Lischer 2010). Se estimó una matriz de distancia genética ocupando el modelo de evolución molecular 2 parámetro de Kimura (K2P; Kimura 1980) en el software Mega 4.0 (Molecular Evolutionary Genetics Analysis; Tamura et al. 2007). La matriz de distancia geográfica se obtuvo con el software Geographic Distance Matrix Generator v.1.2.3.
Análisis filogenéticos. Para obtener una aproximación de la historia evolutiva del oso negro americano en México, las secuencias fueron analizadas con dos diferentes aproximaciones: máxima verosimilitud e inferencia bayesiana. Para ambos análisis, se eligió el modelo evolutivo que mejor se ajustara a nuestros datos usando el programa JMODELTEST 0.1.1 (Posada y Crandall 2008). El análisis de máxima verosimilitud se realizó utilizando el software RaxMl (Stamatakis et al. 2008). El soporte de los nodos se obtuvo por medio de los valores de bootstrap (Felsenstein 1985).
Para el análisis de inferencia Bayesiana se utilizó el programa MrBayes 3.1.2 (Ronquist y Huelsenbeck 2003). El análisis fue realizado con cuatro iteraciones de Monte Carlo (MCMC) de cadenas de Markov con 10,000,000 generaciones con una frecuencia de muestreo de 200, resultando en 50,001 árboles. Una vez terminado este análisis, se realizó una inspección visual de los valores del parámetro estimado de MCMC con TRACER 1.5 (Rambaut y Drummond 2009), para comprobar los valores estimados de la ejecución y el árbol de consenso fue generado con el software TreeAnotator versión 1.6 (Rambaut y Drummond 2009) después de la eliminación del 20% como burn-in.
Se generó un árbol de consenso de regla de mayoría del 50% en MrBayes con un apoyo de un clado indicado como probabilidades posteriores. A partir de un burnin del 10%, los árboles generados fueron enraizados con la secuencia de la Región Control perteneciente al panda gigante (Ailuropoda melanoleuca; GenBank HQ540590; Hu et al. 2010), el oso negro asiático (Ursus thibethanus; GenBank AB013073; Matsuhashi et al. 1999), el oso malayo (Ursus malayanus; GenBank AB098551; Onuma et al. en prensa); el oso gris (Ursus arctos; GenBank HQ602653; Kocijan et al. 2011) y el oso polar (Ursus maritimus; GenBank JF900157; Edwards et al. 2011). Para evaluar la divergencia de las secuencias a una escala temporal entre las poblaciones de la Sierra Madre Occidental y la Sierra Madre Oriental en México se utilizó el programa Beast v. 1.6.1 (Drummond et al. 2007).
Resultados
Diversidad y estructura genéticas. En este estudio se analizó un total de 78 secuencias del gene Región Control del DNA mitocondrial de Ursus americanus de 373 pares de bases cada una. De ellas, 32 haplotipos fueron descargados de la base de datos internacional GenBank, y 10 secuencias de Arizona y nueve secuencias del norte de Sonora fueron donados por la Universidad de Arizona, mientras que 27 secuencias de poblaciones mexicanas del oso negro se amplificaron en este estudio: 26 de la Sierra Madre Oriental y una, de la Sierra Madre Occidental (Chihuahua; Tabla 1).
Nuestros resultados indican que la diversidad haplotípica varió entre poblaciones, siendo alta en la Sierra de Zapalinamé, Sierra de Picachos y Sierra los Ajos (h = 0.824, 1 y 1 respectivamente), mientras que fue baja en Serranías el Burro y en la Sierra de San Luis, (h = 0.286 y 0.333 respectivamente; Tabla 2); el promedio total de h = 0.676 fue moderado.
Se obtuvo una red de haplotipos (Fig. 3) cuya estructura muestra una división en dos grupos: el primero incluye los haplotipos localizados en la Sierra Madre Oriental, mientras que el segundo está alejado del primero por un solo paso mutacional y se encuentra integrado por los haplotipos encontrados en las Sierras de San Luis y Los Ajos en el estado de Sonora, así como los haplotipos localizados en Arizona, EE.UU.
Las distancias genéticas entre los diferentes haplotipos que se encontraron en México mostraron que la mayor distancia se encontró entre una muestra de la Sierra de Zapalinamé y otra de la Sierra de Picachos (21 diferencias entre pares de secuencias y una diversidad del 60%). En general se observó que dos haplotipos de la Sierra de Zapalinamé (Zapaliname 08 y Zapaliname 09), muestran valores muy altos de distancia genética respecto a los demás haplotipos muestreados.
La segregación geográfica de las poblaciones mexicanas de oso negro puesta a prueba con el análisis AMOVA, reconoció una diferenciación entre las poblaciones situadas en la Sierra Madre Oriental y la Sierra Madre Occidental. Los datos indican que la población de Arizona tiene valores de diferenciación significativos respecto a todas las poblaciones mexicanas (Tabla 3). Además, el valor global de Fst fue de 0.49 (P < 0.05), que implica una alta diferenciación entre poblaciones, según la escala de Nei (1987) cuando Fst > 0.25. Se encontró que la mayor varianza en la diversidad genética, con un valor de 50.83%, está dada por las diferencias dentro de las poblaciones. El segundo componente que aporta una considerable cantidad de variación engloba las diferencias entre poblaciones, con un 47.66%. Por otro lado, se encontró que existe una relación directa entre las distancias genéticas de los osos y la distancia geográfica de sus lugares de residencia. Inclusive, este resultado fue consistente con un modelo de aislamiento por distancia (r2 = 0.69, P = 0.005, a = 0.05).
Análisis filogenético. El modelo evolutivo que arrojó un árbol de consenso por mayoría del 50% fue el GTR+G. La topología del árbol obtenido para las poblaciones de oso negro muestra la presencia de dos linajes principales, uno distribuido desde el sur de Alberta y la Columbia Británica a lo largo del Pacífico hasta California, previamente descrito por Wooding y Ward 1997, y el cual se prolongó en este estudio hasta Arizona (Fig. 4). El segundo linaje se encontró en el interior del continente y se dividió en dos subclados, uno "Central" donde se incluyó la mayoría de las poblaciones de osos de la Sierra Madre Occidental México, Arizona, y las Rocallosas, Estados Unidos y otro subclado del "Este" en el que se incluyeron las poblaciones de la Sierra Madre Oriental en México, y Texas, Arkansas, Minnesota y Louisiana en Estados Unidos (Fig. 4). A partir del análisis para calcular el tiempo de divergencia entre los clados de la Sierra Madre Occidental y la Sierra Madre Oriental, se estimó una divergencia de 1.09 millones de años.
Discusión
El muestreo no invasivo del DNA fecal es una alternativa recomendada para los estudios de biología molecular de especies silvestres evasivas o que se encuentren en alguna categoría de riesgo de extinción para favorecer su conservación, como es el caso de los grandes carnívoros (Maldonado 2006). Varios estudios han presentado con éxito datos obtenidos del DNA aislado de excrementos que han demostrado una forma eficaz de obtener información sobre poblaciones silvestres animales, sin la necesidad de capturar u observar a los individuos (Wasser et al. 1997; Kohn et al. 1999; Ernest et al. 2000). De forma similar, nuestro estudio pudo obtener información biológica valiosa de excrementos del oso negro. Por lo tanto, los datos de este trabajo demuestran que la colecta no invasiva de muestras fecales para la obtención de DNA mitocondrial puede tener implicaciones importantes favorables para enriquecer el conocimiento y conservación de este úrsido.
El análisis y manejo de dichas secuencias de DNA permitió explorar y analizar la controversia que existe en la literatura respecto a las relaciones filogenéticas existentes entre oso el negro americano (Ursus americanus), el oso negro asiático (Ursus tibetanus) y el oso malayo (Ursus malayanus). Por un lado, resultados basados en variación proteínica indican que el oso malayo y el oso negro asiático son especies hermanas (Goldman Giri y O'Brian 1989), y que en conjunto son especies hermanas del grupo que conforma el oso gris (Ursus arctos) y el oso polar (Ursus maritimus; Zhang y Ryder 1994; Waits et al. 1999). Por otro lado, resultados del análisis de DNA nuclear sugieren que el oso negro americano es grupo hermano del oso negro asiático (Talbot y Shields 1996; Yu et al. 2004; Hou et al. 2007; Krause et al. 2008); además, otras investigaciones que reportan estudios con ADN mitocondrial y nuclear muestran que el oso negro americano y el oso malayo son taxones hermanos (Zhang y Ryder 1993; 1994). Los resultados de nuestro estudio apoyan esta última propuesta, pues el clado que contiene todas las muestras del oso negro tiene como grupo hermano al oso himalayo con soportes de rama apropiados; los otros osos del género examinados U. thibetanus, U. arctos y U. maritimus se aglutinan en un clado hermano. Por lo tanto, la posición filogenética del linaje evolutivo de las poblaciones de oso negro de México queda claramente marcada.
En este estudio se determinó que los haplotipos D y E reportados por Onorato et al. (2004) que corresponden a un segmento del citocromo B y de la Región Control, no presentaron variación en el fragmento correspondiente solo a la Región Control, por lo que se consideraron como un mismo haplotipo y el cual coincidió con el haplotipo 1 reportado anteriormente por Wooding y Ward (1997); éste se registró en las Sierras de San Luis y Los Ajos en el norte del estado de Sonora, México, dentro de la Sierra Madre Occidental. Los haplotipos A, B y C reportados por Onorato et al. (2004) también corresponden a un único haplotipo para la Región Control y coincide con el haplotipo 15 encontrado por Wodding y Ward (1997); esta secuencia se registró en la Sierra de Zapalinamé y Serranías del Burro en el estado de Coahuila sobre la Sierra Madre Oriental.
Por su parte, nuestro análisis filogenético de las secuencias del gene Región Control del DNA mitocondrial de las poblaciones de oso negro americano confirmó que el linaje evolutivo de esta especie está compuesto de dos ramas. Una de ellas es la que presenta una distribución geográfica a lo largo de la vertiente del Pacífico; la otra, se refiere al linaje Continental. Este hallazgo coincide con los resultados reportados por Wooding y Ward (1997), quienes sugirieron que dichas ramas se originaron a partir de dos refugios pleistocénicos, uno al norte de California (rama Pacífico), y otro de Florida (rama Continental).
La existencia de estos refugios se sustenta a partir del registro fósil del polen que revela que aunque los bosques actuales se extienden ampliamente en toda Norteamérica, su distribución durante el Pleistoceno estuvo restringida a dos pequeñas regiones, una en el Océano Pacífico y otra en el Océano Atlántico (Webb et al. 1993). Así mismo, el estudio filogeográfico realizado para otras especies neárticas como el pájaro carbonero boreal (Parus hudsonicus), el pájaro carbonero de lomo castaño (P. rufescens), la zorra gris (Urocyon cinereargenteus), la ardilla voladora norteña (Glaucomys sabrinus), la zorra roja (Vulpes vulpes), el ratón meteorito de cola larga (Microtus longicaudus), la marta americana (Martes americana) y la ardilla de pino amarillo (Tamias amoenus) presentan linajes con distribución similar a los propuestos para el oso negro americano (Wooding y Ward 1997; Arbogast 1999; Demboski et al. 1999; Demboski y Sullivan 2003; Aubry et al. 2009; Conroy y Cook 2000).
En este estudio el linaje del Pacífico se extendió más al sur de lo que había descrito Wooding y Ward (1997), debido a que nuestro estudio registró un haplotipo de dicha rama en Arizona; sin embargo, se requiere un tamaño de muestra mayor de esa región para sustentar verazmente su presencia. Similarmente, es interesante mencionar que el haplotipo registrado para Casas Grandes, Chihuahua, en la Sierra Madre Occidental, quedó como parte del subclado del Este y no dentro del subclado Central como era de esperarse, por lo que es necesario aumentar el muestreo para evaluar la veracidad de nuestros resultados. De confirmar este hallazgo se podría sugerir que a pesar de la distancia geográfica que existe entre la Sierra Madre Oriental y la Sierra Madre Occidental, existe un flujo génico entre las diferentes poblaciones a través de las "islas de cielo" que permiten el flujo genético de las especies de acuerdo con un modelo de islas. Existe información publicada que demuestra que los osos son capaces de atravesar barreras físicas como los desiertos extensos (Onorato et al. 2004; Atwood et al. 2011).
El estudio de la diversidad genética es imprescindible para el desarrollo de estrategias de conservación a corto y a largo plazo. Por ejemplo, un estudio realizado con el lobo mexicano (Canis lupus baileyi), subespecie de lobo gris extinta en su ambiente silvestre en México, demostró que los individuos de las poblaciones cautivas pueden entrecruzarse para aumentar su diversidad genética y evitar la consanguinidad sin que se vea comprometida su pureza (García-Moreno et al. 1996). Estos hallazgos resultan afortunados sobre todo si se considera que los niveles normales de variabilidad genética intraespecífica en los carnívoros son generalmente bajos (Avise et al. 1998). Nuestros resultados, en el caso del oso negro, produjeron valores de intermedios a altos (Tabla 2), por ejemplo, en el caso de Serranías del Burro en el norte de Coahuila y en la Sierra de San Luis en Sonora, los niveles fueron intermedios, lo que probablemente se debió a que el tamaño de muestra fue pequeño. Estos datos son comparables con poblaciones de oso negro de latitudes más norteñas calculadas a partir del uso de microsatélites, como es el caso de Terranova, Canadá (36%; Paetkau y Strobeck 1994), de Florida (27%; Dixon et al. 2006), de la Isla de Kodiak en Alaska (36%; Paetkau y Strobeck 1994) y de Mobile River Basin, Alabama (31.6%; Edwards 2002), así como en el límite entre Alabama y Mississippi (38%-42%; Warrillow et al. 2001) Estados Unidos.
Por otro lado, las poblaciones de oso negro provenientes de la Sierra de Zapalinamé, Coahuila, y Sierra de Picachos, Nuevo León, presentaron valores de diversidad genética alta (82.4%-100%), comparables con los valores reportados al sur de Quebec, suroeste de Alberta (Paetkau y Strobeck 1994) y costa media y sureste de la Columbia Británica en Canadá (62%-81%; Woods et al. 1999; Marshall y Ritland 2002), así como en el oeste de Arkansas (72.8%; Csiki et al. 2003), norte de Wisconsin (≥ 0.77%; Belant et al. 2005), norte de Idaho (79%; Cushman et al. 2006), norte de Florida (71%; Dixon et al. 2006) y costa norte de California (63%; Brown et al. 2009), Estados Unidos, al igual que entre el límite de Coahuila, México y oeste de Texas, Estados Unidos (71.7%; Onorato et al. 2007).
Como es conocido para otras especies de la fauna silvestre, también la diversidad genética de las poblaciones mexicanas de oso negro pudieron ser afectadas por la fragmentación de los ecosistemas debido a perturbación antropológica, ya que en México en particular durante el siglo XX, la distribución histórica del oso negro se redujo hasta en un 20% (SEMARNAT 2010). Así mismo, como se ha documentado para otros vertebrados (Hernández-Bolaños et al. 2007), la presencia del Desierto Chihuahuense podría representar una barrera biogeográfica que limita el flujo génico entre las poblaciones presentes en Sierra Madre Oriental y la Sierra Madre Occidental, ocasionando que se fijen alelos únicos para ciertas poblaciones aisladas.
Dicha restricción a la migración de este úrsido entre ambas sierras es evidente al observar que las poblaciones de oso negro de la frontera México-Texas y Sierra Madre Oriental presentan haplotipos únicos para cada Sierra, lo cual coincide con lo encontrado por la red de haplotipos que justamente distingue a los dos grupos, separados por un paso mutacional. Esto también tiene sentido si se considera que los resultados de la prueba de Mantel apoyan la hipótesis de un flujo génico restringido, indicando que existe una correlación concordante con el modelo de aislamiento por distancia geográfica, ya que la distribución es distinta de lo que se esperaría por azar. Sin embargo, esta interpretación debe tomarse con precaución debido a que este estudio fue hecho con un solo marcador molecular mitocondrial, por lo que resulta recomendable utilizar marcadores moleculares adicionales.
De acuerdo con los datos del reloj molecular, los sublinajes de la Sierra Madre Oriental y Sierra Madre Occidental, México, se separaron al inicio de una nueva glaciación (el Nebrasquiense hace 1.1 millones de años; Dort 1966), lo que podría explicar en parte la distribución geográfica actual de los haplotipos. Se ha documentado que durante los periodos glaciares, en el norte de México prevaleció un decremento en la temperatura ambiental, existiendo un aumento en las lluvias, lo que produjo ambientes abiertos más templados, caso contrario a lo que sucedió durante los periodos interglaciales, donde prevaleció un aumento de la aridez de los desiertos (Metcalfe et al. 2000; Lozano-García y Vázquez-Selem 2005; Metcalfe 2006); es conocido también que el oso negro prefiere ambientes boscosos con cobertura densa. Por otra parte, también se ha documentado que la Sierra Madre Oriental y la Sierra Madre Occidental fungieron como corredores biogeográficos con el territorio actual de Estados Unidos durante el Pleistoceno (Ceballos, Arroyo-Cabrales y Ponce 2010). Sin duda, esas evidencias históricas apoyan nuestros resultados genéticos que ponen de manifiesto movimientos poblacionales del oso negro durante la conformación de su linaje.
El conocimiento de la historia evolutiva del oso negro y sus características genéticas indica que las poblaciones mexicanas son distintivas y tienen una relación cercana de parentesco filogenético con las poblaciones de latitudes más norteñas con quienes comparten ancestros desde mediados del Pleistoceno. En particular, los osos negros de México pertenecen a la rama del linaje continental por lo que cualquier plan de conservación de esta especie debe considerar sus niveles de diversidad genética y su ancestría. Es evidente de este estudio que cualquier acción de generar barreras no naturales en su área de distribución, como el muro fronterizo entre México y Estados Unidos, puede impactar negativamente el flujo genético y el proceso natural de diferenciación de las poblaciones del oso negro americano.
Conclusiones
En conclusión, esta investigación reporta por primera vez la diversidad genética de poblaciones mexicanas del oso negro (Ursus americanus), en donde destaca la obtención de DNA a partir de técnicas de campo no invasivas. Asimismo, la información filogenética generada apoya la hipótesis de que los osos Ursus americanus y U. malayanus divergieron evolutivamente como taxones hermanos. Se destaca, además, que las poblaciones del oso negro en México manifiestan niveles altos de diversidad genética cuya historia evolutiva indica que dichas poblaciones pertenecen al linaje continental de este taxón. El cambio climático y sus consecuencias en el paisaje influyeron ampliamente en la diferenciación genética del oso negro en México. Esta información será una referencia para planear acciones de conservación de este taxón.
Agradecimientos
Se agradece el apoyo económico proporcionado por el Consejo Nacional de Ciencia y Tecnología (CONACyT), de la misma forma agradecemos a M. A. León Tapia por los comentarios pertinentes al escrito, así como a todas aquellas personas involucradas en la recolección de material biológico y el análisis de los datos.
Literatura citada
Amos, W., y J. Harwood. 1998. Factors affecting levels of genetic diversity in natural populations. Philosophical Transactions of the Royal Society B: Biological Sciences 353:177-186. [ Links ]
Avise, J. C., D. Walker, y G. C. Johns. 1998. Speciation durations and Pleistocene effects on vertebrate phylogeography. Proceedings of the Royal Society of London B. 265:1707-1712. [ Links ]
Arbogast, B. S. 1999. Mitochondria DNA phylogeography of the new world flying squirrels (Glaucomys): implications for Pleistocene biogeography. Journal of Mammalogy 80:142-155. [ Links ]
Aubry, K. B., M. J. Statham, B. N. Sacks, J. D. Perrine, y M. Wisely. 2009. Phylogeography of the North American red fox: Vicariance in Pleistocene forest refugia. Molecular Ecology 18:2668-2686. [ Links ]
Atwood, T. C., J. K. Young, J. P. Beckmann, S. W. Breck, J. Fike, O. E. Rhodes Jr., y K. D. Bristow. 2011. Modeling connectivity of black bears in a desert sky island archipelago. Biological Conservation 144:2851-2862. [ Links ]
Belant, J. L., J. F. Van-Stappen, y D. Paetkau. 2005. American black bear population size and genetic diversity at Apostle Islands National Lakeshore. Ursus 16:85-92. [ Links ]
Brow, S. K., J. M. Hull, D. R. Updike, S. R. Fain, y H. B. Ernest. 2009. Black bear population genetics in California: signatures of population structure, competitive release, and historical translocation. Journal of Mammalogy 90:1066-1074. [ Links ]
Byun, S. A., B. F. Koop, y T. E. Reimchen. 1997. North American black bear mtDNA phylogeography: Implications for morphology and the Haida Gwaii glacial refugium controversy. Evolution 51:1647-1653. [ Links ]
Clement M., D. Posada, y K. Crandall. 2000. TCS: a computer program to estimate gene genealogies. Molecular Ecology 9:1657-1660. [ Links ]
Conroy, C. J., y J. A. Cook. 2000. Phylogeography of a postglacial colonizer: Microtus longicaudus (Rodentia: Muridae). Molecular Ecology 9:165-175. [ Links ]
Cronin, M. A., S. C. Amstrup, G. W. Garner, y E. R. Vyse. 1991. Interspecific and intraspecific mitochondrial DNA variation in North America bears (Ursus). Canadian Journal of Zoology 69:2985-2992. [ Links ]
Csiki, I., C. Lam, A. Key, E. Coulter, J. D. Clark, R. M. Pace, K. G. Smith, y D. D. Rhoads. 2003. Genetic variation in black bears in Arkansas and Louisiana using microsatellite DNA markers. Journal of Mammalogy 84:691-701. [ Links ]
Cushman, S. A., K. S. Mckelvey, J. Hayden, y M. K. Schwartz. 2006. Gene flow in complex landscapes: testing multiple hypotheses with causal modeling. American Naturalist 168:486-499. [ Links ]
Ceballos, G., J. Arroyo-Cabrales, y E. Ponce. 2010. Effects of Pleistocene environmental changes on the distribution and community structure of the mammalian fauna of Mexico. Quaternary Research 73:464-473. [ Links ]
Dort, W., Jr . 1966. Nebraskan and kansan stades: complexit and importance. Science 154:771-772. [ Links ]
Demboski, J. R., K. D. Stone, y J. A. Cook. 1999. Further perspectives on the Haida Gwaii glacial refugium. Evolution 53:2008-2012. [ Links ]
Demboski, J. R., y J. Sullivan. 2003. Extensive mtDNA variation with in the yellow-pine chipmunk, Tamias amoenus (Rodentia: Sciuridae), and phylogeographic inferences for northwest North America. Molecular Phylogenetics and Evolution 26:389-408. [ Links ]
Dixon, J. D., M. K. Oli, M. C. Wooten, T. H. Eason, J. W. Mccown, y D. Paetkau. 2006. Effectiveness of a regional corridor in connecting two Florida black bear populations. Conservation Biology 20:155-162. [ Links ]
Drummond, A. J., y A. Rambaut. 2007. Beast: Bayesian evolutionary analysis by sampling trees. BMC Evololutionary Biology 7:214 [ Links ]
Ernest, H. B., M. C. T. Penedo, B. P. May, M. Syvanen, y W. M. Boyce. 2000. Molecular tracking of mountain lions in the Yosemite Valley region in California: genetic analysis using microsatellites and faecal DNA. Molecular Ecology 9:433-441. [ Links ]
Edwards, A. S. 2002. Ecology of the black bear (Ursus americanus floridanus) in Southwestern Alabama. Tesis de Maestría, Universidad de Tennessee. CIUDAD, EE.UU. [ Links ]
Excoffier, L., G. Laval, y S. Schneider. 2005. Arlequin ver. 3.0: an integrated software package for population genetics data analysis. Evolutionary Bioinformatics Online 1:47-50. [ Links ]
Excoffier, L., y H. E. L. Lischer. 2010. Arlequin suite ver.3.5: A new series of programs to perform population genetics analyses under Linux and Windows. Molecular Ecology Resources 10:564-567. [ Links ]
Edwards, C. J., M. A. Suchard, P. Lemey, J. J. Welch, I. Barnes, T. L. Fulton, R Barnett, T. C. O'Connell, P. Coxon, N. Monaghan, C. E. Valdiosera, E. D. Lorenzen, E. Willerslev, G. F. Baryshnikov, A. Rambaut, M. G. Thomas, D. G. Bradley, y B. Shapiro. 2011. Ancient hybridization and an Irish origin for the modern polar bear matriline. Current Biology 21:1251-1258. [ Links ]
Felsenstein, J. 1985. Confidence limits on phylogenies: An approach using the bootstrap. Evolution 39: 783-791. [ Links ]
Goldman D., P. R. Giri, y S. J. O'Brien. 1989. Molecular genetic-distance estimates among the Ursidae as indicated by one- and two-dimensional protein-electrophoresis. Evolution 43:282-295. [ Links ]
García-Moreno, J., M. D. Matocq, M. S. Roy, E. Geffen, y R. K. Wayne. 1996. Relationships and genetic purity of the endangered Mexican wolf based on analysis of microsatellite loci. Conservation Biology 10:376-389. [ Links ]
Hartl, D. L., y A. G. Clark. 1989. Principles of population genetics. Sinauer Associates, Sunderland. CIUDAD, EE.UU. [ Links ]
Hall, T. A. 1999. Bioedit: a user-friendly biological sequence alignment editor and analysis program for Windows 95/98/NT. Nucleic Acids Symposium Series 41:95-98. [ Links ]
Hernández-Baños, B. E., M. Honey-Escandón, M. N. Cortés-Rodríguez, y G. García-Deras. 2007. Filogeografía de aves mexicanas. Pp 441-466 en Ecología Molecular (Eguiarte, L., V. Souza, y X. Aguirre, eds.). Instituto Nacional de Ecologia/Comisión Nacional para el Uso y Conocimiento de la Biodiversidad. Ciudad de México, México. [ Links ]
Hou, W., Y. Chen, X. Wu, J. Hu, Z. Peng, J. Yang, Z. Tang, C. Zhou, Y. Li, S. Yang, Y. Du, L. Kong, Z. Ren, H. Zhang, y S. Shuai. 2007. A complete mitochondrial genome sequence of Asian black bear Sechuan subspecies (Ursus thibetanus mupinensis). International Journal of Biological Sciences 3:85-90. [ Links ]
Hu, Y., D. Qi, H. Wang, y F. Wei. 2010. Genetic evidence of recent population contraction in the southernmost population of giant pandas. Genetic 138:1297-1306. [ Links ]
Kimura, M. 1980. A simple method for estimating evolutionary rate of base substitutions through comparative studies of nucleotide sequences. Journal of Molecular Evolution 16:111-120. [ Links ]
Kohn, M. H., E. C. York, D. A. Kamradt, G. Haught, R. M. Sauvajot, y R. K. Wayne. 1999. Estimating population size by genotyping faeces. Proceedings of the Royal Society of London, B. 266:657-663. [ Links ]
Krause, J., T. Unger, A. Nocon, A. Malaspinas, S. Kolokotronis, M. Stiller, L. Soibelzon, H. Spriggs, P. H. Dear, A. W. Briggs, S. C. E. Bray, S. J. o'Brien, G. Rabeder, P. Matheus, A. Cooper, M. Slatkin, S. Pääbo, y M. Hofreiter. 2008. Mitochondrial genomes reveal an explosive radiation of extinct and extant bears near the Miocene-Pliocene boundary. BMC Evolutionary Biology 8:1-12. [ Links ]
Kocijan, I., A. Galov, H. Cetkovic, J. Kusak, T. Gmercic, y D. Huber. 2011. Genetic diversity of Dinaric brown bears (Ursus arctos) in Croatia whit implications for bear conservation in Europe. Mammalian Biology 76:615-621. [ Links ]
Lessa, E. P., J. A. Cook, y J. L. Patton. 2003. Genetic footprints of demographic expansion in North America, but not Amazonia, during the Late Quaternary. Proceedings of the National Academy of Sciences of the United States of America 100:10331-10334. [ Links ]
Lozano-García, M. S., y L. Vázquez-Selem. 2005. A high elevation pollen record from Iztaccíhuatl volcano, central Mexico. The Holocene 15:329-338. [ Links ]
Librado, P., y J. Rozas. 2009. DnaSP v5: A software for comprehensive analysis of DNA polymorphism data. Bioinformatics 25:1451-1452 [ Links ]
Matsuhashi, T., R. Masuda, T. Mano, y M. C. Yoshida. 1999. Microevolution of the mitochondrial DNA control region in the Japanese brown bear (Ursus arctos) population. Molecular Biology and Evolution 16:676-684. [ Links ]
Metcalfe, S. E., S. L. O'Hara, M. Caballero-Miranda, y S. J. Davies. 2000. Records of Late Pleistocene-Holocene climatic change in Mexico: a review. Quaternary Science Reviews 19:699-721. [ Links ]
Marshall, H. D., y K. Ritland. 2002. Genetic diversity and differentiation of Kermode bear populations. Molecular Ecology 11:685-697. [ Links ]
Maldonado, J. E. 2006. Monitoreo de especies raras y amenazadas de mamíferos utilizando análisis genéticos y muestreos no invasivos. Pp. 36-44 en Genética y mamíferos mexicanos: "donde estamos y hacia dónde vamos? (Vázquez-Domínguez, E. y D. J. Hafner, eds.). New Mexico Museum of Natural History and Science, EE.UU. [ Links ]
Metcalfe, S. 2006. Late quaternary environments in the northern desert and central transvolcanic belt in Mexico. Annals of the Missouri Botanical Garden 93:258-273. [ Links ]
Nei, M. 1987. Molecular evolutionary genetics. Columbia University Press. New York, EE.UU. [ Links ]
Onorato, D. P., E. C. Hellgren, R. A. Van Den Bussche, y D. L. Doan-Crider. 2004. Phylogeographic patterns within a metapopulation of black bears (Ursus americanus) in the American Southwest. Journal of Mammalogy 85:140-147. [ Links ]
Onuma, M., M. Suzuki, y N. Ohtaishi. 2011. Genetic diversity of the sun bear (Helarctos malayanus) in Borneo based on mitochondrial DNA and microsatellite loci. Unpublished. [ Links ]
Paetkau, D., y C. Strobeck. 1994. Microsatellite analysis of genetic variation in black bear populations. Molecular Ecology 3:489-495. [ Links ]
Paetkau, D., y C. Strobeck. 1996. Mitochondrial DNA and the phylogeography of Newfoundland black bears. Canadian Journal of Zoology-Revue Canadienne De Zoologie 74:192-196. [ Links ]
Posada, D. 2008. Jmodeltest: Phylogenetic Model averaging. Molecular Biology and Evolution 25:1253-1256. [ Links ]
Ronquist, F., y J. P. Huelsenbeck. 2003. MrBayes 3: Bayesian phylogenetic inference under mixed models. Bioinformatics 19:1572-1574. [ Links ]
Rambaut, A., y A. J. Drummond. 2009. Tracer v.1.5., disponible en http://beast.bio.ed.ac.uk/Tracer. [ Links ]
Servheen, C., H. Herrero, y B. Peyton. 1999. Bears: Status Survey and Conservation Action Plan. IUCN/SSC Bear and Polar Bear. Specialist Groups. IUCN, Gland Suiza y Universidad de Cambridge, Inglaterra 309 pp. [ Links ]
Stone, K. D., y J. A. Cook. 2000. Phylogeography of black bears (Ursus americanus) of the Pacific Northwest. Canadian Journal of Zoology-Revue Canadienne de Zoologie 78:1218-1223. [ Links ]
Stamatakis, A., P. Hoover, y J. Rougemont. 2008. A rapid bootstrap algorithm for the raxml web servers. Systems Biology 57:758-771. [ Links ]
SEMARNAT. 2010. Norma Oficial Mexicana NOM-059. Protección Ambiental-Especies nativas de México de flora y fauna silvestres-Categorías de riesgo y especificaciones para su inclusión, exclusión o cambio-Lista de especies en riesgo [ Links ]
Talbot, S. L., y G. F. Shields. 1996. A phylogeny of the bears (Ursidae) inferred from complete sequences of three mitochondrial genes. Molecular Phylogenetics and Evolution 5:567-575. [ Links ]
Tamura, K., J. Dudley, M. Nei, y S. Kumar. 2007. MEGA 4: Molecular Evolutionary Genetics Analysis software versión 4.0. Molecular Biology and Evolution 24:1596-1599. [ Links ]
Varas, C., M. Culver, P. Krausman, J. Ramírez, y S. Cunningham. 2006. Population Genetics of the Black Bear in the Four Peaks Area, Tonto National Forest, Arizona, US. Pp. 80-82 en Borders, Boundaries and Time Scales (Halvorson, B. ed.). Proceedings of the Sixth Conference on Research and Resource Managament in the Southwest Deserts. Tucson, Arizona. [ Links ]
Van Den Busshe, R. A., J. B. Lack, D. P. Onorato, y L. C. Gardner-Santana. 2009. Mitochondrial DNA phylogeography of black bears (Ursus americanus) in central and southern North America: Conservation implications. Journal of Mammalogy 90:1075-1082. [ Links ]
Webb, T. III, P. J. Bartlein, S. P. Harrison, y K. H. Anderson. 1993. Vegetation, lake levels and climate in eastern North America for the last 18,000 years. Pp. 415-457 en Global climatessince the last glacial maximum (H. E. Wright Jr., T. E. Kutzbach, T. Webb III, W. F. Ruddiman, F. A. Street-Perrott, y P. J. Bartlein, eds.). University of Minnesota Press. Minneapolis, EE.UU. [ Links ]
Wasser, S. K., C. S. Houston, G. M. Koehler, G. G. Cadd, y S. R. Fain. 1997. Techniques for application of faecal DNA methods to field studies of Ursids. Molecular Ecology 6:1091-1097. [ Links ]
Waits, L. P., J. Sullivan, S. J. O'Brien, y R. H. Ward. 1999. Rapid radiation events in the Family Ursidae indicated by likelihood phylogenetic estimation from multiple fragments of mtDNA. Molecular Phylogenetics and Evolution 13:82-92. [ Links ]
Wooding, S., y R. Ward. 1997. Phylogeography and Pleistocene evolution in the North American black bear. Molecular Biology and Evolution 14:1096-1105. [ Links ]
Woods, J. G., D. Paetkau, D. Lewis, B. N. Mclellan, M. Proctor, y C. Strobeck. 1999. Genetic tagging of free-ranging black and brown bears. Wildlife Society Bulletin 27:616-627. [ Links ]
Warrillow, J., M. Culver, E. Hallerman, y M. Vaughan. 2001. Subspecific affinity of black bears in the White River National Wildlife Refuge. The Journal of Heredity 92:226-233. [ Links ]
Yu, L., Q. W. Li, O. A. Ryder, y Y. P. Zhang. 2004. Phylogeny of the bears (Ursidae) base on nuclear and mitochondrial genes. Molecular Phylogenetics and Evolution 32:480-494. [ Links ]
Zhang, P., y O. A. Ryder. 1993. Mitochondrial DNA sequence evolution in the Arctoidea. Proceedings of the National Academy of Sciences 90:9557-9561. [ Links ]
Zaang, Y. P., y O. A. Ryder. 1994. Phylogenetic relationships of bears (the Ursidae) inferred from mitochondrial DNA sequences. Molecular Phylogenetics and Evolution 3:351-359. [ Links ]
Notas:
Editor asociado: Jorge Servin
Diseño gráfico editorial: Gerardo Hernández














