INTRODUCCIÓN
La segunda pandemia de cólera inició en el año 1829 en Persia, Afganistán, Bujará y Oremburgo, alcanzando posteriormente a Irán y Azerbaiyán. Desde allí se desplegó por todo el Oriente Próximo.
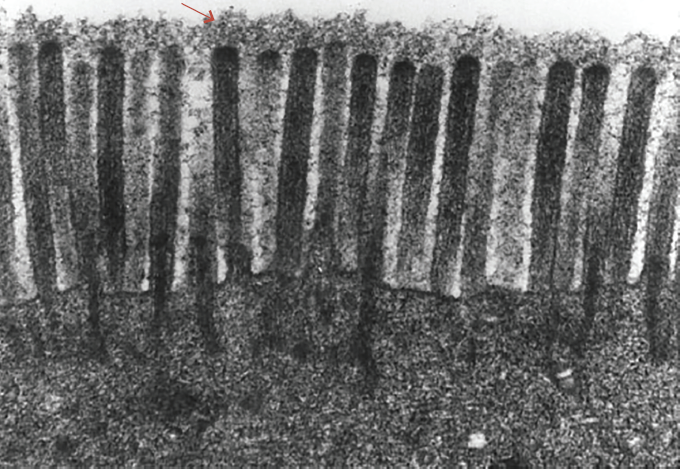
Fue en 1831 que, en este escenario, el doctor William Brooke O’Shaughnessy1, en Irlanda, también afectada por la pandemia, describió el aspecto “más oscuro y espeso de la sangre” en pacientes con cólera, lo que dio pie al posterior desarrollo de las soluciones de administración intravenosa que serían utilizadas en los años siguientes en la reanimación hídrica de los enfermos. Sin embargo, no fue hasta 1966 que Luft describió la fina estructura capilar y la capa endocapilar del sistema circulatorio, actualmente ampliamente estudiada y denominada glicocálix (figura 1).
Se ha demostrado la existencia del glicocálix en la estructura de bacterias, plaquetas, leucocitos, células de la mucosa intestinal, células linfoblastoides además del endotelio vascular.
El descubrimiento y estudio del glicocálix, ha permitido la revisión del principio clásico de Starling, y ha motivado la elaboración de uno que explique mejor el flujo de solventes y solutos a través de la barrera endotelial2.
La presente revisión de la literatura existente busca presentar al lector los puntos más relevantes sobre esta estructura tan importante para la homeostasis vascular.
ENDOTELIO VASCULAR
El endotelio vascular es una capa unicelular que actúa como frontera mecánica de separación entre el vaso sanguíneo y la sangre, y es además el regulador por excelencia de la homeostasis vascular3; tapiza el interior de arterias, venas y capilares4; y es altamente selectivo y metabólicamente muy activo5.
Las células endoteliales producen sustancias con múltiples funciones de crucial importancia. Entre ellas están el óxido nítrico y la prostaciclina, que tiene efecto vasodilatador; la endotelina, el tromboxano A2 y el anión superóxido, con acción vasoconstrictora; el heparán sulfato y la trombomodulina con efecto antitrombótico y el activador e inhibidor del plasminógeno tisular, con función de regulación de la fibrinólisis, entre otras3.
La disfunción endotelial o pérdida de la respuesta fisiológica del endotelio vascular, afecta su capacidad vasodilatadora, antioxidante y de regulación de la coagulación. Esta se caracteriza por una biodisponibilidad reducida de óxido nítrico, estrés oxidante aumentado, expresión aumentada de factores protrombóticos y proinflamatorios y una vasorreactividad aumentada5. Esta condición tiene consecuencias clínicas, como enfermedad vascular cerebral, enfermedad coronaria, disfunción eréctil, insuficiencia cardíaca y complicaciones microvasculares de la diabetes mellitus3. También se ha identificado disfunción endotelial en el tabaquismo, la dislipidemia, síndrome metabólico, hiperhomocisteinemia y enfermedades inflamatorias como el lupus eritematoso sistémico y enfermedad indiferenciada del tejido conectivo6.
ESTRUCTURA Y COMPOSICIÓN DEL GLICOCÁLIX
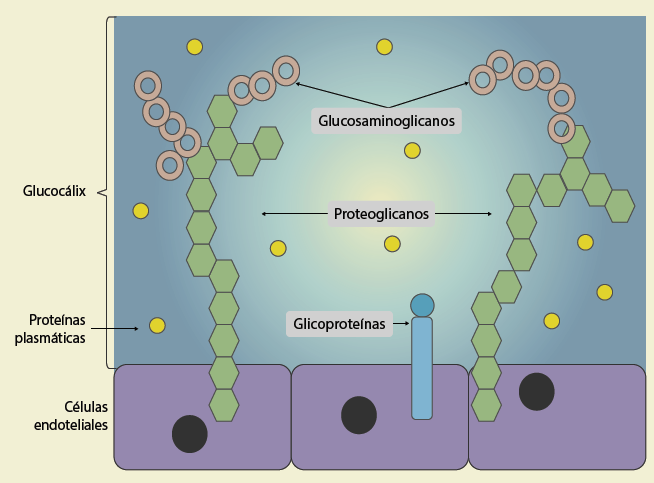
Hace más de 50 años, Luft J. H., observó el glicocálix con la ayuda del microscopio electrónico7. Esta es una estructura dinámica, que tapiza el endotelio vascular y es rica en carbohidratos dispuestos en red, específicamente proteoglicanos, glucosaminoglicanos y glicoproteínas8. Su disposición multicapa reduce el contacto de la célula endotelial con los componentes sanguíneos celulares y macromoleculares4.
La síntesis del glicocálix es un proceso complejo que involucra múltiples vías enzimáticas4. Los 3 componentes principales del glicocálix son los proteoglicanos, glucosaminoglicanos y glicoproteínas, todos sintetizados en las células endoteliales (figura 2).
Proteoglicanos
Son cadenas proteicas que contienen un dominio citoplasmático que sostiene el glicocálix y otro externo donde se anclan las moléculas de glucosaminoglicanos. Los más abundantes son los sindecanos 1, 2 y 4, el glipicano 1 y el perlecano3.
Cada sindecan consta de un dominio extracelular que contiene glucosaminoglicanos, sitios de fijación, un dominio transmembrana de un solo paso y un dominio citoplasmático corto que incluye sitios de fosforilación4. Estos intervienen en fenómenos de señalización celular, unión celular y organización del citoesqueleto.
Específicamente el sindecan 1 participa en los procesos de proliferación y migración celular, así como en la interacción de la célula con la matriz extracelular mediante receptores específicos. Parece tener un papel fundamental en la modulación de las interacciones leucocito-endotelio y en la extravasación de los leucocitos, así como en la actividad de las citoquinas y los distintos factores de crecimiento9.
Glucosaminoglicanos
Se unen al proteoglucano en el dominio externo, siendo los principales heparán sulfato, condroitín sulfato, dermatán sulfato y queratán sulfato. El ácido hialurónico es un glucosaminoglicano no sulfatado y sin núcleo proteico, que se encuentra de manera abundante en la porción más superficial del glicocálix3,4.
Glicoproteínas
Son proteínas cortas con cadenas laterales de azúcares ramificados que se anclan al citoplasma endotelial y son de 2 tipos: moléculas de adhesión endotelial (selectinas, integrinas, moléculas de adhesión intracelular como ICAM, VCAM) y complejos funcionales que regulan la coagulación, fibrinólisis y hemostasia (complejo de glicoproteína Ib-IX-V que se une al factor de Von Willebrand)3.
FUNCIONES DEL GLICOCÁLIX
El glicocálix tiene funciones de regulación de la permeabilidad vascular a las moléculas y líquidos (agua y solutos), la filtración glomerular, la permeabilidad de macromoléculas (proteínas), hematócrito capilar y flujo sanguíneo capilar, la coagulación (localmente), y las cascadas de fibrinólisis y coagulación vascular. Además, previene la adhesión de plaquetas y leucocitos al endotelio y funciona como barrera a la filtración de lipoproteínas, sin embargo, una de sus funciones más importantes es la de modulador entre las fuerzas mecánicas tangenciales del torrente sanguíneo y las células del endotelio vascular3.
Regulación de la permeabilidad
El glicocálix es mediador de los cambios de permeabilidad del agua ante las fuerzas de tensión, evitando el edema y regulando la filtración de proteínas, para lo que son de primordial importancia las cargas negativas de los glucosaminoglicanos10. Esta carga negativa repele las moléculas cargadas negativamente, así como a los glóbulos blancos, glóbulos rojos y plaquetas4.
El glicocálix regula la permeabilidad vascular de 2 maneras: creando un filtro pasivo sobre las uniones célula-célula y actuando como una plataforma de señalización que regula activamente la integridad de la unión; como filtro molecular creando una barrera de permeabilidad pasiva al formar un andamio de polímeros en la pared vascular, al que las proteínas del suero se integran10.
Las macromoléculas mayores de 70 kDa están excluidas de la estructura de malla estrecha del glicocálix. La albúmina (67 kDa), a pesar de su carga negativa y por su carácter anfótero, en pH neutro, se une fuertemente al glicocálix. Debido a esta unión, la conductividad hidráulica a través de la barrera vascular se reduce4.
Transducción de fuerzas mecánicas
El endotelio se encuentra expuesto constantemente a diferentes fuerzas mecánicas y hemodinámicas. Las fuerzas radiales causadas por la presión intravascular, las fuerzas tangenciales en la pared del vaso, y las fuerzas de corte axial causadas por la fricción de la sangre que fluye contra la pared vascular4. Las fuerzas de tensión excesivas provocadas por el torrente sanguíneo, causan una torsión del dominio intracitoplasmático de los proteoglicanos, lo que se transmite al citoesqueleto cortical de actina en la célula endotelial. Esto desencadena la liberación de óxido nítrico.
Las fuerzas de cizallamiento, típicas de los segmentos rectos de las arterias, protegen frente a estímulos aterogénicos, a diferencia de un flujo sanguíneo bajo, flujo oscilatorio u otros patrones de flujo que impliquen cambios en la dirección y la magnitud del flujo, los cuales inducen un estado proinflamatorio y protrombótico, caracterizado por proliferación y muerte celular4.
EL GLICOCÁLIX Y EL MODELO DE STARLING
Durante mucho tiempo, se ha asumido ampliamente, que las fuerzas oncóticas que impulsan los fluidos a través de los vasos están determinadas por la diferencia en la concentración de proteínas plasmáticas entre la luz del vaso y el tejido11. Se desconocía la existencia del glicocálix y, por ende, su papel clave en este intercambio de fluidos. Entender su función permitió renovar la ecuación de Starling.
En el modelo clásico de Starling se describen 4 fuerzas que actúan a nivel del capilar. La presión hidrostática del capilar (PHc), presión hidrostática del líquido intersticial (PHi), la presión oncótica (coloidosmótica) del capilar (POc), y la presión oncótica del líquido intersticial o del intersticio (POi).
Cada una de estas fuerzas exhibe una magnitud y un sentido. La fuerza resultante es la que determina si el agua sale a través del endotelio, se filtra, o si el agua ingresa a través del endotelio desde el intersticio hacia el espacio intravascular, se absorbe (Figura 3)

En el modelo clasico de Starling el resultado neto de las 4 fuerzas determina el movimiento de liquidos y solutos a traves de la membrana capilar.
PHc: presion hidrostatica capilar; PHi: presion hidrostatica del liquido intersticial;
POc: presiononcotica capilar; POi: presion oncotica del liquido intersticial.
Figura 3 Modelo Clasico de Starling
En el nuevo modelo, el subglicocálix es el espacio entre el glicocálix y el endotelio, y este es pobre en proteínas La presión oncótica del líquido intersticial es sustituida por la presión del subglucocálix (POsg). Es la presión oncótica de dicho espacio, la que determina la diferencia entre presión oncótica capilar y del subglicocálix (ΔPO), y no la POi. Tanto la PHi como la POsg son dinámicas y cambian según el flujo de agua desde o hacia el intersticio.
Bajo este nuevo propuesto, la absorción ocurre con menor frecuencia y tiene menor relevancia que la filtración, existiendo tanto en el extremo arteriolar como en el extremo venular del capilar (figuras 4 y 5).

En el nuevo modelo se integra la existencia del subglicocalix. Al aumentar la filtracion, esta lava el subglicocalix, disminuyendo su presion oncotica (POsg) y aumentando la diferencia de presion oncotica entre el capilar y el subglicocalix (ΔPO = POc - POsg). A su vez, lafiltracion genera aumento en la presion hidrostatica del intersticio (PHi), lo que generara mayor oposicion al filtrado, actuando como una retroalimentacion negativa, y evitando o disminuyendo la filtracion.
POc: presiononcotica capilar; POsg: presion oncotica del subglicocalix.
Figura 4 Nuevo modelo en el escenario de aumento de la filtración

Al disminuir la filtracion, se acumulan proteinas en el subglicocalix, lo que genera aumento de la presion oncotica del subglicocalix (POsg),disminuyendo asi la diferencia de presion oncotica entre el capilar y el subglicocalix (ΔPO = POc - POsg). La consecuente disminucion de la presión hidrostatica delintersticio (PHi) exhibira menor oposicion al filtrado, lo que actuara tambien como mecanismo de retroalimentacion negativa.
Figura 5 Nuevo modelo en el escenario de disminucion de la filtración
FACTORES QUE LESIONAN AL GLICOCÁLIX
El glicocálix es una estructura lábil, cuya composición cambia bajo los efectos de factores dañinos, lo que puede generar desde su deterioro hasta su destrucción. Diferentes agresiones, incluyendo la cirugía mayor, la inflamación sistémica, y el daño por isquemia-reperfusión, pueden alterar su integridad, provocando su ruptura y desprendimiento.
Los determinantes de la lesión al glucocálix pueden ser de varios tipos, y entre los más relevantes se encuentran: 1) fuerzas de tensión anormales, 2) especies reactivas de oxígeno (ROS), 3) aumento en el nivel plasmático de sustancias como sodio (hipernatremia), glucosa (hiperglucemia) y colesterol (hipercolesterolemia) y 4) moléculas proinflamatorias.
Cualquiera de estas situaciones, solas o combinadas, tienen la capacidad de provocar disfunción del glicocálix que se verá reflejado clínicamente como: disfunción endotelial, aumento de la permeabilidad vascular, infiltración de lipoproteínas en el subendotelio, activación del sistema de coagulación y aumento de la adhesión de leucocitos y plaquetas al endotelio3.
Cuando se interrumpe su función vasculoprotectora se presenta una grave disfunción endotelial que juega un papel decisivo en diversas enfermedades como la diabetes mellitus, el fenómeno isquemia/reperfusión, la ateroesclerosis y la sepsis12.
Algunas consecuencias del daño a la estructura del glicocálix son el edema pericapilar, el aumento de la permeabilidad a macromoléculas, la filtración de lipoproteínas al espacio subendotelial, el aumento del hematócrito capilar, la adhesión de leucocitos y plaquetas al endotelio y la activación de la coagulación plasmática13.
ENFOQUE TRASLACIONAL
Teniendo en cuenta las funciones del glicocálix, se han desarrollado potenciales blancos terapéuticos de uso clínico en patologías en las que existe disfunción del mismo.
Sepsis. Durante la inflamación aguda, el desprendimiento de glicocálix puede ser parte de la respuesta inmune controlada para mejorar la unión y reclutamiento de los neutrófilos y las plaquetas sitio de la lesión10. También puede ocurrir daño al glicocálix producido por el estado inflamatorio sistémico que lleva a la sobrexpresión de moléculas de adhesión y activación de heparanasa. Estas vías podrían ser modificadas farmacológicamente, evaluando la disminución de la trombosis microvascular y la fuga capilar.
Aterosclerosis. El vínculo entre la existencia de disfunción endotelial y la enfermedad coronaria ha sido ampliamente estudiado y se ha demostrado que el grado de disfunción guarda una relación significativa con la extensión del daño ateroesclerótico, el número de arterias coronarias afectadas y el grado de obstrucción arterial6. El objetivo en esta condición es restaurar el glicocálix y endotelio lesionado, disminuyendo la acumulación de colesterol y plaquetas (con estatinas y ácido acetilsalicílico). A nivel experimental se usan albúmina, heparán sulfato y condroitín sulfato y rhamnan sulfato.
Diabetes mellitus. El factor de daño endotelial es la hiperglicemia, y el blanco clínico es la restauración del glicocálix, a través del fármaco denominado Sulodexide, que es una mezcla de heparina, dermatán y condroitín sulfato, el cual inhibe la heparanasa y a la metaloproteinasa de matriz. Hasta el momento hay resultados alentadores en diabéticos tipo 2.
Isquemia. El daño al glicocálix, se da tanto por la isquemia, como por el fenómeno de reperfusión. Se plantea la medición de glucosaminoglicanos para determinar el grado de lesión endotelial13. Se utilizan fármacos que regeneran el glicocálix como el sulodexide, y se verifica la disminución del área de infarto, los niveles de proteína C reactiva y de las moléculas de adhesión intracelular a nivel miocárdico.
CONCLUSIONES
El glicocálix es una estructura fundamental para mantener la integridad y la función endotelial, y existen diferentes factores que lo dañan, provocando la degradación de sus componentes. Los componentes de degradación del glicocálix pueden brindar información sobre la severidad del daño, y así actuar como biomarcadores medibles.
Su disfunción tiene impacto en diversos escenarios patológicos, por lo que, su estudio y comprensión en el campo clínico, genera nuevas áreas de investigación, sobre todo en el de los fármacos, cuya finalidad debe ser la protección y/o restauración del glicocálix.











 nueva página del texto (beta)
nueva página del texto (beta)