Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista de la Facultad de Medicina (México)
versão On-line ISSN 2448-4865versão impressa ISSN 0026-1742
Rev. Fac. Med. (Méx.) vol.56 no.5 Ciudad de México Ago./Set. 2013
Artículos de revisión
Complejo trombomodulina, proteína C, receptor endotelial de proteína C en sepsis
Thrombomodulin complex, protein C, endothelial protein C receptor in sepsis
Raúl Carrillo Espera, Teresa de la Torre Leónb, Agustín Omar Rosalesb
a Academia Nacional de Medicina. Academia Mexicana de Cirugía. Jefe de la Unidad de Terapia Intensiva. Fundación Clínica Médica Sur. México, DF.
b Medicina del Enfermo en Estado Crítico. Fundación Clínica Médica Sur. México, DF.
Correo electrónico: revistamca95@yahoo.com.mx
Recibido: 02-julio-2012.
Aceptado: 18-octubre-2012.
Resumen
El choque séptico es una de las principales causas de muerte en la unidad de cuidados críticos y es un problema de salud pública. La respuesta inflamatoria sistémica descontrolada desempeña un papel crítico en la patogenia de la sepsis y del choque séptico. El desequilibrio de los mecanismos que controlan la coagulación e inflamación favorecen el desarrollo de coagulación intravascular diseminada. La interacción entre la inflamación y la coagulación es la pieza clave de la patogénesis de la sepsis y el choque séptico. La trombomodulina, proteína C, trombina y el receptor endotelial de la proteína C (TM-PC-T-REPC) forman un complejo en la superficie del endotelio que mantiene el microambiente endotelial en un estado antiinflamatorio y anticoagulante.
El objetivo de este trabajo es revisar el papel crítico que tiene el complejo TM-PC-T-REPC en la interacción entre inflamación y coagulación en sepsis y el uso de la trombomodulina recombinante como una nueva alternativa terapéutica para el manejo de la sepsis grave y el choque séptico.
Palabras clave: Sepsis, choque séptico, trombomodulina, trombina, proteína C, receptor endotelial de la proteína C.
Abstract
Septic shock is a leading cause of death in intensive care units and a public health problem. Uncontrolled systemic inflammatory response plays a critical role in the pathogenesis of sepsis and septic shock. Alterations in the mechanisms controlling coagulation and inflammation may lead to disseminated intravascular coagulation. The interaction between inflammation and coagulation is central to the pathogenesis of both septic shock and sepsis. Thrombomodulin, protein C, thrombin, and endothelial protein C receptor (T-PC-T-EPCR) bind simultaneously forming a complex on the surface of the endothelium. This complex maintains the endothelial microenviroment in an anti-inflammatory and anticoagulant state.
The objective of this paper is to review the critical role that TM-PC-T-EPCR complex plays in the interaction between inflammation and coagulation in sepsis and the use of recombinant thrombomodulin as a new therapeutic alternative in the management of serious sepsis and septic shock.
Key words: Sepsis, septic shock, Thrombomodulin, Thrombin, Protein C, Endothelial protein C receptor.
La sepsis grave y el choque séptico son de los principales motivos de ingreso a la Unidad de Terapia Intensiva (UTI) y representan un problema de salud pública. En Estados Unidos se reportan 750 mil casos anuales con una mortalidad de 30 a 50% en los casos de sepsis grave y hasta un 80 a 90% en pacientes en choque séptico y disfunción orgánica múltiple. La sepsis es secundaria a la respuesta inflamatoria sistémica desencadenada por un proceso infeccioso, esta respuesta inflamatoria induce lesión endotelial, activación de la coagulación y fibrinólisis que resultan en obstrucción y disfunción microvascular1.
La tasa de mortalidad de la sepsis ha tenido una tendencia gradual a la disminución durante la década pasada, esto gracias a los avances científicos y a la implementación de la campaña para incrementar la sobrevida en sepsis. La presencia de sepsis se considera de manera invariable con la asociación de cambios hemostáticos que pueden conducir a la activación subclínica de la cascada de coagulación y a la activación masiva de sistemas procoagulantes con la formación masiva de trombina, fibrina y eventualmente consumo de plaquetas y proteínas2. Así mismo, en pacientes sépticos se presentan manifestaciones trombóticas localizadas que incrementan el riesgo de tromboembolismo venoso3.
En presencia de infección se inicia una respuesta inflamatoria y amplificación del sistema de coagulación, las células endoteliales se lesionan y existe un desequilibrio entre la expresión de moléculas intracelulares de adhesión -1 (ICAM-1) y moléculas celulares de adhesión vascular -1 (VCAM-1), lo que permite la acumulación de leucocitos, el incremento de la permeabilidad y alteraciones en las vías de señalización de la cascada de coagulación que conducen a un círculo vicioso entre la activación de la inflamación y los trastornos de coagulación2,3.
Un mejor entendimiento de lo que ocurre en la inflamación y en la coagulación es fundamental para el manejo en los pacientes con sepsis, se reconoce que los sistemas de coagulación tienen un papel importante en la modulación de la inflamación no solamente a nivel molecular, sino en la interacción entre ambas vías. En la sepsis estas reacciones se modifican significativamente, lo que da como resultado un estado procoagulante que se asocia estrechamente con el inflamatorio, características comunes en la sepsis (figura 1).

El objetivo de este trabajo es revisar el papel que tiene el complejo trombomodulina (TM), proteína C (PC) y receptor endotelial de proteína C (REPC) en la fisiopatología de la sepsis, como integrador común de la coagulación e inflamación y su manipulación terapéutica como una nueva alternativa en los pacientes con sepsis.
TROMBOMODULINA
La TM se descubrió en el año de 1981 por Esmon y Owen, a partir de células endoteliales vasculares de pulmón de conejo, como un cofactor proteico para la activación de la PC mediada por trombina4. Fue purificada un año después por Esmon a partir de placenta humana y en 1984 se identificó su programación genética por Suzuki5. Una vez identificada se establecieron las bases para determinar si los mecanismos moleculares de coagulación, inflamación, fibrinólisis y proliferación estaban regulados por esta molécula6.
El gen de la TM se localiza en el cromosoma 20, mide 3.7 kb y carece de intrones, una característica compartida con otras proteínas como los receptores b-adrenérgicos, interferones alfa/beta y proteínas mitocondriales, este gen ha sido aislado y secuenciado a partir de diferentes especies7. En los seres humanos se distribuye extensamente en el endotelio vascular y en los linfáticos y funciona como un receptor para la trombina, una enzima central en la cascada de coagulación. La TM es una glicoproteína que se sintetiza por células endoteliales, está presente en megacariocitos, plaquetas, células de la glía y leucocitos polimorfonucleares, y su estructura muestra una analogía con los receptores de LDL.8
Esta glicoproteína con propiedades anticoagulantes está formada por 575 aminoácidos y su estructura se compone de 5 dominios (figura 2).

1. Dominio aminoterminal formado por un residuo de lecitina orientado hacia la luz vascular (223 a 226 aa D1).
2. Seis estructuras homólogas al factor de crecimiento epidérmico (236 a 240 aa, EGF, D2).
3. Dominio rico en serina y treonina (34 a 37 aa D3).
4. Dominio o región transmembrana (23 a 24 aa D4).
5. Dominio citoplasmático ( 36 a 38 aa D5)8,9.
El primer dominio D1 (TMD1) tiene actividad anticoagulante y desempeña un papel importante como mediador de las actividades antiinflamatorias. Este dominio contiene 155 de aminoácidos con una región N-terminal10.
La TM es una molécula alargada de 20 nm de cadena única y el TMD1 presenta una estructura nodular de 5 nm en el extremo más lejano de la membrana plasmática. La ubicación de TMD1 ofrece un sitio ideal para una interacción eficaz con otras moléculas. Su estructura y ubicación es similar a la del grupo de proteínas conocido como receptores de lectina tipo C. Estos receptores son proteínas transmembrana con un dominio lectina tipo C que inician la señalización intracelular y se unen a distintos patógenos para activar las vías de señalización intracelulares y de esta manera desencadenar una respuesta inflamatoria que es fundamental para la defensa del huésped10.
El dominio D2 (TMD2) tiene 6 estructuras similares al receptor de factores de crecimiento epidérmico (EFG) este dominio tiene actividad mitogénica mediada por la activación de la vía de la proteína C (MAPK). Se requiere el componente molecular EGF 3-4 para la activación de la PC y la estructura EGF 3-6 para la activación de TAFI9,11.
El tercer dominio rico en serina/treonina tiene sitios potenciales para el inicio de la glicosilación. En este dominio se une el sulfato de condroitina. Esta asociación incrementa la activación de la PC, acelera la neutralización de la trombina y facilita la unión del factor plaquetario 4(PF4) a la PC11.
El dominio D4 tiene una región transmembrana seguido por una porción citoplásmica corta.
El ultimo dominio D5 (citoplasmático) es un dominio transmembrana bien conservado seguido por una cola citoplásmica corta que contiene cisteína en el lugar donde se media la multimerización de la TM11.
PROTEÍNA C
La activación de la PC requiere de la formación del complejo trombina y la trombomodulina, que catalizan la activación de la PC a proteína C activada (PCa). Este proceso se acelera ante la proximidad de otra proteína de membrana, el receptor endotelial de la proteína C (REPC). La PCa en unión a su cofactor, la proteína S, hidroliza los factores Va y VIIIa, inhibiendo la formación de complejos factor IXa- VIIIa y factor Xa-Va (protrombinasa). El equilibrio entre la hemostasia normal y alguna situación patológica, está determinada por la actividad dual de la trombina en sus 2 mecanismos: el primero procoagulante (formación de fibrina y activación de las plaquetas) y el segundo con propiedades anticoagulante (activación de la PC).12
Estructura de la Proteína C
La proteína C (PC) es una glucoproteína de 62 kd con una concentración plasmática de 3 a 5 ug/ml, para su activación requiere de la formación de un complejo de unión de la trombina a la trombomodulina, posteriormente la PCa inicia la proteólisis de los factores VIIIa y va en la membrana celular12.
La PC es una proteasa que se sintetiza principalmente en el hígado, pero también se ha identificado al riñón, pulmón y cerebro como lugares de síntesis. Esta proteína está formada por 419 aminoácidos y el gen humano que la codifica (PROC) se encuentra en el cromosoma 2 (2p13-14)13. Las modificaciones traduccionales y post traduccionales más significativas son las siguientes: 1) la b-hidroxilación, 2) la N-glicosilación, 3) γ- carboxilación de sus 9 residuos de ácido glutámico, lo que da lugar a 9 residuos Gla en el extremo amino terminal (dominio Gla), este dominio es fundamental para su acción anticoagulante. El dominio Gla, en presencia del Ca++, interactúa con los fosfolípidos de carga negativa de la superficie celular, siendo el lugar clave para la interacción de la PC con su receptor endotelial (REPC). La conversión de la PC a su forma activada (PCa) es secundaria a la escisión del enlace peptídico Arg169-Leu170, que libera un dodecapéptido (residuos 158-169) de la cadena pesada. Esta reacción se ve facilitada por la trombina (T) unida a la TM y se incrementa por la interacción de la PC con el REPC en la superficie celular. Y la función anticuagulante de la PCa depende de su capacidad para inactivar dos cofactores de la cascada de la coagulación, el factor V/Va (FV/Va) y el FVIII/FVIIIa. Estas acciones son potenciadas por la presencia de Ca++, fosfolípidos y por la proteína S13.
La activación de la PC es catalizada en la superficie de las células endoteliales posterior a la unión T-TM. La TM funciona como un cofactor de alta afinidad de la trombina, lo que da como resultado un incremento en la activación de la PC en 1.000 veces, activación que se presenta cuando la PC está ligada a su receptor14.
La actividad anticoagulante de la PCa está dada por 2 cofactores, la proteína S y la forma intacta del FV. La proteína S inactiva FVa y la regulación del FVIIIa requieren de la acción sinérgica entre la PCa y la proteína S y el FV. La proteína S es otro de los componentes importantes de esta vía que entre otras funciones regula el sistema del complemento formando un complejo de alta afinidad con la proteína de unión C4b, un regulador de la vía clásica14. La PCa participa en la regulación del sistema fibrinolítico, función mediada por la capacidad para inhibir a 1) al inhibidor del activador del plasminógeno-1 (PAI-1) y 2) inhibidor de la fibrinolisis mediado por la trombina (TAFI).
Propiedades de la proteína C
Los efectos de la PC dependen de la presencia simultánea del REPC y del receptor-1 activado por proteasa (PAR-1) en la membrana celular. Este último, después de su activación por la PCa, desencadena la señalización intracelular de las acciones citoprotectoras que se dividen en: a) alteración de los perfiles de expresión genética, b) actividad antiinflamatoria, c) actividad antiapoptótica, y d) estabilización de la barrera endotelial (figura 3)15.
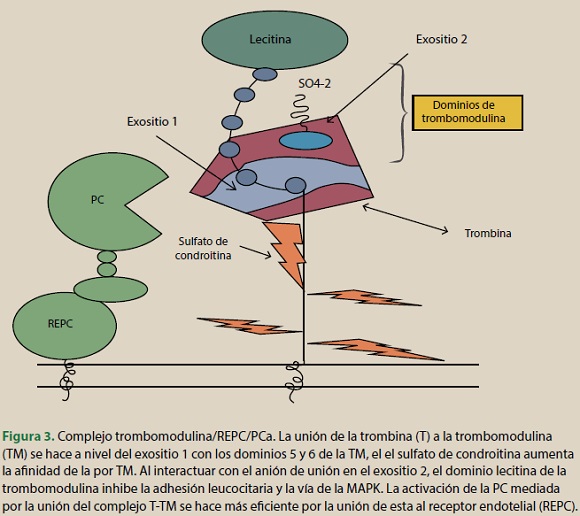
Alteración de los perfiles de expresión genética Las alteraciones en los perfiles de transcripción génica causados por la PCa sobre las células revelaron la modulación en la expresión de los genes de las principales vías de la inflamación y la apoptosis. Estos efectos se caracterizan por la regulación a la baja de las diferentes vías proinflamatorias y proapoptóticas y la regulación a la alza de las vías antiinflamatorias y antiapoptóticas15,16.
La PCa suprime el factor de transcripción nuclear κB (NFκB) mediante la modulación de genes que directamente reducen su expresión y su actividad funcional, induciendo la inhibición de la señalización de citoquinas y la inhibición del factor de necrosis tumoral (TNF), además de sobreexpresar el gen antiapoptótico Bcl-2 y suprimir la expresión de los genes proapoptóticos p53 y Bax. La PCa suprime los factores de transcripción, activados por la inflamación, (AP-1) c-Fos y b-Fos, que inducen directamente a la molécula de adhesión intercelular-1 (ICAM-1) y a la proteína quimiotáctica-1 de monocitos (MCP-1) en las células endoteliales. Esta modulación esta mediada por la participación e interacción de dos receptores, el REPC y el PAR-1. 17
Actividad Antiinflamtoria
La actividad antiinflamatoria vascular de la PCa se divide en sus efectos sobre las células endoteliales y los leucocitos. En las células endoteliales inhibe la liberación de los mediadores inflamatorios y regula las moléculas de adhesión vascular (ICAM-1, VCAM-1 y E-selectina), limitando la adhesión leucocitaria y la infiltración. En los leucocitos, disminuye la liberación de citocinas, lo que modula la intensidad de la respuesta inflamatoria sistémica y reduce la tormenta de citoquinas que se asocia con la sepsis. El REPC y el PAR-1, tienen un papel importante en las interacciones donde participa la proteinasa y el complejo integrina CD11b/CD18 (αM b2, Mac-1, CR3) en los neutrófilos activados18.
Actividad antiapoptótica
La actividad antiapoptótica de la PCa, requiere del sitio enzimático activo y de sus receptores REPC y PAR-1. Esta actividad depende parcialmente de la modulación de la expresión génica, la PCa inhibe la activación de varias caspasas, de tal forma que modifica tanto la activación de caspasas iniciadoras (caspasa-8 inducida por tPA) y la de caspasas efectoras (estaurosporina o caspasa-3 inducida por hipoxia o hipoglucemia)19
Estabilización de la barrera endotelial
La disrupción de la barrera endotelial es un factor clave en la patogénesis de la inflamación y como consecuencia se incrementa la permeabilidad, lesión celular y la perfusión microcirculatoria, procesos que contribuyen a la fisiopatología de la sepsis, la lesión pulmonar aguda y a la disfunción orgánica múltiple. En este contexto, la PCa actúa como un protector de la función de la barrera endotelial y para esta función requiere del REPC, PAR-1 y la esfingosina-1-fosfato (S1P). La PCa participa en una serie de procesos biológicos que se inician con la activación del PAR-1, el cual estimula a la esfingosina quinasa-1 (SphK-1) para formar S1P. Esta última, mediante la activación de su receptor (S1P1), es la responsable del incremento en la protección de la barrera endotelial. La S1P1 incrementa la sobrevida de las células participando en los mecanismos que regulan la expresión de los esfingolípidos (ceramida, esfingosina), los cuales representan la puerta de entrada de las señales que inician o previenen la muerte celular19,20.
ALTERACIONES DEL SISTEMA DE PROTEÍNA C EN SEPSIS
La sepsis se caracteriza por una grave disbalance proinflamatario/procoagulante, lo que da como resultado la obstrucción de la microcirculación e hipo-perfusión tisular. Las alteraciones de la coagulación son fundamentales en la fisiopatología del enfermo con sepsis, no solo por la obstrucción microcirculatoria que inducen, sino también porque son parte central para mantener el estado proinflamatorio21.
La disfunción de la coagulación en el enfermo con sepsis se caracteriza por:
a) Activación de la vía extrínseca de la coagulación (debida a un aumento inducido por citocinas proinflamatorias de la expresión del factor tisular en la superficie de los monocitos y las células endoteliales).
b) Inhibición de la fibrinólisis debido al incremento de la concentración del inhibidor del activador del plasminógeno PAI-1, principal inhibidor de la fibrinólisis.
c) disminución de los mecanismos anticoagulantes fisiológicos la antitrombina y la PC22.
Estos cambios conducen a la formación de depósitos intravasculares de fibrina. La trombina (responsable de la formación de la fibrina) conduce a una amplificación de la respuesta procoagulante y proinflamatoria, originando un círculo vicioso que causa daño a la célula endotelial, trombosis microvascular, disminución de la perfusión tisular y disfunción multiorgánica23.
TROMBOMODULINA EN SEPSIS
La TM funciona como receptor para la trombina es una de las principales enzimas involucradas en la cascada de coagulación. Cuando esta se encuentra libre inicia la coagulación de manera directa convirtiendo el fibrinógeno en fibrina y de manera indirecta mediante la activación de factores de coagulación (V,VIII,XIII) y de la activación plaquetaria24. Cuando se forma el complejo trombina-Trombomodulina (T-TM) se activa la PC, actuando de manera directa sobre la cascada de coagulación inactivando proteolíticamente los cofactores esenciales como el factor Va y VIIa dando como resultado un incremento en la actividad anticoagulante. Este complejo esta implicado en la activación del inhibidor de la fibrinólisis activado por trombina (TAFI) que tiene como consecuencia la inhibición de la fibrinólisis25.
Un estímulo lesiona la pared vascular y desencadena respuestas inmediatas con trastornos trombóticos, se inicia la cascada de coagulación y de esta manera se genera de manera inicial trombina que tiene como principal capacidad convertir el fibrinógeno en fibrina. La TM funciona como receptor de la trombina de manera reversible, cuando existe esta unión la enzima procoagulante tiene efectos anticoagulantes, por la inhibición de la cascada de coagulación dada por las siguiente manera: unión de trombina a trombomodulina (T-TM) activa la PC convirtiendo un cimógeno en una proteasa de serina activa. Esta proteína en su forma activada de manera proteolítica desactiva a los componentes procoagulantes como los factores VA y VIIIa que inhiben a su vez la conversión de protrombina en trombina25.
El dominio D1 de la trombomodulina tiene efectos antiinflamatorios. Estudios con ratones se eliminó la proteína (TMLeD / LED) y en respuesta a la estimulación de un lipopolisacarido (LPS) se liberaron citocinas inflamatorias, factor de necrosis tumoral y la interleucina-1, como consecuencia se presentó una reacción inflamatoria grave posterior a la estimulación con el LPS. En estos ratones transgénicos se presenta un aumento en la respuesta de los leucocitos polimorfonucleares a nivel pulmonar posterior a la inhalación de bacterias gram-negativas e inherentemente se incrementa la mortalidad en la sepsis inducida por esta endotoxina26. Estudios in vitro mostraron que en células endoteliales aisladas de los ratones TMLeD / LED, se presenta una mayor expresión de ICAM-1 y VCAM-1, e incremento de la adherencia de neutrófilos al endotelio27. La TMD1 recombinante (rTMD1) reduce la adhesión de neutrófilos al endotelio e inhibe la activación del factor nuclear kappa B y las vías activadas por proteincinasa y la supresión TMD1 no interfiere con la activación de la proteína C, que tiene efecto directo antiinflamatorio de TMD1. La TMD1 mantiene la adhesión célula-célula y la integridad de las uniones endoteliales manteniendo la estructura y función de los vasos sanguíneos9,26,27.
Los mecanismos moleculares que median los efectos antiinflamatorios de la TMD1 se resumen en los siguientes puntos:
1. Las proteínas de alta movilidad 1 (HMGB1) liberadas por células necróticas o células antiinflamatorias (monocitos) posterior a su estimulación por citocinas, se consideran proinflamatorias y se ha convertido en un objetivo de tratamiento para los estados proinflamatorios de los que destaca la sepsis. HMGB1 se une al receptor endotelial de las superficies celulares a los receptores toll-like (semejantes a Toll) y a los receptores de los productos de la glucosilación avanzada, como consecuencia se activan diferentes vías proinflamatorias induciendo daño tisular28.
2. La unión de HMGB1 con los receptores de los productos de la glucosilación avanzada disminuye el efecto proinflamatorio de HMGB1 y la inflamación. Después de unirse a TMD1, la HMGB1 es degradada por el complejo formado por la trombina-TM con menores efectos proinflamatorios y con regulación a al baja de la respuesta inflamatoria28.
3. Los lipopolisacaridos (LPS) son componentes de la pared celular de las bacterias gramnegativas y actúa como una endotoxina que provoca una respuesta inflamatoria grave secundaria al proceso infeccioso. El LPS se une al receptor CD14 de la superficie celular y traduce señales desde la membrana celular al citosol, iniciando la vía de señalización inflamatoria. La TMD1 o rTMD1 se une directamente al LPS y bloquea la interacción de los LPS con CD14 y en consecuencia reduce la reacción inflamatoria inducida por el LPS, disminuye la liberación de citocinas proinflamatorias y la expresión de la sintasa de óxido nítrico. Estos fenómenos indican que la TMD1 funciona como una opsonina natural de la inmunidad innata contra bacterias gramnegativas. Su actividad antiinflamatoria se relaciona directamente con su capacidad para suprimir la activación del sistema de complemento ya que produce una inhibición a baja de la vía alterna del complemento mediante una mejoría de los inhibidores endógenos del complemento, del factor de complemento I y H para tener como vía final la inactivación de C3b, que funciona como vía proinflamatoria. En pacientes con mutaciones genéticas del complejo TM/TMD1 presentan sobreactivación de complemento y como consecuencia respuesta inflamatoria grave29.
La trombomodulina tiene diversas propiedades anticoagulantes la principal es que funciona como anticoagulante en la unión TM-trombina (T-TM) donde inhibe la capacidad de la trombina de convertir enzimáticamente el fibrinógeno en fibrina29.
La segunda propiedad es la que se produce por el complejo T-TM y es la conversión de la PC en PCa de tal modo que la velocidad de activación de la proteína C aumenta 20,000 veces. Los iones calcio unidos al dominio Gla (gamma-carboxiglutámico) de la PC, favorecen la interacción de esta con el complejo T-TM. Los fosfolípidos de carga negativa son considerados como los principales iniciadores de la actividad de la TM y la PCa es un agente antitrombótico que tiene la capacidad de hidrolizar enzimáticamente los cofactores Va y VIIIa, e inhibe sus actividades en el proceso de coagulación. Con la presencia de la proteína S, la velocidad de activación de los cofactores Va y VIIIa mediada por hidrólisis, se incrementa 25 veces comparada con la hidrólisis en ausencia de la proteína S. El mecanismo de acción de la TM es uno de los más importantes del endotelio vascular para mantener el estado anticoagulante normal de su superficie, ya que la TM ejerce su actividad anticoagulante no sólo por inhibición de la trombina, sino también por la aceleración de la generación de PCa29.
Las propiedades antiinflamatorias de TM pueden explicarse en parte por el concepto de que la afinidad de la trombina a la TM es probablemente mayor que la de otros factores en las vías pro y anticoagulantes lo que podría hacer que la TM se considere como un inhibidor de la trombina circulante30.
El Factor de necrosis tumoral α-(TNF-α) induce la internalización de TM a través de la endocitosis, reduciendo así su expresión en la superficie, esta reducción de la expresión TM en los sitios de lesión inflamatoria puede exacerbar la coagulación sanguínea. En efecto, la supresión de TM a nivel endotelial causa de manera espontánea trombosis tanto arteriales y venosas lo que indica que la TM tiene una función muy importante en la prevención de la formación de trombos30.
La trombomodulina tiene propiedades antiinflamatorias, especialmente la rTMD1, por lo que puede tener un potencial efecto terapéutico en enfermedades inflamatorias. La sepsis es un síndrome clínico causado por una respuesta inflamatoria sistémica inducida por un proceso infeccioso. La endotoxina o LPS del patógeno infeccioso es responsable de los eventos fisiopatológicos que se producen durante la sepsis y conduce al inicio de la respuesta inflamatoria y el inicio de la cascada de coagulación30.
Los efectos antiinflamatorios de la trombomodulina en sepsis son dependientes de la PCa. La TM puede mediar distintas actividades antiinflamatorias utilizando mecanismos de PCa-dependientes y PCa-independiente, en función al escenario que se presente30,31.
Mecanismo dependiente de PCa
La TM realiza sus actividades antiinflamatorias mediante el incremento de la activación de la PC. El resultado es una regulación a la baja en la producción de citoquinas inflamatorias al disminuir la expresión de NF-kB y de la inhibición de los componentes de translocación nuclear9,30.
Los efectos antiinflamatorios dependen de PCa, REPC, y el PAR-1. La unión de la PC/PCA a REPC resulta en el acoplamiento de este complejo en las células endoteliales a través del PAR-1. Tanto el PAR-1 y REPC se asocian a la caveolina 1 formando complejos que dan lugar a la disociación de REPC. Este proceso favorece los efectos antiinflamatorios de las células endoteliales9,30.
La PC activada mejora la barrera endotelial a través de la activación del receptor de señalización de la esfingosina1- fosfato (S1P), la mejoría de la función de la barrera endotelial proporciona efectos antiinflamatorios al disminuir la migración de leucocitos a los sitios de inflamación. El receptor de la apolipoproteína E2 (ApoER2) y angiopoyetina (Ang)/Tie2 tienen propiedades citoprotectoras y antiinflamatorias. Además de actuar sobre las células endoteliales, se ha demostrado que la PCa tiene efectos directos sobre los leucocitos diana y neutraliza la citotoxicidad de las histonas celulares que son liberadas a partir de leucocitos que mueren. La reducción de los niveles de la PCa en pacientes con sepsis se asocia con un incremento en la tasa de morbimortalidad9,30.
Mecanismo independiente de PCa
LA TM modula la fibrinólisis y la inflamación a través del TAFI, que es un zimógeno circulante activado por el complejo T-TM. El TAFI activado elimina los residuos de lisina en el extremo C-terminal de fibrina, suprimiendo así la incorporación de plasminógeno y activador del plasminógeno tisular (t-PA) en el coágulo de fibrina. La activación de TAFI por TM inhibe la fibrinólisis, impidiendo la disolución de los coágulos. Esta actividad complementa la función de TM inducida por la PCa para evitar la formación de nuevos trombos, equilibrando así la hemostasia9,30.
Las alteraciones en la fibrinólisis también afectan el proceso inflamatorio. El TAFI actúa sobre mediadores proinflamatorios como los factores de complemento, anafilotoxinas, bradicinina y osteopontina. Independientemente de la PCa, la TM tiene actividades antiinflamatorias a través del dominio EGF, dominio N-terminal que se une a la trombina, inhibiendo las actividades proinflamatorias de la trombina que incluyen, inducción del oxido nítrico, expresión de la óxido nítrico sintetasa, la actividad quimiotáctica de monocitos, neutrófilos, la regulación positiva de moléculas de adhesión de leucocitos, aumento de la IL-6 e IL-8, activación de células endoteliales, actividad mitogénica de los linfocitos, de los fibroblastos, macrófagos, células mesangiales y los osteoblastos30.
Algunas de las propiedades proinflamatorias están mediadas por la activación del PAR. La unión de TM a trombina disminuye el PAR-1 e induce la activación de ERK1/2 y suprime los efectos mito-génicos de trombina. Las actividades antiinflamatorias del dominio N-terminal similar a lectina, se cree que actúan de forma de PCa-independientes, ya que este dominio es prescindible para la generación de PC. Los ratones mutantes que expresan TM que carece del dominio de lecitina no se vio alterada la generación de PCa, sin embargo, estos ratones exhibían una mayor susceptibilidad a la endotoxina y de manera secundara la inducción de la sepsis es mas grave. Las células endoteliales aisladas de los ratones mostraron elevada expresión de ICAM-1, que regula la adhesión de los leucocitos. Así el dominio N-terminal de lecitina inhibe el TNF-α, induce la fosforilación de ERK y restaura la adhesión de los leucocitos a las células endoteliales. Además, disminuye la apoptosis por la modulación de las vías de señalización del NF-kB.
La TM ejerce efecto antiinflamatoria en el grupo de proteínas HMGB1, proteínas de expresión nuclear que se liberan por células necróticas, que se unen a los receptores de los productos finales de glicación (RAGE). Esta unión RAGE-HMGB1 es el inicio de la vía de señalización implicada en la patogénesis o progresión de varias enfermedades clínicas, infecciones, sepsis, artritis y cáncer. El dominio lectina interfiere con la unión de RAGE-HMGB1, lo que afecta el inicio de esta vía y antagoniza la función de HMGB19,30.
E) NUEVOS HORIZONTES EN LA MODULACIÓN TERAPÉUTICA DEL SISTEMA TM/REPC/PCA EN LA PRÁCTICA CLÍNICA
El sistema de la PC tiene un papel esencial en la protección frente a la enfermedad trombótica, principalmente frente al tromboembolismo venoso, que se desencadena cuando la trombina se une a su receptor, la TM, sobre la superficie de la célula endotelial, y pasa de ser una molécula procoagulante a ejercer funciones anticoagulantes. A su vez, la PC circulante se une a su receptor, el receptor endotelial de la proteína C, el complejo formado por estas proteínas permite la conversión PC en PCa, proceso que es potenciado por el REPC. Este receptor se une a la PC y a la PCa con la misma afinidad (Kd ~ 30 nM)1. Una vez activada, la PCa puede disociarse del REPC con la ayuda de la proteína S (PS) y ejercer su función anticoagulante inhibiendo los factores Va y VIIIa, disminuyendo la generación de trombina. Sin embargo, la PCa puede ejercer otras funciones importantes. Si la PCa permanece unida al REPC sobre la superficie endotelial, puede activar el receptor activado por proteasas de tipo 1 (PAR-1) mediante un corte proteolítico y expresar sus funciones citoprotectoras incluyendo la actividad antiinflamatoria, antiapoptótica y neuroprotectora31.
La TM tiene la capacidad dual para suprimir tanto la vía de coagulación como la inflamación, estas características hacen que sea considerada como un fármaco prometedor para el tratamiento de la coagulopatía y del choque séptico32.
La endotoxina o LPS del patógeno infeccioso es responsable de los eventos fisiopatológicos que se producen durante la sepsis sistémica y que inician todas las alteraciones a nivel de la coagulación y de la inflamación. Como complicaciones más frecuentes de estas dos vías se encuentra la presencia de coagulación intravascular diseminada (CID) y síndrome de insuficiencia respiratoria aguda, ambas complicaciones frecuentes en la sepsis y con una elevada mortalidad. Se han estudiado en varios modelos animales de sepsis el uso de TM recombinante. En ratas, el tratamiento previo con la TM recombinante (rTMD123) redujo significativamente la mortalidad inducida por sepsis. El tratamiento con rTMD123 disminuyó la infiltración de células inflamatorias, los niveles de TNF-α, interleucina 6 y HMGB1, a nivel pulmonar y hepático32.
En un estudio in vitro se demostró que la administración rTMD123 inhibe el factor nuclear-kappa B, en modelos murinos de sepsis disminuyendo de manera significativa los niveles de TNF-α y la respuesta inflamatoria a nivel pulmonar teniendo como consecuencia la disminución en la mortalidad secundaria a sepsis en aquellos modelos que recibieron tratamiento a base de rTMD1. Esta evidencia sugiere que la proteína recombinante TM puede ser utilizada como herramienta para el tratamiento de pacientes con sepsis31,32.
La activación de la PC es deficiente en la sepsis, contribuyendo a la formación excesiva de depósitos de fibrina en la circulación. La deficiente activación de la PC en la sepsis se explica por la disminución de la expresión de la TM, la degradación del complejo de activación de la PC (complejo trombina-trombomodulina), la disminución de la expresión del REPC y la formación de complejos proteína S-C4bBP. Estos cambios justifican el interés por administrar PC en su forma activada, más que PC (inactiva) como tratamiento de la coagulopatía de la sepsis. Ante la actividad anticoagulante, citoprotectora de la PCa se tienen diversos mecanismos de acción como posibles agentes terapéuticos32.
La trombomodulina recombinante humana (ART-123) está compuesta por el dominio activo, extracelular de la trombomodulina. Este dominio se une a la trombina para inactivar la cascada de la coagulación y el complejo de la trombina-ART-123 produce PCa que en presencia de la proteína S inactiva los factores Va y VIIIa, inhibiendo la formación de trombina. La ART-123 tiene una vida media más larga (aproximadamente 20 h) y se ha demostrado que tiene un margen de seguridad más amplio que otros anticoagulantes así como un perfil antitrombótico con disminución en el sangrado en experimentos in vitro. Por lo que se postula el uso de la ART-123 en el tratamiento de CID 33.
Se realizó un estudio multicéntrico, doble ciego, aleatorizado, de grupos paralelos para comparar la eficacia y la seguridad de la TM recombinante humana ( ART-123) comparada con dosis bajas de heparina en el tratamiento de la CID asociada con enfermedad hematológica o infección. La variable principal de eficacia fue la tasa de resolución de la CID, teniendo como resultado que la CID se resolvió en el 66,1% en el grupo donde se utilizó la del grupo ART-123, en comparación con el 49,9% del grupo de heparina. Los pacientes del grupo ART-123 también mostraron mejoría en las manifestaciones de hemorragia. La conclusión de los autores fue que en comparación con la terapia con heparina, ART-123 mejora significativamente la CID y disminuye la hemorragia en enfermos con sepsis y CID.33 Las tendencias sobre la mortalidad en los pacientes con CID asociados con la infección no tuvieron significancia estadística aunque la tasa de mortalidad para el grupo ART-123 fue de 6,6% menor que para el grupo de heparina.

En comparación con la PCa la TM tiene una vida media más larga y posee una estructura única N-terminal que es la que exhibe la actividad antiiflamatoria por lo que podría utilizarse como tratamiento en los pacientes sépticos.33 Sería interesante investigar si ART-123 reduciría significativamente la tasa de mortalidad en un estudio clínico a gran escala, en comparación con el placebo, en pacientes con CID secundaria a sepsis.
CONCLUSIONES
El complejo TM-PC-REPC en su papel dual modula las vías inflamatorias y procoagulantes disminuyendo la amplificación de estos epifenómenos que impactan de una manera favorable en el sustrato fisiopatológico de los pacientes con sepsis. La consecuencia es la disminución de la cascada de eventos que conlleva al colapso y trombosis de la microcirculación que genera isquemia y daño celular por radicales libres estos eventos biomoleculares convergen finalmente en el desarrollo de falla orgánica múltiple y muerte. Esta última como la expresión del rotundo fallo en la interacción del complejo TM-PC-REPC, el cual es un potencial blanco terapéutico para el manejo del paciente séptico.
REFERENCIAS BIBLIOGRÁFICAS
1. Carrillo ER , Carrillo CJ, Carrillo CL. Manejo de la sepsis con paquetes terapéuticos de la Campaña para Incrementar la Supervivencia en Sepsis. Med Int Mex 2008;24:43-45. [ Links ]
2. Esmon C, Fukudome K, Mather T, Bode W, Regan L, Stearns-Kurosawa D et al. Inflammation, sepsis and coagulation. Haematologica 1999; 84:254-259. [ Links ]
3. Esmon N, Owen W, Esmon C. Isolation of a membranebound cofactor for thrombin catalized activation of protein C. J Biol Chem 1982;257:859-864. [ Links ]
4. Esmon C, Owen W. Identification of an endothelial cofactor for thrombin-catalized activation of protein C. Pro Nat Acad Scid 1981;78:2249-2252. [ Links ]
5. Suzuki K, Kusumoto H, Deyashiki Y, Nishioka J, Marumaya I, Zushi M. Structure and expression of human thrombomodulin, a thrombin receptor on endothelium acting as a cofactor for protein C activation. EMBO J 1987;6:1891-1897. [ Links ]
6. Salem H, Marumaya I, Marejus P. Isolation and characterization of thrombomodulin from human placenta. J Biol Chem 1984;259:12246-12251. [ Links ]
7. Fink L, Eidt J, Johnson K, Cook J, Cook C, Morser J et al. Thrombomodulin activity and localization. Int J Dev Biol 1993;37:221-226. [ Links ]
8. Van de Wouwer M, Conway M, Novel functions of thrombomodulin in inflammation. Crit Care Med 2004;32:254-261. [ Links ]
9. Okamosto T, Tanigami H, Shimaoka M. Thrombomodulin: a bifunctional Modulator of Inflammation and Coagulation in Sepsis. Crit Care Res Pract 2012;ID 614545. [ Links ]
10. Yi H, Cheng K, Guey S, Hua W. The role of thrombomodulin lectin-like domain in inflammation. J Biom Sci 2012;19:34-39. [ Links ]
11. Esmon C, Esmon N, Harris K. Complex formation between thrombin and thrombomodulin inhibits both thrombin-catalized fibrin formation and factor V activation. J Biol Chem 1982;257:7944-7997. [ Links ]
12. Esmon C. The Protein C Pathway. Chest 2003;124:26-32. [ Links ]
13. Lorente J. El Sistema De La Proteína C En La Sepsis. Med Intensiva 2003;27:171-173. [ Links ]
14. Arqueros V, Velasco F. El papel de la vía de la proteína C en la inflamación: Implicaciones terapéuticas. Hematologica 2011;96:43-48. [ Links ]
15. Joyce E, Gelbert L, Ciaccia A, DeHoff B, Grinnell B. Gene expression profile of antithrombotic protein C defines new mechanisms modulating inflammation and apoptosis. J Biol Chem 2001;276:11199-11203. [ Links ]
16. Franscini N, Bachli E, Blau N. Gene expression profiling of inflamed human endothelial cells and influence of activated protein C. Circulation 2004;110:2903-2909. [ Links ]
17. Riewald M, Ruf W. Protease-activated receptor-1 signaling by activated protein C in cytokine perturbed endothelial cells is distinct from thrombin signaling. J Biol Chem 2005;280:19808-19814. [ Links ]
18. Cao C, Gao Y, Li Y. The efficacy of activated protein C in murine endotoxemia is dependen ton integrin CD11b. J Clin Invest 2010;120:1971-1980. [ Links ]
19. Liu D, Cheng T, Guo H. Tissue plasminogen activator neurovascular toxicity is controlled by activated protein C. Nat Med 2004;10:1379-1383. [ Links ]
20. Feistritzer C, Riewald M. Endothelial barrier protection by activated protein C through PAR1-dependent sphingosine 1-phosphate receptor-1 crossactivation. Blood 2005; 105:3178-3184. [ Links ]
21. Takano S, Kimura S, Ohdama S, Aoki N. Plasma thrombomodulin in health and diseases. Blood 2000;76:2024- 2029. [ Links ]
22. Fukudome K, Kurosawa S, Stearns-Kurosawa J. The endothelial cell protein C receptor: cell surface expression and direct ligand binding by the soluble receptor. J Biol Chem 1996;271:17491-17498. [ Links ]
23. Stearns-Kurosawa J, Kurosawa S, Mollica J. The endothelial cell protein C receptor augments protein C activation by the thrombin-thrombomodulin complex. Proc Natl Acad Sci 1996;93:10212-10216. [ Links ]
24. Conway M, Van de Wouwer S, Pollefeyt E. The lectinlike domain of thrombomodulin confers protection from neutrophil mediated tissue damage by suppressing adhesion molecule expression via nuclear factor κB and mitogen activated protein kinase pathways. J Exp Med 2002; 196:565-577. [ Links ]
25. Esmon N, Carroll R, Esmon C. Thrombomodulin blocks the ability of thrombin to activate platelets. J Biol Chem 1983;258:12238-12242. [ Links ]
26. Hofsteenge R, Taguchi H, Stone S. Effect of thrombomodulin on the kinetics of the interaction of thrombin with substrates and inhibitors. Bioch Journal 1986;237:243-251. [ Links ]
27. Tsiang S, Lentz R, Sadler E. Functional domains of membrane bound human thrombomodulin. J Biol Chem 1992;267:6164-6170. [ Links ]
28. Villoutreix B, Dahlback B. Molecular model for the C-type lectin domain of human thrombomodulin. J Mol Model 1998;4:310-322. [ Links ]
29. Weisel J, Nagaswami C, Young T, Light D. The shape of thrombomodulin and interactions with thrombin as determined by electron microscopy. J Biol Chem 1996;271: 31485-31490. [ Links ]
30. Conway E. Thrombomodulin and its role in inflammation. Sem Immunopathol 2012;34:107-125. [ Links ]
31. Semeraro N, Ammollo C, Semeraro F, Colucci M. Sepsis, thrombosis and organ dysfunction. Thromb Res 2012;129:290-295. [ Links ]
32. Faust S, Heyderman S, Levin M. Coagulation in severe sepsis: a central role for thromomodulin and activated protein C. Crit Care Med 2001;29:62-68. [ Links ]
33. Saito H, Maruyama I, Shimazaki S, Yamamoto Y, Aikawa N, Ohno R, et al. Efficacy And Safety Of Recombinant Human Soluble Thrombomodulin (Art-123) In Disseminated Intravascular Coagulation: Results Of A Phase III, Randomized, Double-Blind Clinical Trial. Thromb Haemost 2012;5:31-34. [ Links ]















