Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Facultad de Medicina (México)
versión On-line ISSN 2448-4865versión impresa ISSN 0026-1742
Rev. Fac. Med. (Méx.) vol.56 no.6 Ciudad de México nov./dic. 2013
Casos clínicos
Aspergilosis diseminada: hallazgos postmortem en un caso de sepsis materna. ¿Es el embarazo un estado de inmunosupresión?
Disseminated aspergillosis: postmortem findings in a case of maternal sepsis
Miguel Fernando Salazar Moralesa y Elio Germán Recinos Carrerab
a Estudiante de posgrado de la Especialidad en Anatomía Patológica. Hospital General "Dr. Manuel Gea González". México, DF.
b Médico adscrito a la División de Anatomía Patológica. Hospital General "Dr. Manuel Gea González". México, DF.
Contacto:
Salazar Morales Miguel Fernando.
División de Anatomía Patológica del Hospital General "Dr. Manuel Gea González".
Calzada de Tlalpan 4800, col. Sección XVI,
Delegación Tlalpan, C.P. 14080,
México D.F. Tel.: 4000 3000, ext.: 3302.
Correo electrónico: k7nigricans@hotmail.com.
Recibido: 30-octubre-2012.
Aceptado: 17-septiembre-2013.
Resumen
Se comunica un caso de muerte materno-fetal con diagnóstico de aspergilosis diseminada concluido a través del estudio de autopsia.
Caso: Mujer de 20 años de edad con antecedente de preeclampsia quien en su segundo embarazo inició con dolor obstétrico asociado a fiebre y ataque al estado general. El trabajo de parto concluyó con la expulsión de un feto óbito macerado y placenta fétida, hipotonía uterina e inestabilidad hemodinámica. Fue referida a segundo nivel, cursaba con fiebre persistente, foco séptico pélvico, trastornos de la ventilación, evidencia de lesiones encefálicas por tomografía, sangrado de tubo digestivo, oliguria, datos de respuesta inflamatoria sistémica y necrosis bilateral de miembros inferiores. Falleció a los 10 días de haber sido internada.
Resultados: En el examen necrológico, la División de Anatomía Patológica halló pulmones con áreas extensas de consolidación y hemorragia, corazón con vegetaciones valvulares y murales, así como cerebro con múltiples lesiones similares a infarto. La microscopía de luz reveló la presencia de hifas septadas ramificadas en ángulos de 45° que transgredían el lumen de arterias en pulmón, asentadas sobre la superficie endocárdica e invadían el miocardio, el espacio subaracnoideo y neurópilo. Dichas hifas también se identificaron en los cortes histológicos de tiroides, tráquea, estómago y riñón.
Conclusión: La aspergilosis diseminada es una entidad de elevada letalidad que usualmente afecta a pacientes inmunocomprometidos, específicamente a quienes cursan con neutropenia. Si bien durante el embarazo el sistema inmune experimenta determinadas adaptaciones fisiológicas, éstas no predisponen per se al desarrollo de infecciones oportunistas.
Palabras clave: Aspergillus spp, aspergilosis pulmonar invasiva, aspergilosis diseminada, inmunología del embarazo, respuesta inflamatoria durante el embarazo.
Abstract
We describe autopsy findings in a case of maternal death caused by invasive aspergillosis in its disseminated form.
Case: 20 year old female with previous medical history of preeclampsia who started with malaise, pelvic pain and fever during her second pregnancy. A fetal obitus was obtained after labor although she remained with uterine hypotony and hemodynamic unsteadiness. She was referred to a general hospital subsisting with fever, acute pelvic sepsis, deteriorated ventilatory function, cerebral lesions visualized by tomography, gastrointestinal bleeding, oliguria and systemic inflammatory response with bilateral acral lower extremities necrosis. She died ten days after her arrival and autopsy was authorized.
Results: Necropsy uncovered lungs with consolidated areas and extensive haemorrhage, valvular and mural heart vegetations and numerous cerebral lesions with infarct-like appeareance. Light microscopy revealed the presence of septate hyphae with regular acute angle branching invading lung microvasculature, endocardial surface, myocardium, Virchow-Robin space and neuropil. The hyphae were also identified in thyroid, trachea, gastric mucosa and kidney histological sections.
Conclusion: Disseminated aspergillosis is a high-mortality infectious process that usually affects immunocompromised patients, specially those coursing with neutropenia. Despite immunological changes experienced as part of normal pregnancy, these per se do not predispose the mother to infections caused by opportunistic pathogens.
Key words: Aspergillus spp, invasive pulmonary aspergillosis, disseminated aspergillosis, immunology of pregnancy, inflammation during pregnancy.
El género Aspergillus está constituido por especies saprofitas de ascomicetos con distribución ambiental ubicua cuyas formas infectantes, conidias, al ser inhaladas poseen el potencial de incitar un proceso mórbido cuyo progreso depende en gran medida del estado de competencia inmune del anfitrión1-4.
CASO (PRIMERA PARTE)
Mujer de 20 años de edad con antecedente de preeclampsia, quien inició su padecimiento final en marzo del 2011, durante el tercer trimestre de su segunda gestación, con ataque al estado general, fiebre y posterior aparición de dolor obstétrico intenso acompañado de sangrado transvaginal. Fue conducida a la unidad local de cuidados médicos donde se presentó con dilatación y borramiento completos, salida de líquido serohemático fétido y expulsión de un óbito macerado con doble circular a cuello. La paciente persistió con hipotonía uterina e inestabilidad hemodinámica, motivo por el cual fue referida al Hospital General "Dr. Manuel Gea González", donde se recibió con datos francos de choque. Dada la consideración de un foco infeccioso a nivel pélvico, se optó por el manejo quirúrgico mediante la exenteración de matriz y anexos.
Descripción de la pieza quirúrgica y hallazgos histológicos
La División de Anatomía Patológica recibió un producto de histerectomía subtotal con salpingooforectomía izquierda (20 X 17 X 4 cm; 1,200 g) al cual se asignó el número de serie "B1088-11". El útero conservaba su morfología piriforme y exhibía superficie externa rosada, lisa y brillante (figura 1a) que contrastaba pronunciadamente con la superficie de corte y evidenciaba cavidad uterina dilatada en 17 X 11 cm, tapizada por decidua café verdosa y opaca, de aspecto necrótico, con placas constituidas por restos hemáticos adheridos (figura 1b). Los anexos consistían en segmento de salpinge (7 X 0.5 cm) café claro, liso y opaco con luz puntiforme al corte; además de ovario (4 X 3 X 1.5 cm) irregularmente ovoide, café violáceo, de consistencia blanda con superficie de corte café grisácea y opaca.

A nivel histológico se observaron vastas comarcas de necrosis coagulativa del componente decidual con extensión hacia las fibras miometriales inmediatas (figura 1d); incluso salpinge y ovario exhibían cambios acentuados de necrosis isquémica (figura 1c).
La pieza quirúrgica fue diagnosticada como producto de histerectomía postgestacional con decidua, miometrio y anexos con necrosis isquémica multifocal e inflamación aguda.
CASO (SEGUNDA PARTE)
Durante su estancia la paciente permaneció bajo sedación, apoyo mecánico ventilatorio, y cursaba con oliguria, hipotensión refractaria y fiebre de hasta 39.6 °C. Los parámetros de laboratorio mostraron anemia, leucocitosis con 91% de neutrófilos, trombocitopenia, tiempos de coagulación prolongados, hiperbilirrubinemia y elevación de aminotransferasas. Asimismo se realizó tomografía simple de cráneo, que reportó la presencia de múltiples imágenes hipodensas, bilaterales, supra e infratentoriales compatibles con infartos, metástasis o diseminación de un proceso infeccioso.
En sus últimos días se observó la presencia de edema generalizado, piel marmórea y poiquilotérmica con necrosis acral ascendente de las extremidades inferiores. El deterioro progresivo de la función cardiaca y la aparición de asistolia culminó en el fallecimiento de la paciente a los 10 días de estancia intrahospitalaria.
Se autorizó el estudio de necropsia enviándose con los diagnósticos clínicos finales de puerperio patológico tardío posparto eutócico y choque séptico probablemente secundario a corioamnioitis.
EXAMEN POSTMORTEM: PROSECCIÓN Y HALLAZGOZ HISTOPATOLÓGICOS
La División de Anatomía Patológica llevó a cabo el estudio de necropsia "A17-11" en el cuerpo sin vida de una mujer de edad similar a la cronológica, con facies hipocrática y tegumentos marmóreos con cambios de coloración acral negro violácea en ambos pies y manos, acompañados de formación de vesículas con epidermólisis secundaria. A nivel abdominal se observó una herida quirúrgica de 13 cm infraumbilical, longitudinal, bien afrontada, así como un drenaje próximo que contenía 350 ml de líquido serohemático.
Tras la apertura de cavidades, retiro y disección de sistemas por el método de Rokitansky, los cambios anatómicos de mayor trascendencia se encontraron en pulmones, corazón y encéfalo. La pleura visceral mostraba tonalidad café grisácea y opaca con superficie de corte pulmonar y exhibía áreas extensas de consolidación lobar y hemorragia (figura 2a).

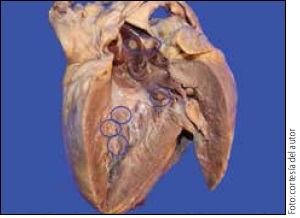
La disección de las cámaras cardiacas por la técnica de Virchow permitió descubrir múltiples y pequeños nódulos, de apariencia exofítica, descansando sobre el endocardio mural y en ambas válvulas aurículoventriculares (figura 3a). Las caras dorsal y ventral del encéfalo mostraban despulimiento del aracnoides con marcada congestión venosa. Los cortes seriados coronales de cerebro revelaron, desde los segmentos más rostrales hasta los más caudales, numerosas lesiones bilaterales distribuidas preferentemente en la interfase sustancia gris-blanca, algunas de ellas reblandecidas de tinte hemorrágico y otras deleznables con centro necrótico ("lesiones similares a infarto") (figuras 4a-d).


A nivel histológico las lesiones del parénquima pulmonar correspondían a múltiples focos de necrosis coagulativa con polimorfonucleares y macrófagos distribuidos alrededor de exuberantes radiaciones anfófilas, con amplitud entre 4 mm y 12 mm, septadas a intervalos regulares, progresivamente dicotómicas en ángulos agudos de 45°, centrífugas con epicentro vascular y positivas para la histoquímica con ácido peryódico de Schiff (PAS) y metenamina de plata de Grocott; propiedades que en conjunto hacen a estas estructuras morfológicamente compatibles con hifas de Aspergillus spp. (figuras 2b-d).
Los nódulos descritos sobre el endocardio mural y valvular representaban conglomerados miceliales de las características ya descritas (figuras 3b y 3d), las cuales además se observaron invadiendo focalmente el miocardio (figura 3c). En el espacio subaracnoideo había infiltrado inflamatorio extenso crónico y agudo con depósito de fibrina así como angioinvasión por el ascomiceto (figura 4e y 4g). Las múltiples lesiones supratentoriales consitían en áreas con manguitos perivasculares y rarefacción del neurópilo entre los cuales se hallaban dispersos grupos de neutrófilos y células de la microglia en torno a fragmentos de hifas (figuras 4f y 4h). También se identificaron estructuras fúngicas en tiroides, mucosa gástrica e intersticio renal (figura 5a-d).

El resto de los órganos sólo evidenció cambios morfológicos de choque: encefalopatía hipóxica, miopatía hipóxica multivisceral, necrosis hepática en la zona III de Rappaport, necrosis tubular aguda y deslipidización adrenocortical. De igual modo, el muñón cervical se encontró totalmente necrótico.
Así, este conjunto de hallazgos permitió finiquitar el caso con el diagnóstico final de aspergilosis invasiva diseminada con choque séptico y falla orgánica múltiple como causas de defunción.
DISCUSIÓN
La aspergilosis comprende un espectro amplio y diverso de presentaciones clínico-patológicas que parte desde reacciones de hipersensibilidad (aspergilosis broncopulmonar alérgica), formas colonizantes (aspergilosis obstructiva bronquial, aspergiloma), hasta procesos de invasión franca con destrucción tisular local o generalizada (infecciones superficiales, aspergilosis pulmonar invasiva, aspergilosis diseminada)1-4.
La inmunidad innata sustenta una función determinante en el control de infecciones fúngicas oportunistas1,5. A nivel pulmonar los macrófagos alveolares poseen la capacidad de fagocitar y lisar conidias, sin embargo, dicha capacidad se encuentra mermada en situaciones de inmunocompromiso. Las conidias prosiguen con su desarrollo y germinación dando origen a hifas que instigan un proceso neumónico. Dichas hifas se caracterizan por un marcado angiotropismo debido a su capacidad de adherencia a laminina (una glucoproteína presente en la membrana basal alveolar) y a la síntesis de elastasa1,6, razón por la cual transgreden la pared vascular y se asientan en el epicentro luminal perturbando la estabilidad de la triada de Virchow con la consecutiva trombosis e infarto del tejido circundante. Así, a partir del pulmón se emprende diseminación hematógena hacia el corazón, cerebro, riñones, hígado, órganos del tracto gastrointestinal y otras estructuras3,6-8.
Se dice que la afección a sistema nervioso central es la forma extrapulmonar más común (ocurre en 10-20% de los casos) y tiene una elevada mortalidad (aproximadamente 90%)9,10. Llama la atención que, en tanto las conidias son relativamente resistentes a la eliminación por polimorfonucleares (dada la producción de catalasa)1, las hifas de Aspergillus son sumamente lábiles al contenido de los gránu-los azurófilos. Éste es el fundamento teórico de que la aspergilosis en sus formas pulmonar invasiva y de diseminación sistémica se observen de manera preferencial en condiciones de inmunocompromiso que involucran neutropenia persistente con cuentas séricas de polimorfonucleares inferiores a 500/mm3 (agranulocytosis)1,11. No obstante, también se han observado asociadas a la administración de corticoesteroides, terapia inmunosupresiva postransplante, procesos neoplásicos, enfermedades de la colágena, diabetes mellitus, tuberculosis, desnutrición y empleo de drogas intravenosas o marihuana1,8.
Por otra parte, el proceso gestacional en mamíferos euterianios (placentados) es un evento de vasta complejidad que conlleva una paradoja inmunológica en la cual el sistema inmunológico materno tolera, sin montar una respuesta de rechazo, el desarrollo de un semialoinjerto (producto) que a la vez establece una relación de parasitismo12. Dicha conceptualización, aunque sobresimplificada, condujo a Medawar en 1953 a proponer 3 hipótesis seminales para explicar esta situación5,12-14: 1) separación física entre la madre y el producto, 2) inmadurez antigénica fetal y 3) inercia inmunológica materna. Como tal, este conjunto de soluciones implica cierta modulación tanto a nivel local como periférico que asegure una relación armónica del binomio madre-hijo sin comprometer en ningún momento la integridad de ninguna de las partes15.
Varias son las adaptaciones fisiológicas del sistema inmune que acontecen durante el embara-zo5,12-14: expansión de la población linfocítica total, aumento de la expresión de indolamina-2,3-dioxigenasa por células de la decidua, dendríticas y T CD4+CD25+ (depleta de triptófano arrestando la proliferación de células T y previniendo su activación), disminución del número de linfocitos T CD8+, aumento en fases tempranas del número de células uterinas NK (uNK), expresión de FasL por la células del trofoblasto así como de moléculas del MCHIb (HLA-G y HLA-E) por la población del citotrofoblasto extravelloso, aumento en la función y actividad de células de la inmunidad innata (granulocitos y macrófagos) e inversión de la proporción Th1/Th2 por efecto estrogénico y progestacional. Este último cambio deriva en el predominio de una respuesta inflamatoria sistémica con un perfil de tipo humoral. Al respecto, es bien conocido por los médicos clínicos el hecho de que ciertas enfermedades de base autoinmunitaria se exacerban durante el embarazo (p. ej., lupus eritematoso sistémico) en tanto que otras se atenúan (p. ej., artritis reumatoide)5,12.
Es innegable la existencia de reportes de aspergilosis en pacientes inmunocompetentes6,16-18, sin embargo en tales circunstancias resultó imposible descartar en forma fehaciente alteraciones inmunológicas de base debido a la expiración tan efímera. En uno de los casos el foco séptico destructivo se encontraba a nivel del seno paranasal izquierdo, pero el manejo quirúrgico oportuno y posterior tratamiento farmacológico con triazol sistémico condujeron a la supervivencia del paciente17. En otro de los casos la ruta de entrada fue a través de una punción epidural con desarrollo fatal de meningitis por Aspergillus fumigatus18.
Igualmente existen reportes de infección por Aspergillus en pacientes embarazadas11,19,20: uno de ellos (aspergilosis pulmonar invasiva) se caracterizó por agranulocitosis resultante del efecto adverso de la administración de ritodrina y cefepima (un simpaticomimético b empleado para tocolisis y una cefalosporina de cuarta generación respectivamente)11. El segundo de los casos (aspergilosis en SNC) ocurrió por inoculación iatrógena durante un procedimiento de anestesia epidural, para operación cesárea, durante un brote de Aspergillus fumigatus en Sri Lanka19. El tercer caso (aspergilosis diseminada) sucedió en una debutante con síndrome HELLP20. También ocurrió otro reporte de muerte por infección diseminada en un caso de síndrome HELLP21, aunque por un ascomiceto distinto (Scedosporium apiospermum).
Retomando algunos de los mecanismos de evasión inmune con los que cuenta Aspergillus, cabe mencionar el papel de la gliotoxina como inhibidor de la función de neutrófilos y de la fagocitosis al prevenir el ensamblaje de la NADPH oxidasa, impedir la acidificación de fagolisosomas y promover la apoptosis en macrófagos y células dendríticas1,22. La síntesis de melanina lo protege contra especies reactivas de oxígeno además de enmascararlo frente a las proteínas del complemento10. Aspergillus también escapa de las diferentes vías del complemento al adquirir una cubierta de inhibidores de éste a partir del anfitrión10. A. fumigatus es un patógeno que se encuentra más comumnente como agente causal de la forma pulmonar invasiva en tanto que A. flavus, a pesar de poseer mayor virulencia y ser productor de aflatoxina B1, sólo afecta piel, mucosa y tejidos blandos debido al mayor tamaño de sus conidias (25 mm), las cuales no llegan a alcanzar los alveolos pulmonares4.
El caso expuesto no dispone de información suficiente que permita esclarecer la manera en que pudo haberse establecido una infección por ascomicetos en la paciente. De forma inicial, no existe evidencia de abuso de sustancias ni de algún padecimiento que implique un estado transitorio o permanente de supresión inmune. Un planteamiento que parece apropiado al respecto (partiendo del antecedente de preeclampsia, trombocitopenia y elevación de aminotransferasas) es un probable desarrollo de síndrome HELLP. Si bien no existe documentada anemia hemolítica microangiopática, la paciente sí cursó con anemia normocítica normocrómica, elevación de lactato deshidrogenasa e hiperrbilirrubinemia (aunque elevada a expensas de la fracción conjugada).
Incluso se desconoce si la concepción es producto de la misma pareja. En lo que concierne al aspecto morfológico, no hubo evidencia de coagulación intravascular diseminada ni se encontraron los cambios hepáticos descritos clásicamente para preeclampsia/eclampsia o síndrome HELLP (depósito de fibrina a nivel de espacios porta y sinusoides periportales, necrosis isquémica periportal y hemorragia en el espacio de Disse)23,24.
Está documentado que la disminución en el estado de competencia inmune y el desarrollo de infecciones fúngicas se hallan asociados a falla hepática aguda y disfunción hepática grave25. Así, tras este curso clínico fugaz aunado a los grandes vacíos de información en el historial clínico, resulta muy difícil y aventurado formular una conclusión satisfactoria acerca de lo acontecido.
Finalmente, una crítica de gran peso respecto al diagnóstico final —aspergilosis diseminada— es su fundamentación sobre una base puramente morfológica sin el apoyo de cultivos u otros métodos de detección que avalen la presencia de dicho género. Aunque la identificación tisular de Aspergillus suele carecer de dificultades (hifas septadas, delgadas con 4 a 12 micras de ancho, de contornos paralelos y dicotomización arborescente en ángulos agudos de aprox. 45°), otros ascomicetos como Pseudallescheria boydii o Fusarium spp. exhiben prácticamente una morfología idéntica y son, por lo tanto, indistinguibles bajo la microscopía de luz7,8,23. La excepción a la regla está dada por Aspergillus terreus, que sobresale del resto de los miembros de su mismo género por la presencia de aleuroconidias (conidias ovales entre 6 mm y 7 mm que brotan a partir de las caras laterales de la hifa tabicada)1,3. Mención aparte amerita la trascendencia del reconocimiento de este último dada su resistencia inherente a la anfotericina B9. Así, el reporte de "infección diseminada por ascomicetos morfológicamente compatibles con Aspergillus spp." resulta mucho más apropiado como diagnóstico final del caso.
CONCLUSIÓN
Si bien durante el embarazo se suscitan numerosas adaptaciones inmunitarias fisiológicas tanto a nivel local (interfaz hemocorial) como sistémico, ninguna de ellas predispone a la madre al desarrollo de procesos infecciosos ni la deja al descubierto frente a plagas oportunistas, con excepción (quizás) de aquellos que se comportan como parásitos intracelulares (p. ej., Leishmania major)5,13,15. Por otra parte, a pesar de la incertidumbre que prevalece respecto al potencial infeccioso de gérmenes micóticos oportunistas, en individuos inmunocompetentes conviene insistir en la tendencia que muestran los ascomicetos para emerger en contextos de inmunocompromiso (sobre todo los que cursan de manera característica con agranulocitosis).
Es así que, si se contraponen ambas premisas, resulta imperativa la búsqueda intencionada de una alteración de base inmunosupresiva para situaciones de sepsis por hongos oportunistas no justificables por un proceso gestacional. Lamentablemente la gravedad del padecimiento, en conjunto con la fugacidad del deterioro clínico, no en pocas ocasiones hacen de este objetivo una proeza insolventable cuya última y máxima virtud yace en su carácter docente.
REFERENCIAS BIBLIOGRÁFICAS
1. Murray PR, Rosenthal KS, Pfaller MA. Aspergillosis. En: Murray PR, Rosenthal KS, Pfaller MA. Medical Microbiology. 6ta ed. Mosby Elsevier. Section 7 Mycology Chapter 68 Pathogenesis of Fungal Disease, Chapter 74 Opportunistic Mycoses. 2009. pp. 687-688, 763-766. [ Links ]
2. Mitchell GT. Aspergillosis. En: Brooks GF, Butel JS, Morse Sa. Jawetz, Melnick & Adelbergs Medical Microbiology. 23 ed. 2004 McGraw-Hill. Part V Mycology Chapter 45 Medical Mycology. Pp 649-650. [ Links ]
3. Watts JC, Chandler FW. Aspergillosis. En: Connor DH, Chandler FW, et al. Pathology of Infectious Diseases. 1a ed. 1997 Apple Lange. Vol II Part IV Chapter 100. Pp 933-941. [ Links ]
4. Hedayati MT, Pasqualotto AC, Warn PA, et al. Aspergillus flavus: human pathogen, allergen and mycotoxin producer. Microbiology. 2007;153:1677-92. [ Links ]
5. Veenstra van Nieuwenhoven AL, Heineman MJ, Faas MM. The immunology of successful pregnancy. Human Reproduction Update. 2003;9(4): 347-57. [ Links ]
6. Uppin MS, Challa S, Uppin SG, et al. Cerebral Aspergillus arteritis with bland infarcts: a report of two patients with poor outcome. Neurol India. 2007;55:298-300. [ Links ]
7. Ellison D, Seth L, et al. Aspergillosis. En: Ellison D, Seth L, et al. "Neuropathology. A reference text of CNS pathology". 1a ed. Mosby International Ltd. Section 5 Chapter 17 Fungal Infections. 1998. pp 17.2-17.4 [ Links ]
8. Gyure KA. Aspergillosis. In: Prayson RA. Neuropathology. 2a ed. Elsevier Saunders 2012. Chapter 7 Infections. Pp 332-335. [ Links ]
9. De Rosa FG, Garazzino S, Audagnotto S. Aspergillosi invasiva in paziente immunocompromesso: considerazioni cliniche e terapeutiche. Le Infezioni in Medicina. 2007;4:262-6. [ Links ]
10. Speth C, Rambach G. Complement attack against Aspergillus and corresponding evasión mechanisms. Interdisciplinary Perspectives on Infectious Diseases Vol 2012, Article ID 463794, 9pp. Doi:10.1155/2012/463794. [ Links ]
11. Aoki F, Sando Y, Tajima S, et.al. Invasive Pulmonary Aspergillosis in a Puerperant with Drug-induced Agranulocytosis. Internal Medicine. 40:1128-31, 2001. [ Links ]
12. Chaouat G. The Th1/Th2 paradigm: still important in pregnancy. Semin Immunopathol. 2007;29:95-113. [ Links ]
13. Mellor AL, Munn DH. Immunology at the maternal-fetal interface: Lessons for T cell tolerance and supression. Annu Rev Immunol. 2000;18:367-91. [ Links ]
14. Koch CA, Platt JL. T cell recognition and immunity in the fetus and mother. Cellular Immunology. 2007;248:12-7. [ Links ]
15. Raghupathy R. Th1-type immunity is incompatible with succesful pregnancy. Viewpoint Immunology Today. 1997; 18(10):478-82. [ Links ]
16. Shakoor MT, Ayub S, Ayub Z, et al. Fulminant invasive aspergillosis of the mediastinum in an immunocompetent host: a case report. Journal of Medical Case Reports. 2012;6:311. doi: 10.1186/1752-1947-6-311. [ Links ]
17. Sethi P, Saluja R, Jindal N, et al. Invasive aspergillosis in an immunocompetent host. J Oral Maxillofac Pathol. 2012;16(2): 297-300. [ Links ]
18. Pettit AC, Kropski JA, Castilho JL, et al. The index case for the fungal meningitis outbreak in the United States. N Engl J Med. 2012. doi: 10.1056/NEJMoa1212292. [ Links ]
19. Lokuhetty MD, Wijesinghe HD, Weerasundera B, et al. Iatrogenic aspergillus infection of the central nervous system in a pregnant woman. Indian J Pathol Microbio 2009;52:427-9. [ Links ]
20. Kobayashi M, Ito M, Hotchi M. An autopsy case of HELLP syndrome with disseminated aspergillosis. Jpn J Med Mycol. 2000;41:103-7. [ Links ]
21. Riddell J 4th, Chenoweth CE, Kauffman CA. Disseminated Scedosporium apiospermum infection in a previously healthy woman with HELLP syndrome. Mycoses. 2004;47(9-10): 442-6. [ Links ]
22. Orciuolo E, Stanzani M, Canestraro M. Effects of Aspergillus fumigatus gliotoxin and methylprednisolone on human neutrophils: implications for the pathogenesis of invasive aspergillosis. Journal of Leukocyte Biology. 2007; 82:839-48. [ Links ]
23. McAdam AJ, Sharpe AH. Aspergilosis. En: Kumar V, Abbas AK, et al. Robbins y Cotran Patología Estructural y Funcional. 8° ed. en Español 2010 Elsevier España. Patología General Capítulo 8 Enfermedades Infecciosas. p. 385. [ Links ]
24. Scheuer PJ, Lefkowitch JH. The liver in pregnancy. En: Scheuer PJ, Lefkowitch JH. Liver Biopsy Interpretation. 6th ed. WB Saunders 2000. Chapter 16 The Liver in Systemic Disease and Pregnancy. pp. 311-313. [ Links ]
25. Prodanovic H, Cracco C, Massard J. Invasive pulmonary aspergillosis in patients with decompensated cirrhosis: case series. BMC Gastroenterology. 2007;7:2. doi: 10.1186/1471-230X-7-2. [ Links ]














