Introducción
En la segunda mitad del siglo XIX se describió, por primera vez, en levaduras y otros organismos, al L-lactato y al etanol como productos de la fermentación de diversos azúcares. Se observó que las concentraciones de ambos metabolitos eran características de los procesos de fermentación anaerobios, y que ambos disminuían sus concentraciones en presencia de oxígeno. A esta disminución de la fermentación se le denominó efecto Pasteur. Para la primera década del siglo XX, utilizando células del músculo esquelético de ancas de rana, Walter M. Fletcher y Frederik G. Hopkins reportaron que durante la estimulación muscular, cuando se llegaba a la fatiga, el transporte de lactato hacia el plasma aumentaba, y que la concentración de esta molécula en el plasma disminuía cuando las fibras musculares se colocaban en condiciones de alta oxigenación1. En la década de 1940, Otto Fritz Meyerhof y Gustav Embdem demostraron que el lactato derivaba de la degradación del glucógeno muscular y de la vía glucolítica (figura 1a). En este contexto, las funciones de la lactato deshidrogenasa y del lactato quedaron relegadas a ser parte de un mecanismo que permitía la oxidación del NADH citoplasmático en la segunda parte de la vía glucolítica, siendo elemental para el correcto funcionamiento de la glucólisis2.
Con estas evidencias se estableció la idea ampliamente difundida de que el lactato era un metabolito de desecho, producto de la reducción del piruvato, y que se presentaba básicamente en condiciones de fatiga muscular o cuando las concentraciones de oxígeno resultaban insuficientes3. En contraste con esta concepción minimalista, en este trabajo se proporcionan evidencias de las múltiples y complejas funciones de este metabolito. Se muestra que el lactato siempre es el producto final de la glucólisis, independientemente de la concentración de oxígeno en la que se encuentren las células, y que participa en 2 tipos de lanzadera; una que se encuentra en el espacio intermembranal de la mitocondria, y otra intercelular que conecta a diferentes tipos celulares y que se encarga de alimentar con lactato a ciertos tipos celulares, como las neuronas y algunas células cancerosas. Asimismo, se describen aspectos del metabolismo del lactato en los espermatozoides y en los hepatocitos.
La reacción enzimática de la lactato deshidrogenasa y la relación lactato/piruvato en las células
La lactato deshidrogenasa (LDH) es un heterotetrámero que se presenta en 5 isoformas (M4, M3H1, M2H2, M1H3 y H4) y cuya composición es tejido específica (figura 1b). La constante de equilibrio (Keq) de la reacción catalizada por la LDH está fuertemente favorecida hacia la formación de lactato (3.03 × 1011 M-1)4.
Piruvato + NADH + H+1 Lactato + NAD+
La LDH es muy activa en la mayoría de los tejidos, por lo que no es sorprendente encontrar que la relación lactato/piruvato sea generalmente mayor a 5, como en los músculos esquelético y cardiaco, en el hígado, riñón, bazo, sistema nervioso central e incluso en el tejido adiposo5,6. En el tejido hepático la relación es de 7:17; en neuronas, de 23:18; en el músculo en reposo, de 13:17, pudiendo alcanzar valores de 160:19 en condiciones de ejercicio intenso. En el caso de tejidos dañados por isquemia, la relación puede ser de 25:1 o hasta de 40:1 como en el cerebro10-11.
La acidosis láctica que se deriva del ejercicio intenso
Asociado con la fatiga muscular, un aspecto metabólico importante fue la vinculación del lactato con la acidosis metabólica durante el ejercicio físico intenso. Es cierto que la lactoacidosis ocurre como resultado del ejercicio anaeróbico, y que los valores de acidez en el plasma pueden tomar valores de pH incluso de 7.2. Aunque se ha considerado que esta acidificación se debe a la liberación del ácido láctico (CH3COOH), realmente se produce como consecuencia del cotransporte electroneutro del anión lactato (CH3COO-) con un protón (figura 2a). Se debe considerar que el valor del pKa del grupo carboxilo del ácido láctico es de 3.8, el cual es al menos 3 unidades menor que el valor del pH plasmático o intracelular, por lo que la relación lactato/ácido láctico es de 10,000:4, incluso en condiciones de acidosis metabólica extrema debida al ejercicio anaeróbico intenso. Esto quiere decir que para una concentración de lactato de 1 mM12, la de ácido láctico sería de 0.0004 mM (0.4 µM). Como se puede apreciar, es un valor insignificante considerando la concentración de lactato.
El lactato es el producto final de la glucólisis y se encuentra en el sistema circulatorio y dentro de las células
El paradigma que describe al lactato como un compuesto de desecho derivado del metabolismo anaerobio fue prácticamente aceptado en el ámbito científico y clínico, por lo que entró a formar parte de los libros de texto de bioquímica. Sin embargo, durante la segunda mitad del siglo XX, se comprobó que las concentraciones normales de lactato en sangre eran de 0.8 a 2 mM, mientras que en el interior de las células variaba de 1 a 1.8 mM13, inclusive en condiciones donde la presión parcial de oxígeno era mayor de los 5-25 Torricellis14-16. Es importante hacer notar que la presencia de oxígeno no modifica de manera significativa las concentraciones de lactato, como originalmente se propuso.
Asimismo, a principios de la primera década del siglo XXI, Brooks, Gladden y Shchur sugirieron que el lactato, en lugar del piruvato, es el producto final de la glucólisis, y que este metabolito se produce constantemente en las células, inclusive en condiciones de normoxia (pO2 20-90 Torr), en donde la cadena de transporte de electrones tiene un funcionamiento normal. Por ejemplo, los astrocitos del cerebro humano pueden liberar cerca de 50 micromol min-1 Kg-1 de lactato en estas condiciones12. Esto rompió con el paradigma de que el piruvato se transforma en acetil coenzima A (acetil-CoA) en condiciones aerobias y en lactato en condiciones de anaerobiosis.
El lactato es necesario para la reparación de tejidos dañados
Una de las paradojas más llamativas relacionadas con el metabolismo del lactato fue la efectividad de las soluciones salinas glucosadas complementadas con lactato para reparar tejidos dañados por condiciones de hipoxia, por ejemplo, durante la falla cardiaca17, un evento vascular cerebral18 el shock endotóxico19 o la sepsis inmunosupresiva20. En estos y otros casos, las soluciones salinas glucosadas carentes de lactato resultaban insuficientes para reparar los tejidos dañados21, por lo que se sugirieron nuevas funciones para el lactato que iban más allá de la de un metabolito de desecho1. Es probable que la lanzadera mitocondrial de lactato sea la responsable de este efecto benéfico en la reparación del daño tisular.
Las lanzaderas intracelulares e intercelulares de lactato
En 1998 Brooks describió la lanzadera mitocondrial de lactato, acoplada a la de malato-aspartato (MAS) (figura 3), como uno de los principales mecanismos para dirigir el poder reductor del NADH citosólico al interior de la mitocondria. De esta manera, el lactato que se produce en el citosol por la actividad glucolítica, entra al espacio intermembranal de la mitocondria, en donde se oxida a piruvato por otra lactato deshidrogenasa. El piruvato, a través de su transportador, ingresa a la matriz mitocondrial, en donde se descarboxila oxidativamente para entrar al ciclo de Krebs como acetil-CoA, mientras que los electrones del NADH que se produjo en el espacio intermembranal se introducen a la matriz mitocondrial por medio de la lanzadera de aspartato-malato (figura 3). La ventaja energética de este sistema es que en vez de eliminar al lactato que se produce en el citosol, este se introduce a la matriz mitocondrial como piruvato y el poder reductor adicional en forma de NADH alimenta a la cadena respiratoria para la síntesis de ATP (figura 3). La lanzadera de lactato puede funcionar en ambos sentidos, dependiendo de las concentraciones de los metabolitos a cada lado de la membrana mitocondrial interna.

La lanzadera de lactato funciona acoplada a la lanzadera de malato-aspartato. Su adecuado funcionamiento permite alimentar a la cadena de transporte con los electrones del NADH del espacio intermembranal. Modificada de Kane2.
LDH: lactato deshidrogenasa; MDH: malato deshidrogenasa; PDH: complejo de la piruvato deshidrogenasa; AAT: aspartato aminotransferasa; LAC: lactato; Mal: malato; Asp: aspartato; OAA: oxaloacetato; Glu: glutamato; αKG: alfa ceto glutarato.
Figura 3 La lanzadera mitocondrial de lactato
Las lanzaderas de lactato intercelular también permiten que este metabolito funcione como un intermediario entre las células de diferentes tejidos22. En este caso, el transportador de monocarboxilato (MCT) cataliza el transporte de lactato a través de la membrana plasmática23. El ciclo de Cori es el ejemplo clásico de lanzadera intercelular (figura 4b). En este ciclo, el lactato que se produce en músculo y eritrocitos, entre otros órganos o células, se libera al torrente circulatorio, llega al hígado en donde se transforma, por medio de la gluconeogénesis, en glucosa que se libera a la sangre para su uso por los tejidos que lo requieren. El ciclo de Cori está involucrado en la regulación de la glucemia (figura 4b).
En las otras lanzaderas, es común que las células con una mayor tasa de crecimiento o mayor tasa respiratoria sean consumidoras de lactato, mientras que las células con una menor tasa de crecimiento o de consumo de oxígeno funcionan como centros productores de lactato (figura 4b)24. Un ejemplo de este sistema de comunicación célula-célula mediada por el lactato es el que ocurre entre los astrocitos y las neuronas glutamatérgicas25, en donde los astrocitos tienen un metabolismo glucolítico (fermentativo) y las neuronas un metabolismo respiratorio26. Es decir, los astrocitos liberan lactato al medio extracelular y mantienen el metabolismo respiratorio de las neuronas a través del funcionamiento de la lanzadera mitocondrial de lactato (figura 4a)27. En este sentido, el lactato actúa como una molécula endocrina. Es importante resaltar que el sistema nervioso maduro depende totalmente del correcto funcionamiento de la lanzadera de malato-aspartato28-30. Otros ejemplos de sistemas tisulares comunicados a través del lactato son el tejido cardiaco y muscular31,32, el hígado y el riñón33,34, las células de Sertolli y los espermatozoides35-38.
Un caso que requiere el adecuado funcionamiento de la lanzadera de lactato es el de las mitocondrias de músculo esquelético sometido a ejercicio constante39,40 en donde, al igual que en el músculo cardiaco, el lactato se prefiere sobre la glucosa y los ácidos grasos para la obtención de energía31,41.
Los espermatozoides, un ejemplo de transporte de lactato a la matriz mitocondrial
Para la capacitación de los espermatozoides y su rápido movimiento se requiere de un eficiente aporte energético, en el que la fructosa y el lactato son fundamentales como donadores de energía. La presencia de una lactato deshidrogenasa espermática (LDH-X o LDH-C4) en la matriz mitocondrial permite la producción del NADH en un mecanismo que no requiere de la lanzadera de malato aspartato42. De esta manera, con la reducción del piruvato en el citosol, se regenera el NAD+ y se potencia la glucólisis, y si a esto se le añade que el transporte de lactato a la matriz mitocondrial genera NADH (figura 5), el resultado es un incremento en la síntesis de ATP, que permite una mayor tasa de movilidad de los espermatozoides43.

El lactato que se produce durante la glucólisis o que proviene del medio extracelular se transporta a la matriz mitocondrial para ser oxidado a piruvato, generando NADH que servirá como un sustrato para el complejo I respiratorio. Figura modificada de Ferramosca43.
Figura 5 El lactato como fuente de energía para las células tumorales NAD+
El lactato y la oxidación del etanol en el hígado
En el hígado existen varios sistemas que se encargan de oxidar al etanol44. De estos, el más importante es el de la alcohol deshidrogenasa (ADH), que cataliza la reacción en la que se produce acetaldehído y NADH. Puesto que la LDH consume NAD+, que es uno de los sustratos de la ADH, la estimulación de la oxidación del etanol por lactato sugiere un mecanismo alterno e independiente de la ADH. Utilizando centrifugaciones diferenciales e inhibidores de los diversos sistemas enzimáticos, se encontró que la oxidación del etanol dependía de la acción acoplada de una lactato oxidasa, de localización citosólica y peroxisomal, y de la catalasa45. Como resultado de la actividad de la lactato oxidasa se produce peróxido de hidrógeno, el cual reacciona con el etanol para dar agua y acetaldehído. Esta última reacción está catalizada por la catalasa que trabaja en forma de peroxidasa (figura 6).
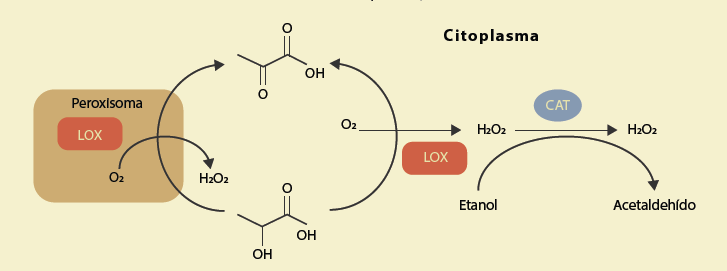
El peróxido de hidrógeno producido por la lactato oxidasa lo utiliza la catalasa para oxidar al etanol. La lactato oxidasa se encuentra en el citosol y en los peroxisomas. Figura modificada de Villalobos-Garcia45.
Figura 6 La lactato oxidasa hepática y la oxidación del etanol
El lactato como un agente antiinflamatorio y como regulador de la expresión génica
El papel antiinflamatorio del lactato administrado por vía intravenosa originalmente se explicó por su efecto osmótico y su función como amortiguador del pH. Se propuso que al cotransportarse el lactato con sodio y con protones hacia el interior de las células (figura 2b), se controlaba el daño provocado por el incremento de la presión osmótica en la cavidad intracraneal, al mismo tiempo que se regulaba el pH del fluido transcelular46-48. Sin embargo, recientemente se ha descrito al lactato como un regulador de la expresión genética, que al unirse al receptor de 7 segmentos transmembranales GPR815,49,50, y a través de la vía del AMPc y del receptor de unión al AMPc (CREB), inhibe diversas vías inflamatorias51. Hashimoto (2007) demostró cambios en la expresión de 673 genes al exponer a las células L6 a concentraciones de 10-20 mM de lactato52, mientras que Martínez-Outschoorn (2011) observó cambios en 4,131 genes, utilizando células epiteliales MCF7; muchos de estos cambios son similares a los que produce el factor de hipoxia 1 (HIF-1)53-55.
El lactato como un agente tumorogénico
El lactato estimula la glutaminólisis oxidativa y promueve el crecimiento de las células tumorales (figura 7), debido a la sobreexpresión del transportador de glutamina (ASCT2) y de la glutaminasa 1 (GLS1)1,56, que se traduce en un aumento en el transporte de la glutamina y el glutamato y su posterior metabolismo. Asimismo, hay un incremento en la actividad de la enzima málica debido a defectos en su regulación57. La acidificación del medio circundante es otro de los papeles centrales del lactato durante el desarrollo tumoral, ya que al ser cotransportado junto con protones, las células tumorales lo utilizan para disminuir el pH en casi 2 unidades, con valores entre 7.0 y 5.558,59. Por otro lado, el transporte de lactato del líquido extracelular al citosol también es importante para el crecimiento de las células tumorales. Aunque se considera que las células cancerosas se especializan en liberar lactato, se ha reportado un alto consumo de lactato en diversos tipos de células tumorales, como las de pulmón que requieren de este metabolito para favorecer su crecimiento y diseminación por los tejidos circundantes3. En ausencia de lactato, las células de tumores de pulmón disminuyen su crecimiento en casi un 80%1,35. En el cáncer de mama, de cuello, de cabeza, el renal, el adrenal, el pancreático, el colorrectal y el ovárico, así como en diversos tipos de melanomas, hay un alto consumo de lactato60.
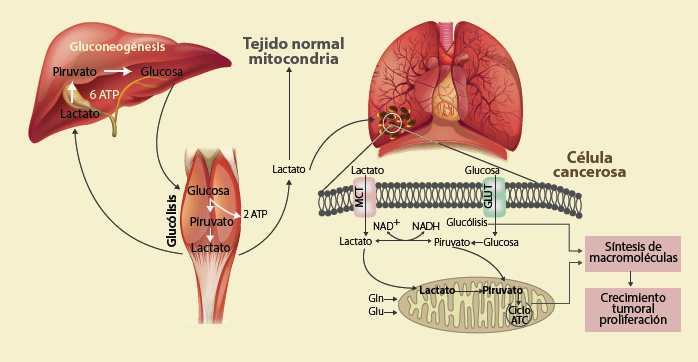
El lactato puede ser tomado por algunas células cancerosas, como las del pulmón, en donde es dirigido hacia las mitocondrias. Los transportadores de glucosa 1 y 3 (GLUT 1 y 3), los transportadores de monocarboxilato 1 y 4 (MCT 1 y 4) y los transportadores de glutamato/glutamina, permiten la energización de estas células. Esquema modificado de Martínez-Reyes3.
Figura 7 El lactato como fuente de energia para las celulas tumorales
También se ha asociado este metabolito con la vascularización y migración celular en los gliomas y otros tipos de cáncer61. Recientemente, este vínculo se explicó parcialmente al observarse que el lactato estimula la liberación de los factores de crecimiento vascular endotelial (VEGF) y de crecimiento transformante (TGF-β2), las interleucinas proangiogénicas 1 y 8 (IL-1, IL8), el factor de necrosis NFκβ, y el factor inducible de hipoxia 1 (HIF-1α), siguiendo en todos los casos una relación dosis-respuesta entre la concentración de lactato y la expresión de los factores antes mencionados62-65. Cuando se inhibe a la LDH con oxamato, disminuye la vascularización64. Otra evidencia que vincula a la actividad de la LDH con la angiogénesis se encontró en diversas líneas celulares tumorales en las que la eliminación del gen de la LDH inhibió la migración celular, la angiogénesis y la vascularización66-68, lo que confirma el papel del lactato y la LDH en las funciones metabólicas de las células cancerígenas.
Conclusiones
El lactato es el producto final de la glucólisis independientemente de la presencia de oxígeno. Una vez que se forma en el citosol, el lactato puede expulsarse a través de un cotransporte con protones al torrente circulatorio, en donde participa en el ciclo de Cori para la síntesis de glucosa o se utiliza como fuente de energía por neuronas, cardiomiocitos o células tumorales, entre otros. El lactato también puede transportarse al espacio intermembranal de la mitocondria, en donde se acopla a la lanzadera de aspartato-malato para introducir los equivalentes reductores a la cadena respiratoria. Existe un acarreador específico para el lactato en las mitocondrias de los espermatozoides, que hace más eficiente la oxidación de este metabolito y la síntesis de ATP. A nivel hepático, la presencia de la lactato oxidasa favorece la oxidación del etanol. Finalmente, el lactato tiene otras funciones entre las que se incluyen la regulación de la expresión génica.











 nueva página del texto (beta)
nueva página del texto (beta)






