INTRODUCCIÓN
El orden Lepidoptera habita la Tierra desde hace más de 110 millones de años (Heikkila et al., 2012; Kawahara et al., 2019) y se han descrito 157,424 especies distribuidas en 45 superfamilias (van Nieukerken et al., 2011). Su sobrevivencia se debe a una serie de adaptaciones miméticas, sistemas de defensa químicos y físicos, y patrones conductuales, entre otros (Badger & Kenney, 2006). Las mariposas diurnas se agrupan en la superfamilia Papilionoidea, con 18,768 especies en el mundo (van Nieukerken et al., 2011; Llorente-Bousquets et al., 2014), y más de 1,900 en México (Llorente-Bousquets et al., 2014), lo que representa un poco más del 10 % de la diversidad mundial.
Actualmente, el uso de especies bioindicadoras se perfila como un método prometedor que puede permitir la detección temprana de disturbios ambientales que pongan en peligro a la biodiversidad de los ecosistemas (Heink & Kowarik, 2010; González & Vallarino, 2014). Hay estudios que utilizan a las mariposas diurnas como bioindicadoras (Erhardt, 1985; Andrade, 1998; Brown & Freitas, 2000; Cleary, 2009; Abrol, 2012), y estudios que los cuestionan (Gerlach et al., 2013; Whitworth et al., 2018; Forsberg et al., 2020) en parte porque las mariposas no reaccionan de manera homogénea a los cambios estacionales (DeVries & Walla, 2001; Legal et al., 2020), o físicos del ambiente, dependiendo si el efecto de borde es un ecotono natural o consecuencia de alteraciones antropogénicas (Lourenço et al., 2019).
Las especies bioindicadoras son aquellas que pueden usarse como estimadoras del estatus de otras especies o condiciones ambientales de interés que resultan difíciles, inconvenientes o costosas para medir directamente (González & Vallarino, 2014). Para McGeoch (2007), la esencia de la bioindicación es la predictibilidad de la relación entre una especie bioindicadora y el parámetro ambiental de interés. Heink y Kowarik (2010) sugieren que ante la ambigüedad del término “bioindicador” es preciso especificarlo en los estudios respectivos y propone la utilización de la clasificación de McGeoch (2007), la cual ocupa tres categorías de bioindicadores: ambientales, ecológicos y de biodiversidad (McGeoch, 2007; Holt & Miller, 2011). Cada una de estas categorías tiene su objetivo de indicación y varían en la precisión con la que pueden ser cuantificadas, así como su grado de predictibilidad.
Las especies bioindicadoras ambientales reaccionan de manera predecible a cambios en los parámetros ambientales físicos y químicos (Holt & Miller, 2011), y se utilizan una vez ya probados los efectos (McGeoch, 2007; Pozo et al., 2014), por lo que normalmente se relacionan con alguna sustancia contaminante (Corke, 1999; Siddig et al., 2016, Shephard et al., 2020, Meléndez-Jaramillo et al., 2021). El uso de insecticidas (Braak et al., 2018; Peterson et al., 2019) y otras técnicas, v. gr. control biológico contra comunidades de mariposas (Urretabizcaya et al., 2010; Malpartida-Zeballos et al., 2013; Ibarra & Rincón-Castro, 2015), las afectan de manera importante, teniendo como consecuencia la reducción de su riqueza y abundancia; además, el uso de herbicidas (Pekin, 2013) afecta indirectamente a las mariposas, al dañar a sus especies vegetales hospederas, consideradas arvenses o malezas.
Los bioindicadores de diversidad son especies o un grupo funcional cuya variación refleja la diversidad (riqueza) de otros taxones en determinado hábitat o conjunto de hábitats (McGeoch, 2007; Pozo et al., 2014). A esta clasificación pertenecen las especies que tienen relaciones muy estrechas con otras, ya sean vegetales o animales; por ejemplo, la existente entre algunas mariposas riodínidas y licénidas que están asociadas con hormigas para su desarrollo larval (Flores-Contreras & Luna-Reyes, 2017; Arellano-Covarrubias et al., 2018). En México, dos estudios señalan especies bioindicadoras de diversidad, uno que determina especies indicadoras del tipo de vegetación selva alta subperennifolia húmeda en la península de Yucatán (Maya-Martínez et al., 2005), y otro que identifica 218 especies indicadoras de selvas altas perennifolias y subperennifolias en la provincia biogeográfica del Golfo de México (Flores-Contreras & Luna-Reyes, 2017).
Las bioindicadoras ecológicas son especies o poblaciones cuya presencia o ausencia refleja los efectos de una alteración del hábitat y sus correspondientes estados sucesionales, problemas derivados de su fragmentación, afectaciones por el cambio climático, o cambios de la biota asociada a una comunidad o a un ecosistema. Su presencia se relaciona con aspectos de grados de conservación biológica (McGeoch, 2007). En este sentido, varias investigaciones relacionan la estructura y composición de las mariposas con la diversidad existente en el resto de la comunidad y el estado de conservación del ecosistema (Andrade, 1998; Brown & Freitas, 2000; Fraija & Fajardo, 2006; Molina-Martínez & León-Cortés, 2006; Sant’Anna et al., 2014; Meléndez-Jaramillo, 2017).
A nivel nacional, existen estudios de lepidópteros como indicadores ecológicos por su sensibilidad a los disturbios y a los cambios en su ecosistema (Pozo & Galindo-Leal, 2006; Maya-Martínez et al., 2009; Balam-Ballote & León-Cortés, 2010; González-Valdivia et al., 2016; Meléndez-Jaramillo et al., 2018). Otros estudios (v. gr.De la Maza & White, 1990; De la Maza & Soberón, 1998; González-Valdivia et al., 2016) proponen a las especies frugívoras de la familia Nymphalidae como bioindicadoras de calidad del hábitat e incorporan la variable de la coloración de las mariposas como una característica que se asocia con las alteraciones del paisaje.
Diversos autores (Brown, 1991; Andrade, 1998; Holt & Miller, 2011; Sánchez, 2012; Pozo et al., 2014) han descrito las características que deben cumplir las especies bioindicadoras de acuerdo con el ámbito y la finalidad con que se pretendan utilizar. Así, las especies bioindicadoras más adecuadas para cualquier categoría son las que cumplan con la mayoría de los siguientes criterios: a) individuos fácilmente observables y reconocibles, manipulables en campo y en laboratorio; b) biología e historia natural conocida; c) taxonomía estable y bien conocida; d) distribución geográfica amplia; e) ecológicamente bien diversificados; f) patrón de riqueza fuertemente correlacionado con otros taxones, animales o vegetales; g) sensibilidad alta y fidelidad ecológica; h) abundantes, no furtivas, fáciles de encontrar en campo; i) con ciclos de vida cortos, entre otros.
Algunas especies como Danaus plexxipus plexxipus (Linnaeus, 1758), pueden cumplir con todos estos criterios; sin embargo, la alteración natural como artificial del hábitat provoca diferentes respuestas en dependencia de las características particulares de cada especie, desde su tamaño, capacidad de dispersión, historia de vida, fenología, el tamaño de la población, ciclos de vida, hábitos alimentarios, entre otras (Andrade, 1998; Orozco, 2006; Pozo & Galindo-Leal, 2006; Bouyer et al., 2007; McGeoch, 2007; Balam-Ballote & León-Cortés, 2010).
El objetivo de este artículo es establecer el estado del arte sobre las mariposas como bioindicadoras ecológicas en México y responder las siguientes preguntas: ¿Cuántas publicaciones abordan el tema de mariposas como bioindicadoras ecológicas en México? ¿Cuáles son las especies identificadas como bioindicadoras ecológicas y en respuesta a que estado de conservación? ¿Qué métodos estadísticos fueron utilizados para establecer la relación entre la especie bioindicadora y el estado de conservación de un área? ¿Cuáles son los aportes bibliográficos que permiten identificar en campo a las especies bioindicadoras de México? y ¿Cómo contribuiría esta información para el diseño de un monitoreo ambiental eficiente? Para lograrlo se revisó la bibliografía disponible y se subdividió en temas de interés. Finalmente se destacan los vacíos de información y se sugieren recomendaciones para estudios posteriores y el uso prudente del concepto de bioindicador.
MATERIALES Y MÉTODOS
Se realizó una búsqueda de información enfocada principalmente a las especies de mariposas como bioindicadoras en México, Latinoamérica y en el mundo. Se comenzó con el análisis y revisión de artículos referentes a especies bioindicadoras en México, para ello fueron muy útiles las revisiones bibliográficas de tres documentos compilatorios para este país (Gutiérrez, 2002; Warren, 2005; Vargas-Fernández et al., 2016) y para la zona neotropical (Lamas, 2008; 2021). Para obtener la mayor cantidad de publicaciones, se exploraron diversas bases de datos académicas como Google Scholar (www.scholar.google.com), Academia (www.academia.edu), SciELO (www.scielo.org), Redalyc (www.redalyc.org), ScienceDirect (www.sciencedirect.com), TesiUNAM (www.tesis.unam.mx), utilizando las palabras clave en combinación “bioindicadoras”, “bioindicators”, “Lepidoptera”, “Papilionoidea”, “mariposas”, “butterflies”, “Mexico”, “México”. La búsqueda no tuvo un límite temporal y se consideraron las publicaciones en español, inglés y portugués. De igual forma, se revisaron las citas bibliográficas relevantes de los artículos obtenidos y así se identificaron y localizaron artículos que no fueron registrados por ningún motor de búsqueda.
La base de datos se clasificó con el gestor de referencias Mendeley; primero se identificaron los estudios nacionales; posteriormente los documentos se clasificaron por temas: 1) catálogo de especies, cuando el objetivo principal del estudio era realizar un registro de las especies de mariposas en determinada área; 2) ecología de mariposas, estudios que abarcaron patrones de distribución y su relación con otras especies o variables ambientales, de ellos se seleccionaron todos los que mencionaron especies indicadoras y; 3) mariposas como bioindicadoras, estudios cuyo objetivo era fundamentar y documentar las correlaciones entre mariposas y sus variables ambientales, empleando métodos estadísticos y proponiendo especies indicadoras.
Para la compilación de especies bioindicadoras, se corroboró la nomenclatura taxonómica y se actualizó acorde a las listas taxonómicas de referencia publicadas por Vargas et al. (2016) para Papilionidae, Pieridae y Nymphalidae, exceptuando la subfamilia Satyrinae; Llorente et al. (2006) para Lycaenidae y Riodinidae, y Warren et al. (2016) para Hesperiidae. Para el cotejo de los nombres de las especies vegetales y su pertenencia a familias botánicas se utilizó la página World Flora Online (WFO, 2022).
RESULTADOS
Se revisaron 219 documentos, 58 estudios mencionan mariposas indicadoras de hábitat y de alteraciones del ambiente en México; de ellos 37 son empíricos, ya que infieren la indicación con base en los resultados de la presencia o ausencia de las especies encontradas, sin un análisis estadístico que relacione las características ambientales con las especies identificadas como indicadoras. Los otros 21 estudios sustentan sus propuestas con base en análisis estadísticos, en su mayoría multivariables. De estos últimos, solo uno se desarrolló con enfoque de indicadoras ambientales relacionando mariposas con el gradiente de contaminación en áreas urbanas y suburbanas (Meléndez-Jaramillo et al., 2021), cuatro son estudios con enfoque de indicadoras de diversidad; los dos primeros identifican especies exclusivas de selvas altas y medianas perennifolias y subperennifolias del Golfo de México y la península de Yucatán (Maya-Martínez et al., 2005; Flores-Contreras & Luna-Reyes, 2017); el tercero relaciona especies indicadoras y su fenología con cambios climáticos (Pozo et al., 2008), y el cuarto identifica especies indicadoras de cambios en los gradientes altitudinales desde el matorral submontano y bosque de encino hasta el bosque mesófilo de montaña (Meléndez-Jaramillo et al., 2019). Los 16 estudios restantes tienen enfoque de bioindicadoras ecológicas, realizados en su mayoría en el sur de México donde destacan los estados de Campeche y Chiapas. En contraste, 31 % de los estados carece de estudios sobre el tema (Fig. 1).
En el Anexo 1 se presenta la lista con 179 especies de mariposas bioindicadoras en México, en 16 estudios identifican especies indicadoras de hábitats con disturbio y conservados con base en análisis estadísticos, realizados en los estados de Campeche (Pozo & Galindo-Leal, 2006; Vester et al., 2007; Pozo et al., 2014; Cavanzón-Medrano et al., 2018), Chiapas (Molina-Martínez & León-Cortés, 2006; Balam-Ballote & León-Cortés, 2010; León-Cortés et al., 2019), Morelos (Legal et al., 2020), Nuevo León (Friesen, 2019), Quintana Roo, Yucatán (Maya-Martínez et al., 2009), San Luis Potosí (Rodríguez, 2021), Tabasco (González-Valdivia et al., 2011b; González-Valdivia et al., 2016), Tamaulipas (Meléndez-Jaramillo et al., 2017; Meléndez-Jaramillo et al., 2018) y Veracruz (Raguso & Llorente-Bousquets, 1990). El 65 % de las especies registran alguna información sobre su planta huésped, fitofagia, voltinismo, grado de especialización, tipo de hábitat y ubicación geográfica estatal. El 31 % son especies consideradas únicamente como bioindicadoras de áreas conservadas, 55 % son bioindicadoras de áreas con disturbio y 14 % fueron identificadas en ambas categorías, aunque en diferentes estudios y hábitats (Cuadro 1).
Cuadro 1 Número de especies bioindicadoras ecológicas de la superfamilia Papilionoidea en México. *En diferentes estudios y/o hábitats.
| Familia | Bioindicadoras de conservación |
Bioindicadoras de áreas con disturbio |
De ambas condiciones* | Total |
|---|---|---|---|---|
| Nymphalidae | 26 | 59 | 20 | 105 |
| Pieridae | 8 | 19 | 4 | 31 |
| Hesperiidae | 10 | 6 | 1 | 17 |
| Papilionidae | 7 | 7 | 14 | |
| Lycaenidae | 3 | 6 | 9 | |
| Riodinidae | 1 | 2 | 3 | |
| Total | 55 | 99 | 25 | 179 |
Algunas especies de Nymphalidae, Papilionidae y Pieridae fueron mencionadas como bioindicadoras ecológicas en más de un estudio; las más frecuentes se muestran en la Figura 2. En el caso de las especies de las familias Hesperidae, Lycaenidae y Rionidae, se propusieron una sola vez, a excepción del licénido Eumaeus toxea (Godart, [1824]), registrado como indicador de disturbio en dos estudios (Anexo 1).

Figura 2 Especies de mariposas mencionadas con mayor frecuencia en la literatura y porcentajes por familia de mariposas bioindicadoras (área roja= de disturbio; área verde= de conservación).
El 19 % de la familia Nymphalidae, el 13 % de Pieridae y el 6 % de Hesperiidae fueron especies identificadas como indicadoras de ambas categorías ambientales (Cuadro 1). En algunos casos podrían haber respondido a preferencias de condiciones de hábitat abierto y no como respuesta al disturbio, por ejemplo Nathalis iole Boisduval, 1836, Danaus plexippus plexippus (Linnaeus, 1758), Phoebis philea philea (Linnaeus, 1763) y Phoebis sennae marcellina (Cramer, 1777), consideradas bioindicadoras de conservación en un área abierta, un humedal en una reserva ecológica en Chiapas (León-Cortés et al., 2019); pero bioindicadoras de disturbio en áreas de selvas bajas (Meléndez-Jaramillo et al., 2017, Legal et al., 2020). Otro caso es Morpho helenor montezuma Guenée, 1859 que se consideró indicadora de disturbio en el bosque mesófilo de montaña (Balam-Ballote & León-Cortés, 2010) pero indicadora de conservación en la selva baja subcaducifolia (Pozo & Galindo-Leal, 2006).
Identificar una especie en ambas condiciones sugiere que, aunque puede ser bioindicadora de buen estado de conservación para un hábitat en particular, no la excluye de encontrarse en otro tipo de hábitat con disturbio, siempre que comparta algunas variables ambientales parecidas a las del hábitat conservado o viceversa, como pueden ser condiciones climáticas similares (temperatura y humedad), presencia de plantas huésped, y cercanía a las islas o remanentes de hábitat conservado o de disturbio. Por lo tanto, para seleccionar mariposas bioindicadoras, lo primero es reconocer en cuál hábitat o tipos de vegetación fueron identificadas como tales (Fig. 3) y a partir de ahí, considerar aquellas encontradas en áreas similares a las de interés.

Figura 3 Riqueza de especies bioindicadoras ecológicas registradas por tipo de hábitat en México. ASUB= Área suburbana, AURB= Área urbana, BMM= Bosque mesófilo de montaña, BPE= Bosque de pino encino, HUM= Humedal, HUM URB= Humedal urbano, PAS= Pastizal, RIP= Vegetación riparia, SAMP= Selvas altas y medianas perennifolias, SBC= Selva baja caducifolia, SBEC= Selva baja espinosa caducifolia, SBSC= Selva baja subcaducifolia, SBSC-VS= Selva baja subcaducifolia vegetación secundaria, SMSP= Selva mediana subperennifolia, SM-VS= Selva mediana vegetación secundaria, VS= Vegetación sabanoide.
Las mariposas bioindicadoras de disturbio son las que predominan en casi todos los tipos de vegetación y hábitats; áreas urbanas, pastizales, vegetación sabanoide y secundaria solo registran de disturbio (Fig. 3). Para el bosque de pino-encino (Rzedowski, 2006) sólo hay registro de cuatro especies indicadoras de áreas conservadas, Pterourus pilumnus (Boisduval,1836), Electrostrymon guzanta (Schaus, 1902), Anaea troglodyta aidea (Guérin-Méneville, [1844]) y Phyciodes graphica graphica (R. Felder, 1869). Para humedales, bosque mesófilo (Rzedowski, 2006) y el resto de los tipos de selvas (Miranda & Hernández, 1963) se registraron mariposas indicadoras de conservación, de disturbio o en ambas categorías (Anexo 1).
Tanto el tipo de vegetación como los hábitats en los que ocurren son el componente principal e indicador de las especies bioindicadoras que se pueden encontrar en un ecosistema; sin embargo, existen factores ecológicos, climáticos y temporales ajenos a las especies (como fenómenos meteorológicos, la estación seca o de lluvias) que determinan su presencia. Otras características fundamentales propias de cada especie son el voltinismo, grado de especialización y presencia de plantas huésped.
En las especies bioindicadoras, el voltinismo es una característica relevante ya que asegura que su presencia o ausencia se deba a los parámetros ecológicos con las que se están relacionando y no a una diapausa obligatoria consecuente a su voltinismo. Sin embargo, de las 179 especies bioindicadoras (Anexo 1), solo 26 presentan información de voltinismo, 20 especies se registran multivoltinas, es decir, que es frecuente encontrarlas en cualquier época del año, y seis univoltinas v. gr. Baronia brevicornis brevicornis Salvin, 1893, Danaus gilippus thersippus (H. W. Bates, 1863), Dryas iulia moderata (Riley, 1926), Marpesia chiron marius (Cramer, 1779), Siproeta stelens biplagiata (Fruhstorfer, 1907) y Parides photinus (Doubleday,1844), que solo se encuentran en una estación o periodo. De las 153 especies restantes no se encontró registro de esta característica.
El grado de especialización se reportó en el 39 % de las especies encontradas como bioindicadoras. De las 179 especies que se reportan, 38 son generalistas (nueve en ambientes conservados, 24 de disturbio, cinco en ambas), 28 especialistas (siete en ambientes conservados, 18 de disturbio y tres en ambos), cuatro se clasificaron como generalistas y en otros estudios como especialistas (dos en ambientes conservados: Astraptes fulgerator azul (Reakirt, [1867]) y Anaea troglodyta aidea, y dos de disturbio: Euptoieta claudia daunius (Herbst, 1798) y Agraulis vanillae incarnata [Riley,1926]), y en 109 especies no se encontró registro de esta característica (Anexo 1).
Otra característica relevante es el conocimiento de las plantas huéspedes que permite asociar la presencia-ausencia de determinadas especies bioindicadoras a un tipo de hábitat o vegetación. Con base en el Anexo 1, se elaboró un catálogo con las plantas huésped registradas para México, encontrando información solo para 116 especies (Anexo 2). Considerando que las orugas pueden ser polífagas (cuando se alimentan de varias especies de plantas de diferentes familias botánicas), oligófagas (se alimentan de un grupo restringido de especies, usualmente de la misma familia botánica) o monófagas (que dependen de un solo género) (Hernández, 2010; Mulanovich, 2007), se clasificó a 25 especies como monófagas, 48 oligófagas y 43 polífagas (Fig. 4).
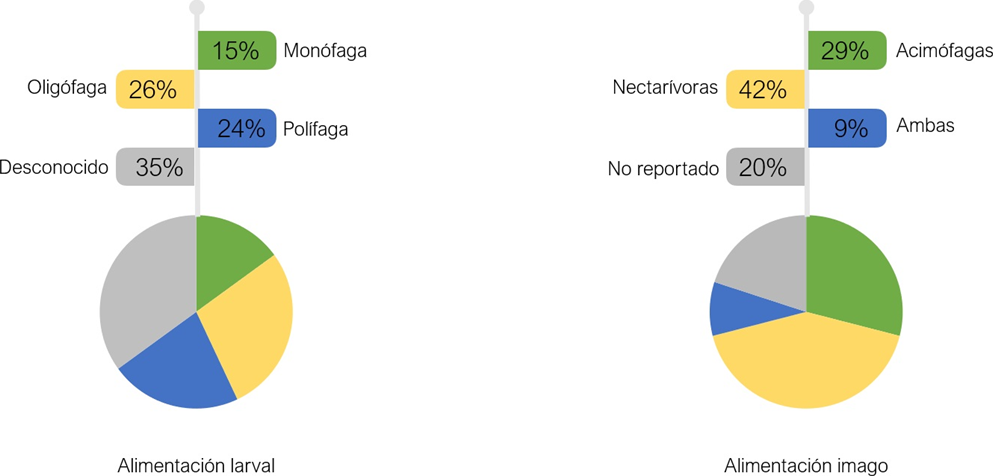
Figura 4 Porcentajes del registro del tipo de alimentación reportada para mariposas en sus estadios larval e imago.
Por último, una característica que se es de gran utilidad conocer en las especies bioindicadoras es su tipo de alimentación en estadio imago, ya que permite determinar la técnica de recolecta y muestreo. De las 179 especies citadas en el Anexo 1, 77 son nectarívoras, 51 acimófagas y 16 fueron reportadas para ambos hábitos (Fig. 4). Las técnicas de recolecta están directamente vinculadas con los hábitos alimentarios y con el gradiente altitudinal del sitio de muestreo. De esta forma, si el estudio se realiza en una elevación menor a 1,500 m en ambientes tropicales, lo ideal es la combinación de la red entomológica para especies nectarívoras y las trampas Van Someren-Rydon para especies acimófagas. Además de la red entomológica, es necesario desarrollar métodos que permitan el muestreo en el dosel, ya que existen predominancias para este estrato en este tipo de hábitats, especialmente mariposas riodínidas. Al incrementar la elevación, prevalecen los subtipos templados en los sitios de muestreo; en ellos, el uso de las trampas pierde relevancia (Vargas-Fernández et al., 1992; 1999; DeVries & Walla, 2001; Pozo et al., 2005; Arellano-Covarrubias et al., 2018). En la Figura 5, se presenta una propuesta para el muestreo de la fauna, poniendo más énfasis en el registro y estudio de las especies bioindicadoras y las técnicas adecuadas en las diferentes condiciones ambientales y sus pisos altitudinales.
Uso de métodos estadísticos para designar especies bioindicadoras
Se identificaron 16 estudios sobre especies bioindicadoras con base en análisis estadísticos. Los métodos estadísticos no multivariados utilizados fueron la ecuación de modelos enzimáticos de Michaelis-Menten (Raguso & Llorente-Bousquets, 1990), análisis de regresiones lineales simples (Molina-Martínez & León-Cortés, 2006) y pruebas de chi-cuadrada X2 (Balam-Ballote & León-Cortés, 2010). El 81 % restante utilizó métodos multivariados de ordenación y clasificación para analizar la relación entre los parámetros ecológicos de sitios conservados o con disturbio contra los datos de presencia-ausencia de las especies; se han usado principalmente de ordenación. El análisis canónico de correspondencia (ACC) fue el más utilizado (siete estudios), le sigue el índice de valor de indicador (IndVal) (cuatro estudios) y el análisis de escalamiento multidimensional no métrico (NMDS) (tres estudios). Solo dos utilizaron análisis de clasificación, como el método de grupos de pares no ponderados con media aritmética (UPGMA), en combinación con otros tipos de análisis de clasificación, como el NMDS o el ACC (Cuadro 2).
Cuadro 2 Análisis estadísticos utilizados para la definición de especies bioindicadoras.
| Estudio | Método estadístico utilizado | Especies |
|---|---|---|
| Raguso & Llorente-Bousquets (1990) | Pruebas de independencia 2 x 2 G. | 51 |
| Molina-Martínez & León-Cortés (2006) | Transformaciones logarítmicas y regresiones lineales simples. | 6 |
| Pozo & Galindo-Leal (2006) | Análisis de un escalamiento multidimensional no métrico (NMDS), análisis canónico de coordenadas principales (CAP) y análisis de correspondencia canónica (ACC). | 39 |
| Vester et al. (2007) | Análisis multivariables de permutaciones no paramétricas (ANOVA), análisis permutacional de dispersiones multivariables (PERMDISP), análisis permutacional de varianzas multivariables (PERMANOVA) y análisis de escalamiento multidimensional no métrico (NMDS). | 7 |
| Maya-Martínez et al. (2009) | Análisis de correspondencia sin tendencia (DCA), análisis de correspondencia canónica (ACC) y diagramas de ordenación. | 7 |
| Balam-Ballonte & León-Cortés (2010) | Pruebas de X2, ANOVA y análisis de correlación. | 63 |
| González-Valdivia et al. (2011b) | Análisis de escalamiento multidimensional no métrico (NMDS), análisis de apareamiento de medias aritméticas no ponderadas (UPGMA), método de asignación del Valor de indicador o (IndVal) y correlaciones de Pearson. | 14 |
| Pozo et al. (2014) | Análisis canónico de coordenadas principales (CAP) y análisis canónico de correspondencia (ACC). | 16 |
| González-Valdivia et al. (2016) | Análisis de apareamiento de medias aritméticas no ponderadas (UPGMA), análisis de correspondencia canónica (ACC), análisis de similitud (ANOSIM) y análisis de similitud porcentual (SIMPER). | 26 |
| Meléndez-Jaramillo et al. (2017) | Índice de similitud Bray-Curtis y análisis de correspondencia AC. | 9 |
| Cavanzón-Medrano et al. (2018) | Análisis de escalamiento multidimensional (MDS), análisis con coeficientes de correlación de Spearman y pruebas de Kruskall-Wallis. | 1 |
| Meléndez-Jaramillo et al. (2018) | Índice de similitud Bray-Curtis e índice de valor indicador (IndVal). | 21 |
| Friesen (2019) | Análisis de correspondencia canónica (ACC). | 2 |
| León-Cortés et al. (2019) | Regresiones logísticas múltiples, análisis de correspondencia canónica (ACC) y análisis de especies indicadoras, valor de indicador o (IndVal). | 39 |
| Legal et al. (2020) | Redes neuronales artificiales, mapas de algoritmos autoorganizados (SOM) y análisis cladísticos. | 30 |
| Rodríguez (2021) | Análisis de componentes principales (PCA) e índice de valor indicador (IndVal). | 15 |
Se debe mencionar que el término “especies indicadoras” ha sido utilizado desde antes del auge de los análisis multivariados, aunque de manera empírica, señalando especies exclusivas a un tipo de vegetación o condición del hábitat. Este conocimiento es un importante antecedente en este campo de investigación. Los 37 estudios empíricos con base en observaciones de presencia/ausencia, sin relacionarlas con parámetros ambientales a través de un análisis estadístico se realizaron en los estados de: Baja California (Brown et al., 1992), Campeche (Pozo & Galindo-Leal 2000; Pozo et al., 2003), Chiapas (Marín et al., 2009; De la Maza, 2010; De la Maza & De la Maza, 2015), Ciudad de México (Luis-Martínez & Llorente-Bousquets, 1990; Guzmán, 2014), Coahuila (Hernández-Jerónimo et al., 2019), Estado de México (Hernández-Mejía et al., 2008; Hernández-Mejía, 2009; Sánchez-Jasso et al., 2019), Guerrero (Vargas-Fernández et al., 1992; Sánchez, 2012; Figueroa-Fernández et al., 2014), Hidalgo (Pérez, 2017; Martínez-Sánchez et al., 2020), Jalisco (Vargas-Fernández et al., 1999), Morelos (De la Maza, 1975; Luna-Reyes et al., 2010, 2012; Legal et al., 2017; De la Maza & De la Maza, 2021b), Oaxaca (Arellano-Covarrubias et al., 2018; Luis-Martínez et al., 2020), Puebla (Barranco, 2016; De la Maza, 2021), Querétaro (Ramírez-Segura & Wallace-Jones, 2017), Quintana Roo (De la Maza & Soberón, 1998; León-Cortés et al., 2003), San Luis Potosí (De la Maza, 1988; De la Maza & White, 1990; Hernández, 2019), Sinaloa (Cárdenas-Lugo et al., 2015), Tabasco (Dénommée, 2010; González-Valdivia et al., 2011a) y Veracruz (Ross, 1967).
DISCUSIÓN
Mariposas bioindicadoras en México
La bibliografía sobre mariposas en México es amplia, solo hasta el año 2014, había aproximadamente 2,300 artículos y otros tipos de documentos, como tesis y reportes (Gutiérrez, 2002; Lamas, 2008; Pozo et al., 2014). Para este artículo de revisión se compiló la mayor cantidad de información disponible acerca de mariposas bioindicadoras con un enfoque ecológico, así como acerca de sus hábitos alimentarios y aspectos ecológicos y fenológicos, ya que de acuerdo con los criterios de selección para especies bioindicadoras, es indispensable el conocimiento que permita establecer claramente cuáles son sus relaciones ecológicas con los demás elementos del ecosistema que habitan (Paoletti, 1999). Sin embargo, tal como se menciona en los resultados, faltan estudios rigurosos, ya que la mayoría (63.8 %) son empíricos, y en muchos casos la definición de especies indicadoras fue circunstancial y no era el objetivo principal del estudio. Las zonas áridas y semiáridas del país son las que más carecen de estudios lepidoptero-faunísticos, especialmente con enfoque de bioindicadoras.
En cuanto a los estudios que sí tenían como objetivo identificar especies bioindicadoras, la mayoría utilizó el ACC, el cual se considera una variación del análisis de componente principales (PCA) y es uno de los primeros análisis multivariados utilizados en ecología. La desventaja del uso de PCA es que responde mejor a las relaciones lineales entre variables, pero en los ecosistemas hay muchas variables que se interconectan, que son discontinuas, no normales y que tienen influencia en el desarrollo de los seres vivos, por lo que los análisis NMDS, se consideran más adecuados en los estudios de ecología de comunidades (McCune & Grace, 2002). Sin embargo, de los análisis estadísticos registrados, el único que tiene por objeto central identificar especies indicadoras es el IndVal propuesto por Dufrene y Legendre (1997), y que de acuerdo con McGeoch (2007), identifica especies “especializadas” con alta especificidad y fidelidad a una circunstancia o condición; o a especies “generalistas” que abarcan una mayor gama de estadios ecológicos y tienen un nivel intermedio de especificidad (McGeoch, 2007). La finalidad del IndVal, es calcular el valor de asociación de cada especie con un tipo de hábitat particular; cuatro estudios en México lo utilizan y consideran el criterio de grado de conservación para relacionarlas (González-Valdivia et al., 2011b; Meléndez-Jaramillo et al., 2018; 2019; Whitworth et al., 2018; León-Cortés et al., 2019; Sharma et al., 2020; Rodríguez, 2021).
El 86 % de especies bioindicadoras con más estudios se agruparon en las familias Nymphalidae, Pieridae y Papilionidae, y el 14 % en las familias Hesperiidae, Lycaenidae y Riodinidae (Anexo 1). La mayoría de las especies de la familia Hesperiidae incumplen con las características que definen a las especies bioindicadoras, como sugieren Andrade (1998), Brown (1991), Holt y Miller (2011), Sánchez (2012) y Pozo et al. (2014); esto debido a que presentan una taxonomía muy compleja y sus individuos son difíciles de capturar e identificar en campo, a pesar de ser la familia con mayor riqueza biológica (Warren, 2000); lo anterior las coloca en desventaja al ser poco estudiadas. No obstante, se registraron 18 especies en 13 artículos, siendo Astraptes fulgerator azul, Cogia calchas (Herrich-Schäffer, 1869) y Achlyodes pallida (R. Felder, 1869) las más citadas, en cinco artículos cada una. De igual forma, por localizarse en microhábitats muy específicos y volar en el dosel, la recolecta y observación de muchas especies de la familia Riodinidae, sea difícil, y por ello muchas de las investigaciones faunísticas las registran como poco abundantes (Arellano-Covarrubias et al., 2018), lo que también descartaría a la mayoría de ellas como bioindicadoras, aun cuando fueron identificadas tres en la presente recopilación (Calephelis yautepequensis R. G. Maza & Turrent, 1977, Emesis emesia (Hewitson, 1867), Emesis tenedia C. Felder & R. Felder, 1861). Con respecto a la familia Lycaenidae, se identificaron nueve especies, pero al igual de Hesperiidae, la mayoría incumple con el criterio de fácil identificación.
Otra explicación de los porcentajes de representatividad de cada familia podría estar relacionado con su tamaño. Pozo (2006) encontró una tendencia en Calakmul, Campeche, en donde las especies pequeñas suelen ser univoltinas, y las de mayor tamaño multivoltinas. Respecto a esto, algunos autores (Gilbert & Singer, 1975; Kitahara & Fuji, 1994; 2005; Nylin, 2009) sugieren una relación directa entre las especies multivoltinas y generalistas vs. univoltinas y especialistas, debido a que las multivoltinas, al ser generalista tiene recursos a lo largo de todo el año, y las univoltinas son especialistas temporales, pues los recursos de los que depende son efímeros y muy estacionales (Kitahara & Fujii, 1994). Por lo tanto, se podría inferir que el hallazgo de especies univoltinas se presentará cuando existan las condiciones óptimas para su desarrollo, lo que corresponde generalmente en la época de lluvias o al final de ésta. Esta característica resulta relevante para el monitoreo de especies bioindicadoras con la finalidad de identificar los periodos de muestreo, aunque este tipo de información aún es desconocida para el 83 % de las especies de mariposas registradas como bioindicadoras en el Anexo 1.
Las especies bioindicadoras pueden ser especialistas o generalistas en función de los patrones de utilización de recursos en dos aspectos del nicho ecológico (tiempo y alimento). Las mariposas son fitófagas obligadas en su fase larvaria, lo que provoca una relación forzosa con su planta huésped. Pueden ser polífagas, oligófagas o monófagas en función de cuantas especies de plantas utilizan para su desarrollo (Mulanovich, 2007; Hernández, 2010). En los resultados se observó un desconocimiento de la fitofagia larvaria en el 35 % de las especies encontradas. Sin embargo, en algunos casos se reconocen algunas generalidades para incrementar el conocimiento de éstas, por ejemplo, una mariposa polífaga suele ser considerada generalista (Friesen, 2019) y multivoltina (Shapiro, 1974; Vargas-Fernández et al., 1999); y una monófaga especialista (Montero-A. & Ortiz-P., 2013) y univoltina (Shapiro, 1974; Vargas-Fernández et al., 1999).
El conocimiento de la relación larva-planta huésped permite comprender mejor la dinámica entre comunidades e inferir cómo los cambios en la composición vegetal afectan a las mariposas, y viceversa. El estatus de una comunidad de mariposas refleja, en parte, el de la comunidad vegetal, de forma que la presencia de las especies bioindicadoras está indudablemente influenciada por la presencia, distribución espacial y abundancia de su planta huésped (Montero-A. & Ortiz-P., 2013), aunque existen excepciones como: Anaea troglodyta aidea, Asterocampa leilia (W. H. Edwards, 1874), Danaus gilippus thersippus (H. Bates, 1863), Eunica tatila tatila (Herrich-Schäffer, [1855]), Euptoieta claudia daunius, Euptoieta hegesia meridiana Stichel, 1938, Memphis pithyusa pithyusa (R. Felder, 1869), Phoebis sennae marcellina y Zerene cesonia cesonia (Stoll, 1790), que presentan hábitos migratorios (Pozo et al., 2008; Hobson et al., 2021).
Los imagos presentan dos hábitos alimentarios (nectarívoros y acimófagos), hábito relevante si se pretenden utilizar con fines de monitoreo y con ello realizar diseños de muestreo eficientes. El hábito hidrófilo es una conducta que se da principalmente en machos que requieren alcanzar la madurez sexual (Vásquez et al., 2017), y se presenta tanto en especies nectarívoras como acimófagas. Las especies acimófagas pertenecen a la familia Nymphalidae: subfamilias Satyrinae, Biblidinae, Charaxinae y algunas especies de Nymphalinae (Shapiro, 1974; Vargas-Fernández et al., 1992; Sirua, 2006; Freitas et al., 2014; Martínez-Noble et al., 2015). Este gremio, otorga una ventaja para su estudio, pues al recolectarse con la técnica de la trampa Van Someren-Rydon con base en frutos fermentados, son fácil de censar. La estandarización del uso de esta técnica disminuye el sesgo atribuible al recolector y su pericia con el uso de la red entomológica, y garantiza la representación de su riqueza y abundancia de los especímenes obtenidos. En México, esta técnica de trampeo ha reportado mayor eficiencia en el bosque tropical subcaducifolio y disminuye conforme al ascenso altitudinal, principalmente hacia los tipos de vegetación templados, en parte debido a una mayor presencia de especies nectarívoras que acimófagas (Shapiro, 1974; Vargas-Fernández et al., 1992).
Más del 50 % de las especies bioindicadoras presentan hábitos acimófagos que facilita su uso en un monitoreo biológico. En el 20 % de las especies que no se observó de manera explícita su tipo de alimentación; algunas generalidades muestran que las familias Hesperiidae, Lycaenidae, Papilionidae, Pieridae, Riodinidae y un 50 % de las especies de Nymphalidae son nectarívoras (Vargas-Fernández et al., 1992; Freitas et al., 2014). La mayoría de las especies que viven en hábitats templados y de alta montaña son nectarívoras, y el hábito acimófago es típico en mariposas de hábitats tropicales y subtropicales, como sucede del 50 al 75 % de las especies tropicales de Nymphalidae (Hernández-Mejía et al., 2008; Hernández-Mejía, 2009; Freitas et al., 2014; Martínez-Noble et al., 2015).
Uso de especies bioindicadoras: diseño de muestreo
Hay dos posibilidades que determinan el tipo de muestreo. A priori, cuando se cuenta con un catálogo previo de mariposas del sitio, y a posteriori, cuando se carece de dicha lista. Para realizar un estudio de especies bioindicadoras con conocimiento a priori, el primer paso es identificar el o los tipos de vegetación del área de estudio (Brown, 1991; Schulze et al., 2001), posteriormente seleccionar y definir cuáles especies serán el objeto de búsqueda, así como sus plantas huésped (Anexo 2) y hábitos alimentarios de los imagos, esto permitirá identificar los sitios con mayor probabilidad de encontrarlas (Waltz & Covington, 2004). De esta forma, es importante tomar en cuenta la distribución geográfica, los gremios alimentarios y la fenología al momento de diseñar el muestreo. El conocimiento de su fenología facilitará la identificación de la mejor temporada para su recolecta, y los hábitos de vuelo permitirán identificar el estrato de vegetación en el que se debe realizar la búsqueda (Montero, 2014); es decir, conocer el objeto y propósito de búsqueda eficientiza el potencial uso de las especies bioindicadoras (Fleishman & Murphy, 2009). Así, es posible probar una hipótesis asociando los parámetros ambientales con la presencia o ausencia de las especies bioindicadoras.
En la posibilidad a posteriori, la opción es realizar el estudio del hábitat que considere a la comunidad de mariposas y los parámetros ambientales con los que se pretende asociar su presencia para determinar si son bioindicadoras de un ambiente conservado o perturbado. Pozo et al. (2005) mencionan que para realizar un estudio de especies bioindicadoras sin conocimiento previo (tipo a posteriori), se sugiere que los sitios de muestreo se definan mediante el método de búsqueda dirigida, con el cual los transectos o puntos de muestreo se deberán establecer donde esté la mayor cantidad de plantas en floración, claros con suficiente radiación solar y fuentes naturales o artificiales de humedad. Diversos estudios coinciden en dos épocas para la mejor recolecta de mariposas: a) al final de la época seca y b) al final del periodo de lluvias, lo cual ocurre para la mayor parte de México en los meses de abril-mayo en la época seca, y a los meses de septiembre-noviembre para la época húmeda (Balcázar, 1993; Vargas-Fernández et al., 1999; Pozo et al., 2005; Lourenço et al., 2020), debido a que la mayoría de las especies univoltinas emergen uniéndose a las multivoltinas, generando un aumento de riqueza en la temporada, aunado a una mayor floración (Luis-Martínez & Llorente-Bosuquets, 1990; Vargas-Fernández et al., 1992).
Un muestreo adicional en las semanas más húmedas permitirá identificar los picos poblacionales de determinadas especies de una comunidad. En los estudios sobre riqueza de mariposas se estima que un 20-30 % corresponde a especies con registro único o especies raras, con cinco o menos ejemplares (Pozo & Galindo-Leal, 2006; Pozo et al., 2008), las cuales son omitidas en los análisis estadísticos para la identificación de especies bioindicadoras, debido a su alta probabilidad de variación mensual o anual; aunque sí son consideradas para los cálculos de índices de diversidad generales (Lang & Bühler, 2012). Los registros históricos permiten identificar patrones anómalos, como ausencias, explosiones de poblaciones o presencias intermitentes anuales (Nowicki et al., 2008; Dennis et al., 2013; De la Maza, 2021b), derivados de algún fenómeno natural o disturbio atribuible al cambio climático o al cambio de uso de suelo; aunque en muchos casos, estas variaciones poblacionales suceden por razones aún desconocidas (Lang & Bühler, 2012). Por lo tanto, es recomendable realizar estudios de especies bioindicadoras de mediano y/o largo plazo (Grøtan et al., 2012), para lo que es recomendable optimizar los recursos económicos y al menos realizar tres muestreos anuales (Graça et al., 2017).
Dependiendo el objetivo de estudio, los parámetros ambientales de asociación que deberán estar incluidos en el muestreo son: a) condiciones del hábitat (cobertura vegetal, especies exóticas, cercanía a área urbanizadas, etc.), aquellas que correspondan a describir un sitio como conservado o con disturbio, b) niveles de contaminación o, c) especies (animales o vegetales) asociadas, que deben estar dentro o muy cercanos al sitio de muestreo (Siddig et al., 2016). En el 25 % de los estudios revisados determinaron empíricamente la magnitud de alteración del ambiente (Raguso & Llorente-Bousquets, 1990; Balam-Ballote & León-Cortés, 2010; Meléndez-Jaramillo et al., 2018; León-Cortés et al., 2019). Esta situación evidencia otra debilidad en el uso de especies bioindicadoras, que es el planteamiento por parte de los autores, el gradiente de disturbio del sitio. Debido a que algunos estudios pueden reportar hábitat alterados o modificados sin especificar en que magnitud, al comparar resultados de la biodiversidad de mariposas encontradas en diferentes sitios con características de conservación aparentemente similares, podrían diferir cuando la alteración no es en la misma magnitud, ni tiene el mismo origen o causa.
Los estudios de Brown (1991), Sant’Anna et al. (2014) y Lourenço et al. (2019) demuestran que las comunidades de mariposas varían gradualmente conforme se amplía el ecotono, y su respuesta es diferente si el cambio de estructura de la vegetación es por causas naturales o antropógenas. El cambio en la composición de la comunidad de mariposas no es estricto con los cambios de hábitat, pero sí se refleja en los cambios de abundancia en dependencia de los requerimientos para su desarrollo (Balam-Ballote & León-Cortés, 2010); lo anterior es otra posible explicación de porqué algunas especies identificadas como indicadoras de sitios conservados, en otros lugares son indicadoras de disturbio. Por lo tanto, para ambos diseños de muestreo a priori y a posteriori, se sugiere usar una metodología para cuantificar la cantidad o intensidad de disturbio (Martorell & Peters, 2005; Rodríguez, 2021), con el que se pretenda realizar la asociación de bioindicación, y de esta forma tener una mayor claridad de la magnitud del disturbio al momento de comparar hábitats similares.
Pozo et al. (2014) proponen una metodología para realizar un monitoreo con mariposas bioindicadoras donde se detalla el proceso de selección para este grupo, así como métodos estadísticos para el análisis de los resultados; sin embargo, no profundiza en la necesidad de determinar el grado de disturbio, lo cual es necesario si se desea que la información resultante sea replicable y se pueda utilizar en otras condiciones ambientales similares en cualquier otro sitio.
Bioindicadoras ecológicas: ¿Conservación, disturbio o ambas?
Definir el grado de disturbio al que se hace referencia puede aclarar situaciones como las que se presentan en los resultados, donde 26 especies se identifican como bioindicadoras de conservación y de disturbio al mismo tiempo. Una primera explicación es que sus registros suceden en condiciones contrastantes de tiempo (estación del año) o condición de la vegetación; la explicación se puede deber a que no se establecieron los mismos criterios para definir el tipo y grado de disturbio que afectaba a cada uno de los hábitats considerados; por ejemplo, donde el sitio de muestreo fue un área de reserva ecológica conservada pero cerca de ambientes urbanos (León-Cortés et al., 2019), esto pudo haber influenciado los resultados del muestreo.
Algunos autores consideran que el incremento de la fragmentación del hábitat beneficia a las especies generalistas o euritópicas al registrar el aumento de su población a medida que el hábitat se altera (Waltz & Covington, 2004; Kitahara & Fujii, 2005; Bobo et al., 2006; Molina-Martínez & León-Cortés, 2006), debido a que ocupan una mayor amplitud en uno o varios factores del ambiente, como mayor cantidad de plantas hospederas y/o multivoltinismo (Kitahara & Fujii, 2005; Pérez, 2017), así como zonas de forrajeo de los imagos en lugares abiertos. En los resultados se observó que un 62 % de las especies generalistas identificadas eran bioindicadoras de áreas con disturbio, pero un 25 % fue indicadora de ambientes conservados, y el 13 % restante fueron relacionadas con ambas condiciones de conservación.
Por el contrario, una especie especialista o estenotópica tiene una amplitud limitada en los factores ambientales en los que vive, como una dieta especializada en su estado larval, o son generalmente univoltinas, con densidades de población bajas y una distribución geográfica reducida. Suelen ser especies de localización difícil y extremadamente sensibles a los cambios ambientales, lo que las hace muy vulnerables a la extinción (Kitahara & Fujii, 2005). Sin embargo, en los resultados se encontró que un 64 % de las especies especialistas identificadas eran bioindicadoras de áreas con disturbio, y solo un 25 % de ambientes conservados.
Aunque en los resultados 109 especies carecen de asignación de especies generalistas o especialistas, las que sí la tienen impiden confirmar con absoluta certeza que una especie generalista corresponda a sitios con disturbio o una especialista a sitios conservados. Holt y Miller (2011) sugieren que las especies bioindicadoras tengan una adaptación moderada a la variabilidad ambiental, pero que su respuesta sea perceptible a los cambios; es decir, que mientras se identifiquen claramente los parámetros de variación y su respuesta, especies especialistas y generalistas pueden funcionar como bioindicadoras ecológicas indistintamente.
Por otro lado, algunas mariposas suelen tener distribución amplia e inclusive ser migratorias, esto hace factible que en hábitats conservados se encuentren individuos característicos de áreas con disturbio, o viceversa, siendo esta una de las razones de la importancia de hacer muestreos anuales y descartar con certeza a las especies migratorias que podrían haberse presentado de manera esporádica o circunstancial en determinado año. Los muestreos anuales también permiten robustecer los índices de bioindicación como el IndVal, y así establecer una hipótesis de bioindicación a mediano o largo plazo.
Prospectiva del uso de bioindicadoras en México
La relevancia de considerar todos los aspectos que permitan explicar la presencia de mariposas bioindicadoras, es para diseñar un sistema de monitoreo que ayude a definir el nivel de alteración o conservación de un hábitat; algunos sistemas de monitoreo en algunos países ya son utilizados con esta finalidad, v. gr. Alemania, Bélgica, España, Finlandia, Francia, Irlanda, Países Bajos, Reino Unido, Suecia y Suiza (Dennis et al., 2013; van Swaay et al., 2015; 2019; Schmucki et al., 2020). Un ejemplo de cómo trabajan estos sistemas es el esquema de monitoreo de mariposas del Museo de Ciencias Naturales de Granollers, Cataluña, España: Catalan Butterfly Monitoring Scheme (CBMS: www.catalanbms.org), el cual funciona con apoyo de la sociedad civil y que mantiene monitoreada una selección de especies de mariposas relevantes caracterizadas por su fácil identificación.
Aun cuando no exista un índice estandarizado de bioindicación con mariposas en México, con programas estadísticos libres como R, se pueden utilizar técnicas de análisis multivariable como el SOM Self-Organizing Maps (Legal et al., 2020), que se basan en el uso de modelos de sistemas conexionistas (conocidos como redes neuronales artificiales), donde a través de la autoorganización se reconocen patrones, y se identifican las relaciones intrínsecas entre éstos y otros estímulos o respuestas, lo que permite el aislamiento de influencias externas potencialmente sesgadas o subjetivas (Yin, 2008). En Europa, se han desarrollado otros paquetes estadísticos como BRCindicadores, que funciona con estimaciones anuales de abundancia o presencia de especies, y las agregan a un valor indicador escalado con intervalos de confianza (Dennis et al., 2019; van Swaay et al., 2019). Existe también el paquete RBMS R Butterfly Monitoring Schemes, cuyo objetivo es facilitar la implementación de métodos estadísticos y matemáticos para calcular índices de abundancia relativa a partir de series de tiempo anuales de conteos de mariposas, considerando los patrones temporales relacionados con su fenología (Comay et al., 2020; Schmucki et al., 2020; 2021).
En México se requiere trabajar en el diseño de un índice que permita analizar e interpretar las tendencias poblacionales de las mariposas bioindicadoras. El uso de este tipo de índices, aplicado a proyectos de monitoreo a mediano y largo plazo, fortalecen las hipótesis de cambio positivo o negativo en un entorno. En este sentido y conociendo su alta sensibilidad a las condiciones meteorológicas, el conocimiento profundo acerca de la fenología de las mariposas puede ser una herramienta que permita identificar otras afectaciones sutiles del cambio climático, además de las evidentes por la pérdida y transformación del hábitat.
Actualmente en el país, es posible avanzar en el desarrollo de herramientas para monitoreo y conservación, utilizando el conocimiento que se tiene de este taxón e identificación de las especies bioindicadoras aquí presentadas, aunado al uso de las megabases de datos disponibles como las del Instituto Nacional de Estadística y Geografía (INEGI), la Comisión Nacional para el Conocimiento y uso de la Biodiversidad (CONABIO), y otras plataformas promovidas por organizaciones no gubernamentales como Naturalista (https://www.naturalista.mx/), permitiendo avanzar hacia una estandarización de la información y de sus resultados. Lo anterior es una oportunidad para un área de investigación que proponga y estandarice esquemas de monitoreo y se acompañen con índices que permitan entender las tendencias poblacionales de las especies bioindicadoras.
CONCLUSIONES
A pesar de que México contiene aproximadamente el 10 % de la riqueza de Papilionoidea (sensu lato) del mundo, son pocos los trabajos en los que se han citado o utilizado sus especies como bioindicadores del estado de conservación de un ambiente, y en general, existe una carencia de investigaciones sobre lepidopterofauna con este enfoque, especialmente en las regiones áridas y semiáridas del país, las cuales se destacan por sus endemismos.
La información recopilada en este artículo es un valioso insumo para el diseño de un sistema monitoreo ambiental con fines de conservación, ya que brinda una orientación sobre cuáles mariposas son bioindicadoras de conservación y cuáles de disturbio, y en que hábitats.
La mayoría de las especies bioindicadoras ecológicas encontradas (86 %) se agruparon en las familias Nymphalidae, Pieridae y Papilionidae, que incluyen las especies de mayor tamaño y notoriedad. Los hábitats más estudiados han sido las selvas bajas, medianas y altas, destacando las especies de la familia Nymphalidae, probablemente por la facilidad de la técnica de muestreo utilizada, la trampa Van Someren-Rydon, la cual es altamente efectiva en estos tipos de vegetación











 nueva página del texto (beta)
nueva página del texto (beta)





