Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de fitopatología
versión On-line ISSN 2007-8080versión impresa ISSN 0185-3309
Rev. mex. fitopatol vol.29 no.1 Texcoco 2011
Artículos científicos
Evaluación, Selección y Caracterización de Genotipos de Papa Tolerantes al Síndrome de Punta Morada
Evaluation, Selection and Characterization of Potato Genotypes Tolerant to Purple Top Syndrome
Víctor Manuel Parga Torres1, Víctor Manuel Zamora Villa2, Fernando Borrego Escalante2, Juan Manuel Covarrubias Ramírez3, Alfonso López Benítez4 e Isidro Humberto Almeyda León5
1 Campo Experimental Saltillo, Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias (CES-INIFAP), Blvd. Vito Alessio Robles, No. 2565, Col. Nazario Ortiz Garza, Saltillo, Coah., CP 25100, México.
2 Universidad Autónoma Agraria Antonio Narro (UAAAN), Buenavista, Saltillo, Coah., CP 25315, México.
3 CES-INIFAP.
4 UAAAN.
5 Campo Experimental General Terán, Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias, Carr. Montemorelos-China km. 31, General Terán, N.L., CP 67400, México. Correspondencia: halmeyda30@hotmail.com
Recibido: Junio 14, 2010
Aceptado: Octubre 23, 2010
Resumen
En el Noreste de México, la reducción del rendimiento comercial de papa debido al síndrome de la punta morada puede alcanzar hasta 90% y en ocasiones, debido al manchado interno de los tubérculos las pérdidas pueden ser totales. En Arteaga, Coah., México, durante el año 2006 se establecieron 214 genotipos con el objetivo de evaluarlos y caracterizarlos por su tolerancia al síndrome, y seleccionar aquellos que mostraran tolerancia cuando no se llevara a efecto el control de vectores. Los parámetros evaluados fueron; altura, cobertura del follaje, días a inicio de síntomas, días a muerte de la planta, inicio de síntomas a muerte de la planta, producción total de tubérculo por planta, número de tubérculos por planta, número de tubérculos con manchado interno por planta y brotación, que se analizaron mediante métodos estadísticos multivariados. Los primeros tres componentes principales explicaron el 76.8% de la varianza total, separando en primera instancia los genotipos productores de los no productores y en segunda a los más tardíos, con mayor cobertura y menor brote de hilo de aquellos con características opuestas. El análisis de conglomerados identificó tres grupos, el primero con 114 genotipos que no produjeron tubérculos, que presentaron más temprano los primeros síntomas y murieron. El segundo grupo, con 53 genotipos de mayor tolerancia, en el que se obtuvo la mayor media de producción de tubérculo por planta. El tercero con 47 genotipos, presentó tardíamente los primeros síntomas, tuvo el intervalo más amplio a marchitez y baja producción. En los tubérculos se detectó la presencia de bacterias, virus y fitoplasmas. Los genotipos: Gigant, Alpha, Norteña, Bayonera, Nieder, Atlantic y los clones 91-29-10, 98-14-01, 94-02-01 y 96-01-01, fueron seleccionados con base en su producción o por no presentar manchado interno de tubérculo, aún y cuando no se controlaron los vectores.
Palabras clave: Solanum tuberosum, punta morada, producción, características agronómicas.
Abstract
Potato commercial yield reduction due to purple top syndrome in northeastern Mexico can reach up to 90% and sometimes losses can be total due to internal staining of the tubercles. A total of 214 genotypes were established during 2006 in Arteaga, Coah., Mexico, in order to evaluate and characterize their tolerance to the syndrome, and select those that had tolerance revealed as no vectors control were performed. The evaluated parameters were: height, foliage coverage, days to onset symptoms, days to plant death, onset of symptoms to death of the plant, total production of tubercles per plant, number of tubercles with internal staining per plant and sprouting of the plant, which were analyzed by multivariate statistical methods. The first three main components explained 76.8% of the total variance, separating first the producing genotypes from those non-producing; and second, the later with a higher coverage and lower thread outbreak from those with opposite characteristics. A total of three groups were identified by the cluster analysis: the first with 114 genotypes that did not produce tubercles, which had the symptoms revealed earlier and died. The second group, with 53 genotypes of greater tolerance, which had the highest average yield of tubercles per plant. The third with 47 genotypes, which had late manifestation of onset symptoms, had a wider range to wilt and a low production. The presence of bacteria, viruses and phytoplasm was detected in the tuber. The genotypes Gigant, Alpha, Norteña, Bayonera, Nieder, Atlantic and the clones 91-29-10, 98-14-01, 94-02-01 and 96-01-01 were selected based on their production or the absence of internal staining, even if the vectors were not controlled.
Keywords: Solanum tuberosum, purple top, production, agronomical characteristics.
En México, la papa Solanum tuberosum L., es un cultivo importante debido a la derrama económica que genera, ya que representa el 1% del Producto Interno Bruto Total y el 2.6% del Producto Agropecuario del país (ITESM, 2003). Durante el año 2007, se sembraron 64,000 ha de papa, con una producción total de 1.7 x106 t y un rendimiento promedio de 27.7 t ha-1 (SIAP, 2010). En los países en desarrollo, el consumo de papa por persona aumentó de 10 kg (1961-1963) a 21.5 kg en 2003; sin embargo, sigue siendo bajo en comparación con el de los países desarrollados, cuyo consumo promedio anual es de 93 kg por persona (Bayer, 2008). Debido al auge en el consumo de comidas rápidas y de papa frita (hojuela) al inicio de la década de los 90's, se introdujeron a México variedades con características de calidad adecuadas para la industria; sin embargo, las variedades introducidas muestran alta susceptibilidad a las principales enfermedades (tizón tardío, tizón temprano, enfermedades de la raíz, virosis, etc.) que afectan este cultivo (Parga, 2008). Recientemente, el síndrome de la punta morada fue considerado el principal problema fitopatológico para la producción de papa en la región noreste de México; éste es ocasionado por diferentes factores bióticos o abióticos, entre los primeros se encuentran los fitoplasmas (Maramorosch, 1988), virus (Salazar, 1995), hongos (Garza, 1999) y recientemente la bacteria Candidatus Liberibacter solanacearum, patógeno que causa enfermedades en especies de la familia solanaceae, como el tomate Solanum lycopersicum L. y la papa; esta bacteria es transmitida por el psilido Bactericera cockerelli (Sulc) (Hansen et al., 2008). Entre los factores abióticos se encuentran las deficiencias de nutrición (Rubio, 1998) y la alta temperatura y sequía (Davis, 1998). A finales de la década de los 90's, en el noreste de México, se reportaron pérdidas del 35% en la calidad del producto, destinado tanto al mercado fresco como a la industria por el manchado interno del tubérculo debido al síndrome de la punta morada (Parga, 2000). En el ciclo agrícola 2004, los daños por punta morada provocaron más del 50% de pérdidas en producción y hasta el 100 % en calidad (Flores et al., 2008). En la actualidad, para producir papa en el Noreste de México, se requieren de 30 a 50 aplicaciones de insecticidas para el control de los principales virus y fitoplasmas. El uso intensivo de los agroquímicos representa hasta el 35% del costo del cultivo. Lo anterior es preocupante por el riesgo que representa para los productores, trabajadores consumidores y el ecosistema (Parga, 2008). Por otra parte el principal objetivo que tiene el programa de mejoramiento genético de la papa en nuestro país, es la generación de germoplasma con resistencia al tizón tardío de la papa (Phytophthora infestans); este programa es líder a nivel mundial. Debido al incremento del problema de punta morada actualmente se están realizando evaluaciones para determinar y detectar fuentes de resistencias contra el síndrome de la punta morada (Rivera, 2008).
Las variedades comerciales utilizadas en México, tienen un parentesco cercano, con un intervalo de endogamia de 0.062 a 0.125, ya que provienen principalmente de Holanda. Los cultivares multiplicados en Europa están estrechamente interrelacionados ya que no se ha hecho mayor esfuerzo técnico importante encaminado a ampliar su base genética. Es conocido que cuando se usan estos cultivares en el mejoramiento genético la progenie resultante tendrá algún grado de endogamia debido al parentesco entre sus progenitores, lo que podrá reducir su rendimiento y estabilidad (Estrada, 1999), esta situación ha ocasionado fuerte dependencia hacia el uso de agroquímicos, debido a la falta de resistencia a las enfermedades y a la falta de adaptación de los cultivares a las condiciones adversas (Spiertz et al., 1996). La sociedad actual demanda que la producción agrícola sea inocua para el humano y el ambiente, debido a lo cual se requiere seleccionar genotipos con tolerancia que coadyuven en la reducción del uso de agroquímicos, por lo que es necesario que genetistas y mejoradores estudien las características de tolerancia y sus múltiples relaciones para su comprensión y hacer más eficiente el proceso de mejoramiento por resistencia múltiple al síndrome de la punta morada. Los métodos multivariados constituyen una herramienta que permite identificar las relaciones entre variables, agrupar y caracterizar genotipos, ofreciendo al fitomejorador una guía más objetiva en la selección (Ye et al., 2001). El objetivo de este estudio fue: evaluar y caracterizar preliminarmente genotipos de papa tolerantes al síndrome de la punta morada.
MATERIALES Y MÉTODOS
Durante el ciclo primavera-verano 2006, se evaluaron 214 genotipos bajo condiciones de riego en el Campo Experimental Saltillo ubicado en el Ejido Emiliano Zapata, municipio de Arteaga, Coah. México, que se localiza a 25° 14' LN y 100° 35' LO, a una altitud de 2200 msnm. El clima es templado subhúmedo con precipitaciones todo el año (García, 1988). El germoplasma provino del Programa Nacional de Papa de México (INIFAP) con 200 genotipos; del Programa Nacional de Cuba (Cubanita e Ibis); Estados Unidos de Norteamérica (FL-1867, Russet Burbank, Early Valley y Atlantic) y Holanda (Gigant, Vivaldi, Felsina, Granola, Escort, Platina, Liseta y Alpha). Se utilizaron mini-tubérculos provenientes de invernadero para asegurar el uso de semilla libre de virus y bacteria, lo cual fue corroborado mediante análisis ELISA y PCR. Se estableció un tubérculo por genotipo, debido a que los clones están en proceso de formación (etapas tempranas de evaluación) y por lo tanto no se dispuso de semilla-tubérculo suficiente para evaluar en mayor cantidad. Cada tubérculo-semilla se colocó a 20 cm entre planta y 92 cm entre surcos. Durante el desarrollo del cultivo se monitoreó semanalmente la presencia de los vectores en la parcela: paratrioza (Bactericera cockerelli Sulc), pulgones (Myzus spp) y chicharritas (Empoasca spp), mediante trampas amarillas pegajosas que se colocaron orientadas de norte a sur, a la altura del ápice de la planta (Zavala-Quintana, 2002). Entre el período de emergencia a desvare no se realizaron aplicaciones de insecticidas y las aplicaciones de fungicidas preventivos para el tizón tardío, se realizaron semanalmente después de emergencia. El manejo del cultivo se realizó de acuerdo con las recomendaciones del Campo Experimental Saltillo (Parga et al., 2005). Las variables evaluadas fueron: Altura de Planta (AP; cm), desde la superficie del suelo hasta el ápice al momento del desvare o muerte de la planta. La Cobertura de la planta (COB; cm); se consideró el diámetro del follaje de la planta a los 80 días después de emergencia o a la muerte de planta. Días a Inicio de Síntomas (DIS); consideró los días desde la emergencia hasta la aparición de los primeros síntomas del síndrome de punta morada (decoloración o enrollamiento de las hojas). Días a Muerte de Planta (DMP); días transcurridos desde la emergencia hasta la muerte de la planta. Inicio de Síntomas a Muerte de planta (ISM); días transcurridos que se observaron los primeros síntomas hasta que ocurrió la muerte de la planta. Producción total por planta (PT) expresada en g/planta. Número de Tubérculos por planta (NT) y Manchado Interno del Tubérculo (MIT); para estas variables se contabilizó el número de tubérculos por planta, de los cuales aleatoriamente tres fueron partidos para evaluar el porcentaje de manchado o pardeamiento interno y se expresó en porcentaje. De aquellos genotipos que produjeron mayor número de tubérculos, Brotación (B); los tubérculos sobrantes se almacenaron por seis meses con el objeto de evaluar la presencia de Brote de Hilo (BH) y la falta de brotación o Sin Brotes (SB) (Cadena-Hinojosa et al., 2003).
Con el objeto de determinar la incidencia poblacional de fitoplasmas, virus y bacterias en el lote de evaluación se colectó al azar un tubérculo de cada uno de los 35 genotipos que produjeron tubérculos y se enviaron para su análisis al Laboratorio de diagnóstico Fitopatológico del Campo Experimental Valle de Culiacán del INIFAP. La detección de fitoplasmas y bacteria (Xilella fastidiosa Wells), fue mediante la técnica de la Reacción en Cadena de la Polimerasa (PCR) (Almeyda-León et.al., 2001, Martínez-Soriano et al, 1999). Para detectar a los virus PLRV y PVY se utilizó la técnica de ELISA (Enzyme-Linked Inmunosorbent Assay) (Salazar, 1995). Con el fin de analizar los datos poblacionales, reducir la dimensionalidad de los datos, establecer la relación entre las variables y agrupar individuos semejantes (Manly, 1986; Jhonson y Wichern, 1988), se utilizó la técnica de Análisis de Componentes Principales (ACP) y un Análisis de Conglomerados (AC).
RESULTADOS Y DISCUSIÓN
Solamente el 46.7% de los genotipos evaluados produjo tubérculos; el resto presentó los síntomas característicos del síndrome de la punta morada y murió sin llegar a producción. El análisis de componentes principales (ACP), explicó76.8% de la varianza total con los primeros tres componentes principales (Cuadro 1). El primer componente contuvo 40.59% de dicha varianza, e indicó asociación positiva entre todas las variables estudiadas; en este Cp1 resaltaron características como días a inicio de primeros síntomas y días a muerte, producción por planta y número de tubérculos por planta con valores superiores a 0.7, por lo que se puede llamar "Componente de producción o tolerancia", ya que tiende a separar los genotipos productores de los no productores (Figura 1).
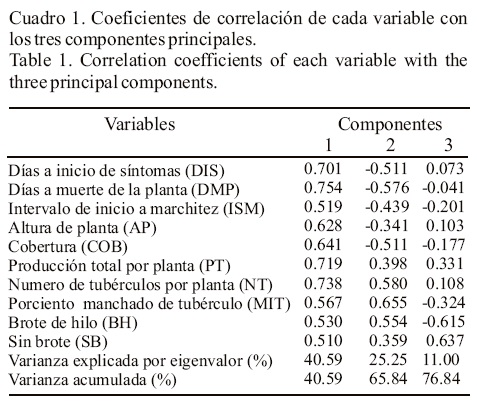
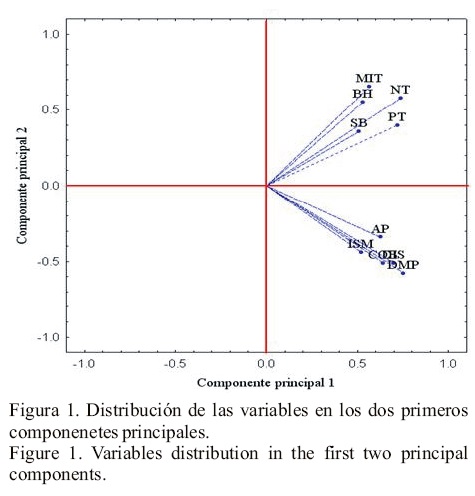
El segundo componente principal explicó la asociación negativa entre los días a inicio de primeros síntomas (ISM), días a muerte (DMP) y cobertura (COB), que presentaron valores superiores a -0.5, con el número de tubérculos por planta (NT), porciento de manchado de tubérculos (MIT) y brote de hilo (BH), que presentaron asociación positiva entre sí con valores superiores a 0.5. Estos valores en las características agronómicas y de tubérculos, son síntomas de alta susceptibilidad al síndrome de la punta morada (Maramorosch, 1988; Salazar, 1995; Cadena 1996; Flores et al., 2008), por lo cual este componente puede denominarse de "Susceptibilidad al síndrome de la punta morada", ya que tiende a agrupar variables asociadas a los síntomas de este síndrome (Figura 1). Para el tercer componente principal, los valores significativos pero opuestos fueron; para características de brotación de tubérculo brote de hilo (BH) -0.615 y sin brote (SB) 0.637, por lo que este CP3 que incide en la calidad de la semilla-tubérculo puede denominarse "Componente de viabilidad de semilla" (Cadena-Hinojosa et al., 2003).
Los síntomas de de BH y SB, son característicos del daño por el virus potato leaf roll (PLRV) independiente y en asociación con el potato virus Y (PVY) y fitoplasmas presentan un daño más severo (Bokx, 1980), siendo de los principales patógenos que favorecen la degeneración acelerada de la semilla. Actualmente los fitoplasmas han sido señalados como patógenos de gran peligrosidad en las zonas productoras de papa comercial o como semilla, debido a que pueden pasar desapercibidos al estar presentes en tubérculos-semillas con brotación normal (Martínez-Soriano et al., 1999). En la Figura 1, se aprecia lo expresado para los componentes principales que explicaron la mayor cantidad de variación, sugiriendo una clasificación preliminar de los genotipos evaluados por su susceptibilidad al síndrome de la punta morada, así la línea trazada en el punto cero del CP1 de la Figura 2, separa a los genotipos productores a la izquierda de la línea y a los no productores a la derecha. El CP2 separó los genotipos más productores, con mayor número de tubérculos y mayor porcentaje de manchado, menor altura y cobertura, menor inicio y muerte así como intervalo de inicio a muerte, de aquellos genotipos más altos, de mayor cobertura, tardíos, menos productores y con menor número de tubérculos. Para confirmar las clasificaciones anteriores, se procedió a realizar un análisis de conglomerados mediante la metodología de Ward (1963), la cual identificó hasta tres grupos cuyos valores medios y número de integrantes aparecen en el Cuadro 2. Al comparar tales grupos se detectó alta significancia entre la mayoría de las variables, excepto para altura de planta entre el Grupo I y II. El Grupo I estuvo conformado por 114 genotipos que se caracterizaron por no producir tubérculo y porque sus características agronómicas obtuvieron los valores más bajos, debido posiblemente a la susceptibilidad mostrada al síndrome de punta morada. Los genotipos que conformaron el Grupo II (53), fueron los de mayor tolerancia al síndrome, ya que presentaron la mayor media de producción por planta (49.77 g planta-1) y sobrevivieron, de inicio de síntomas a marchitez, 17 días. En este grupo probablemente ocurrió la más rápida translocación de fotosintatos para el llenado de tubérculo antes de que el floema fuera afectado por hipertrofia, hiperplasia y proliferación o necrosis de células y acumulación anormal de callosa en las paredes o por la tasa de translocación del virus o fitoplasma, que depende del ritmo de multiplicación y para la cual se ha reportado que difieren las variedades como lo señalan Bokx (1980) y Ploaie (1981). El Grupo III sobresale por presentar más tarde los primeros síntomas (56 días), así como el intervalo más amplio a marchitez (23.08), lo que sugirió lento desarrollo de la enfermedad o presencia de características que las hacen poco atractivas para los vectores. La media de producción de este grupo fue muy baja (6.531 planta-1). Esta baja producción pudo deberse a la reducción en la translocación de los hidratos de carbono del follaje a los tubérculos y que da como resultado la acumulación de almidón en las hojas, abultamiento del tallo en los lugares de inserción de las hojas y formación de tubérculos aéreos como sugieren Ames (1980) y Maramorosch (1988). Los bajos valores promedios de producción por planta que se obtuvieron en este estudio probablemente fueron debidos a la presencia de altas poblaciones de vectores ya que no se realizaron aplicaciones de insecticidas para su control, consecuentemente la transmisión de la enfermedad fue mayor, los pulgones presentaron mayor población con relación a la paratrioza y chicharrita desde la emergencia la que se uniformizó a los 21 días después de la siembra (Figura 3). La sintomatología del síndrome de punta morada en planta y tubérculo, puede ser causada por virus y fitoplasmas (Bokx, 1980; Martínez-Soriano et al., 1999), así como por la bacteria Xilella fastidiosa (Wells); esta última también es reportada como inductora de los síntomas característicos de esa enfermedad (Secor et al., 2006). Es posible que también estuviera presente la bacteria Candidatus Liberibacter solanacearum, especie que solo afecta a especies de la familia solanaceae como el tomate y la papa y es transmitida por Bactericera cockerelli (Sulc) (Hansen et al., 2008). Lo anterior hace difícil dilucidar la importancia de cada una de ellas, ya que en las muestras que se analizaron, se encontraron los virus PLRV y PVY, fitoplasma y la bacteria Xilella fastidiosa (Wells). El fitoplasma fue detectado en 80% de las muestras, seguido del PVY y PLRV con 31 y 28.6% respectivamente. En cuanto a las combinaciones detectadas, la más frecuente fue PVY y fitoplasma (28.6%). Como la trasmisión de estos patógenos se realiza a través de vectores y se utilizó semilla sana (minitubérculos provenientes de invernadero y analizados contra la presencia de virus y fitoplasmas), se asume que los patógenos fueron adquiridos a través de los vectores. Para la bacteria Candidatus Liberibacter solanacearum no se realizó análisis; sin embargo, la presencia de su principal vector (Bactericera cockerelli Sulc) y otros hospederos alternos de la bacteria como la correhuela (Ipomoea spp.) y el cilindrillo (Licium berlandieri) hace suponer su presencia en el sitio de evaluación. En virtud de lo complejo del problema del síndrome de la punta morada debido al gran número de agentes causales, es importante seleccionar aquellos genotipos menos susceptibles y utilizar el método más adecuado para controlar la enfermedad. En la Figura 4, se observa el agrupamiento de genotipos que lograron producir (Grupo II), así como los que alcanzaron baja producción (Grupo III) y nula producción (Grupo I); con base en esto, el componente CP1 separó los genotipos con y sin producción. De acuerdo con estos resultados, el Grupo II es de mayor impo rtancia para iniciar un programa de mejoramiento, al tener mayor tasa de translocación de fotoasimilados o mayor resistencia a la afectación del floema, comparándolo con el Grupo I en el que fue nula la producción de tubérculo y más temprano el inicio de síntomas y muerte de planta, y con el Grupo III, que mostró más tardío el inicio de síntomas y muerte de la planta y baja producción, por lo que son necesarios estudios más precisos para determinar las causas de su comportamiento. En el Cuadro 3; aparecen los genotipos del Grupo II que superaron a la media de producción por planta; en dicho grupo quedaron incluidas las principales variedades comerciales (Alpha, Atlantic y Gigant), así como las nuevas variedades liberadas por el INIFAP (Nieder y Bayonera) y algunos clones promisorios del mismo Instituto. Los genotipos Alpha, Gigant, 91-29-10 y CIP-30, son relevantes porque no presentaron manchado interno de tubérculo y los clones 94-02-01, 98-14-01 y 96-01-01 fueron tolerantes para este síntoma con 25, 18 y 25% respectivamente. Para los cultivares, Alpha y Gigant, existen informes de resistencia al manchado (Cadena, 1996; Cazares et al., 2003), éstos genotipos al igual que el clon 9129-10 pudieran ser utilizados como progenitores en un programa de mejoramiento por resistencia al manchado.

CONCLUSIONES
Dentro de los grupos generados, el Grupo II conformado por 53 genotipos resultó más tolerante al síndrome de la punta morada, destacando en él los genotipos Gigant, Alpha, Norteña, Bayonera, Nieder, Atlantic, 91-2910, 98-14-01, 94-02-01 y 96-01-01, por su mayor producción y menor manchado del tubérculo cuando no se controlan vectores de la enfermedad por medios químicos. Estos materiales se constituyen como alternativas para ser utilizados en programas de mejoramiento genético, orientados a la búsqueda de resistencia o tolerancia al síndrome de punta morada de la papa.
LITERATURA CITADA
Almeyda, L.I.H., Rocha, P.M.A., Piña, R.J., Martínez, S.J.P. 2001. The use of polymerase chain reaction and molecular hybridization for detection of Phytoplasma sp. in different plant species in Mexico. Revista Mexicana de Fitopatología 19:1-9. [ Links ]
Ames, T.I. 1980. Compendio de enfermedades de la papa. Centro Internacional de la Papa. Lima, Perú. Pp: 25-26. [ Links ]
Bayer, 2008. Manual del tizón tardío (Phytophthora infestans). Información Técnica. Bayer de México, S. A. de C.V. 45p. [ Links ]
Bokx, J.A. 1980. Viruses of potatoes and seed-potato production. Centre for Agricultural Publishing and Documentation, Wageningen, The Netherlands. 291p. [ Links ]
Cadena, H. Μ. A. 1996. La punta morada de papa en México: II Efecto de cubiertas flotantes, cultivares y productos químicos. Revista Mexicana de Fitopatología. 14:20-24. [ Links ]
Cadena-Hinojosa, Μ. A., Guzmán-Plazola, R., Díaz-Valasis, Μ., Zavala-Quintana T.E., Magaña, T.O.S., Almeyda-León. I.H., López-Delgado, H., Rivera-Peña. A. y Rubio-Covarrubias, O. 2003. Distribución, incidencia y severidad del pardeamiento y la brotación anormal en los tubérculos de papa en Valles Altos y Sierras de los estados de México, Tlaxcala y el Distrito Federal, México. Revista Mexicana de Fitopatología. 21:248-259. [ Links ]
Cazares, M.I.G., de la Jara, A. F., Rodríguez, D.A.M. y Cadena, H.M.A. 2003. Comparación de patrones electroforéticos de proteínas e isoenzimas en tubérculos sanos y con síntomas de punta morada de siete variedades de papa (Solanum tuberosum L.). Revista Mexicana de Fitopatología. 21:102-108. [ Links ]
Davis, H.V. 1998. Physiological mechanisms associated with the development of internal necrotic disorders of potato. American. Journal ofPotato Research. 75:37-44. [ Links ]
Estrada, R.N. 1999. La biodiversidad en el mejoramiento genético de la papa. Ed. Centro de Información para el desarrollo. Centro Internacional de la Papa. Libro Técnico. La Paz Bolivia. Pp:17- 63. [ Links ]
Flores, O.A., Alemán, N.I.A. y Notario, Z.M.I. 2008. Alternativas para el manejo de la punta morada de la papa. Pp. 66-89. In: Flores Olivas, A. y Lira Saldivar, R.H. (eds). Detección, Diagnóstico y Manejo de la Enfermedad Punta Morada de la Papa. Ed. Parnaso. Málaga, España. [ Links ]
García, E. 1988. Modificaciones al sistema de clasificación climática de Köpen (para adaptarlo a las condiciones de la República Mexicana). 4a. ed. Universidad Nacional Autónoma de México, Instituto de Geografía. México, D. F. 217 p. [ Links ]
Garza, L.J.C. 1999. Control de la marchitez de la planta y necrosis interna del tubérculo en papa en Coahuila y Nuevo León. Campo Experimental Saltillo, INIFAP. Folleto Técnico No. 1. 11p. [ Links ]
Hansen, A.K., Trumble, J.T., Stouthamer, R. and Paine, T.D. 2008. A new Huanglonbing (HLB) species, "Candidatus Liberibacter psyllaurous," found to infect tomato and potato, is vectored by psyllid Bactericera cockerelli (Sulc). Applied Environmental Microbiology 74:5862-5865. [ Links ]
ITESM. 2003. Informe del Foro Cadena Agroalimentaria de Papa (Alta Tecnología). Instituto Tecnológico de Estudios Superiores de Monterrey Campus Saltillo. Saltillo, Coah., México. 35p. [ Links ]
Johnson, R.A. and Wichern, D.W. 1988. Applied Multivariate Statistical Analysis. 2nd ed. Prentice-Hall. Englewood Cliffs, NJ, USA. 607p. [ Links ]
Manly, B.F.J. 1986. Multivariate Statistical Methods: A Primer. Ed. Chapman and Hall. London. 160p. [ Links ]
Martínez-Soriano, J.P., Leyva-López, N.E., Zavala-Soto, M.E., Beres, Μ. y Leal-Klevezas, D.S. 1999. Detección molecular del agente causal de la "bola de hilo" de la papa en semillas infectadas y asintomáticas. Biotecnología Aplicada 16:93-96. [ Links ]
Mendoza, H.A. 1997. Development ofpotatoes with multiple resistances to biotic and abiotic stresess. Advances in Potato Pest. Biology and Management. APS Press. Pp:627-642. [ Links ]
Maramorosch, K. 1988. Potato purple top wilt. Entomology Department, Cook College, Rutgers-The State University. NJ, USA. 456p. [ Links ]
Parga, T.V.M. 2000. Devoran a la Papa: Plaga y Altos costos. Nota periodística publicada el 23 de octubre del 2000 en el periódico la PALABRA. Saltillo Coah. México.
Parga, T.V.M. 2008. Mejoramiento genético por resistencia a punta morada de la papa (Solanum tuberosum L.). Pp:49-56. In: Flores Olivas, A. y Lira Saldivar, R.H. (eds). Detección, Diagnóstico y Manejo de la Enfermedad Punta Morada de la Papa. Ed. Parnaso. Málaga, España. [ Links ]
Parga, T.V.M., García, G.S.J., Villavicencio, G.E.E., Sánchez, S.J.A., Contreras, de la R.F.J., Arellano, G.M.A., Covarrubias, R.J.M., Rubio, C.O.A. y Fernández E.J. 2005. Tecnología para producir papa en Coahuila y Nuevo León. Campo Experimental Saltillo, INIFAP. Folleto Técnico No. 5. Saltillo, Coah., México. 164p. [ Links ]
Ploaie, P.G. 1981. Plant Diseases and Vectors Ecology and Epidemiology. Maramorosch, K. and Harris, K.F. (eds.). Academic Press. NY, USA. 368p. [ Links ]
Rivera, P.A. 2008. Generación de variedades de papa en México. Memorias del XII Congreso Nacional de Papa. Los Mochis, Sinaloa, México. Pp:45-48. [ Links ]
Rubio, C.O.A. 1998. Manejo Integrado de la nutrición del cultivo de la papa. Memorias del 2° Simposium Internacional de la Papa. Toluca, México. Pp:35-42. [ Links ]
Salazar, L.F. 1995. Los virus de la papa y su control. Centro Internacional de la Papa (CIP), Lima, Perú. 226p. [ Links ]
Secor, G., Munyaneza, J. y Ming-Lee, I. 2006. Una nueva enfermedad tipo punta morada causando pérdidas en el cultivo de la papa en Norte América. En: Mora-Aguilar, R. y H. Lozoya-Saldaña. Memorias del XXII Congreso de la Asociación Latinoamericana de la Papa. Toluca, México. Pp:2-5. [ Links ]
Servicio de Información Agroalimentaria y Pesquera (SIAP). 2010. Cierre de la producción agrícola por cultivo. El cultivo de papa. Año 2009. Informe SIAP. México, D.F. http://www.siap.gob.mx/index.php?option=com_wrapper&view=wrapper&Itemid=350. (consulta, noviembre 2010). [ Links ]
Ward, J.H.Jr. 1963. Hierarchical grouping to optimize an objective function. Journal of the American Statistical Association 58:236-244. [ Links ]
Ye, C.W.E., Díaz, S.H., Lozano del R.A.J., Zamora, V.V.M. y Ayala, O.M.J. 2001. Agrupamiento de germoplasma de triticale forrajero por rendimiento, ahijamiento y gustosidad. Técnica Pecuaria en México 39:15-30. [ Links ]
Zavala-Quintana, T.E. 2002. Experiencias en el valle de Toluca sobre punta morada. Memorias del XI Congreso Nacional de la Papa. León, Guanajuato México. Pp:81-97. [ Links ]














