En el devenir evolutivo, los patógenos han desarrollado mecanismos para obtener nutrientes de las plantas causando enfermedad o la muerte del hospedante. En respuesta, las plantas han desarrollado barreras físicas y químicas para dificultar el progreso del patógeno. Estas pueden ser barreras pre-existentes, inherentes a la planta, como las cutículas cerosas o los alcaloides. Otras, son inducidas y se activan ante la interacción con los fitopatógenos, como el reforzamiento de paredes celulares con lignina o la producción de compuestos tóxicos como las fitoalexinas (Muthamilarasan y Pasard, 2013). A través del tiempo, estos mecanismos de ataque y defensa han evolucionado. Algunos patógenos, como los oomicetos, incluso han desarrollado la habilidad de interrumpir, interferir o evadir las respuestas de defensa de las plantas (Brich et al., 2008; Lamour et al., 2012), lo que los vuelve devastadores. Por su parte, las plantas han desarrollado las proteínas R, que confieren resistencia a patógenos específicos, y ante su presencia, inducen una rápida reacción de hipersensibilidad que interrumpe la infección (Sanzón-Gómez y Zavaleta-Mejía, 2011; Gururani et al., 2012). El patosistema formado por Capsicum spp.-Phytotphthora capsici en la mayoría de los casos resulta dañino para el hospedante lo que causa la marchitez del chile. Las evidencias experimentales sugieren la posible ausencia de proteínas R que reconozcan al oomiceto en el género Capsicum (Smith et al. 1967; Reifschneider et al., 1992; Minamiyama et al., 2007), no obstante, se observa una marcada resistencia en ciertos genotipos (Mongkolporn y Tylor, 2011). También, se ha reconocido que la resistencia de Capsicum a P. capsici es de naturaleza multigénica y que los genes de defensa involucrados en la resistencia al oomiceto se encuentran agrupados en el cromosoma 5, pero la intensidad y la velocidad de la respuesta defensiva varía entre las diferentes variedades (Castro-Rocha et al., 2012; Barchenger et al., 2018). Asimismo, los niveles de resistencia a P. capsici son modificados por la presencia de algunos agentes de control biológico (Veloso y Díaz, 2012). El objetivo de esta revisión fue hacer un análisis crítico del estado del arte del patosistema en cuestión, que permitió proponer de forma sintetizada mediante esquemas la compleja red de comunicación que define el desenlace de la interacción entre el chile y P. capsici como resistente, tolerante o susceptible.
La solanaceae hospedante: Capsicum spp. El género Capsicum es nativo de los trópicos de América. Su producción y rendimiento son limitados por diversos fitopatógenos como bacterias (Xhanthomonas vesicatoria Doidge y Pectobacterium carotovorum Jones), hongos (Fusarium oxysporum Scltdl., Rhizoctocnia solani J.G. Kühn y Leveillula taurica (Lév.) E.S. Salmon), virus (Pepper mottle virus, Pepper mild mottle virus, Cucumber mosaic virus y Tobacco mosaic Virus), nematodos (Meloidogyne spp. Goeldi y Nacobus spp. Thorne) y oomicetos (Pythium ultimum Trow y P. capsici) (Goldberg, 2001). Particularmente, P. capsici ha llamado la atención de los fitopatólogos; nombrado como “el destructor de plantas de Capsicum”, el oomiceto establece un patosistema complejo al interactuar con su hospedante. Sin embargo, algunos cultivares de Capsicum han mostrado altos niveles naturales de resistencia y, en otros casos, algunas variedades son capaces de resistir el ataque en presencia de microorganismos agentes de control biológico (ACBs) con capacidades antagonistas o de promoción de crecimiento vegetal (Cuadro 1). En ambos casos, el desarrollo o supresión de la enfermedad está determinada por una red comunicacional mediada por una variedad de moléculas.
Moléculas de Capsicum spp. involucradas en la red comunicacional. Como otras plantas, Capsicum spp. presenta tres tipos diferentes de moléculas en la interacción con microorganismos benéficos o patógenos. Las involucradas en el reconocimiento de posibles amenazas, las que llevan el mensaje de alerta y las expresadas como respuestas de defensa.
Moléculas de reconocimiento. Mediante Receptores de Reconocimiento de Patrones (PRRs) las plantas detectan y reconocen estímulos físicos, químicos y biológicos del ambiente (Muthamilarasan y Prasad, 2013). Las proteínas receptoras con dominios de repeticiones ricas en leucina y un C-terminal ligado a la membrana (RLPs); y las quinasas RLKs, que poseen un dominio extracelular con un N-terminal, un dominio transmembranal y un dominio quinasa C-terminal dentro de la célula son los receptores más descritos. Ambos receptores se localizan en la membrana, perciben moléculas extrañas y emiten una alerta al interior de la célula. Así, los PRRs detectan los Patrones Moleculares Asociados a Microorganismos (MAMPs) y a Patógenos (PAMPs) tales como: dominios de flagelinas, exopolisacáridos, productos del sistema de secreción tipo 3 (T3SS) y sus dominios peptídicos, peptidoglicanos y moléculas relacionadas al quorum sensing como las N-acil-homoserin-lactonas (AHL) (bacterias Gram negativas) u oligopéptidos (bacterias Gram positivas). Estos patrones moleculares evidencian la presencia de bacterias en la planta. La presencia de hongos es revelada por moléculas como la quitina, las β-glucanas, las lipoproteínas, proteínas glicosiladas específicas, el ergosterol y los oligomanósidos. En oomicetos como P. capsici los dominios de PEP-13 de la transglutaminasa, proteínas tipo PcNPP1, elicitinas como la capsiceina y lípidos como el ácido araquidónico revelan su presencia a la planta (Bent y Makey, 2007; Muthamilarasan y Prasad, 2013; Vidhyasekaran, 2014). En el año 2010, Yi junto a su grupo de investigación describieron un receptor del tipo RLK en Capsicum, asociado con el retardo de la Respuesta de Hipersensibilidad (RH). A pesar de la habilidad de los PRRs para detectar la presencia de microorganismos invasores, algunos fitopatógenos han desarrollado diferentes estrategias para establecerse y colonizar los tejidos de la planta. Los patógenos que afectan significativamente la producción agrícola son capaces de bloquear, interferir o evadir las respuestas de defensa de las plantas (Lamour et al., 2012). Por su parte, las plantas han desarrollado receptores moleculares especializados como las proteínas R (productos de los genes de resistencia), capaces de desencadenar una respuesta de defensa violenta. Las proteínas R permanecen en el citosol con el fin de reconocer directamente a los efectores (modelo receptor-ligando), o bien, pueden estar acopladas a la molécula diana para reconocer la acción del efector sobre ésta (modelo guardián) (Brich et al., 2008), y así activar la resistencia mediada por la RH. Las proteínas R consisten en un dominio con repeticiones ricas en leucina (LRR) y un sitio de unión a nucleótidos (NB) acoplados a un receptor del tipo 1 Toll-Interleucina (TIR-NB-LRR) (Gururani et al., 2012).
Cuadro 1 Diversidad de agentes de control biológico usados para proteger a la planta contra la marchitez del chile y sus mecanismos de acción implicados y el efecto resultante de la interacción.
| Agente de Control Biológico | Variedad de Chile | Mecanismo Reportado en: | Efecto | Referencia | |
|---|---|---|---|---|---|
| Antagonista | Planta | ||||
| Bacillus amyloliquefaciens, B. thuringensis | Hibrido SV3198HJ | Antibiosis | - | Inhibición en germinación de zoosporas | Ley-López et al.,2018. |
| Penicillumsp. | Anaheim | Micoparasitismo y competencia | - | Desintegración de hifas | Jiménez-Camargo et al.,2018 |
| Trichoderma hamatumy Pseudomonas aeruginosa | Landung | Micoparasitismo y competencia | - | Reducción de la incidencia de la enfermedad | Chemeltorit et al.,2017. |
| Paenibacillus polymixa | Supermanitta | Antibiosis e ISR | POX, PPO, PAL, SOD | Promoción de la salud vegetal | Xu y Kim 2016. |
| Streptomyces plicatus | California wonder | Antibiosis, hiperparasitismo | - | Reducción de la incidencia de la enfermedad | Chen et al.,2016 |
| Fusarium oxysporum | - | ISR y competencia | PR1, CHI, SC | Promoción de salud vegetal | Veloso y Díaz, 2012 |
| Trichoderma ovalisporum, T. hamatum, T. theobromicola, T. stilbohypoxyl, T. carbbaeum | Bugang | Micoparasitismo y antibiosis | CHI, PR4, EAS, SC | Reducción en el desarrollo de la enfermedad | Bae et al.,2011 |
| Xylaria poitei | Mirasol | Competencia | - | Protección de la planta | Ramos et al.,2010 |
| Glomus mosseae, G. etunicatum, G. fasciculatum, G. margarita | Charliston Bagci | ISR y competencia | PAL, CHI, GLU, capsidiol | Mayor desarrollo de raíces y resistencia a la enfermedad | Ozgonen et al.,2009 |
CHI Quitinasas; EAS Epi-5-Aristoloqueno sintasa; GLU Glucanasas; PAL Fenilalanina amonio liasa; POX Peroxidasas; PPO Polifenoloxidasas; PR1 y PR4 Proteinas relacionadas a la patogénesis; SC Sesquiterpeno cyclasa; SOD Superóxido dismutasa / CHI Chitinases; EAS Epi-5-Aristoloquene synthase; GLU Glucanases; PAL Phenylalanine amonnia lyase; POX Peroxidases; PPO Polyphenoloxidases; PR1 and PR4 Proteins related to pathogenesis; SC Sesquiterpene cyclase; SOD Superoxide dismutase.
Los genes R de Capsicum son bien conocidos: el gen Bs2 confiere resistencia a Xanthomonas campestris (reconoce a AvrB2), CaMi a Meloidogyne incognita (reconoce diferentes moléculas relacionadas a la interacción planta-nematodo), pvr1 y pvr2 al Potato virus Y (reconocen a Vpg), y L1, L2 y L3 al Turnip mosaic virus (reconocen una proteína de la capside) (Gururani et al., 2012). Cannon et al. (2002) sugieren la posible presencia de más genes R distribuidos en las especies de Capsicum. Varios autores han enfocado sus esfuerzos en la búsqueda de genes R específicos involucrados en la resistencia a P. capsici en líneas resistentes como el genotipo serrano Criollo de Morelos 334 (CM334), ACC 2258 y Smith 5 (Smith et al. 1967; Reifschneider et al., 1992; Minamiyama et al., 2007). Los resultados son contradictorios y no se han podido obtener líneas con resistencia estable (Mongkolporn y Tylor, 2011). Con base en esta información es posible especular que el fenómeno de resistencia no se relaciona a la presencia de proteínas R. Otros autores concuerdan en atribuir la resistencia a un origen multigénico; en donde una rápida, intensa y coordinada respuesta, lleva a una RH local acompañada de la sobre expresión de genes como PAL, EAS y genes PR como POX, GLU y CHI principalmente (Fernández-Herrera et al., 2012; Sudisha et al., 2012; Villar-Luna et al., 2015). Las evidencias experimentales sugieren que en general, las plantas de Capsicum son capaces de reconocer al oomiceto P. capsici, y activar las mismas respuestas de defensa, sin embargo, solo algunos cultivares muestran resistencia (Castro-Rocha et al., 2012).
Moléculas Señal. Si la planta reconoce un riesgo potencial, transmite y amplifica la señal a través de una serie de moléculas diversas. Éstas pueden ser desde especies reactivas de oxígeno (ROs), proteínas (proteínas dependientes de Ca+, proteínas quinasas activadas por mitógenos), reguladores de crecimiento que cumplen la función de moléculas señal (ácido jasmónico, etileno, ácido salicílico), hasta receptores complejos e incluso factores de transcripción (WRKY, CaRFLP, MYC) (Yi, et al., 2010; Vidhyasekaran, 2014).
Moléculas Respuesta. La resistencia en especies de Capsicum se encuentra lejos de ser comprendida en su totalidad; en algunos cultivares depende de la densidad del inóculo o del estado fisiológico de la planta. No obstante, varios investigadores han demostrado el importante papel de algunos productos de los genes relacionados con la defensa en plantas de chile. Entre éstos, la familia de genes que codifican para la fenilalanina amonio liasa (PAL), involucrada en la síntesis de fenoles, los cuales son precursores en procesos de reforzamiento de paredes celulares y defensa por toxicidad, y también es una enzima clave para la síntesis de ácido salicílico (Vidhyasekaran, 2014). Genes como EAS, involucrado en la síntesis de la fitoalexina capsidiol y POX, involucrado en los procesos de lignificación, contribuyen a establecer barreras químicas y físicas, respectivamente (Villar-Luna et al., 2015; Villar-Luna et al., 2017). Adicionalmente, los genes de proteínas relacionadas con la patogénesis (PRs) como PR2 (glucanasas) y PR3 (quitinasas), degradan las paredes celulares de los patógenos (Dahiya et al., 2006; Hardham y Shan, 2009). La rápida acumulación de estas moléculas en la planta la vuelve un medio hostil que limita el ciclo biológico del fitopatógeno. Aunque estos genes son los principales involucrados en la defensa, hay muchos otros que participan en la respuesta de la planta y que son regulados positiva o negativamente. Por ejemplo, la familia de genes que codifican para la enzima hidroximetilglutaril-coenzima A reductasa (HMGR), involucrada en desviar la ruta del mevalonato hacia la síntesis de compuestos isoprenoides, como los esteroles (HMG1) que favorecen el desarrollo del oomiceto, o a la producción de fitoalexinas sesquiterpenicas, como el capsidiol (HMG2 y HMG3) que limita su desarrollo (Villar-Luna et al., 2017).
El patogeno: Phytophthora capsici. El rango de hospedantes de P. capsici incluye a especies de Capsicum (C. annuum, C. baccatum, C. chinense, C. frutesens and C. pubescens), cucurbitáceas, berenjenas y jitomates, así como ejotes y habas (Lamour et al., 2012). El éxito parasítico de P. capsici se debe a varias ventajas evolutivas: 1) sus zoosporas motiles flageladas dotadas de receptores incrementan su capacidad de diseminación y búsqueda (Bishop et al., 2002); 2) sus estructuras de resistencia (oosporas de pared gruesa) son capaces de sobrevivir hasta por 4 años en el suelo, siendo el principal recurso de inóculo primario (French et al., 2007); 3) su capacidad de disgregar la pared celular mediante la secreción de poligalacturonasas, pectinmetil esterasas y pectato liasas (Feng et al., 2010), y la membrana celular mediante la secreción de la capsiceina (Nespoulous et al, 1999); y 4) sus hábitos hemibiótrofos, facultad de alimentarse de tejido vivo y muerto (Hardham y Shan, 2009).
Moléculas de P. capsici involucradas en la interacción con Capsicum. P. capsici puede activar o suprimir la inmunidad basal de las plantas a través de la producción de moléculas especializadas que podrían propiciar un ambiente favorable para su desarrollo y reproducción (Hardham y Shan, 2009); estas moléculas se conocen como PAMPs (Patrones Moleculares Asociados a Patógenos) y efectores (Kamoun, 2006; Bent y Mackey, 2007).
PAMPs. Los PAMPs y MAMPs son moléculas conservadas que contribuyen a la aptitud biológica de los microorganismos (Thomma et al., 2011). También se conocen como elicitores, y son reconocidos por los receptores de la célula vegetal activando la inmunidad de la planta; este evento es conocido como Inmunidad Activada por Patógenos o por Microorganismos (PTI o MTI) (Torto et al., 2009). Los PAMPS de P. capsici que interactúan con Capsicum son: el Péptido PEP-13, una glicoproteína de pared celular que activa la síntesis de fitoalexinas y de ROs (Tör, 2008). PcPNPP1, que actúa como factor de virulencia, le permite cambiar de hábitos biótrofos a necrótrofos, e induce muerte celular programada (MCP) (Jupe et al., 2013). Capsiceina, compuesto que encapsula el ergosterol de la membrana de la célula hospedante y lo trasloca a las células del patógeno, y dispara también diversas respuestas (Nespoulous et al, 1999). Ácido Araquidónico, que induce el incremento en la concentración de etileno y dispara la RH (Bostock et al., 2011).
Efectores. El efecto de estas moléculas depende del genotipo de la planta. En plantas susceptibles, el efector actúa como un factor de virulencia modificando la estructura y función celular induciendo enfermedad. En plantas resistentes (con genes R específicos) el mismo efector puede activar la inmunidad de la planta (ETI) actuando como factor de avirulencia (Win et al., 2012). Además, los simbiontes no patogénicos producen efectores para establecer relaciones parasíticas de tipo mutualista o comensalista (Torto et al., 2009). Los efectores producidos por P. capsici son: RXLR, proteínas con un dominio N-terminal altamente conservado y un motivo RXLR dónde X participa en su translocación a la célula hospedante; este efector modula y suprime las respuestas de defensa durante la fase biotrófica y actúa como potenciador durante la patogénesis. Al menos 400 genes putativos relacionados a estas moléculas han sido identificados en P. capsici (Brich et al., 2008; Lamour et al., 2012). Crinklers, contienen un dominio N-terminal, un motivo LXLFLAK altamente conservado y un dominio C-terminal (promotor de la virulencia); actúan sobre proteínas del núcleo posiblemente involucradas en el transporte de ácidos nucleicos. Estas moléculas están asociadas a la necrosis y la epinastia; se han identificado 80 genes que parecen codificar para efectores tipo crinkler en P. capsici (Stam et al., 2013). Otros efectores, como los EPI similares a los inhibidores de glucanasas descritos en P. sojae y proteasas tipo cistatina descritos en P. infestans (Tian et al., 2016), podrían también ser producidos por P. capsici pues se ha detectado la presencia de genes EPI en su genoma.
Inmunidad activada por MAMPs o PAMPs y la inducción de resistencia sistémica en Capsicum spp. La interacción entre Capsicum spp. y P. capsici se lleva a cabo a través de un dialogo mediado por las moléculas mencionadas anteriormente. El resultado de este diálogo depende estrechamente de la aptitud biológica de los organismos (capacidad de responder a los estímulos), los factores ambientales, e incluso de múltiples factores particulares. Por ejemplo: el manejo agronómico, el estado fenológico en el que ocurre la interacción o incluso el tipo de poblaciones microbianas presentes en el patosistema en ese momento. La sumatoria de las particularidades bajo las cuales tiene lugar un patosistema, está directamente relacionada con los diferentes desenlaces en los que pueda culminar la interacción.
El primer desenlace posible es que la inmunidad sea activada por MAMPs o por PAMPs (MTI o PTI). La planta se comporta como resistente ante patógenos, endófitos, patógenos no adaptados o atenuados, o como tolerante resultando en infecciones asintomáticas. En este proceso, los MAMPs o los PAMPs estimulan a los receptores RLPs y RLKs (incluyendo a CaRLK1). Éstos activan a las proteínas G de la membrana que actúan como un interruptor que “enciende” las bombas de iones (Vidhyasekaran, 2014). Se inicia un flujo iónico a través de la membrana introduciendo H+ y Ca2+ y bombeando Cl- y K+ al exterior (Sanzón-Gómez y Zavaleta-Mejía, 2011). El incremento de iones Ca2+ en el citosol activa procesos de señalización y a la NADPH oxidasa, aumentando la producción de ROs (H2O2, O2 - y OH-), y preparando a la célula para una posible MCP (Glowacki et al., 2011). Adicionalmente, el Ca2+ activa proteínas como las calmodulinas (CaMs), calcineurinas tipo B (CLBs) y quinasas dependientes de calcio (CDPKs) (Vidhyasekaran, 2014). Estas proteínas fosforilan a las MAP-Ks, llevando la señal río abajo a los factores de transcripción tipo WRKY que reconocen las cajas W (TTGAC[C/T]) de los genes relacionados a la defensa; entonces una reprogramación en la transcripción induce cambios metabólicos en la zona de infección (Jingyuan et al., 2011) (Figura 1).
Las células de Capsicum circundantes al área de infección acumulan substancias toxicas como compuestos fenólicos (sintetizados en la ruta de los fenilpropanoides donde es clave la enzima PAL) o productos de su oxidación, y fitoalexinas como capsidiol (sintetizado por EAS). También, hay un incremento en la síntesis de PRs involucradas en la disociación de las paredes celulares de los patógenos (GLU y CHI), y en el reforzamiento de paredes de las células del hospedante por lignificación (POX) (Castro-Rocha et al., 2012). Además de las respuestas de defensa, el estímulo sobre el receptor CaRLK1, especifico de Capsicum,incrementa la expresión de enzimas superóxido dismutasa (SOD), aparentemente para aliviar el estrés oxidativo y para retrasar la MCP, permitiendo que otros procesos ocurran. El radical superóxido (H2O2) y el óxido nítrico (NO) son esenciales para activar la RH, pero cuando un patógeno necrotrófico, no adaptado o atenuado, endófitos o ACBs estimulan los receptores CaRLK1, éstos incrementan la producción de SOD, disgregando el H2O2 e incrementando la concentración del radical de oxígeno libre (O2 -). Al reaccionar el O2 - con el NO forma peroxinitrito (ONOO-), que previene la interacción entre NO y H2O2 y retrasa la MCP (Figura 1). Adicionalmente, el ONOO- es tóxico para algunos microorganismos incluyendo patógenos necrotróficos (Yi et al., 2010).

Figura 1 Imnunidad activada por MAMPs o por PAMPs en plantas de Capsicum (Yi et al., 2010; Glowacki et al., 2011; Jingyuan et al., 2011; Sanzón-Gómez y Zavaleta-Mejía, 2011; Castro-Rocha et al., 2012; Vidhyasekaran, 2014). ApSOD Superóxido dismutasa en el apoplasto; CaMs Calmodulinas; CaRLK Receptor tipo quinasa en Capsicum relacionado al retrazo de la RH; CBLs Calcineurinas tipo B; CDPKs Quinasas Dependientes de Calcio; CHI PR3- Quitinasas; Cpsdl Síntesis de capsidiol; CySOD Superóxido dismustasa en el citosol; EAS 5-epi-aristoloqueno sintasa; GLU PR2-Glucanasas; GP Proteínas G; IONP Bombas de iones; HRD Respuesta de Hipersensibilidad retrasada; LDR Respuestas de defensa locales; Lig Proceso de lignificación de paredes celulares; MAP-Ks Proteínas Quinasas Activadas por Mitógenos; MTI Inmunidad activada por MAMPs; NADPH Nicotinamida adenina dinucleótido fosfato; NADP NADPH reducido; NADPHOx Enzima NADPH oxidasa; NO Óxido Nítrico; ONOO- Peroxinitrito; PAL Fenilalanina Amonio Liasa; Phn Síntesis de fenoles; POX PR9-Peroxidasas; PRRs Receptores reconocedores de patrones; PTI Inmunidad activada por PAMPs; RLK Receptor tipo quínasa; RLP Receptores tipo proteína; ROs Especies Reactivas de Oxígeno; WRKY Factores de transcripción WRKY.
La defensa basal (MTI/PTI) es efectiva contra algunos patógenos necrotróficos o microorganismos invasivos no asociados a la planta, pero sólo cubre el área circundante a la infección. Simultáneamente a la MTI/PTI, toman lugar eventos de señalización mediados por reguladores de crecimiento como el ácido jasmónico (JA) y el etileno (ET) para inducir resistencia sistémica (ISR) en la planta de Capsicum. Naturalmente, la fosfolipasa A (PLA) libera ácido α-linoleico (α-lin) de la membrana, pero el daño causado por la entrada de patógenos o ACB causa una mayor liberación de éste. La presencia de α-lin y la creciente concentración de ROs estimula la ruta octadecanoide, en donde la lipoxigenasa (LOX) y otras enzimas convierten el α-lin libre en oxilipinas (Bertoni, 2012). Entre las oxilipinas producidas, el grupo más importante es el del JA, mismo que trasmite la señal a las células distantes en donde un receptor complejo (JAR) formado por tres moléculas (la proteína COI1 con caja F, la proteína con dedos de zinc JAZ e inositol pentaquisfosfato) recibe la señal de alerta. No es claro aún si el proceso de señalización continua río abajo vía MAP-Ks, sin embargo, la señal llega al núcleo activando una familia de factores de transcripción formados por una proteína básica del tipo hélice-bucle-hélice (factores MYC); éstos a su vez activan la expresión de genes relacionados con la defensa (Vidhyasekaran, 2014). Algunos de los genes expresados en solanáceas por la señal del JA corresponden a los que codifican para PRs como PR1, PR5 (proteínas tipo taumatina) y PR6 (inhibidores de proteasas) (Sudisha et al., 2012) (Figura 2A). Al mismo tiempo, la vía de señalización del ET toma lugar para completar la activación de la ISR. El incremento en la concentración de ROs activa la transcripción de dos enzimas clave para la síntesis del ET: la ACC sintasa (ACS) y la ACC oxidasa (ACO); adicionalmente, las CDPKs activadas por el Ca+ incrementan la actividad de estas enzimas, iniciando la síntesis de ET. La creciente concentración de ET lleva la alerta a las células distantes, en donde es reconocido por receptores transmembranales (ETR) compuestos por cinco moléculas (ETR1, ETR2, ERS1, ERS2 y EIN4). Las moléculas de ETR interactúan entre ellas y con CTR1 (una Raf quinasa considerada como una MAP-K) para activar la señal hacia el núcleo vía MAP-Ks (Vidhyasekaran, 2014). Después, el factor de transcripción CaERLFP, recibe la señal y reconoce las cajas GCC de los genes de PRs (Lee et al., 2004), induciendo la expresión de PRs como PR 2 (GLU), PR 3 (CHI), PR 7 (endoproteinasas), PR 9 (POX) y PR 12 (defensinas) (Sudisha et al., 2012) (Figura 2A). La activación de la ISR varía en intensidad de acuerdo a las circunstancias de la interacción, y no siempre resulta en la activación sistémica de las respuestas de defensa, pero puede resultar en una mayor capacidad de responder más rápida e intensamente contra el ataque por fitopatógenos en el tejido circundante (efecto priming) (Conrath, 2009). La ISR es efectiva contra un amplio rango de fitopatógenos, pero es más compleja de lo que aquí se explica, ya que las vías de señalización que participan en su activación, también regulan positiva y negativamente una considerable cantidad de genes que podrían estar involucrados en el proceso de la inducción de resistencia.

Figura 2 Inducción de resistencia sistémica, inmunidad activada por efectores y resistencia sistémica adquirida en plantas de Capsicum. (A) Inducción de resistencia sistémica (ISR); (B) inmunidad activada por efectores (ETI); (C) resistencia sistémica adquirida (SAR) (Lee et al., 2004; Lee y Hawng, 2005; Conrath, 2009; Yi etal., 2010; Sanzón-Gómez y Zavaleta-Mejía, 2011; Bertoni, 2012; Gururani et al., 2012; Sudisha et al., 2012; Veloso et al., 2014; Vidhyasekaran, 2014). αLin Ácido α-Linoleico; Act. Activa a; ACS ACC Sintasa; ACO ACC Oxidasa; AvrBS2 Proteína R producto de los genes de resistencia; BS2 Proteína de Avirulencia (Efector); CaERLFP Factores de transcripción activados por la señalización vía ET; CaMs Calmodulinas; CDPKs Quinasas dependientes de calcio; CHI PR3-Quitinasas; CTR1 Raf Quinasa considerada como MAP-K; CySOD Superóxido dismustasa en el citosol; Cyt Citoplasma; ET Etileno; ETI Inmunidad activada por efectores; ETR Receptores de Etileno; GLU PR2-Glucanasas; GP Proteínas G; HR Respuesta de Hipersensibilidad; HRTNC HR activada en células vecinas; ICS Isocorismato Sintasa; IONP Bombas de iones; ISR Resistencia Sistemica Inducida; JAR Receptores de Ac. Jasmónico; JA Ac. Jasmónico; LDR Resepuestas de defensa locales; LOX Lipoxigenasas; RLK Receptor tipo quínasa; RLP Receptores tipo proteína; MAPKs Proteínas quinasas activadas por mitógenos; MYC Factores de transcripción activados por la señalización vía JA; NADPHOx Enzima NADPH oxidasa; NO Óxido Nítrico; NPR1, 3, 4 Receptores de alta afinidad a SA; Nuc Núcleo; OctPth Ruta octadecanóica; PAL Fenilalanina Amonio Liasa; PLA Fosfolipasa A; Phn Síntesis de fenoles; PR1 Proteína Relacionada a la Patogénesis del grupo 1; PR5 Taumatina; PR6 Inhibidor de proteasa; PR7 Endoproteinasas; PR12 Defensinas; POX PR9-Peroxidasas; ROs Especies Reactivas de Oxígeno; SA Ac. salicílico (al aparecer + como sufijo acompañando a un signo denota el incremento en la concentración de éste compuesto, un mayor número de + denota un mayor incremento); SAR Resistencia Sistémica Adquirida; SDR Activación sistémica de las respuestas de defensa; Ub Marcaje por ubiquitinación; VROB Rápido incremento en la concentración de ROs; TGA Factor de transcripción activado por NPR; * Va hacia, ? Ruta de señalización en vías de investigación.
Un segundo posible desenlace es el desarrollo de la enfermedad. Factores como un déficit nutrimental, la ausencia de microorganismos benéficos, el estado fenológico, el potencial de inóculo y el manejo afectan directamente la expresión de la MTI/PTI, la ISR e incluso a los ACBs. La combinación de condiciones no óptimas para el desarrollo de la planta y la presencia de un genotipo patogénico fácilmente adaptable, lleva al desarrollo de la enfermedad. En este caso, P. capsici entra al tejido directamente o a través de la formación de un apresorio, pero en ambos casos mediante la secreción de enzimas (Feng et al., 2010; Castro-Rocha et al., 2012). Durante la fase biotrófica, las hifas permanecen en el apoplasto y la toma de nutrientes y secreción de factores de virulencia se lleva a cabo mediante un haustorio especializado invaginado en la membrana celular del hospedante. En este punto, P. capsici secreta moléculas como la capsiceina para obtener los esteroles contenidos en la membrana de la célula hospedante (Nespoulous et al, 1999). Sin embargo, la presencia de ésta y otras moléculas como Pep-13 y ácido araquidónico (PAMPs), alertan a la planta y activan la PTI. En respuesta, P. capsici libera los efectores RLXLR y Crinklers (CRN) para evadir las respuestas de defensa. Diversas contribuciones revelan que en interacciones compatibles estos efectores se acumulan en los núcleos del hospedante bloqueando la expresión de genes de defensa (Stam et al., 2013). Así, la modulación de la expresión de los genes locales suprime la PTI durante la fase biotrófica (Kamoun, 2006). Este evento permite al oomiceto alimentarse y madurar. Después, produce la proteína PcPNPP1, la cual primero cambia el comportamiento del fitopatógeno de biotrófico a necrotrófico; y después, al ser secretada al tejido del hospedante, induce la MCP y la necrosis, permitiéndole al patógeno colonizar el tejido y causar enfermedad (Lamour et al., 2012; Jupe et al., 2013).
Inmunidad activada por efectores (ETI) y resistencia sistémica en Capsicum spp. Para explicar hipoteticamente la resistencia específica a P. capsici, es necesario basarse en el conocimiento que se tiene del funcionamiento de las proteínas R ante patógenos biotróficos como Xanthomonas campestris o Meloidogyne incognita en cultivares resistentes de Capsicum. Las proteínas R reportadas para Capsicum corresponden al reconocimiento de bacterias, nematodos y virus con hábitos biotróficos, por ahora no se han reportado proeínas R para fitopatógenos fúngicos u oomicetos con hábitos necrotróficos o biotróficos. Cuando las proteínas R de Capsicum reconocen un efector, generan un incremento dramático en la concentración de ROs vía señalización de Ca+, éste inhibe la expresión local de enzimas como SOD y se favorece un balance entre H2O2 / NO, activando la RH (Yi etal., 2010; Gururani et al., 2012). El Ca+ también activa las respuestas de defensa vía MAP-K y la expresión de la isocorismato sintasa (ISC) vía CaMs. La expresión de PAL resulta en la acumulación de fenoles y compuestos fitotóxicos que acompañan a la RH y la expresión de ISC en la síntesis de SA (Lee y Hawng, 2005; Sanzón-Gómez y Zavaleta-Mejía, 2011). Este evento se caracteriza por culminar en una MCP rápida e intensa, y es conocido como inmunidad activada por efectores (ETI) (Figura 2B). La creciente producción de SA propicia su translocación a células distantes, en donde es percibido por tres receptores: NPR1 (afinidad media a SA), NPR3 (baja afinidad) y NPR4 (alta afinidad). Ante la llegada de SA a la célula distante, NPR1 migra del citosol al núcleo en donde NPR4 se une a éste y lo marca por ubiquitinación para su degradación, no obstante, si la concentración de SA incrementa, NPR4 se une a SA y libera a NPR1. El continuo incremento en la concentración de SA propicia la unión entre NPR1 y una molécula de este regulador de crecimiento, dicho complejo actúa como un cofactor del factor de transcripción TGA, activando las respuestas de defensa asociadas a la resistencia sistémica adquirida (SAR). Finalmente, a altas concentraciones de SA, NPR3 se une al complejo SA-NPR1, lo cual activa la MCP en las células vecinas (Veloso et al., 2014) (Figura 2C). La activación de la ETI y la SAR en Capsicum involucra la activación local y sistémica de ciertas respuestas de defensa mientras ocurre la RH, principalmente la deposición de calosa, la lignificación de paredes celulares y el incremento en la concentración de PRs como PR-1 (defensina), PR-2 (glucanasas), PR-3 (quitinasas), PR-5 (osmotina), PR-9 (peroxidasas), PR-10 y PR-13 (tioninas) (Lee y Hwang, 2005). La ETI es efectiva contra fitopatógenos que tienen los genes Avr correspondientes a las proteínas R en Capsicum, y la defensa de la SAR es duradera y efectiva contra un amplio rango de fitopatógenos.
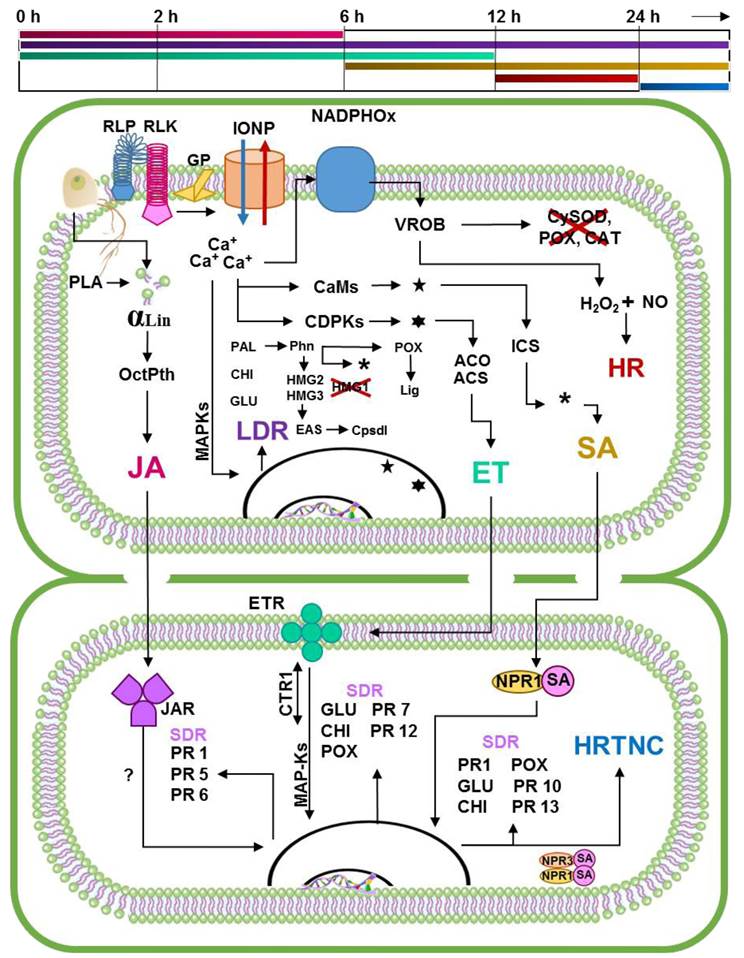
Figura 3 Propuesta del dialogo molecular que toma lugar en la resistencia específica de Capsicum a Phytophthora capsici. En la parte superior de la figura aparece una línea que marca los tiempos en los cuales se estima que suceden los eventos relacionados con la expresión de resistencia específica de Capsicum a P. capsici. La primera línea corresponde a la vía de señalización del JA. La segunda corresponde a la activación de respuestas de defensa locales activadas en cada punto de infección, la cual sucede de forma similar al proceso de MTI/PTI. La tercera línea corresponde a la vía de señalización del ET. La cuarta línea indica la vía de señalización del SA. La quinta línea corresponde al proceso de activación de la HR local inducida por ROs en materiales resistentes, mientras que la sexta, indica la activación de la HR en las células vecinas inducida por el constante incremento en la concentración de la SA. Con base al crítico análisis del estado del arte del patosistema en cuestión, la presente propuesta sugiere que la resistencia específica de Capsicum a P. capsici es el resultado de la sumatoria de una serie de eventos coordinados en la cual los principales actores son los reguladores de crecimiento involucrados en las vías de señalización (Egea et al., 1996; Kim y Hwang, 2000; Jung et al., 2005; Lee y Hawng, 2005; Bent y Makey, 2007; Conrath, 2009; Ozgonen et al., 2009; Ueeda et al., 2006; Yi et al., 2010; Glowacki et al., 2011; Jingyuan et al., 2011; López-Martínez et al., 2011; Sanzón-Gómez y Zavaleta-Mejía, 2011; Bertoni, 2012; Gururani et al., 2012; Sudisha et al., 2012; Castro-Rocha et al., 2012; Muthamilarasan y Prasad, 2013; Veloso et al., 2014; Villar-Luna et al., 2015; Vidhyasekaran, 2014; Villar-Luna et al., 2009, 2017). αLin Ácido α-Linoleico; ACS ACC Sintasa; ACO ACC Oxidasa; CaMs Calmodulinas; CDPKs Quinasas dependientes de calcio; CHI PR3-Quitinasas; CTR1 Raf Quinasa considerada como MAP-K; Cpsdl Síntesis de capsidiol; CySOD Superóxido dismustasa en el citosol; EAS 5-epi-aristoloqueno sintasa; ET Etileno; ETR Receptores de Etileno; GLU PR2-Glucanasas; GP Proteínas G; HMG 1, 2, 3 familia de genes codificantes para la enzima hidroximetilglutaril-coenzima A reductasa; HR Respuesta de Hipersensibilidad; HRTNC HR activada en células vecinas; ICS Isocorismato Sintasa; IONP Bombas de iones; JAR Receptores de Ac. Jasmónico; JA Ac; Jasmónico; LDR Resepuestas de defensa locales; Lig Proceso de lignificación de paredes celulares; RLK Receptor tipo quínasa; RLP Receptores tipo proteína; MAPKs Proteínas quinasas activadas por mitógenos; NADPHOx Enzima NADPH oxidasa; NO Óxido Nítrico; NPR 1, 3 Receptores de alta afinidad a SA; OctPth Ruta octadecanóica; PAL Fenilalanina Amonio Liasa; PLA Fosfolipasa A; Phn Síntesis de fenoles; PR1 Proteína Relacionada a la Patogénesis del grupo 1; PR5 Taumatina; PR6 Inhibidor de proteasa; PR7 Endoproteinasas; PR12 Defensinas; POX PR9-Peroxidasas; SA Ac. salicílico; VROB Rápido incremento en la concentración de ROs; *, /, /, Va hacia.
Resistencia específica de Capsicum spp a Phytophthora capsici. Para entender el tercer desenlace (la resistencia específica de Capsicum a P. capsici) es necesario considerar las diferencias consignadas entre cultivares resistentes y susceptibles. 1) En cultivares susceptibles la expresión de enzimas degradadoras de ROs como POX, SOD y CAT es acelerada y contribuye al retraso de la MCP, contrariamente, en los cultivares resistentes, la expresión de estas enzimas es lenta y son suprimidas localmente por el violento incremento en la concentración de ROs (Ueeda et al., 2006; Yi et al., 2010). 2). En los cultivares resistentes, la ruta octadecanóica siempre está activa y genera incrementos drásticos en los niveles de JA (Ueeda et al., 2006), a diferencia de los cultivares susceptibles. 3) Hay una correlación entre la concentración de capsidiol, el total de área necrosada y la invasión del oomiceto; en cultivares resistentes: grandes cantidades de capsidiol se concentran en pequeñas áreas necróticas inhibiendo el progreso de P. capsici; en plantas susceptibles: las cantidades de ésta fitoalexina son menores, las áreas necróticas grandes y hay mayor infección en el tejido (Egea et al., 1996; Villar-Luna et al., 2015). 4) Los cultivares resistentes muestran una mayor expresión de los genes PAL, HMG2, HMG3 y EAS asociado a una mayor actividad de las enzimas correspondientes; esto se refleja en una mayor concentración de fenoles tóxicos para el oomiceto y precursores de lignina, y síntesis de fitoalexinas (López-Martínez et al., 2011; Villar-Luna et al., 2015; Villar-Luna et al., 2017) y SA (Lee y Hawng, 2005).
Con base en lo expuesto, proponemos que la Resistencia Especifica de Capsicum a P. capsici (RECP) inicia con el reconocimiento de PAMPs por los receptores RLPs y RLKs al igual que la PTI, pero en este caso se genera un rápido incremento en la concentración de ROs que inactiva localmente las enzimas que disocian el H2O2. El H2O2 acumulado reacciona con el NO activando la RH (entre 12 h y 24 h) (Villar-Luna et al., 2009). Durante este tiempo, se activan las respuestas de defensa locales como en la PTI. En cultivares resistentes, las rutas octadecanoica y de la ICS generan incrementos drásticos de los reguladores de crecimiento involucrados en la señalización (JA-ET o SA). A diferencia de la ISR y la SAR, en donde las vías de señalización parecen ser antagónicas, en la RECP se observa un proceso coordinado en donde cada regulador de crecimiento cumple un rol importante en un tiempo determinado (Ueeda et al., 2006). Inicialmente, el JA alcanza concentración máxima aproximadamente a las 2 h tras el reconocimiento, sensibilizando el tejido vecino; el ET incrementa al máximo nivel de las 6 a las 12 h, induciendo la acumulación de PRs en las células vecinas (Kim y Hwang, 2000). En conjunto, estos reguladores de crecimiento inducen el proceso de reforzamiento de las paredes celulares llevado a cabo por POX, y la expresión sistémica de GLU y CHI previene nuevos puntos de infección (Jung et al., 2005), al igual que en la ISR. Una vez activadas las respuestas de defensa, disminuyen los niveles de JA a las 6 h y de ET a las 12 h. En cambio, la concentración de SA incrementa desde las 6 h y alcanza su máxima entre las 12 h y 24 h coincidiendo con la activación de la RH (Ueeda et al., 2006, Villar-Luna et al., 2009). En esta etapa de la respuesta, los cultivares que se comportan como resistentes muestran zonas necróticas en los puntos de infección con alta concentración de capsidiol y fenoles (López-Martínez et al., 2011; Ozgonen et al., 2009; Villar-Luna et al., 2009), las paredes celulares circundantes son engrosadas y protegidas por la concentración de PRs (Jung et al., 2005). Posteriormente, el incremento de SA estimula la expresión sistémica de los genes de defensa asociados a la SAR, además, si el nivel de SA alcanza altas concentraciones, éste activa la MCP en las células vecinas a la zona infectada dificultando el progreso del fitopatógeno (Veloso et al., 2014) (Figura 3).
El proceso de la RECP descrito, se basó en las evidencias experimentales que abordan la interacción entre cultivares resistentes, tolerantes y susceptibles con el oomiceto y con ACB, con la finalidad de proponer una base que promueva investigaciones que aborden las particularidades de este patosistema. A pesar de que las evidencias experimentales son bastas y permiten relacionar la información para explicar hasta cierto punto la resistencia de Capsicum a P. capsici, se tienen aún muchas interrogantes, como por ejemplo: 1) ¿Qué hace que los cultivares resistentes respondan con mayor rapidez e intensidad a P. caspici?; 2) ¿Hay proteínas R u otros receptores no descritos involucrados en este proceso?; 3) ¿Esta respuesta rápida está ligada a la expresión diferencial de los genes de la ruta mevalonica HMG1, HMG2, HMG3, EAS y a la actividad incrementada de la ruta octadecanoica en cultivares resistentes?; 4) ¿La aplicación de ACBs podría ser una estrategia para incrementar los niveles de tolerancia en los cultivares susceptibles? Y de ser así, ¿cuánto tiempo durará la protección?
Consideraciones finales. El análisis crítico del estado del arte de este patosistema permitió discernir que la resistencia específica de Capsicum a P. capsici es el resultado de un proceso coordinado mediado por los reguladores de crecimiento JA, ET y SA. Esto supone una excepción al antagonismo comúnmente mencionado entre estas vías de señalización. No obstante, se requiere de mayores estudios que aborden el rol de cada regulador de crecimiento en el proceso de señalización en la defensa contra este oomiceto. Aunque es claro que genes como PAL, HMG, EAS, GLU, CHI y POX están estrechamente relacionados con el proceso de defensa y resistencia de Capsicum hacia P. capsici, en el trasfondo hay un gran número de genes que son afectados positiva y negativamente por las vías de señalización de estos reguladores de crecimiento. Dado que este es un fenómeno de causa multifactorial, las nuevas tecnologías de generación masiva de datos pueden ofrecer un panorama más amplio en cuanto a los genes activados y suprimidos durante la interacción. También, es importante destacar la implicación de estos reguladores de crecimiento en el proceso de inducción de resistencia por microorganismos benéficos, los cuales son un componente importante de la microbiota nativa del suelo que se asocia al patosistema. La diversidad microbiana juega un papel importante al afectar directamente el resultado del dialogo molecular; primero, al actuar como una barrera para dificultar o prevenir que el fitopatógeno se establezca sobre la planta, y en segundo lugar, al incrementar la capacidad defensiva al activar la defensa basal e inducir resistencia. A pesar del avance logrado, hay aún muchas incógnitas por resolver. En la medida en la que se avance a la comprensión de los patosistemas y que la investigación abarque la complejidad de los ecosistemas agrícolas, se podrá reducir gradualmente el impacto de los fitopatógenos. El control de fitopatógenos no debe dirigirse a su exclusión de los agroecosistemas, sino a emplear tecnologías ecológicas que promuevan el balance de las poblaciones de los microorganismos del suelo, y que eventualmente se logre un manejo sustentable de fitopatógenos y plagas.











 texto en
texto en 


