Introducción
El chile (Capsicum annuum) es un cultivo de importancia económica en México, su producción se estima en 3,112,481 toneladas anuales, lo que posiciona al país como el cuarto productor de chile a nivel mundial en 2022 (SADER, 2023). Sin embargo, este cultivo es afectado por diferentes patógenos incluyendo virus, bacterias, oomicetos y hongos, que ocasionan alteraciones metabólicas en el cultivo, limitando el rendimiento y la calidad del fruto (Ramos-Sandoval et al., 2010; Majid et al., 2017). La marchitez o secadera del chile, considerada como la enfermedad más destructiva para el cultivo (Barchenger et al., 2018), se asocia principalmente al oomiceto Phytophthora capsici, que se propaga por el agua de riego y lluvia a través de oosporas y zoosporas (Sanogo et al., 2023). Las pérdidas económicas relacionadas con esta enfermedad se consideran de gran importancia para el agricultor y su control significa un aumento considerable en los costos de producción del cultivo (Moreira-Morrillo et al., 2022).
En México, se han desarrollado distintos estudios sobre la presencia, diversidad genética y búsqueda de variedades de chile resistentes contra de este patógeno (Castro-Rocha et al., 2016; Palma-Martínez et al., 2017; Pons-Hernández et al., 2020). Se han obtenido aislados en diferentes especies y variedades de chile provenientes de zonas productoras de Aguascalientes, Chihuahua, Guanajuato, Jalisco y Michoacán, además de caracterizar la distribución del patógeno y su gama de hospedantes en cultivos de importancia económica de las familias Solanaceae y Cucurbitaceae (Reyes-Tena et al., 2021).
Para el control de la marchitez del chile, se exploran diferentes alternativas, como los inductores de resistencia o defensa vegetal, que pueden ser péptidos, polisacáridos, lípidos, entre otros tipos de biomoléculas. Su mecanismo de acción es la generación de una respuesta de defensa inducida o “priming”, que incluyen cambios a nivel fisiológico, molecular o epigenético como consecuencia de la percepción de un estímulo relacionado con un proceso de patogénesis, donde la planta genera una respuesta de resistencia que la mantiene protegida ante el ataque posterior de patógenos (Hönig et al., 2023).
Se han reportado diferentes moléculas como inductores de resistencia contra el género Phytophthora. Desde fitohormonas como el ácido jasmónico y jasmonato de metilo que demostraron retardar el progreso de la infección de P. infestans en papa (Arévalo-Marín et al., 2021). Hasta fungicidas de bajo espectro como el fosfito de potasio, un análogo funcional del ácido salicílico como el acibenzolar-S-metil y un aminoácido no proteico como el ácido β-aminobutírico (BABA) que redujeron las lesiones y síntomas de la enfermedad asociada a P. infestans en tomate de árbol (Solanum betaceum) (Castaño-Monsalve et al., 2015).
El género Dahlia incluye plantas herbáceas perennes que se caracterizan por sus inflorescencias con flores liguladas y discoides, con raíces tuberosas, desarrolladas a partir de un rizoma corto. Este género cuenta con 38 especies, de las cuales 35 son endémicas de México (Carrasco-Ortiz et al., 2019). El principal uso de la dalia es como planta ornamental; aunque en la actualidad se están promoviendo sus beneficios medicinales y nutricionales. Particularmente, las raíces tuberosas se caracterizan por su contenido de fibra, proteína, minerales y vitaminas, así como por su alto porcentaje de carbohidratos, en forma de inulina y otros fructanos (HernándezEpigmenio et al., 2022). Dependiendo de la madurez de la raíz y de la especie, el contenido de inulina puede fluctuar entre 52 y 83 % de carbohidratos presentes en los tubérculos (Santana-Legorreta et al., 2016). En este sentido, los fructanos son polímeros compuestos por unidades de fructosa unidas mediante enlaces de tipo β(2-1) y/o β(2-6) que generalmente tienen un resto de glucosa terminal y algunos derivados han sido reportados como inductores de defensa vegetal para algunos cultivos (Sun et al., 2013; Zhang et al., 2009; Zhang et al., 2013). Para el cultivo del chile (C. annuum), se ha reportado la aplicación de fructanos de agave (Agave tequilana var. Azul) de diferentes grados de polimerización y concentraciones induciendo un efecto protector contra los síntomas severos de la infección con P. capsici, disminuyendo la incidencia y daño a la raíz por su aplicación foliar (Navarro-López et al., 2019). También, se ha reportado que la aplicación de inulina (200 µM) a la base de la planta de chile disminuyó la incidencia de la enfermedad y el daño de la raíz provocado por P. capsici hasta un 40 % (López-Velázquez et al., 2019a). Esta protección de la inulina se pudo incrementar hasta en un 80 % con el uso de hidrogeles biodegradables que protegieron de la lixiviación y degradación al polímero en el suelo (López-Velázquez et al., 2019b). En los tres estudios se evaluó la protección a la enfermedad con la disminución de la incidencia, daño a la raíz y presencia del patógeno en la raíz, aunque no se realizaron ensayos para determinar si esta protección se desencadenó por la inducción de resistencia en la planta.
Considerando la importancia de validar que la protección dada por la aplicación de la inulina se asocia con la inducción de mecanismos de defensa vegetal, así como el efecto de diferentes dosis del polímero, en este trabajo el objetivo fue evaluar el efecto de protección de cuatro concentraciones de inulina de tubérculos de dalia grado reactivo aplicadas a la base de la planta de chile. La concentración que presentó la mayor protección se evaluó su inducción de una respuesta de defensa bioquímica efectiva mediante la actividad enzimática de β-1,3 glucanasas, peroxidasas y la producción de compuestos fenólicos totales.
Materiales y Métodos
Localización y Área de estudio. La presente investigación se desarrolló en las instalaciones de la Unidad de Biotecnología Vegetal del Centro de Investigación y Asistencia en Tecnología y Diseño del Estado de Jalisco AC. Unidad Zapopan, entre los meses de agosto-diciembre de 2018.
Material Vegetal. Se utilizaron semillas de chile serrano (Capsicum annuum) cv. Camino Real (Harris Moran Seed Company). Las semillas se desinfestaron sumergiéndose por 3 minutos en hipoclorito de sodio comercial (NaClO) al 3 %, posteriormente se enjuagaron con agua destilada y se colocaron para su germinación en charolas con sustrato estéril compuesto de peat-moss, arena y vermiculita en proporción 6:2:1, respectivamente.
Material biológico. Se utilizó la cepa de Phytophthora capsici (CH11) de la colección de cepas del CIATEJ, proporcionada y aislada en 2011 por la Dra. Sylvia Fernández Pavía, del Instituto de Investigaciones Agropecuarias Forestales de la Universidad Michoacana San Nicolás de Hidalgo (Reyes-Tena et al., 2019). Las condiciones de cultivo y generación del inóculo fueron las mismas que se describieron con López-Velázquez et al. (2019a).
Medio de cultivo v8 clarificado. Se utilizó jugo v8 (Campbell’s) clarificado por filtración. Se mezcló 50 mL de jugo clarificado, 0.5 g de carbonato de calcio (Sigma-Aldrich, St. Louis, MO, USA) y 15 g de agar (Sigma-Aldrich, St. Louis, MO, USA) en agua destilada. Esta mezcla fue colocada en agitación y aforada a 1 L con agua destilada. El medio se esterilizó en autoclave a 121 °C durante 20 min (Trinidad-Cruz et al., 2021).
Soluciones de inulina de tubérculos de dalia. Se prepararon soluciones de inulina de tubérculos de dalia grado reactivo (Sigma-Aldrich, St. Louis, MO, USA). Se disolvió en agua destilada a concentraciones 20, 100, 200 y 300 μM. La solución fue esterilizada por filtración con membranas de 20 μm antes de su aplicación.
Evaluación de la protección de inulina de dalia en el control de P. capsici. Se utilizaron 10 plántulas de chile de 30 días de edad por tratamiento, las cuales se trasplantaron en vasos de poliestireno de 275 mL con sustrato estéril compuesto de peat-moss, arena y vermiculita en proporción 6:2:1. Después del trasplante se aplicaron 10 mL de inulina de tubérculos de dalia a la base del tallo. Las concentraciones de inulina fueron 20, 100, 200 y 300 μM. Transcurridos 10 días después de la primera aplicación de la inulina, se hizo una segunda aplicación e inmediatamente después se inocularon las plántulas con 10 mL de la suspensión de zoosporas de P. capsici (1×104 zoosporas mL-1) (Wang et al., 2013). El experimento finalizó dos semanas después de la inoculación, se hizo un registro fotográfico y se determinó la altura y el peso fresco de las plántulas. Se determinó el nivel de protección a la enfermedad, considerando la siguiente escala de severidad de la enfermedad que fue propuesta con base en los síntomas observados a lo largo del experimento: 1. Plántula sana, sin síntomas evidentes de enfermedad; 2. Plántula con clorosis, oscurecimiento en tallo y raíces, marchitez en las hojas; 3. Plántula que presenta daño en las hojas, necrosis en el tallo y raíces, raíces cortas, defoliación severa y tamaño menor que el control y 4. Plántula muerta. Se utilizó un diseño experimental de bloques al azar con 10 repeticiones cada uno. Se consideraron como controles plántulas a las que se aplicó agua destilada estéril en lugar de la inulina y plántulas inoculadas solamente con el patógeno. El experimento se realizó por duplicado separados por espacio y al mismo tiempo.
Determinación del daño en las raíces. Para determinar el daño a las raíces se comparó la viabilidad de las raíces entre los diferentes tratamientos. La viabilidad se determinó con la reducción del cloruro de 2,3,5-trifeniltetrazolio (TTC) (SigmaAldrich, St. Louis, MO, USA) a 1,3,5-trifenilformazan (TTF) con el método descrito por Wang et al. (2013) con algunas modificaciones (López-Velázquez et al., 2019a). La viabilidad de las raíces se obtuvo mediante el cálculo de la intensidad de reducción del TCC (mg g-1 h) = absorbancia del TTC reducido / PF h, donde PF es la masa de la raíz fresca y h es el tiempo de incubación.
Presencia del oomiceto en la raíz. Se determinó la presencia del oomiceto en la raíz del chile por la tinción del micelio con azul de tripano (López-Velázquez et al. 2019b). Se tomaron muestras de raíces y se decoloraron con hidróxido de potasio 1.7 M (Sigma-Aldrich, St. Louis, MO, USA) y peróxido de hidrógeno 0.5 M (Sigma-Aldrich, St. Louis, MO, USA). Posteriormente fueron teñidas con azul de tripano 100 μM (Sigma-Aldrich, St. Louis, MO, USA) por 2 h. El exceso de colorante fue eliminado con lavados de lactoglicerol y las muestras fueron observadas en microscopio óptico (Microscopio Olympus modelo BH-2, Tokio, Japón).
Evaluación de inducción de respuesta de defensa en chile por el tratamiento con inulina de dalia contra P. capsici. Se utilizaron plántulas de 30 días de edad, las cuales se trasplantaron a bolsas de polietileno de 1 kg con sustrato estéril. Después del trasplante se aplicaron a la base de la plántula 10 mL de inulina de tubérculos de dalia a la concentración que presentó la mayor protección (200 μM), se consideró un tratamiento con inulina y el oomiceto, un tratamiento solo con el patógeno y un tratamiento con agua destilada como control. Transcurridos 10 días después de la primera aplicación de la inulina se hizo una segunda aplicación e inmediatamente después se inocularon las plantas con 10 mL de la suspensión de zoosporas de P. capsici (1×104 zoosporas mL-1) (Wang et al., 2013).
Extracción enzimática y ensayos de actividad. Se tomaron muestras de raíces y hojas de las plantas al momento de la inducción, el día de la inoculación con el patógeno (considerándose como día 0) y a los días 1, 2, 3, 5, 7 y 9 después de la inoculación con el patógeno. Se determinó la actividad enzimática de proteínas relacionadas con patogénesis (PR) con las actividades de β-1,3 glucanasas y peroxidasas. La producción de fitoalexinas se asoció con la cuantificación de compuestos fenólicos totales absorbidos a 650 nm. Las muestras fueron maceradas con nitrógeno líquido. Para la determinación de β-1,3 glucanasas y peroxidasas se resuspendieron en buffer de fosfato de sodio 0.1 M pH 7.0. Para la cuantificación de compuestos fenólicos totales se resuspendieron en metanol al 80 % (v/v).
Determinación de la actividad de β-1,3 glucanasas. Se realizó con el método colorimétrico para detección de azúcares reductores a 515 nm, como producto de la hidrólisis enzimática y la reducción del DNS (ácido 3,5-Dinitrosalicílico, SigmaAldrich, St. Louis, MO, USA). La cuantificación se realizó empleando una curva de calibración con glucosa, y la actividad específica fue reportada en nanokatales (nkat) por gramo (g) de proteína total (nkat g-1 g-1 PT). Se define como 1 nkat a 1 nmol de D-glucosa liberada de la laminarina (Sigma-Aldrich, St. Louis, MO, USA) por segundo, bajo las condiciones del ensayo (Oliveira et al., 2014).
Determinación de la actividad de peroxidasas. Se realizó siguiendo el método propuesto por Oliveira et al. (2014). Se emplearon 10 µL de extracto de hoja y raíz para las reacciones. La variación de una unidad de absorbancia por minuto se definió como una unidad de actividad peroxidasa (1 UA) y fue expresada por gramo de proteína total (UA g-1 g-1 PT).
Determinación de la inducción de compuestos fenólicos totales. Se determinó por medio de la cuantificación de compuestos fenólicos totales siguiendo la metodología propuesta por Ainsworth and Gillespie (2007), con algunas modificaciones (López-Velázquez et al., 2019a). La cuantificación se realizó empleando una curva estándar de concentraciones conocidas de catecol (0.2 1 mM) y los resultados se expresaron como nmol catecol g -1 PF-1.
Análisis estadístico. Los datos se normalizaron con la prueba de Anderson-Darling. Posteriormente, se realizó un análisis de varianza unifactorial utilizando los procedimientos del paquete estadístico Statgraphics Centurion XVI, versión 16.1.11 (Statistical Graphics, Englewood Cliffs, NJ, USA). Para la separación entre medias, se realizó un análisis mediante la prueba LSD, con un nivel de significancia del 95 %.
Resultados
Protección de inulina de dalia en el control de la infección de P. capsici en chile. Para determinar el grado de protección contra la infección de P. capsici por la aplicación de inulina de dalia en plántulas de chile serrano, se evaluaron diferentes parámetros como la disminución de los síntomas de la enfermedad, incluyendo la altura y peso fresco de la plántula, la incidencia de la enfermedad, así como el daño, viabilidad y la presencia del patógeno en la raíz. Los resultados obtenidos en la prueba de efectividad biológica mostraron que las plántulas inoculadas con el patógeno (P) tuvieron una incidencia de la enfermedad del 80 %, una severidad de la enfermedad nivel 4 y un daño a la raíz severo observado como un volumen radicular significativamente menor al control (C) (Figura 1). Además, se observó una disminución significativa en el peso fresco, la altura de la plántula y la viabilidad de la raíz con respecto al grupo control (Cuadro 1). Para las plántulas tratadas con 20 μM de inulina (I1+P), no hubo respuesta de inducción de protección, los síntomas, la incidencia, la severidad de la enfermedad y el daño a la raíz fueron semejantes a lo observado en las plántulas infectadas con P. capsici (Figura 1a). El mismo efecto se tuvo en el peso fresco, la altura de la planta y la viabilidad de la raíz (Cuadro 1). El tratamiento con 100 μM de inulina (I2+P) mostró un efecto positivo en la inducción de protección a la infección de P. capsici, con este tratamiento se presentó una incidencia del 50 % de la enfermedad, la severidad se catalogó en el nivel 3 y no se vio daño significativo en la raíz (Figura 1b). El peso fresco y la altura de la plántula fueron equivalentes al testigo, aunque la viabilidad de las raíces fue equivalente a las plántulas infectadas (Cuadro 1). Para las plántulas tratadas con 200 μM de inulina (I3+P) también se observó la inducción de protección a la infección de P. capsici, aunque con un nivel de severidad de la enfermedad de nivel 2 y una incidencia del 40 %, siendo la mejor protección observada en todos los tratamientos (Figura 1).
Finalmente, en las plántulas tratadas con 300 μM de inulina (I4+P) se observó
la inducción de protección. Se presentó una disminución de la incidencia de 50 %, la severidad de la enfermedad fue de nivel 3 y no se observó daño en la raíz (Figura 1). El peso fresco y la altura de la planta fueron equivalentes al control, aunque la viabilidad de las raíces fue equivalente a las plantas infectadas (Cuadro 1). En todos los tratamientos que fueron inoculados con el patógeno, se comprobó la infección por la presencia del micelio de P. capsici, esto indicó que el oomiceto fue capaz de colonizar las raíces (Figura 1c). En los resultados obtenidos destacó que la viabilidad por mg de raíz de las plantas tratadas con inulina no presentó diferencias significativas con respecto a las plantas infectadas con P. capsici (Cuadro 1). A partir de estos resultados se consideró el tratamiento de 200 μM de inulina (I3+P) como aquel que indujo la mejor protección contra la infección de P. capsici en las plantas
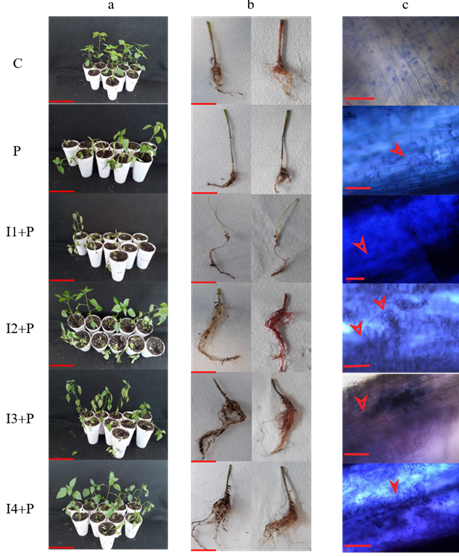
Figura 1 Evaluación de la inulina de dalia en la protección de la infección de P. capsici en plántulas de chile. a: Prueba de efectividad biológica de inulina en plántulas de chile, la escala equivale a 10 cm; b: Daño en las raíces, la escala equivale a 5 cm; c: Presencia del oomiceto en el tejido vegetal, la escala equivale a 20 µm, las flechas indican la presencia del oomiceto. Los tratamientos corresponden: C: Control, plántulas tratadas con agua destilada estéril; P: Plántulas inoculadas con P. capsici; I1+P: Plántulas inoculadas con P. capsici y tratadas con inulina 20 μM; I2+P: Plántulas inoculadas con P. capsici y tratadas con inulina 100 μM; I3+P: Plántulas inoculadas con P. capsici y tratadas con inulina 200 μM; I4+P: Plántulas inoculadas con P. capsici y tratadas con inulina 300 μM.
Cuadro 1 Parámetros de crecimiento y protección inducidas por inulina de dalia en plántulas de chile.
| Tratamiento | Peso fresco (g) | Altura de la plántula (cm) | Viabilidad de la raíz (mg g-1 h PF) | Severidad de la enfermedad | Incidencia de la enfermedad (%) |
|---|---|---|---|---|---|
| C | 1.8 ± 0.27a | 27.7 ± 0.66a | 1.7 ± 0.11 c | 1 | 0 |
| P | 0.8 ± 0.18a | 22.5 ± 2.04a | 0.9 ± 0.20a | 4 | 80 |
| I1+P | 0.7 ± 0.18a | 22.1 ± 0.89a | 0.9 ± 0.09ab | 4 | 80 |
| I2+P | 1.3 ± 0.18a | 26.3 ± 1.06a | 1.0 ± 0.16ab | 3 | 50 |
| I3+P | 1.8 ± 0.37bc | 26.9 ± 1.54a | 0.9 ± 0.35ab | 2 | 40 |
| I4+P | 1.5 ± 0.23bc | 28 ± 1.2a | 0.6 ± 0.03a | 3 | 50 |
Los tratamientos se describen en la figura 1. Medias con letras diferentes difieren por prueba LSD para p<0.05.
de chile. Esta concentración fue utilizada para las evaluaciones de inducción de la respuesta de defensa efectiva en chile.
Inducción de defensa en plántulas de chile por la aplicación de inulina de dalia contra P. capsici
Actividad de β-1,3 glucanasas. La respuesta en la raíz se consideró como una respuesta de defensa local y la respuesta en hojas se consideró como una respuesta de defensa sistémica. En hojas y raíces el análisis estadístico mostró diferencias significativas entre los tratamientos y los muestreos (p < 0.05). Respecto a la respuesta local (Figura 2a), la actividad de β-1,3 glucanasas en las plántulas infectadas con
P. capsici (P) aumentó de manera significativa con respecto al testigo hasta el día 5 después de la inoculación del patógeno, esta actividad se mantuvo elevada en el día 7 y disminuyó al nivel del testigo al día 9. Por su parte, en las plántulas tratadas con inulina e infectadas con P. capsici (IP) se observó un aumento en su actividad a partir del día 2 después de la inoculación del patógeno y se mantuvo elevada hasta el día 7, después se observó una disminución significativa de la actividad en el día
9. La inulina de dalia fue capaz de aumentar la actividad de β-1,3 glucanasas de
manera local y temprana en las plántulas inoculadas con P. capsici.
Con respecto a la respuesta sistémica, se observaron cambios en la actividad de β-1,3 glucanasas en las hojas en las plántulas tratadas (Figura 2b). La actividad de β-1,3 glucanasas en las plántulas infectadas (P) aumentó de manera significativa con respecto al testigo a partir del día 2 después de la inoculación del patógeno, esta actividad disminuyó al nivel del testigo en el día 3, manteniéndose al mismo nivel en el día 5, la actividad disminuyó de manera significativa en el día 7 y finalmente aumentó la actividad en el día 9. Por su parte, en las plántulas infectadas y tratadas con inulina (IP) el aumento de la actividad se observó a partir del día de la inoculación con el patógeno, este aumento se mantuvo los días 1, 2, 3 y 5, se observó una
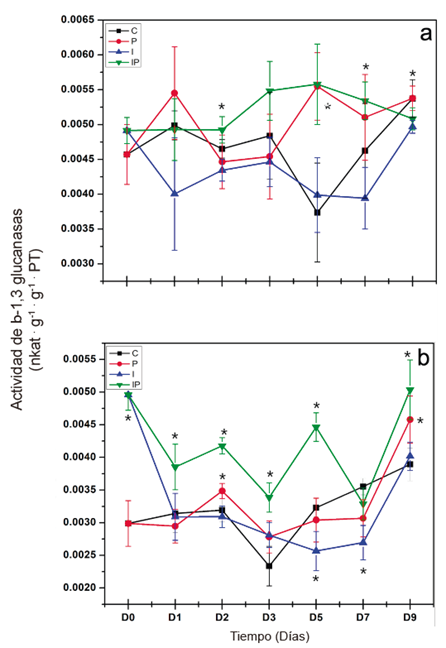
Figura 2 Evaluación de la actividad β-1,3 glucanasas en raíces (a) y en hojas (b) de plántulas de chile tratadas con inulina de dalia e inoculadas con P. capsici. C: Plántulas control, tratadas con agua destilada estéril; P: Plántulas inoculadas con P. capsici; I: Plántulas tratadas con 200 μM de inulina; IP: Plántulas inoculadas con P. capsici y tratadas con 200 μM de inulina. Las líneas verticales representan la desviación estándar. Los asteriscos representan diferencias significativas con respecto al testigo.
disminución al nivel del testigo al día 7 y de nuevo un aumento significativo en el día 9. La inulina de dalia fue capaz de aumentar la actividad de β-1,3 glucanasas de manera sistémica y temprana en las plantas inoculadas con P. capsici.
Actividad de peroxidasas. En este estudio, se evaluó la actividad de enzimas con actividad de peroxidasas en hojas y raíces de plántulas de chile inoculadas con P. capsici y tratadas con inulina de dalia. Respecto a la respuesta local, se observó una diferencia estadística entre muestreos y tratamientos (p < 0.05) (Figura 3a). La actividad de peroxidasas en las plántulas infectadas con P. capsici (P) disminuyeron de manera significativa al día 2 después de la inoculación del patógeno, esta actividad se mantuvo baja, aunque con niveles cercanos al testigo los días 3 y
5. Se observó un aumento significativo de la actividad de peroxidasas en el día 7 y una nueva disminución al nivel del testigo al día 9. Por su parte, en las plántulas tratadas con inulina e infectadas con P. capsici (IP) se observó un aumento en su actividad a partir del día de la inoculación del patógeno. Esta actividad disminuyó al nivel del testigo a partir del día 1 y se mantuvo al nivel del testigo hasta el día 2. Se observó una disminución significativa de la actividad hasta el día 3 y un aumento significativo a partir del día 5 que se mantuvo los días 7 y 9. La inulina fue capaz de aumentar la actividad de peroxidasas de manera local y temprana en las plantas infectadas con P. capsici.
Se observó una respuesta sistémica al presentarse cambios en la actividad de peroxidasas en las hojas (Figura 3b). La actividad de peroxidasas en las plántulas infectadas con P. capsici (P) aumentó de manera significativa al día 1 después de la inoculación del patógeno, esta actividad se mantuvo elevada al día 2. Se observó una disminución de la actividad al nivel del testigo partir del día 3, y se mantuvo el día 5. Se observó una disminución significativa el día 7 y nuevamente un aumento al nivel del testigo al día 9. Por su parte, en las plántulas tratadas con inulina e infectadas con P. capsici (IP) se observó un aumento en su actividad a partir del día de la inoculación del patógeno, que se mantuvo al día 1. Esta actividad disminuyó al nivel del testigo al día 2 y aumentó de manera significativa al día 3. Se observó una disminución al nivel del testigo al día 5 y una disminución significativa al día 7, para aumentar al nivel del testigo al día 9. La inulina fue capaz de aumentar la actividad de peroxidasas de manera sistémica en las plántulas infectadas con P. capsici, y de manera diferenciada con respecto a las plantas sin tratamiento. Las plántulas tratadas con inulina de dalia presentaron un aumento en la actividad de peroxidasas a nivel local y sistémico, que se asoció con la inducción de una respuesta de defensa efectiva contra la infección de P. capsici.
Inducción de la producción de compuestos fenólicos. En este estudio se asoció el contenido de los compuestos fenólicos totales con la producción de fitoalexinas.
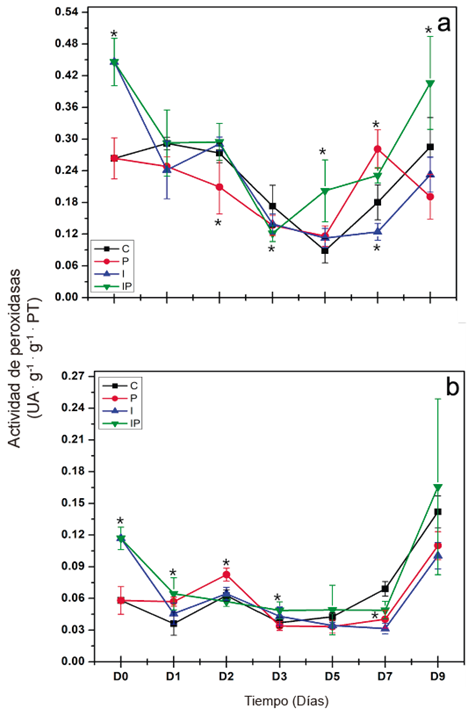
Figura 3 Evaluación de la actividad peroxidasas en raíces (a) y en hojas (b) de plántulas de chile. Los tratamientos se describen en la figura 2. Las líneas verticales representan la desviación estándar. Los asteriscos representan diferencias significativas con respecto al testigo.
Respecto a la respuesta local, las plántulas infectadas con P. capsici (P) no presentaron diferencias significativas con el control (C) en los días evaluados (Figura 4a). Por su parte, en las plántulas tratadas con inulina e infectadas con P. capsici (IP) solo presentaron un aumento significativo en el contenido de los compuestos fenólicos a los 5 días después de la inoculación del patógeno, y una disminución importante al día 7.
Por otra parte, se observó una respuesta sistémica en las hojas de las plántulas de chile (Figura 4b). El contenido de compuestos fenólicos en las plántulas infectadas con P. capsici (P) disminuyó de manera significativa al día 2 después de la inoculación del patógeno, después se observó un aumento hasta el nivel del testigo al día 3 que se mantuvo durante los demás días evaluados. Por su parte, en las plántulas tratadas con inulina e infectadas con P. capsici (IP) se observó el mismo comportamiento que las plántulas infectadas con respecto al testigo. Sin embargo, se observaron diferencias significativas entre las plántulas infectadas (P) y las tratadas con inulina (IP). Se observó un aumento significativo del contenido de compuestos fenólicos en el día 5 y una disminución en el día 7. La inulina indujo una respuesta sistémica diferenciada del contenido de compuestos fenólicos totales en las plántulas infectadas con P. capsici.
De acuerdo con los resultados obtenidos en este estudio se asoció el aumento en los niveles de actividad enzimática y las diferencias significativas observadas en el contenido de compuestos fenólicos a nivel local y sistémico como un tipo de respuesta de defensa inducida efectiva por la inulina contra la infección de P. capsici en chile serrano.
Discusión
La producción de chile verde en México tiene gran importancia económica. Sin embargo, este cultivo es susceptible a hongos y oomicetos que pueden causar pérdidas económicas considerables (Pérez-Acevedo et al., 2017). Para su control, se emplean productos químicos que son costosos y con altas probabilidades de generar resistencia a largo plazo, la búsqueda de alternativas para el manejo de estos fitopatógenos es de gran importancia. El potencial de la inulina como un inductor de defensa vegetal surgen como una alternativa para incluirse en el manejo integral de dichas enfermedades, considerando su disponibilidad, bajo costo y nula toxicidad, además de tener un efecto indirecto que disminuye las probabilidades de la generación de resistencia. Previamente se ha descrito el efecto de protección contra la infección de P. capsici en chile con la aplicación de inulina, disminuyendo la incidencia y síntomas de la enfermedad a una sola concentración de 200 μM (López-Velázquez et al. 2019a, 2019b). El mecanismo de esta protección se ha
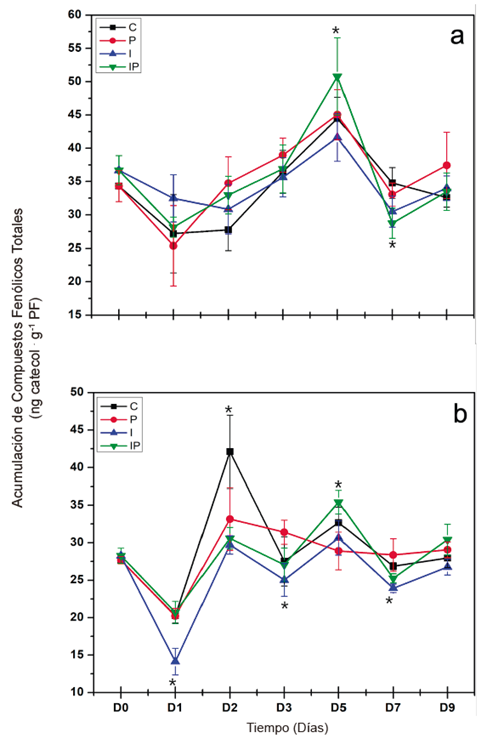
Figura 4 Cuantificación de compuestos fenólicos totales en raíces (a) y en hojas (b) de plántulas de chile. Los tratamientos se describen en la Figura 2. Las líneas verticales representan la desviación estándar. Los asteriscos representan diferencias significativas con respecto al testigo.
asociado a la inducción de la defensa efectiva en la planta. Sin embargo, no se había comprobado este efecto de inducción de defensa vegetal en chile.
En este estudio se observó que una concentración entre 100 a 300 μM de inulina tuvo un efecto protector contra la infección de P. capsici, observándose una disminución de la severidad de la enfermedad e incidencia, así como una fluctuación sobre el peso fresco y la altura de la planta. Adicionalmente, se observó la disminución de la viabilidad de la raíz de las plantas tratadas con inulina y las plantas infectadas con el patógeno. Esta disminución de la viabilidad no afectó su crecimiento y se observó que el volumen radicular puede llegar a ser mayor que el control. Mientras que, en la planta infectada el volumen radicular es significativamente menor y puede asociarse con daño significativo en el crecimiento de la raíz.
Se desencadenan diferentes tipos de respuestas que están relacionadas con la protección de las plantas, incluyendo la activación de las proteínas PR y la producción de fitoalexinas, sus fluctuaciones y cambios en los niveles de actividad y acumulación de metabolitos en comparación con las plantas enfermas, se consideran como una respuesta de defensa efectiva contra el patógeno. De acuerdo con los resultados obtenidos, se observó que la aplicación de inulina indujo un aumento en la actividad de enzimas β-1,3 glucanasas a nivel local y sistémico. Esto concuerda con los resultados descritos para otros oligosacáridos con actividad de elicitores. Sajeesh (2015), reportó la inducción de enzimas defensivas, entre ellas β-1,3 glucanasas, mediante la aplicación de quitosano, un oligosacárido derivado de la quitina y ampliamente reportado en la defensa de plantas, esta respuesta se observó en el control de Phytophthora infestans en papa (Solanum tuberosum).
Por otra parte, se han reportado a los fructooligosacáridos Burdock (BFO) como inductores de una respuesta de defensa efectiva. Zhang et al. (2009) aplicaron de manera foliar BFO en pepino (Cucumis sativus) y posteriormente inocularon el patógeno Colletrotrichum orbiculare bajo condiciones de invernadero; observaron que a los 6 días después de la inoculación del patógeno, un aumento significativo en la actividad de β-1,3 glucanasas tanto en las hojas tratadas con BFO consideradas locales, como en las que no fueron tratadas con BFO, consideradas como sistémicas, en contraste con las hojas sin tratamiento e inoculadas con C. orbiculare. Esto fue equivalente a lo observado en este estudio, donde se incrementó la actividad de β-1,3 glucanasas en las plantas tratadas con inulina e inoculadas con P. capsici. En este mismo estudio observaron un incremento en la respuesta local y de menor intensidad en la respuesta sistémica. En este estudio, con inulina, se observó que la respuesta local y sistémica de la actividad de β-1,3-glucanasas fueron semejantes. En este mismo sentido, Sun et al. (2013) reportaron el aumento de la actividad de β-1,3 glucanasas y protección a la infección de Botrytis cinerea con la aplicación postcosecha de BFO en uva de Kyoho (Vitis vinifera ‘Kyoho’). La actividad aumentó en los primeros días después de la inoculación del patógeno (días 1, 2 y 3) para disminuir posteriormente en los días 4 y 5. En este estudio, la actividad de β-1,3 glucanasas a nivel local presentó un comportamiento similar, aunque el aumento fue a partir del día 2 y la disminución hasta el día 9. Una diferencia importante con respecto a lo reportado en la literatura es que los polímeros son aplicados a nivel foliar, mientras que este estudio fue a la base de la planta.
Otro grupo de proteínas PR evaluadas en este estudio fueron las peroxidasas. Se ha descrito que algunos carbohidratos con actividad de elicitores inducen la actividad de peroxidasas (Chaliha et al., 2018), y su activación también se ha asociado a una respuesta de defensa efectiva en cultivares de chile resistentes a P. capsici (Wang et al., 2013). La inducción de la actividad de peroxidasas asociado a una respuesta de defensa efectiva por carbohidratos con actividad de elicitores ha sido descrita para diferentes patosistemas (Chaliha et al., 2018). Zhang et al. (2009) reportaron la aplicación foliar de los fructooligosacáridos Burdock (BFO) en pepino y posterior inoculación del patógeno C. orbiculare bajo condiciones de invernadero observaron que a los 6 días después de la inoculación del patógeno, se presentó un aumento significativo en la actividad de enzimas con actividad de peroxidasas, incluyendo superóxido dismutasa (SOD) y polifenol oxidasa (PPO). Asimismo, observaron un mayor incremento en la respuesta local y una menor intensidad en la respuesta sistémica. En este estudio se observó un comportamiento similar para las plantas tratadas con inulina. Otro carbohidrato que se ha reportado como inductor de defensa vegetal es la trehalosa, que fue capaz de inducir la activación de peroxidasas en trigo (Triticum aestivum) para contrarrestar a Blumeria graminis (Reignault et al., 2001). Se describió un aumento en la actividad de peroxidasas a nivel local a partir del día 2 después de la inoculación del patógeno en plantas tratadas con trehalosa, una respuesta que corresponde con lo observado en este estudio.
Finalmente, se evaluó la inducción de fitoalexinas en las plántulas de chile a partir de los tratamientos con inulina. En este estudio se asoció el contenido de los compuestos fenólicos totales con la producción de fitoalexinas (Yu et al., 2022). Se ha reportado la producción de fitoalexinas inducidas por trehalosa en trigo para el control de B. graminis, asociadas con la activación de la fenilalanina amonioliasa (PAL) un día después del tratamiento (Reignault et al., 2001). En contraste, Sun et al. (2013) reportaron la disminución del contenido de fenoles totales con la aplicación postcosecha de BFO en uva de kyoho en la infección de B. cinerea. En este estudio, el aumento en el contenido de compuestos fenólicos totales por el tratamiento con inulina a nivel local fue mínimo y no se podría asociar con una respuesta de defensa efectiva. A nivel sistémico, se pudo observar una respuesta diferenciada entre las plantas infectadas y las tratadas con inulina, que permitió monitorear los cambios en el contenido de los compuestos fenólicos totales. Sin embargo, aún hace falta asociar estos cambios con una respuesta efectiva contra la infección de P. capsici.
En este estudio se pudo asociar una protección por la aplicación de la inulina de dalia como un efecto de inducción de defensa vegetal o también denominada como elicitor (Bektas y Eulgem 2015). Las plantas tratadas con la inulina presentaron un aumento en los niveles de actividad de β-1,3 glucanasas y peroxidasas a nivel local y sistémico contrastantes con las plantas infectadas con P. capsici y el testigo. El uso de fructooligosacáridos en la agricultura como inductores de defensa vegetal representa un área de oportunidad y con gran potencial. Se han descrito algunos trabajos relacionados con la protección vegetal de otros fructooligosacáridos como los fructanos de agave en chile que dependen del grado de polimerización para aumentar o disminuir la protección (Navarro-Lopez et al, 2019), aunque sin determinar si la protección fue por inducción de defensa vegetal. En el caso de la inulina, será importante evaluar si esta protección puede modificarse de manera positiva dependiendo de sus propiedades fisicoquímicas, origen o pureza, lo que facilitaría su uso y transferencia tecnológica al disminuir los costos de producción, aprovechando su inocuidad, solubilidad y estabilidad en su almacenaje (Leyva-Porras et al., 2014).
Conclusiones
La inulina de tubérculos de dalia presentó un efecto protector contra la infección de Phytophthora capsici, a concentraciones que oscilan de 100 a 300 μM, al disminuir la incidencia y los síntomas de la enfermedad. Esta protección fue asociada a la inducción de una respuesta de defensa efectiva, con un aumento de la actividad de las enzimas β-1,3 glucanasas y peroxidasas a nivel local y sistémico. Esta respuesta fue diferenciada entre las plántulas tratadas con inulina y las plántulas infectadas con P. capsici. A partir de estos resultados, se propone el uso de la inulina de dalia como un agente protector contra la infección de P. capsici en chile serrano.











 texto en
texto en 


