Introducción
Los hongos del género Aspergillus spp. se consideran un grupo complejo de ascomicetos que comprende 350 especies aceptadas (Kocsubé et al., 2016). Son descritos como hongos filamentosos, capaces de secretar una amplia gama de metabolitos secundarios y enzimas, cuya función es degradar y reciclar biopolímeros de tejidos vegetales (El-Enshasy, 2007). El género Aspergillus spp., por lo general se encuentran en semillas almacenadas, vegetación en descomposición y suelo, donde se desarrollan como saprófitos (Mousavi et al., 2016).
Aunque los hongos del género Aspergillus spp. no se consideran fuentes importantes de enfermedades fitosanitarias, son responsables de alteraciones en plantas y productos almacenados, al ser mohos oportunistas prosperan en condiciones de almacén (Awuchi et al., 2021). Además es un género reconocido por su producción de micotoxinas identificando alrededor de 300 y 400, como las aflatoxinas, ácidos secalónicos, ácido ciclopíazonico, aflatrem, citrinina, estregmatocistina, glicotoxina, ocratoxina A (OTA), y terreína (Navale et al., 2021), con potencial riesgo a la salud humana como de animales, a la par también afectan el medio ambiente e influyen negativamente en la economía mundial (Bueno et al., 2015). Un ejemplo importante de este tipo de metabolitos secundarios tóxicos son las aflatoxinas, las cuales suponen un riesgo para los productos en postcosecha y son considerados como indicadores de degradación biológica de suelo (Marshall et al., 2020). Generan cambios cualitativos nutricionales y sensoriales en los productos de origen vegetal, ya que la infección puede provocar sabores u olores desagradables, podredumbre y decoloración (Kozakiewic, 1989).
Algunos hongos del género Aspergillus spp., como A. flavus, A. nidulans, A. nomius y A. parasiticus, tienen importancia agronómica, debido a que son productores de aflatoxinas (AF) (Hesseltine et al., 1970; Gomi, 2014), principalmente B1, B2, G1 y G2, han demostrado ser fuertes biotoxinas cancerígenas, citotóxicas y potencialmente mortales para el ser humano y el ganado (Ráduly et al., 2019).
A. flavus se ha reportado como causante de contaminación por aflatoxinas AFB1 en cualquier etapa de la cadena de suministro de maní (importadores, fabricantes y minoristas), en países como Malasia, donde las condiciones de clima tropical son favorables para el crecimiento de este hongo (Norlia et al., 2018, 2019). En México el maíz se ha visto afectado por la contaminación con aflatoxinas, de igual manera granos como arroz, cebada, frijol, sorgo, trigo, algunas oleaginosas y frutos secos son susceptibles a estas biotoxinas, producidas por A. flavus (AFB1 y AFB2), A. parasiticus y A. nomius (AFG1 y AFG2) (Anguiano-Ruvalcaba et al., 2005; Escobar et al., 2023).
Es importante destacar, la existencia de cepas no toxigénicas, dentro de Aspergillus spp., las cuales no generan aflatoxinas y pueden aplicarse en el área de cultivo, llegándose a instalar, competir y desplazar a las cepas toxigénicas, resultando en la reducción de aflatoxinas (Marshall et al., 2020; Senghor et al., 2020). Cepas no toxigénicas de A. niger, A. sojae y A. oryzae, no producen compuestos que contengan en esencia un anillo de furano unido al núcleo de cumarina, importantes en la ruta de biosíntesis de aflatoxinas, y no generan ácido ciclopiazónico en conjunto con aflatoxinas como A. flavus (Dorner et al., 2000; Padrón et al., 2013).
Cepas de Aspergillus spp. que no producen aflatoxinas pueden ser utilizadas como agentes de biocontrol fúngico en la prevención de contaminación por biotoxinas (Barberis et al., 2019). Las cepas A. westerdijkiae 107, A. fumigatos C143, A. tamarii C122 y A. niger C187 han demostrado en términos de inhibición y producción de OTA tener resultados favorables, siendo la cepa A. niger C187 la que obtuvo un 100% de inhibición de la producción de OTA y del crecimiento de A. ochraceus, A. westerdijkiae, A. carbonarius y A. niger en granos de café (de Almeida et al., 2019). De igual manera suelen utilizarse en la industria farmacéutica, y en procesos industriales como la fermentación de alimentos, debido a que son fuentes abundantes de enzimas como proteasas, amilasas y amiloglucosidasas entre otras (Schuster et al., 2002; Olempska-Beer et al., 2006; Samson et al., 2014; Gómez et al., 2016). La producción de poligalacturonasa (Exo-PGs), un consorcio de enzimas necesarias para la hidrólisis de pectina, se encuentra dentro de las aplicaciones de la cepa A. sojae ATCC 20235, útil en la despectinización y clarificación de jugos de frutas, extracción de aceites de cascaras de vegetales y cítricos, y tratamiento de aguas residuales pésicas (Tari et al., 2008).
Por lo tanto, al ser un hongo que cuenta con cepas no toxigénicas, A. oryzae figura como una de las especies más importantes debido a su potencial uso como herramienta biotecnológica, en procesos metabólicos degradativos de diversos almidones y proteínas; en el metabolismo de aminoácidos, y transportadores de absorción de aminoácidos y azúcares (Machida et al., 2005, 2008; Watarai et al., 2019; Daba et al., 2021). A. oryzae es considerado por la FDA como “generalmente reconocido como seguro” (GRAS), esto hace referencia a cualquier sustancia agregada intencionalmente a alimentos, la cual debe estar sujeta a revisión y aprobación previa antes de su comercialización, a menos que la sustancia sea generalmente reconocida, entre los expertos calificados (Gad, 2005; FDA, 2019). Por lo tanto, la OMS avala la seguridad ante el uso de A. oryzae (He et al., 2019). Siendo de este microorganismo apto para su aplicación en la industria alimenticia como la fermentación de alimentos, producción de alcohol y vinagre, en la industria farmacéutica y cosmética mediante la formulación de fármacos y agentes despigmentantes, dichas aplicaciones se deben a la producción de enzimas y metabolitos secundarios como lipasas, celulasas, pectinasas, β-galactosidasa, amilasas, ácido kójico, ácido málico, ácido fumárico y ácido felurico entre otros (Daba et al., 2021).
Por lo tanto, el presente estudio se enfoca en revisar trabajos de investigación y literatura sobre los diversos productos derivados de A. oryzae, sus aportaciones y aplicaciones en el área agrícola como biorremediadores, inductores de crecimiento y agentes de control biológico. Es necesario destacar, que, si bien el estudio de A. oryzae ha tenido un enfoque en mayor parte para el área industrial, en el presente trabajo solo se consideraron aquellos trabajos e investigaciones en los que su aplicación va dirigida a la parte agronómica. Se pone principal atención en el ácido kójico y cepas de A. oryzae involucradas en su producción, debido a que el proceso fermentativo presenta características sustentables, y sus aplicaciones son novedosas para el área agrícola.
El objetivo principal de esta revisión es dar a conocer el potencial de A. oryzae en áreas poco estudiadas de importancia agrícola. Si bien A. oryzae ha sido estudiado en gran medida en áreas industriales, alimenticias y médicas, los estudios de su potencial agronómico son pocos y en México su estudio es prácticamente nulo, de tal manera que parte de esta revisión busca el desarrollo en un futuro de trabajos científicos referentes a A. oryzae encaminados al sector agrícola, aportando al desarrollo y cuidado del campo mexicano.
Morfología y descripción de Aspergillus oryzae; origen, aislamiento y desarrollo
Aspergillus spp. presenta hifas septadas hialinas, con ramificación dicotómica de 45° (Cuervo-Maldonado et al., 2010), el crecimiento forma micelios extendidos que cubren toda la superficie de los medios de cultivo (Gomi, 2014) (Figura 1). La
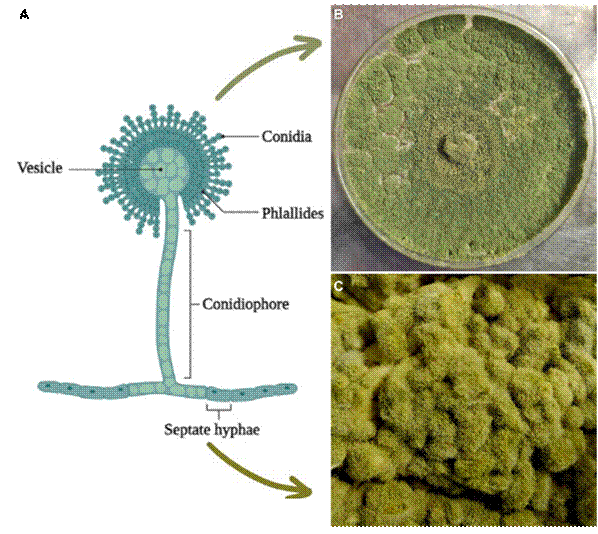
Figura 1 Morfología de A. oryzae; A) Partes y estructura del hongo (Adaptado de “Structure of Aspergillus spp.”, 2023), B) A. oryzae cultivado en medio PDA, y C) Crecimiento de A. oryzae en arroz al vapor (köji).
vesícula en forma de globo mide de 100 a 200 µm de diámetro con una estructura formada por conidios de forma ovalada de 5 a 8 µm de largo que contiene cuatro núcleos de textura suave y ligeramente rugosa. Las fiálides se encuentran en la vesícula y pueden ser esterigmas uniseriados o biseriados. Los tallos son incoloros y de 1 a 5 mm de largo con textura áspera (Moubasher, 1993; Powell et al., 1994). Ahlburg (1876) aisló por primera vez a A. oryzae del köji, el material fermentado por el moho de A. oryzae cultivado en un medio sólido de arroz al vapor (Machida et al., 2008). Dicho hongo pertenece a la Clase Erotiómycetes; Orden: Eurotiales; Familia: Trichocomaceae (Daba et al., 2021). El uso de A. oryzae en la producción de sake (bebida alcohólica fermentada de arroz), vinagre, miso (pasta de soja), y salsa de soja, se ha reportado durante al menos dos milenios (Furukawa, 2012; Chang et al., 2014), en general se considera seguro, y no se conoce ninguna cepa que produzca aflatoxinas (Machida et al., 2005).
Los genes que codifican la vía enzimática para la biosíntesis de aflatoxinas están agrupados en una región del ADN de 75 Kb en A. flavus, este grupo se encuentra en A. oryzae, pero no parece ser funcional (Yu et al., 2004). A. oryzae y A. flavus son morfológicamente similares, varios estudios sugieren que son ecotipos, refiriéndose a una misma especie que en ambientes diferentes tienen una expresión diferente por la interacción de los genes con el medio donde se encuentran (Kurtzman et al., 2018). Dando a entender que A. oryzae fue el resultado de la domesticación de A. flavus después de siglos de cultivo (Payne et al., 2006).
Aspergillus oryzae ser reportado como microorganismo domesticado, no se puede encontrar en la naturaleza. Sin embargo, existen algunos reportes donde se habla del aislamiento de A. oryzae de alimentos, plantas y suelo, presentándose con menor frecuencia (Klich, 2002). Un archivo historio describía que A. oryzae debía aislarse de una espiga de arroz, dando a entender que puede haber existido en la naturaleza antes de la domesticación (Murakami, 1980).
Dicho hongo crece en varios medios, incluidos agar dextrosa de papa, donde crece particularmente rápido en 7 días a 25 °C (Moubasher, 1993), su etapa de esporulación comienza a los 7 días, cuando el crecimiento alcanza de 7 a 8 cm comienza a formarse un contorno amarillo, que gradualmente se torna verde (Daba et al., 2021). Las condiciones ideales para el desarrollo de A. oryzae incluyen pH ligeramente ácido entre 5 y 6, a la par la temperatura debe oscilar entre 32 a 36 °C (±1 °C), variaciones en la temperatura superiores a 44 °C inhiben su crecimiento. Estos hongos muestran un desarrollo eficiente en medios con actividad de agua superior a 0.8 y rara vez crecen por debajo de este rango (Gomi, 2014).
Aplicaciones de Aspergillus oryzae y su posible implementación en la agricultura
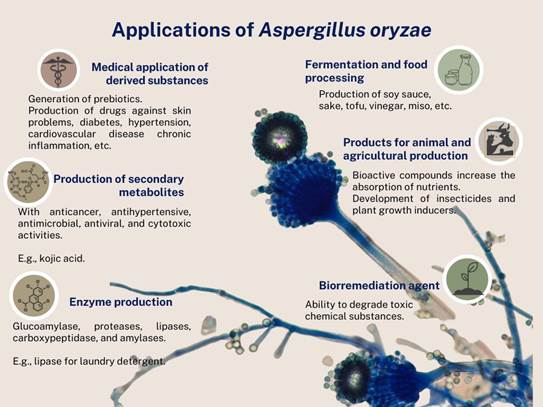
La versatilidad de A. oryzae, se ve reflejada en el amplio espectro de áreas donde se puede llevar acabo su aplicación (Figura 2), ya que es altamente efectivos en la
fabricación de productos biotecnológicos principalmente por su diversidad metabólica y enzimática (El-Enshasy, 2007).
Lee y colaboradores (2016), proporcionaron un perfil metabólico obtenido durante la fermentación de köji con A. oryzae, el cual comprende los metabolitos secundarios secretados en el proceso fermentativo, clasificándolos en; a) azucares ( xilosa, fructosa y glucosa); b) polioles ( glicerol, eritriol, xilitol, sorbitol y myoinositol); c) ácidos orgánicos (ácido succínico, ácido glicérico, ácido fumárico, ácido málico, ácido kójico, ácido cítrico y ácido glucónico); d) ácidos fenólicos ( ácido 4-hidroxybenzoico y ácido ferúlico); e) aminoácidos (alanina, prolina, glicina, serina, treonina, aspartato y GABA); f) ácidos grasos (ácido palmítico, ácido linoleico, ácido oleico y ácido pinélico); y g) vitaminas (vitamina B3). Cada uno de estos compuestos tiene diferentes propiedades antimicrobianas, antioxidantes, anticancerígenas, antivirales, compuestos hormonales y quelantes de metales (Frisvad et al., 2018; Daba et al., 2021).
La aplicación de A. oryzae y en la producción de ácido málico y ácido fumárico (Xu et al., 2012; Brown et al., 2013), propone la posibilidad de la creación de un proceso de biorrefinería para la producción de ácidos orgánicos y enzimas, sustituyendo los polímeros derivados del petróleo actualmente utilizados (Brink et al., 2023). El proceso de biorrefinería puede ser potencializado al implementar de subproductos agrícolas, sustratos baratos y no alimenticios, reduciendo costos de producción y siendo una opción libre de productos químicos (Jiménez-Quero et al., 2020).
Las enzimas microbianas empleadas en la industria han demostrado ser mejores en su aplicación, económicas y respetuosas con el medio ambiente en comparación con productos químicos (Whiteley y Lee, 2006). Cuentan con ventajas técnicoeconómicas implicando menores tiempos de producción, mejor espacio por unidad de enzima producida y potencial ilimitado en cuanto a disponibilidad de nuevas enzimas (Scriban, 1985).
Se ha reportado la aplicación de A. oryzae en el proceso de fermentación de orujo de uva, mediante la producción de enzimas (celulasa, pectinasa y tanasa) las cuales facilitan la extracción acuosa de polifenoles (ácido gálico, ácido sinápico y ácido ferúlico), con propiedades antioxidantes y prebióticas, como aditivos alimenticios, en donde A. oryzae tiene una mayor producción y selectividad de tanasa en condiciones húmedas, teniendo un efecto positivo sobre la actividad antioxidante, el cual puede verse influido por la producción de ácido gálico (Meini et al., 2021). Por otro lado, A. oryzae tiene la capacidad de estimular la fermentación ruminal al mejorar el consumo y digestión del alimento y materia seca en ganado vacuno, mediante su aplicación como aditivo microbiano en el alimento del ganado (Sosa et al., 2022), a la par se ha demostrado la eficiencia en el aumento de ácidos grasos volátiles, haciendo de A. oryzae un elemento de mejora para potencializar las dietas de los rumiantes de manera diferente, además influye en el suministro de enzimas en ensilaje de maíz, heno de avena y heno de alfalfa (Kong et al., 2021).
El progreso tecnológico ha aprovechado el potencial de A. oryzae (Matsunaga et al., 2002) para uso industrial en el desarrollo de detergentes, pigmentos, antioxidantes, (Christensen et al., 1988; Machida et al., 2008; Panchanawaporn et al., 2022). De igual forma su aplicación en la fermentación de alimentos (Machida et al., 2008; Yasui et al., 2020) y la implementación de la producción de metabolitos como ácidos orgánicos y reguladores de crecimiento vegetal son áreas importantes de estudio (El-Enshasy, 2007; Siddiqui, 2016). Además puede ser útil en actividades biológicas como en el área de la veterinaria como probióticos para aves de corral y digestivo de pienso de ganado (Lee et al., 2006; Murphy, 2021; Podversich et al., 2023).
A. oryzae como biorremediador de suelos, promotor de crecimiento y control biológico
A. oryzae puede ser una alternativa para el desarrollo de una agricultura sustentable y ecológicamente amigable, en específico en México donde sus aplicaciones en campo no son tema de estudio. La siguiente información describe algunas áreas de oportunidad donde se puede aplicar este microorganismo en la agricultura, con la finalidad de dar pie a posibles estudios científicos dirigidos al campo mexicano. Los hongos endófitos vegetales, son aquellos que habitan en los tejidos de plan tas y no causan ningún daño evidente. Debido a esto en algunas ocasiones se identifica una relación mutualista (endófito-hospedero) desencadenando la producción de sustancias bioactivas (metabolitos secundarios, enzimas etc.) las cuales influyen en la promoción del crecimiento, la supervivencia del hospedero bajo diversas condiciones ambientales, disminuir la susceptibilidad a enfermedades y ayudar en el control de insectos plaga y agentes fitopatógenos (El-hawary et al., 2020; Murali et
al., 2012; Sharma and Singh, 2021).
Si bien A. oryzae no se reporta comúnmente como endófito natural, se ha proporcionado información sobre su aislamiento en raíces de Ginkgo biloba en China (Machida et al., 2005).Sun y colaboradores (2018), mediante el estudio de la inoculación de semillas de Raphanus sativus con la cepa A. oryzae BNCC341706, lo establecieron como un hongo con propiedades endófitas, al no afectar la germinación de la semilla inoculada, y promover el crecimiento del cultivo de R. sativus con alturas de 116 mm en comparación con el testigo con una altura de 99.6 mm. Otro efecto del uso de A. oryzae, se vio reflejado en la salud de su principal insecto plaga Plutella xylostella, afectando los parámetros de consumo, peso de larvas y pupas. Lo cual, abre la posibilidad al tratamiento de semilla de crucíferas, y el control de insectos plaga mediante A. oryzae.
De igual manera como agentes biorremediadores los hongos endófitos, ha demostrado ser eficaces en la degradación de contaminantes sin dejar rastros de subproductos tóxicos (Skinder et al., 2022), representando una ventaja debido a sus características de biomasa, largo ciclo de vida y su red de hifas (Sun et al., 2012), a la par la capacidad de degradar sustancias químicamente tóxicas mediante modificación o actuando sobre su biodisponibilidad química (Bornyasz et al., 2005). En el caso de A. oryzae como agente biorremediador, el estudio in vitro de las cepas A. oryzae AM1 y AM2, demostró la capacidad de degradar atrazina (90%), endosulfán (56 y 76%) y clorpirifós (50 y 73%), y a la par logra obtener un buen desarrollo bajo concentraciones altas de pesticidas, lo que genera la posibilidad de degradar este tipo de productos químicos (Barberis et al., 2019).
La OTA, es una micotoxina que afecta la salud humana y productos agrícolas, por lo cual se buscan medidas de control, por lo tanto, la biodegradación se plantea como un método prometedor. La cepa A. oryzae M30011, es capaz de degradar hasta en un 94% la OTA en un periodo de 72 h, en condiciones de pH de 8, temperatura de 30 °C y concentración del inoculo de 104 UFC mL-1. Por otra parte, el reducir los niveles de aflatoxinas, es un tema de importancia, debido a que son una amenaza a la seguridad alimentaria mundial (Xiong et al., 2021). Se ha demostrado, que la cepa A. oryzae M2040, es capaz de inhibir en un 87% la producción de AFB1, y la proliferación de A. flavus, en condiciones in vitro, y en maní al desplazar al hongo productor de aflatoxinas con éxito, mediante la secreción de compuestos antimicóticos, los cuales no han sido reportados (Alshannaq et al., 2018). Estos estudios respaldan el potencial de A. oryzae en la industria agrícola y alimentaria.
El potencial que tiene el uso de A. oryzae, se ha enfatizado en el desarrollado de trabajos de investigación como promotor de crecimiento y agente de control biológico, presentes en el Cuadro 1.
Cuadro 1 Uso de A. oryzae como promotor de crecimiento, agente de control de plagas y biorremediador de suelos contaminados.
| Application | Strain | Crop / Pest | Results | Reference |
|---|---|---|---|---|
| Arsenic biorremediator and growth enhancer | FNBR_L35 | Oat (Avena sativa), Calendula (Calendula officinalis), Ashwagandha (Withania somifera) | Effects of bioaccumulation and biovolatilization of arsenic in concentrations of 100 to 10,000 ppm in a period of 21 days and enhancement of plant growth | Singh et al., 2015 |
| Entomopathogen | XJ-1 | Locusta migratoria | Mortality in third instar of the insect | Zhang et al., 2015 |
| Growth enhancer and control agent | BNCC341706 | Radish seeds (Raphanus stativus), Puntella xylostella | Greatest plant height. Inhibition of feeding and low weight of larvae and pupae | Sun et al., 2018 |
| Removal of glyphosate | AM1 and AM2 | In vitro | Degradation of 50% in glyphosate concentrations, long periods of incubation and permanence of the fungus | Carranza et al., 2019 |
| Entomopathogen | USMN05 USMM03 NRRL2097 | Spodoptera litura | Mortality of 20% and inability to produce aflatoxins | Fitriana et al., 2021 |
La facultad de A. oryzae en la secreción de enzimas, es una alternativa para el desarrollo de compuestos de origen microbiológico, debido a que desempe ñan actividades biológicas que pueden ser adaptadas en el área agronómica. Un ejemplo, es la actividad antifúngica de la xilanasa producida por la cepa A. oryzae MN894021, la cual presenta una reducción en un 75, 90 y 100% de la incidencia de Botrytis cinerea, Fusarium solani, F. chlamydosporum, F. incranatum, Macrophomina phaseolina, Rhizotocnia solani y Sclerotinia sclerotiorum, en semillas de haba recubiertas con xilanasa, brindando una protección contra la invasión de estos hongos fitopatógenos (Atalla et al., 2020). Los resultados obtenidos de la xilanasa producida por la cepa A. oryzae MN894021, coinciden la actividad de la xilanasa de Trichoderma harzianum kj831197 contra Corynespora cassiicola, Alternaria spp.,F. oxysporum y Botrytis fabae (Ellatif et al., 2022).
El control de hongos fitopatógenos es un desafío importante para la agricultura. El desarrollo procesos de control sostenibles, ecológicos, fáciles y respetuosas con la naturaleza, es constante en la investigación actual, una opción es la síntesis biogénica de nanopartículas (Zhang et al., 2020). La cepa A. oryzae MTCC3107 ha sido implementada en la formulación de nanopartículas de plata (AgNP), cuyo potencial antimicrobiano contra Sclerotinia sclerotium, reflejó inhibición del 100% a una concentración de 100 µL mL-1. El papel de A. oryzae en la formulación, se debe a la secreción de amilasa, la cual cataliza el proceso de producción de las AgNP, haciéndolo un proceso de síntesis verde (Gupta y Saxena, 2023).
El estudio y publicación de información relacionada con el potencial de A. oryzae, sirven de respaldo para futuras investigaciones en el área de la fitopatología, ya que ha sido relativamente poco estudiada. Si bien A. oryzae cuenta con un amplio margen de sustancias bioactivas producidas, son pocos los aplicados en esta área. Algunas actividades y metabolitos se presentan en el Cuadro 2.
Cuadro 2. Actividad de sustancias bioactivas producidas por A. oryzae contra fitopatógenos.
| Bioactive substances | Strains | Application | Result | Reference |
|---|---|---|---|---|
| Kojic acid | NRRL 447, 552, 552, 1730 Y30038 (S-03) | Prevention of contamination by toxins in agricultural products | Reduction of aflatoxins in peanut | Dorner et al., 1998 |
| Kojic acid | * | Insecticide: Glyphodes pyloalis | Inhibition of phenyloxidase activity | Sharifi et al., 2013 |
| Oryzaeins A-D | KM999948 | Antiviral: TMV | Rates of inhibition of 22.4 - 30.6% | Zhou et al., 2016 |
| Xylanase | MN894021 | antifungal: Alternaria alternata, Fusarium oxysporum, Phoma destructor, Rhizotocnia solani and Sclerotium rolfsii | Reduction of the live growth Reduction in percentages of incidence of root rotting | Atalla et al., 2020 |
| Kojic acid | * | Antifungal activity: Sclerotinia slerotiorum | Inhibiyion of chitin and melanin synthesis Reduction of oxalic acid of the virulence factor | Zhu et al., 2022 |
*Strain not provided by the author.
Ácido kójico metabolito secundario de A. oryzae; alternativa de control contra los fitopatógenos
Dentro de los principales metabolitos secundarios producidos por A. oryzae, el ácido kójico es de los más relevantes (Figura 3) (Yamada et al., 2014), su aplicación dentro el control de agentes fitopatógenos e insectos plaga es un tema relativamente nuevo; sin embargo, los informes de investigación muestran que esta aplicación puede ser una alternativa factible para el control de plagas en cultivos.
A. oryzae cuenta con propiedades bactericidas, fungicidas e insecticidas (Mohamad et al., 2010), su modo de acción está relacionado con la inhibición de enzimas oxidativas tanto de plantas como de artrópodos. Estudios han demostrado que el ácido kójico inhibe de manera eficaz la tasa de formación de productos pigmentados y de absorción de oxígeno cuando compuestos como las catecolaminas (DL-DOPA, dopamina y norepinefrina), al ser oxidados por la enzima la tirosinasa (Kahn, 1995; Kahn y Ben-Shalom, 1997).
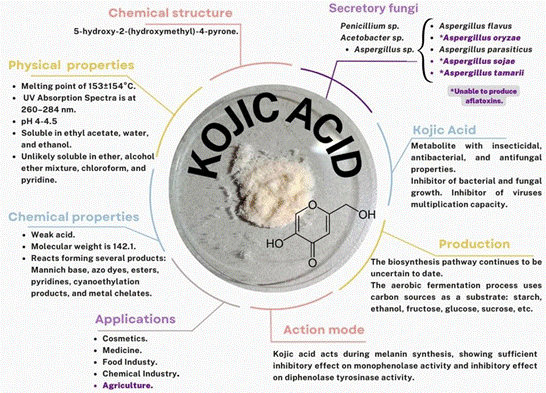
Figura 3 Características y generalidades del Ácido kójico basado en los informes de Phasha et al. (2022) y Siddiquee (2018).
Mahmoud y colaboradores (2023), analizaron la actividad insecticida del ácido kójico producido por la cepa A. oryzae ASU44 (OL314732), contra Aphis gossypii, vector del virus del enanismo de la hoja del algodón (Cotton leafroll dwarf virus-CLRDV) (Mahas et al., 2022). Evaluaron la diferencia entre el ácido kójico extraído de la cepa A. oryzae ASU44 (OL314732) y el ácido kójico sintético, indicando que el ácido kójico producido por A. oryzae ASU44 (OL314732), era más eficaz contra Aphis gossypii, con concentración letal media (CL50) de 11.2 ppm, concentración letal (CL90) de 50.3 ppm, y tiempo letal (LT90) de 7 días, ya que los resultados son menores que los del ácido kójico sintético, destacando su aplicación como un modelo de evaluación in vitro eficaz y económico (Mahmoud et al., 2023). De igual manera, la actividad antifungica del ácido kójico, se ha evaluado con A. terrus, A. flavus, A. parasiticus, A. fumigatus, Penicilium y Sclerotinia sclerotiorum (Kim et al., 2012; Kim y Chan, 2014; Zhu et al., 2022). En el caso de S. sclerotiorum, el ácido kójico inhibe la biosíntesis de melanina, lo que afecta el desarrollo de esclerocios, y la biosíntesis de quitina y β-1,3-glucanos, lo que altera la pared celular y el crecimiento del micelio, rediciendo en su totalidad, los síntomas de S. sclerotiorum, en las vainas de soya con 50 mM de ácido kójico. Tiene la capacidad de prevenir como inhibir los síntomas de S. sclerotiorum, a la par cuenta mayor eficiencia que fungicidas comerciales (carbendazim y procloraz) (Zhu et al., 2022). Con mayor frecuencia se ha señalado a los nematodos fitoparásitos como la causa de pérdidas económicas importantes en diversos cultivos oscilan alrededor de $77 mil millones de dólares a nivel mundial, lo cual genera preocupación en la agricultura, horticultura y silvicultura (Yadav, 2017; Seo et al., 2019). Por ejemplo, Meloidogyne spp. nematodo agallador, es responsable de pérdidas anuales, las cuales se elevan a $100 mil millones de dólares. Kim y colaboradores (2016) establecieron un método de control de estos nematodos mediante el uso de ácido kójico como ingrediente activo, el cual fue producido por la cepa A. oryzae EML-DML3PNa1 obtenida de plantas de cornejo (Cornus alba). Durante sus experimentos, se demostró un efecto inhibidor de la eclosión de huevos y el desarrollo de larvas y se sugirió la implementación del ácido kójico en conjunto con un agente dispersante, penetrante o tensioactivo, con la finalidad de mejorar la absorción y el efecto del producto en el cultivo (Kim et al., 2016). La acción nematicida del ácido kójico reportó un 87.6% de mortalidad en juveniles de Meloidogyne incognita bajo condiciones del 20% de un filtrado de caldo fermentativo. Presentó inhibición en la incubación del nematodo y una mortalidad dependiente de la dosis, con valores de concentración efectiva media (CE50) de 195.2 µg mL-1 y 238.3 µg mL-1, respectivamente, a las 72 h posteriores a la exposición, lo cual sugiere que tiene un potencial como agente de control biológico (Kim et al., 2016).
El interés por productos agrícolas seguros para la salud y libres de contaminación va en aumento, esto debido la conciencia sobre la toxicidad residual ocasionada por el uso de pesticidas. La implementación de microorganismos que tienen actividad nematicida se recomienda por ser respetuosos con el medio ambiente al ser obtenidos a partir de productos naturales, como lo es el caso del ácido kójico, por lo cual su implementación en la agronomía abre una puerta para el desarrollo de productos sustentablemente económicos, amigables con el medio ambiente y sobre todo que no generen daños a la salud de quien los aplica.
Conclusiones
El presente estudio destaca el potencial de las cepas de A. oryzae y sus derivados (enzimas y metabolitos secundarios), considerando la capacidad de competir con productos químicos comerciales como plaguicidas, ya que, presenta características insecticidas, fungicidas y nematicidas, las cuales representan una alternativa económica y sustentable, debido a que su manera de producción deja de lado el uso de productos de elevados costos. Desarrollar nuevos trabajos de investigación y optar por la aplicación de productos procedentes de A. oryzae a nivel invernadero, es necesario para comprobar su adaptabilidad en condiciones externas al laboratorio, y verificar si los beneficios de A. oryzae se mantienen o disminuyen de tal manera que puedan llegar a ser empleados en campo. Finalmente, el estudio de A. oryzae y sus productos derivados es poco estudiado en México, por lo cual, lo convierte en un tema debatible para ser explotado para el beneficio del desarrollo del campo en México, ya que abre una nueva vertiente de estudio, en el desarrollo de productos benéficos para cultivos, y para el control de agentes fitopatógenos.











 texto en
texto en