Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Salud mental
versión impresa ISSN 0185-3325
Salud Ment vol.34 no.2 México mar./abr. 2011
Actualización por temas
Alteraciones del ciclo circadiano en las enfermedades psiquiátricas: papel sincronizador de la melatonina en el ciclo sueño–vigilia y la polaridad neuronal
Circadian cycle alterations in psychiatric diseases: melatonin role as a synchronizer of sleep–awake cycle and the neuronal polarity
Graciela Jiménez–Rubio,1 Héctor Solís–Chagoyán,1 Aline Domínguez–Alonso,1 Gloria Benítez–King1
1 Departamento de Neurofarmacología. Subdirección de Investigaciones Clínicas. Instituto Nacional de Psiquiatría Ramón de la Fuente Muñíz.
Correspondencia:
Dra. Gloria Benítez–King.
Departamento de Neurofarmacología.
Instituto Nacional de Psiquiatría Ramón de la Fuente Muñíz.
Calzada México–Xochimilco 101, San Lorenzo Huipulco,
Tlalpan, 14370, México, DF.
Tel: (55)41605097, (55)41605099, Fax: (55) 55133722.
E–Mail: bekin@imp.edu.mx; graylin@imp.edu.mx
Recibido: 27 de octubre de 2010.
Aceptado: 6 de diciembre de 2010.
Abstract
Circadian rhythms are oscillations of physiological functions. The period of their oscillation is about 24 h, and can be synchronized by environmental periodic signals as night–day cycle.
The endogenous periodical changes depend on various structural elements of the circadian system which consists of the effectors, the secondary oscillators, the synchronizers and the circadian pacemaker.
In mammalian species, the physiological function better understood respect their oscillation pattern are the synthesis and release of several hormones (i.e. cortisol and melatonin), the body temperature, the sleep–awake cycle, the locomotive activity, cell proliferation, neuronal activity among other rhythms.
The Suprachiasmatic nucleus is the main circadian pacemarker in mammals; its oscillation keeps the circadian system synchronized particularly with respect to the environment photo period. When light reaches the pigment melanopsin in ganglionar neurons in the retina, the photoperiod signal is sent to Suprachiasmatic nucleus, and its postsinaptic neurons distributes the temporal signal to pheripheral oscillators by nervous or humoral pathways.
Among the oscillators, the pineal gland is a peripheral one modulated by Suprachiasmatic nucleus. At night, the indolamine melatonin is synthesized and released from pinealocytes, and reaches other peripheral oscillators. Melatonin interacts with membrane receptors on Suprachiasmatic nucleus pacemarker neurons, reinforcing the signal of the photoperiod.
In mammals, exogenous melatonin synchronizes several circadian rhythms including locomotive activity and melatonin release. When this indolamine is applied directly into the Suprachiasmatic nucleus, it produces a phase advance of the endogenous melatonin peak and increases the amplitude of the oscillation.
In humans, melatonin effect on the circadian system is evident because it changes the circadian rhythms phase in subjects with advanced sleep–phase syndrome, night workers or blind people. Also it reduces jet lag symptoms enhancing sleep quality and reseting the circadian system to local time.
Melatonin effects on circadian rhythms indicate their role as a chronobiotic, since decreased daily melatonin levels that occur with age and in neuropsychiatric disorders are associated with disturbances in the sleep–awake cycle.
In particular, it has been described that Alzheimer's disease patients have disturbed sleep–awake cycle and have decreased serum melatonin levels. Sleep disorders in Alzheimer's disease patients decrease when they are treated with melatonin. Moreover, sleep disturbances have been observed in bipolar disorder patients and often precede relapses of insomnia–associated mania and hypersomnia–associated depression. These disturbances are linked to delayed– and advanced– phases of circadian rhythms or arrhythmia; therefore, it has been suggested that bipolar disorder patients could be treated with light and dark therapy. In depressed patients, the levels of melatonin are low throughout the 24 hour period and have a delayed onset of the indolamine concentration and showed an advance of its peak.
Schizophrenic patients have decreased levels in the plasmatic melatonin in both phases of the light–dark cycle. Melatonin administration to these patients increases their sleep efficiency.
In addition, melatonin acts as a neuroprotector because of its potent antioxidant action and through its cytoskeletal modulation properties. In neurodegenerative animal models, its protector effect has been observed using okadaic acid. This neurotoxin is employed for reproducing cytoskeletal damage in neurons and increased oxidative stress levels, which are molecular events similar to those that occur in Alzheimer's disease.
In N1E–115 cell cultures incubated with okadaic acid, the administration of melatonin diminishes hyperphosphorylated tau and oxidative stress levels, and prevents the neurocytoskeletal damage caused by the neurotoxin.
Although it is known that melatonin plays a key role in the circadian rhythms entrainment, little is known about its synchronizing effects at molecular and structural level. In algae, it has been observed a link between morphological changes and the light–dark cycle and it is known that shape is determinated by the cytoskeletal structure.
In particular, the alga Euglena gracilis changes its shape two times per day under the effect of a daily light–dark cycle. This alga has a long shape when there is a higher photosynthetic capacity at the half period of the day; on the contrary, it showed a rounded shape at the end of 24 h cycle.
Also, the influence of the cell shape changes on the photosynthetic reactions was investigated by altering them with drugs that disrupt the cytoskeletal structure as cytochalasin B and colchicine. Both inhibitors blocked the rhythmic shape changes and the photo–synthetic rhythm.
Moreover, there are some reports about cytoskeletal changes in plants targeted by circadian rhythms. Guarda cells of Vicia faba L. showed a diurnal cycle on the alpha and beta tubulin levels.
In addition, it has been proposed that melatonin synchronizes different body rhythms through cytoskeletal rearrangements. In culture cells, nanomolar melatonin concentrations cause an increase in both the polimerization rate and microtubule formation through calmodulin antagonism.
A cyclic pattern produced by melatonin in the actin microfilament organization has been demonstrated in canine kidney cells. Cyclic incubation of MDCK cells with nanomolar concentrations of melatonin, resembling the cyclic pattern of secretion and release to plasma produces a microfilament reorganization and the formation of domes.
Studies in animals are controvertial regarding if the amount of microtubules in different tissues varies cyclically. In rats and baboons, melatonin administration or exposure of rats to darkness induced an increased number of microtubules in the pineal gland. However, in the hypothalamus, the exposure of rats to light resulted in an increase in the microtubular protein content. Similarly, (X–tubulin mRNA was augmented during the light phase in the hypothalamus, hippocampus and cortex. By contrast, in rats maintained in constant darkness, a decreased level in the tubulin content was observed in the visual cortex.
Additional information on cycle variations observed in cytoskeletal molecules indicated that beta actin mRNA levels are lower during the day in the hippocampus and cortex. But no change was observed in actin protein levels in the cerebral cortex. However, increased levels of actin and its mRNA were observed in the hypothalamus. Exogenous melatonin administration at onset of night decreased the amount of actin in the hypothalamus, while the actin mRNA levels decreased when the administration was realized in the morning.
In this review we will describe the synchronizer role of melatonin in the sleep–awake cycle and in the organization of cytoskeletal proteins and their mRNAs. Also, we will describe alterations in the melatonin secretion rhythm associated with a neuronal cytoskeleton disorganization in the neuropsychiatric diseases such as Alzheimer, depression, bipolar disorder and schizophrenia.
Key words: Melatonin, neuropsychiatric diseases, circadian rhythms, microtubules, microfilaments.
Resumen
Los ritmos circadianos son patrones de oscilación con un periodo cercano a 24h que se observan en los procesos fisiológicos. En los mamíferos se han descrito funciones biológicas con regulación circádica tal como el ciclo sueño–vigilia.
La administración de la melatonina, una indolamina secretada por la glándula pineal, sincroniza los ritmos circadianos. En los humanos, este efecto se ha estudiado en sujetos con síndrome de <<fase de retraso de sueño>>, personas que sufren el síndrome de jet lag, en los trabajadores nocturnos y en los invidentes. La melatonina puede reducir los síntomas de jet lag y mejorar la calidad del sueño, además de acelerar la sincronización de la fase circadiana al tiempo local.
Los niveles de la melatonina disminuyen con la edad y en las enfermedades neurodegenerativas y psiquiátricas. Los pacientes con enfermedad de Alzheimer muestran alteraciones del sueño como cambios en su ritmicidad y en su estructura. La administración de la melatonina a estos pacientes provoca mejoría en los síntomas de agitación que se presentan al atardecer. Los pacientes con trastorno bipolar manifiestan insomnio asociado con la fase de manía e hipersomnia durante la fase de depresión. Estas alteraciones en el sueño se relacionan con un desfasamiento del ritmo circadiano y/o arritmia. En pacientes con depresión y con esquizofrenia existe una disminución en los niveles plasmáticos de la melatonina en ambas fases del ciclo luz–oscuridad. La administración de melatonina incrementa la eficiencia del sueño en ellos.
Además de las alteraciones en el sueño y en el ritmo de secreción de la melatonina observado en pacientes neuropsiquiátricos, existen cambios estructurales y funcionales en regiones específicas cerebrales que son producidas por la pérdida neuronal o por alteraciones de la polaridad y de la morfología neuronal, que son funciones reguladas por el citoesqueleto. A pesar de la información que existe sobre el papel de la melatonina como un sincronizador de los ritmos biológicos, no se conoce si ésta sincroniza la citoarquitectura neuronal.
Está descrito que en organismos unicelulares, en plantas y en especies de vertebrados, existen cambios rítmicos en la organización del citoesqueleto asociados con el fotoperiodo. En células en cultivo la melatonina produce un aumento en la formación de los microtúbulos. En roedores, la administración de esta indolamina y la exposición a la oscuridad constante produce un incremento en el contenido de los microtúbulos en la glándula pineal. Sin embargo la exposición constante a la luz, que inhibe la síntesis de la melatonina, produce un incremento en el contenido de los microtúbulos hipotalámicos, en tanto que el RNAm de α–tubulina en el hipotálamo, el hipocampo y la corteza cerebral, se incrementa durante el día.
La regulación cíclica de la organización de los microfilament os de actina inducida por la melatonina se ha demostrado en células de riñón en cultivo. La melatonina provoca un incremento en la reorganización de actina asociado con un aumento en la formación de domos los cuales son un índice del transporte bidireccional de agua en las células epiteliales. En tanto que, en estudios en roedores, se ha observado que los niveles de RNAm de actina se incrementan durante la noche en el hipocampo y en la corteza. Sin embargo, otros estudios señalan que la melatonina tiene un efecto inhibitorio en la síntesis de actina en el hipotálamo.
En esta revisión se describe el papel sincronizador de la melatonina en el ciclo sueño–vigilia y en la estructura del citoesqueleto neuronal. Asimismo, se menciona cómo en las enfermedades neuropsiquiátricas el ritmo de secreción de la melatonina se encuentra alterado, lo cual se puede asociar con una desorganización del citoesqueleto neuronal.
Palabras clave: Melatonina, enfermedades neuropsiquiátricas, ritmos circadianos, microtúbulos, microfilamentos.
INTRODUCCIÓN
Las enfermedades neuropsiquiátricas tales como la depresión mayor (DP), el trastorno bipolar (TB), la esquizofrenia crónica (EZ), la ansiedad, la enfermedad de Alzheimer (AZ) y la enfermedad de Parkinson, se caracterizan por mostrar un curso progresivo crónico degenerativo. Son enfermedades incapacitantes y causan alteraciones conductuales y en las relaciones interpersonales. Sus síntomas se han relacionado con perturbaciones en los ritmos circadianos tales como el ciclo sueño–vigilia y el ciclo de secreción de la melatonina (5–metoxi–N–acetiltriptamina; MEL), entre otros.1–3
Las perturbaciones de los ritmos biológicos en las enfermedades neurodegenerativas han propiciado la búsqueda de tratamientos alternativos y coadyuvantes para sincronizar estos ciclos y mejorar la calidad de vida de los pacientes y sus familiares.4 En esta revisión se describen los conceptos básicos que definen a los ritmos circadianos así como las evidencias que apoyan que la MEL es un cronobiótico, un neuroprotector, un sincronizador del citoesqueleto (CSK) y su uso puede ser relevante en el tratamiento de las enfermedades psiquiátricas.
LOS RITMOS BIOLÓGICOS: CONCEPTOS BÁSICOS
Los ritmos circadianos (del latín circa: cerca y diem: día) son patrones de oscilación observados en muchos procesos fisiológicos cuya característica principal es que presentan un período cercano a las 24h y se piensa que surgieron de la adaptación de los seres vivos a la variación periódica de su ambiente.5
La expresión de los ritmos circadianos depende de un conjunto de elementos estructurales que constituyen el sistema circadiano. Este sistema mantiene organizado temporalmente al organismo y le permite sincronizarse con una oscilación ambiental o Zeitgeber. Uno de los Zeitgeber más potentes es el ciclo del día y de la noche.6
En los mamíferos, las funciones biológicas expresadas circadicamente incluyen: el ciclo sueño–vigilia, la síntesis y la liberación hormonal (como el cortisol y la MEL) y la regulación de la temperatura corporal, entre otras.7 Las oscilaciones de estas funciones son generadas y organizadas por una estructura marcapaso o reloj circadiano: el núcleo supraquiasmático (NSQ) localizado en el hipotálamo. El NSQ mantiene sincronizado al organismo con su ambiente, en particular cuando se detecta como Zeitgeber el ciclo del día y la noche.8 Para que este marcapaso sincronice al sistema circadiano con el día y la noche, la luz que es percibida por las células ganglionares fotosensibles de la retina, se transforma en impulsos nerviosos que llegan al NSQ. Éste, a su vez, transmite la información de la duración del día a los osciladores secundarios, en particular a la glándula pineal9 en donde se sintetiza la MEL durante la noche, por lo que se le ha llamado <<la hormona de la oscuridad>>.10 La recepción de la MEL por receptores localizados en el NSQ o en los osciladores secundarios, retroalimenta la información del fotoperiodo enviada desde el NSQ y de esta forma se refuerza la sincronización del sistema circadiano.
LA MELATONINA COMO UN CRONOBIÓTICO: IMPORTANCIA PARA LA PSIQUIATRÍA
Un efecto cronobiótico significa que un compuesto químico administrado de manera exógena es capaz de influir en la sincronización del reloj o marcapaso circadiano.11 Este efecto sobre el reloj se puede observar indirectamente midiendo los ritmos que son controlados por el marcapaso circadiano. Por ejemplo, en roedores mantenidos en ausencia de un Zeitgeber, la administración diaria de MEL sincroniza el ritmo endógeno de secreción de la indolamina misma y el ritmo circadiano de la actividad locomotora.12
En los seres humanos, el efecto de la MEL como cronobiótico se demostró en el trastorno del jet lag. Éste se produce por la desincronización del reloj circadiano respecto del fotoperiodo cuando se realiza un viaje transmeridiano, lo que repercute principalmente en el ritmo sueño–vigilia. Los síntomas característicos del jet lag son la presencia de insomnio durante la noche y la excesiva somnolencia durante la vigilia, además de malestar gastrointestinal, cefaleas y mareos intermitentes.13 Estos síntomas se presentan durante los días que tarda el reloj en resincronizarse con el nuevo tiempo local. La administración de la MEL acelera la resincronización del reloj circadiano, reduciendo la intensidad y el tiempo en el que se presentan los síntomas del jet lag.14,15
El efecto de la MEL como cronobiótico se ha demostrado también en las personas de la tercera edad y en los pacientes con enfermedades neuropsiquiátricas. En estas personas el nivel circulante de la MEL está disminuido lo que genera alteraciones en el reloj biológico,2 que se reflejan en particular en el ritmo sueño–vigilia.
En los pacientes con la enfermedad de AZ, TB, DP y EZ crónica, los niveles circulantes de la MEL también están disminuidos16–18 y se han descrito alteraciones en distintos ritmos circadianos como en el de la temperatura corporal, el estado de ánimo y en el ritmo sueño–vigilia.2,19–22 Se ha observado que la administración cíclica de la MEL a estos pacientes incrementa la eficiencia del sueño mejorando las alteraciones en el ciclo sueño–vigilia.23–26
ALTERACIONES ESTRUCTURALES DEL SISTEMA NERVIOSO CENTRAL EN ENFERMEDADES NEUROPSIQUIÁTRICAS: DEFICIENCIAS EN LA ORGANIZACIÓN DEL CITOESQUELETO
En las enfermedades psiquiátricas, además de las alteraciones en el ritmo de secreción de la MEL y en el del sueño–vigilia, se han descrito modificaciones estructurales y funcionales en regiones específicas del Sistema Nervioso Central (SNC). Estas alteraciones se han asociado con deficiencias en la organización del CSK.27
En estudios de imágenes generadas por resonancia magnética del SNC de pacientes con DP, TB, EZ, se ha encontrado una disminución en el volumen de estructuras como la corteza (Cx) prefrontal, la Cx temporal, la Cx orbitofrontal, el cerebelo, los ganglios basales y el sistema límbico.28,29 Estas alteraciones anatómicas se han establecido a partir de estudios histológicos. En éstos se demostró una disminución del tamaño de las neuronas de estas estructuras, en particular una disminución en la longitud de las dendritas y en el número de las espinas dendríticas.30–33 Se ha sugerido que las alteraciones estructurales del SNC descritas en los pacientes con EZ, TB, DP y AZ se producen por la alteración en la polaridad y la morfología neuronal que es establecida por el CSK.34 Por ejemplo, las alteraciones en el CSK producidas por una fosforilación excesiva de la proteína tau que se presenta en la enfermedad de AZ y en otras demencias conocidas como taupatías, origina la desorganización del CSK con la consecuente pérdida de la polaridad morfofuncional. Además la proteína tau que se asocia al CSK se fosforila en exceso y como consecuencia se ensambla en filamentos helicoidales apareados.35 La tau hiperfosforilada causa la inhibición y la ruptura de los microtúbulos (MT),36 lo cual resulta en la inhibición del flujo axoplásmico y causa la pérdida de las sinápsis y la cognición.37 Por otro lado, en la EZ se ha observado un decremento de MAP2 (por sus siglas en inglés Microtubule associated proteins MAPs) en la Cx prefrontal, así como un decremento de MAP2 y MAP1B en el subículum y la Cx entorrinal de la formación hipocampal.38 Estas proteínas también se asocian a los microtúbulos y al igual que la tau participan en la estabilización de su estructura.
LA MELATONINA MODULA LA ORGANIZACIÓN DEL CITOESQUELETO DE LAS NEURONAS
La MEL, además de participar en la sincronización del sistema circadiano y de funcionar como un cronobiótico, es un modulador de la organización del CSK neuronal; su aplicación aumenta la formación y alargamiento de nuevas neuritas (para una revisión completa ver: Benítez–King).39 La MEL también actúa como un neuroprotector porque su estructura le permite atrapar radicales libres,40 evitando la desestabilización del CSK y la reducción del tamaño de las neuritas.
El efecto modulador de la MEL sobre el CSK fue demostrado en células en cultivo de origen neuronal. La MEL induce rearreglos de los microfilamentos (MF) durante la neuritogénesis temprana ya que incrementa el número de células con conos de crecimiento, filipodios y principalmente de neuritas largas.41
Los efectos neuroprotectores de la MEL se han observado en modelos de neurodegeneración in vitro. El ácido ocadáico (AO) es una neurotoxina que produce alteraciones en el CSK e incrementa el estrés oxidativo de modo semejante a lo que ocurre en pacientes con taupatías.42 En células N1E–115, la administración de MEL antes de la adición del AO previene la retracción del CSK alrededor del núcleo, manteniéndolo en el citoplasma y en las neuritas. Además, la MEL inhibe el incremento en la lipoperoxidación inducida por el AO43 y previene la hiperfosforilación de la proteína tau causada por este compuesto.44 Asimismo, la MEL restaura la extensión de los MT, los conos de crecimiento y las microespigas, en células dañadas por las especies reactivas de oxígeno generadas con el peróxido de hidrógeno.45
LA MELATONINA COMO UN SINCRONIZADOR DE LA ORGANIZACIÓN DEL CITOESQUELETO
Existen evidencias que indican que la organización del CSK en células neuronales y no neuronales varía de forma circádica y de que la MEL podría participar en la sincronización de este ritmo.
Los experimentos que se han publicado acerca de los cambios circadianos en la estructura del CSK se han realizado principalmente en plantas,46 en algas47 y en los mamíferos se ha demostrado en un modelo epitelial en cultivo que se originó de un riñón de perro (células MDCK). La administración cíclica de MEL en los cultivos de células MDCK induce el rearreglo rítmico de los MF48 asociado con un incremento en la formación de domos y en el transporte vectorial de agua.
En modelos animales también se ha demostrado que el arreglo del CSK neuronal tiene una variación circadiana y que la MEL participa en la sincronización de este ritmo. En el hipocampo de ratas mantenidas en ciclos de luz–oscuridad (LO) y que tienen un patrón circádico de secreción de MEL, se observó un incremento de los niveles de actina (ACT) organizada en MF durante la noche, mientras que la tubulina (TUB) organizada en MT no se modificó. Recientemente, con el objeto de dilucidar si las variaciones observadas en la organización de los MT y los MF de ACT de hipocampo de rata estaban relacionadas con los niveles de MEL plasmática circulante, se midió la cantidad de MT y MF, en ratas mantenidas en LO a las que les fue extirpada la glándula pineal para abolir los niveles de MEL plasmática, sin perder la actividad del NSQ ni la influencia del Zeitgeber.
En las ratas pinealectomizadas, los MF y los MT se incrementaron dos semanas después de la pinealectomía, en tanto que 12 semanas después se observó un decremento en la cantidad de los MF y los MT. La ausencia crónica de la MEL no tan sólo afectó la variación diaria de la organización del CSK, sino que originó la disminución de la TUB y la ACT organizada en MT y MF por debajo de los niveles mínimos observados durante la variación diaria.
Con el fin de determinar si la administración de la MEL restablecía el patrón de organización de los MT y los MF en el hipocampo, se inyectó esta indolamina (1 mg/kg i.p.) durante una semana a ratas pinealectomizadas mantenidas en LO. Después de 6 h de la última administración de MEL, se observó un incremento tanto de la ACT como de la TUB organizada en MF y MT. En contraste, en las ratas pinealectomizadas que fueron tratadas con el vehículo, los MF y los MT se mantuvieron disminuidos.
El patrón circadiano observado en la variación de la ACT y la TUB depende del tejido que sea estudiado. Por ejemplo, la cantidad de ACT se incrementa en el hipocampo durante la noche así como con la administración de la MEL, mientras que en el hipotálamo la ACT aumenta durante el día49 y la aplicación de MEL la disminuye.50
Además de la variación cíclica de la ACT y la TUB, también se han observado cambios en los niveles de sus RNAm relacionados con el ciclo LO. En el hipotálamo, el hipocampo y la Cx cerebral de ratas, el RNAm de TUB se incrementó durante la mañana,51 periodo en el que la concentración de MEL circulante es menor (figura 1). El patrón de variación del RNAm de ACT también depende del tejido estudiado. Por ejemplo, sus niveles se incrementan en el hipocampo y en la Cx durante la noche,52 aunque en el hipotálamo se incrementa en el día49 en tanto que la aplicación de MEL provoca su disminución (figura 2).50
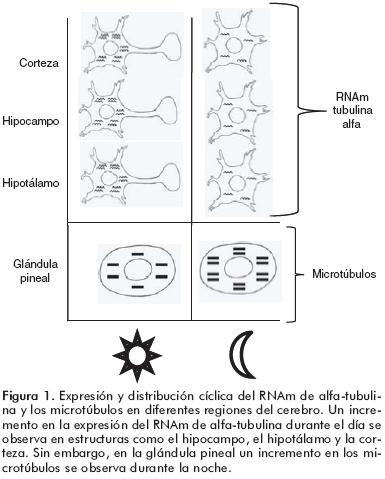
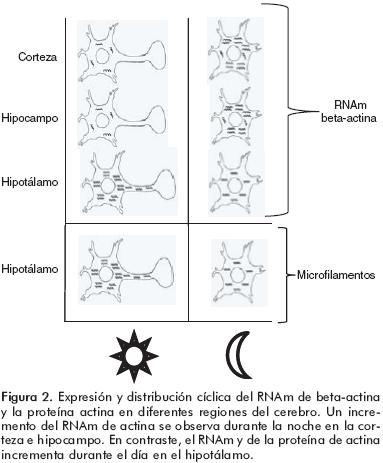
Las implicaciones de las variaciones cíclicas de la expresión de proteínas del neurocitoesqueleto son cruciales para la fisiología cerebral. El vínculo existente entre la oscilación circadiana de los niveles de MEL con el ciclo de LO, se refleja en los cambios observados en los niveles de RNAm y de proteínas tanto de ACT como de TUB. Sin embargo, las variaciones tienen un comportamiento distinto en diferentes estructuras del cerebro lo que podría implicar que la morfofuncionalidad de las células presentes es totalmente distinta.
Las neuronas, que son células asimétricas y polarizadas, necesitan poseer un dinamismo estructural que permita la formación de axones y dendritas para mantener la comunicación sináptica entre ellas. La evidencia mencionada apoya que existe un rearreglo constante del CSK, donde los niveles elevados de ACT durante la noche por acción de la MEL podrían generar o reforzar los contactos sinápticos, en tanto que la cantidad elevada de TUB durante el día podría referirse a una estabilización de estas conexiones sinápticas mediante la formación de MT. Más adelante, esta estabilidad de MT y MF también podría reforzarse por proteínas asociadas al CSK que intervendrían en la plasticidad sináptica para generar una modificación de la circuiteria cerebral.
CONCLUSIONES
La evidencia acumulada a la fecha indica que la MEL actúa como un cronobiótico, un neuroprotector y un modulador del CSK neuronal. Además, la evidencia presentada aquí sugiere que la disminución de los niveles de la hormona podría estar relacionada con alteraciones del CSK neuronal que se observan en las enfermedades neuropsiquiátricas. Asimismo, se ha descrito que los transtornos del sueño y los cambios en el estado de ánimo que se presentan en estas enfermedades podrían estar relacionados con una disfunción del reloj biológico que interfiere con los ritmos circadianos de la MEL. Este concepto es sustentado por experimentos en los que se demostró que la privación de sueño inhibe las concentraciones de la MEL y la cantidad de espinas dendríticas en el hipocampo. Estos datos sugieren que la MEL puede ser utilizada como un coadyuvante en el tratamiento de las enfermedades neuropsiquiátricas ya que podría promover la formación de los contactos sinápticos además de sincronizar el ciclo sueño–vigilia en estos pacientes.
REFERENCIAS
1. Lamont EW, Legault–Coutu D, Cermakian N, Boivin DB. The role of circadian clock genes in mental disorders. Dialogues Clin Neurosci 2007;9:333–342. [ Links ]
2. Cardinali DP, Furio AM, Reyes MP. Clinical perspectives for the use of melatonin as a chronobiotic and cytoprotective agent. Ann N Y Acad Sci. 2005;1057:327– 336. [ Links ]
3. Whitehead DL, Davies AD, Playfer JR, Turnbull CJ. Circadian rest–activity rhythm is altered in Parkinson's disease patients with hallucinations. Mov Disord 2008;23:1137–45. [ Links ]
4. Mahé V, Chevalier JF. Role of biological clock in human pathology. Presse Med 1995;24:1041–1046. [ Links ]
5. Pittendrigh CS. Circadian systems: General perspective. En: Aschoff J (ed). Handbook of behavioral neurobiology. Vol. 4. New York: Plenum Press USA; 1981. [ Links ]
6. Pittendrigh CS, Daan, S. A functional analysis of circadian pacemakers in nocturnal rodents IV, Entrainment: Pacemakers and clocks. J Comp Physiol 1976;106:291–331. [ Links ]
7. Alila–Johansson A. Daily and Seasonal rhythms of melatonin, cortisol, leptin, free acids and glycerol in goats. Helsinki: Department of Basic Veterinary Sciences, Faculty of Veterinary; 2008; p. 88. [ Links ]
8. Rusak B, Zucker I. Neural regulation of circadian rhythms. Physiol Rev 1979;59:449–526. [ Links ]
9. Kappers JA. Short history of pineal discovery and research. En: Kappers JE, Pévet P (eds). The pineal gland of vertebrates including man. Amsterdam: Elsevier; 1979. [ Links ]
10. Reiter RJ. Pineal melatonin: cell biology of its synthesis and of its physiological interactions. Endocr Rev 1991;12:151–180. [ Links ]
11. Pévet P, Bothorel B, Slotten H, Saboureau M. The chronobiotic properties of melatonin. Cell Tissue Res 2002;309:183–191. [ Links ]
12. Redman J, Armstrong S, Ng KT. Free–running activity rhythms in the rat: entrainment by melatonin. Science 1983;219:1089–1091. [ Links ]
13. American Academy of Sleep Medicine. The international classification of sleep disorders. Segunda edición. Diagnostic and Coding Manual. Westchester, Illinois (US): American Academy of Sleep Medicine; 2005. [ Links ]
14. Petrie K, Conaglen JV, Thompson L, Chamberlain K. Effect of melatonin on jet lag after long haul flights. BMJ 1989;298:705–707. [ Links ]
15. Petrie K, Dawson AG, Thompson L, Brook R. A double–blind trial of melatonin as a treatment for jet lag in international cabin crew. Biol Psychiatry 1993;33:526–530. [ Links ]
16. Nurnberger JI, Adkins S, Lahiri DK, Mayeda A et al. Melatonin suppression by light in euthymic bipolar and unipolar patients. Arch Gen Psychiatry 2000;57:572–579. [ Links ]
17. Nair NP, Hariharasubramanian N, Pilapil C. Circadian rhythm of plasma melatonin in endogenous depression. Prog Neuropsychopharmacol Biol Psychiatry 1984;8:715–718. [ Links ]
18. Robinson S, Rosca P, Durst R, Shai U et al. Serum melatonin levels in schizophrenic and schizoaffective hospitalized patients. Acta Psychiatr Scand 1991;84:221–224. [ Links ]
19. Barbini B, Bertelli S, Colombo C, Smeraldi E. Sleep loss, a possible factor in augmenting manic episode. Psychiatry Res 1996;65:121–125. [ Links ]
20. Detre T, Himmelhoch J, Swartzburg M, Anderson CM et al. Hypersomnia and manic–depressive disease. Am J Psychiatry 1972;128:1303–1305. [ Links ]
21. Tsujimoto T, Yamada N, Shimoda K, Hanada K et al. Circadian rhythms in depression. Part I: Monitoring of the circadian body temperature rhythm. J Affect Disord 1990;18:193–197. [ Links ]
22. Tandon R, Shipley JE, Taylor S, Greden JF et al. Electroencephalographic sleep abnormalities in schizophrenia: relationship to positive/negative symptoms and prior neuroleptic treatment. Arch Gen Psychiatry 1992;49:185–194. [ Links ]
23. Brusco LI, Márquez M, Cardinali DP. Monozygotic twins with Alzheimer's disease treated with melatonin: Case report. J Pineal Res 1998;25:260–263. [ Links ]
24. Robertson JM, Tanguay PE. Case study: the use of melatonin in a boy with refractory bipolar disorder. J Am Acad Child Adolesc Psychiatry 1997;36:822–825. [ Links ]
25. Dolberg OT, Hirschmann S, Grunhaus L. Melatonin for the treatment of sleep disturbances in major depressive disorder. Am J Psychiatry 1998;155:1119–1121. [ Links ]
26. Shamir E, Laudon M, Barak Y, Anis Y et al. Melatonin improves sleep quality of patients with chronic schizophrenia. J Clin Psychiatry 2000;61:373–377. [ Links ]
27. Benítez–King G, Ramírez–Rodríguez G, Ortíz L, Meza I. The neuronal cytoskeleton as a potential therapeutical target in neurodegenerative diseases and schizophrenia. Curr Drug Targets CNS Neurol Disord 2004;3(6):515–533. [ Links ]
28. Stockmeier AC, Mahajan JG, Konick CL, Overholser CJ et al. Cellular changes in the postmortem hippocampus in major depression. Biol Psychiatry 2004;56:640–650. [ Links ]
29. Soares JC, Mann JJ. The anatomy of mood disorders – review of structural neuroimaging studies. Biol Psychiatry 1997;41:86–106. [ Links ]
30. Chana G, Landau S, Beasley C, Everall IP et al. Two–dimensional assessment of cytoarchitecture in the anterior cingulate cortex in major depressive disorder, bipolar disorder, and schizophrenia: evidence for decreased neuronal somal size and increased neuronal density. Biol Psychiatry 2003;53:1086–1098. [ Links ]
31. Rosoklija G, Toomayan G, Ellis SP, Keilp J et al. Structural abnormalities of subicular dendrites in subjects with schizophrenia and mood disorders. Arch Gen Psychiatry 2000;57:349–356. [ Links ]
32. Senitz D, Winkelmann E. Morphology of the orbitofrontal cortex in persons schizophrenic psychotics. A Golgi and electron microscopy. Psychiatr Neurol Med Psychol 1981;33:1–9. [ Links ]
33. Broadbelt K, Byne W, Jones LB. Evidence for a decrease in basilar dendrites of pyramidal cells in schizophrenic medial prefrontal cortex. Schizophr Res 2002;58:75–81. [ Links ]
34. Benítez–King G, Domínguez–Alonso A, Ramírez–Rodríguez G. Neurocytoskeletal protective effect of melatonin: Importance for morpho–functional neuronal polarization. Open Neuroendocrinol J 2010;3:105–111. [ Links ]
35. Eidenmuller J, Fath T, Hellwing A, Reed J et al. Structural and functional implications of tau hyperphophorylation: information from phosphorylation–mimicking mutated tau proteins. Biochemistry 2000;39: 13166–13175. [ Links ]
36. Alonso AC, Zaidi T, Grundke–Iqbal I, Iqbal K. Role of abnormally phosphorylated tau in the breakdown of microtubules in Alzheimer disease. Proc Natl Acad Sci USA 1994;91:5562–5566. [ Links ]
37. Iqbal K, Grundke–Iqbal I, Zaidi T, Merz PA et al. Defective brain micro–tubule assembly in Alzheimer's disease. Lancet 1986;2:421–426. [ Links ]
38. Arnold SE, Lee VM, Gur RE, Trojanowski JQ. Abnormal expression of two microtubule–associated proteins (MAP2 and MAP5) in specific subfields of the hippocampal formation in schizophrenia. Proc Natl Acad Sci USA 1991;88:10850–1854. [ Links ]
39. Benítez–King G. Melatonin as a cytoskeletal modulator: implications for cell physiology and disease. J Pineal Res 2006;40(1):1–9. [ Links ]
40. Reiter RJ, Tan DX, Mayo JC, Sainz RM et al. Melatonin as an antioxidant: biochemical mechanisms and pathophysiological implications in humans. Acta Biochim Pol 2003;50(4):1129–1146. [ Links ]
41. Bellon A, Ortíz–López L, Ramírez–Rodríguez G, Antón–Tay F et al. Melatonin induces neuritogenesis at early stages in N1E–115 cells through actin rearrangements via activation of protein kinase C and Rho–associated kinase. J Pineal Res 2007;42:214–221. [ Links ]
42. Arendt T, Holzer M, Bräckner MK, Janke C et al. The use of okadaic acid in vivo and the induction of molecular changes typical for Alzheimer's disease. Neuroscience 1998;85:1337–1340. [ Links ]
43. Benítez–King G, Túnez I, Bellon A, Ortíz GG et al. Melatonin prevents cytoskeletal alterations and oxidative stress induced by okadaic acid in N1E–115 cells. Exp Neurol 2003;182:151–159. [ Links ]
44. Jiménez–Rubio G, Benítez–King G, Ortiz–López L. Melatonin elicits neuritogenesis and reverses Tau hyperphosphorylation in NIE–115 neuroblastoma cells treated with okadaic Acid. En: Fernández AJ (ed). Focus on neuroblastoma research. Hauppauge, New York: Nova Science Publisher; 2007. [ Links ]
45. Benítez–King G, Ortíz–López L, Jiménez–Rubio G. Melatonin precludes cytoskeletal collapse caused by hydrogen peroxide: participation of protein kinase C. Therapy 2005;2:762–778. [ Links ]
46. Fukuda M, Hasezawa S, Nakajima N, Kondo N. Changes in tubulin protein expression in guard cells of Vicia faba L. accompanied with dynamic organization of microtubules during the diurnal cycle. Plant Cell Physiol 2000;41:600–607. [ Links ]
47. Lonergan TA. Regulation of Cell Shape in Euglena gracilis: I. Involvement of the biological clock, respiration, photosynthesis, and cytoskeleton. Plant Physiol 1983;71:719–730. [ Links ]
48. Ramírez–Rodríguez G, Meza I, Hernández ME, Castillo A et al. Melatonin induced cyclic modulation of vectorial water transport in kidney–derived MDCK cells. Kidney International 2003;63:1356–1364. [ Links ]
49. Iovanna J, Dusetti N, Calvo E, Cardinali DP. Diurnal changes in actin mRNA levels and incorporation of 35S–methionine into actin in the rat hypothalamus. Cell Mol Neurobiol 1990;10:207–216. [ Links ]
50. Iovanna J, Dusetti N, Cadenas B, Cardinali DP. Time–dependent effect of melatonin on actin mRNA levels and incorporation of 35S–methionine into actin and proteins by the rat hypothalamus. J Pineal Res 1990;9:51–63. [ Links ]
51. Bredow S, Guha–Thakurta N, Taishi P, Obál F Jr et al. Diurnal variations of tumor necrosis factor alpha mRNA and alpha–tubulin mRNA in rat brain. Neuroimmunomodulation 1997;4:84–90. [ Links ]
52. Taishi P, Bredow S, Guha–Thakurta N, Obál F et al. Diurnal mRNA variations of interleukin 1–beta mRNA and beta–actin mRNA in rat brain. J Neuroinmunol 1997;75:69–79. [ Links ]














