ANTECEDENTES
En todo el mundo la enfermedad renal crónica es la causa número 12 de mortalidad y la causa número 17 de discapacidad, razón por la que se considera un problema de salud pública en vista del número de pacientes afectados y el costo del tratamiento de sus diversas complicaciones.1,2 Estas complicaciones incluyen: complicaciones cardiovasculares, hipertensión arterial, enfermedad oseometabólica, acidosis metabólica y alteraciones hidroelectrolíticas, incluida la hipercalemia; de ahí que el tratamiento de la enfermedad renal crónica sea complejo y costoso por su continua evolución.
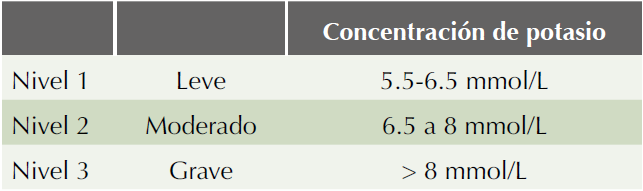
La hipercalemia es uno de los trastornos electrolíticos más comunes e importantes en la práctica clínica en pacientes que padecen enfermedad renal crónica con y sin terapia sustitutiva, por las alteraciones electrofisiológicas y por su elevada morbilidad y mortalidad;3,4 la hipercalemia se define como el incremento en la concentración sérica de sodio mayor al normal, hay diversos puntos de corte que van de 5, 5.5 a más de 6 mmol/L, se clasifica en tres niveles (Cuadro 1).
Epidemiología
La incidencia y prevalencia de la hipercalemia en la población general es de 2 a 3%,5-7 con incremento de la frecuencia en pacientes con enfermedad renal crónica a 40-50%, especialmente en sujetos con diabetes mellitus, estadios avanzados de la enfermedad renal crónica, receptores de trasplante renal y pacientes tratados con inhibidores del sistema renina angiotensina aldosterona (ISRAA).4,5,8-11 En otras series, la incidencia varía de 2 a 42% a medida que disminuye la tasa de filtrado glomerular de 60 a 20 mL/min,12 mientras que en pacientes con hemodiálisis la prevalencia de hipercalemia prehemodiálisis > 6 mmol/L varía de 4 a 6.3%.13
La asociación de los ISRAA con la aparición de hipercalemia se ha descrito en diversos estudios clínicos; los estudios clínicos iniciales no reportaron la incidencia de hipercalemia y los grados de discontinuación relacionada con esta complicación fue baja, típicamente menor a 2%.14-16 En estudios posteriores, la incidencia de hipercalemia se incrementó de 1.9 a 38.4%, fue más común en pacientes con enfermedad renal crónica y con el número de ISRAA recibidos (Cuadro 2).17-21
Cuadro 2 Hipercalemia asociada con la administrción de inhibidores del sistema renina angiotensina aldosterona (ISRAA) en pacientes con enfermedad renal crónica
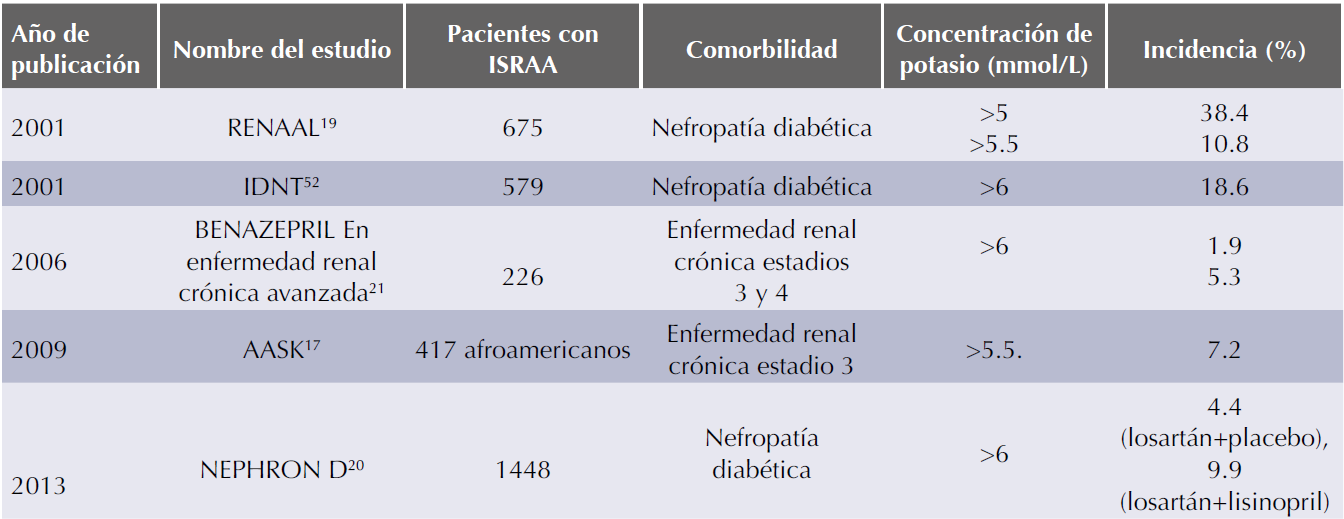
AASK: African American Study of Kidney Disease and Hypertension; IDNT: Irbesartan Diabetic Nephropathy Trial; NEPHRON D: Veterans Affairs Nephropathy in Diabetes; RENAAL: Reduction of Endpoints in Noninsulin-Dependent Diabetes Mellitus with the Angiotensin II Antagonist Losartan.
Equilibrio de potasio a nivel corporal
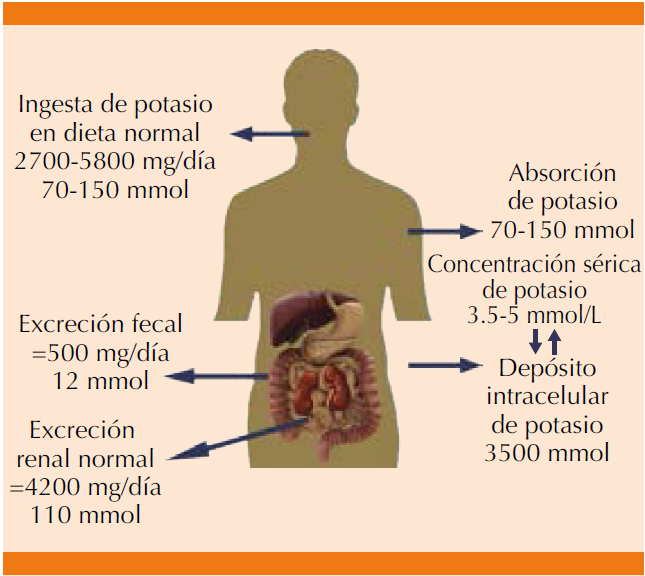
La ingesta diaria de potasio en la dieta americana varía de 35-70 a 110-150 mmol/día. Después de la absorción intestinal existe distribución en los compartimentos intracelular y extracelular a diferentes concentraciones, que son reguladas por múltiples mecanismos renales y no renales que mantienen las concentraciones de potasio sérico en intervalos de 3.5 a 5 mmol/L. En un estado de equilibrio, la cantidad absorbida diaria de potasio se elimina a través de la orina (90%) y el resto por la materia fecal (Figura 1).22
El cuerpo humano está constituido por agua y electrólitos. La molécula de agua es un solvente ideal para las reacciones fisiológicas; es aquí donde los electrólitos, como el cloruro de sodio (NaCl) se disocian a sus equivalentes catiónico (Na+) y aniónico (Cl-). Existen muchos electrólitos, entre los que resaltan Na+, K+, Ca2+, Mg2+, Cl- y HCO3, con distribución muy heterogénea en el líquido corporal.
Existe diferencia notable en la concentración de iones en los líquidos intracelular y extracelular; la separación de concentraciones de moléculas cargadas establece un gradiente eléctrico en la membrana plasmática (negativo en el interior de la célula y positivo en el exterior); este gradiente electroquímico es mantenido en gran parte por la bomba Na-K-ATPAsa.23
La bomba Na-K-ATPAsa24 está distribuida en todas las células y está localizada en la membrana plasmática bombeando sodio al exterior e introduciendo potasio en una relación 3 a 2 (3Na:2K) creando así un gradiente de Ki/Ke que determina el potencial de membrana; este gradiente es decisivo para mantener la conducción nerviosa, la contracción cardiaca y muscular, el volumen celular y el contenido intracelular de electrólitos.
En el cuerpo, 98% del potasio es intracelular (Figura 2) y está distribuido principalmente en el músculo liso y el músculo estriado,25 el 2% restante se distribuye en el medio extracelular; pequeñas cantidades se localizan en el sistema óseo, eritrocitos, hígado y piel.
Regulación renal del potasio
Mecanismos en los diferentes segmentos de la nefrona
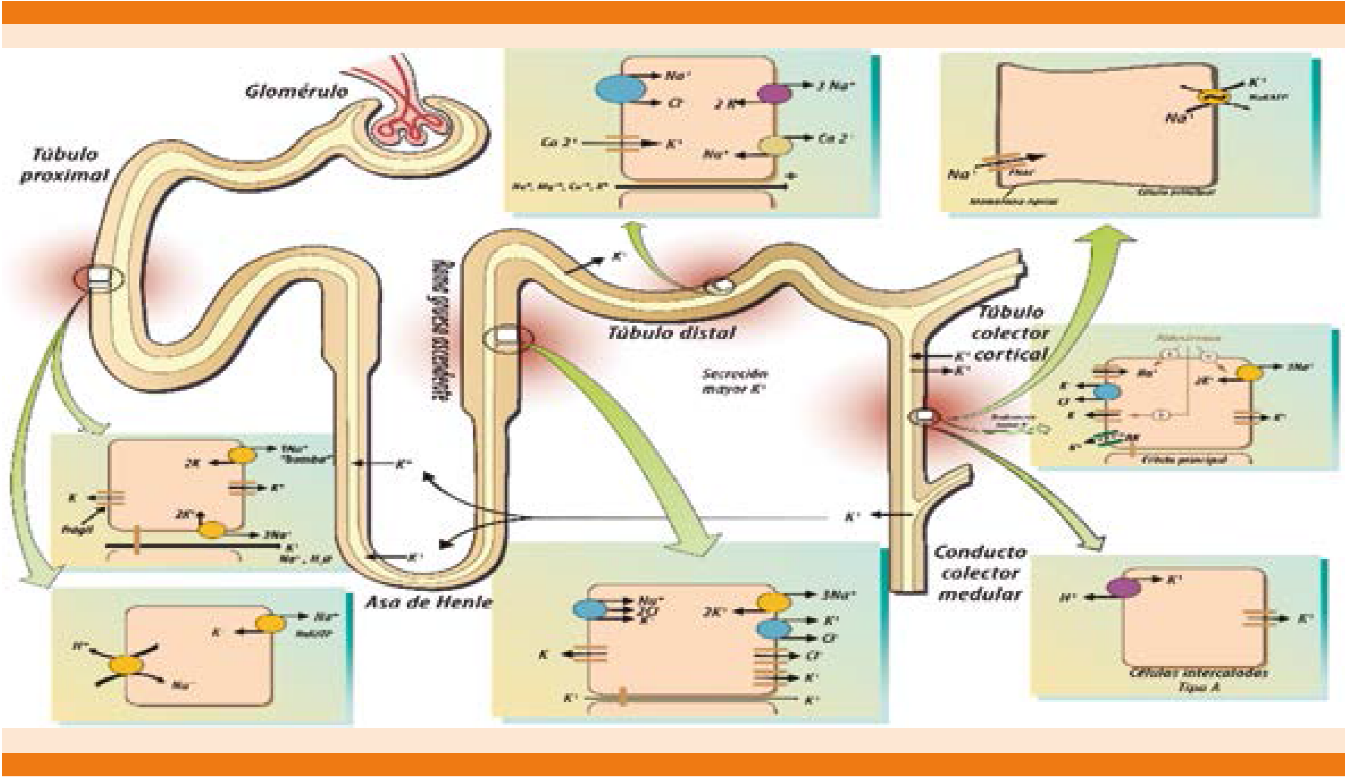
En condiciones normales, los riñones determinan el contenido total de potasio corporal mediante los canales que se encuentran en los diversos segmentos de la nefrona (Figura 3).
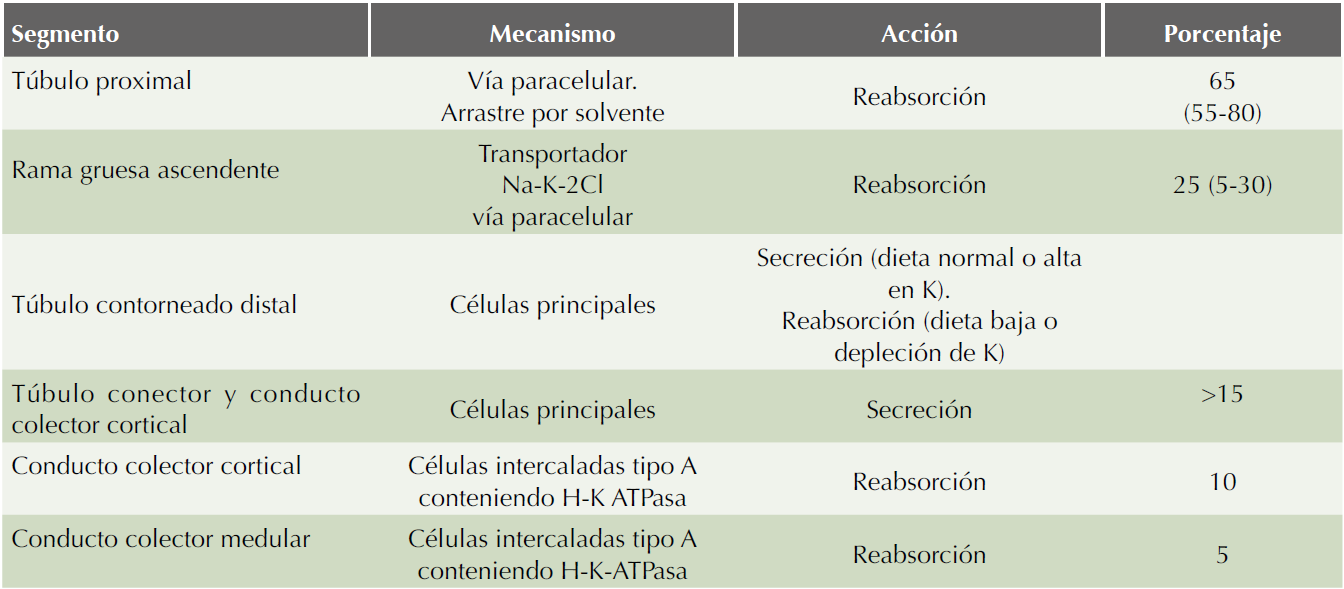
El potasio es libremente filtrado hacia la cápsula de Bowman y es reabsorbido en su mayor parte en el túbulo contorneado proximal y la rama gruesa ascendente del asa de Henle, llevándose a cabo una regulación más fina de absorción y secreción, en el túbulo contorneado distal y el conducto colector medular (Cuadro 3).26-28 La reabsorción y secreción se llevan a cabo de manera simultánea e intervienen múltiples moduladores, como la dieta, el equilibrio ácido base y los esteroides.
En el túbulo proximal, cerca de 65% de potasio filtrado es reabsorbido; no se han descrito canales de potasio específicos en este segmento de la nefrona, la absorción de potasio en las partes iniciales está ligada a la absorción de sodio y agua (difusión y arrastre por solvente); el sistema más importante es el antiporte Na/H y la difusión es creada por la Na/K-ATPAsa al generar un potencial eléctrico negativo luminal que crea altas concentraciones de Cl, mientras que en la parte final del túbulo proximal la absorción de potasio es a través de la vía paracelular.
Al pasar por el asa de Henle, específicamente en la rama gruesa ascendente existen diversos cotransportadores y canales iónicos que participan en el complejo sistema regulatorio para la absorción de potasio; el mejor caracterizado es el canal multiforme Na-K-2Cl (denominado también NKCC2), localizado en la membrana luminal o apical, que transporta sodio fuera del lumen tubular y es inhibido por los diuréticos de asa (furosemida). Este canal reabsorbe cerca de 25 a 30% del potasio filtrado, por lo que cerca de 10% pasa a la nefrona distal. Para que ocurra la reabsorción de potasio, existen canales de potasio denominados canales ROMK1, ROMK2 y ROMK3 (renal outer medullary potasium channel 1, 2, 3),28 localizados en la membrana apical de toda la nefrona, con excepción del túbulo proximal (Figura 4).29
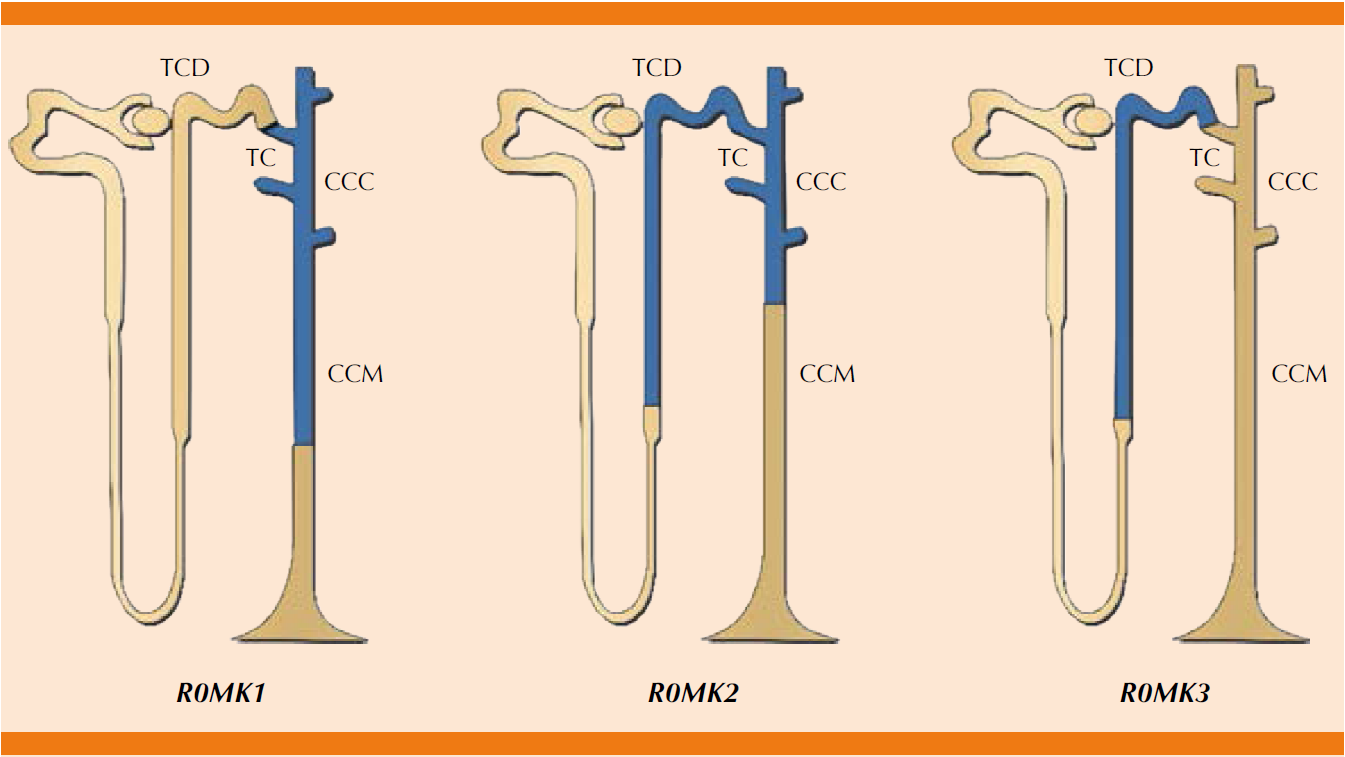
TDC: túbulo contorneado distal; TC: túbulo conector; CCC: conducto colector cortical; CCM: conducto colector medular.
Figura 4 Localización de los canales ROMK en la nefrona.
Los canales ROMK 2 median el flujo de salida de potasio que se requiere para transportar cloruro de sodio por el cotransportador NKCC2, generando también el flujo de corriente transepitelial y la diferencia de potencial importante para la reabsorción paracelular de sodio y calcio en la rama gruesa ascendente (Figura 5).
La nefrona distal está compuesta por un número de segmentos que incluyen: el túbulo contorneado distal (TCD), el túbulo conector (TC) y el conducto colector cortical (CCC).
En el túbulo contorneado distal está localizado el cotransportador apical sodio/cloro (NCCT), que es inhibido por los diuréticos tipo tiazidas. Este cotransportador modula también la eliminación de calcio y magnesio. Los canales NCCT y ROMK regulan la excreción de potasio bajo la influencia de serin-treonina cinasas, aunque se ha demostrado que el receptor sensible a calcio también interviene en el transporte de iones al inhibir la actividad del canal ROMK.28,29
El CCC es el principal sitio de excreción de potasio. A este nivel se han identificado dos factores circulantes para la secreción de potasio: la aldosterona y un segundo factor aún no identificado que incrementa el número de canales de potasio.30
En el CCC la eliminación de potasio está dada por la participación de dos tipos de células:
Retroalimentación de potasio
La retroalimentación es un mecanismo fisiológico que mantiene parámetros específicos en un rango óptimo. La retroalimentación negativa implica la elevación del potasio plasmático que activa el estímulo necesario para retornarlo a un valor normal; uno de los primeros mecanismos es mediado por la insulina que estimula la bomba de Na-K en la célula muscular disminuyendo su concentración; al rebasar esta capacidad de almacenamiento intracelular, se activa la aldosterona, que activa la secreción de potasio en las células principales induciendo a la baja la bomba de Na-K-ATPasa e incrementando los canales de potasio a nivel luminal de la membrana celular y a nivel colónico.31
Hasta la fecha la aldosterona se considera el principal regulador del homeostasia de potasio en el riñón al unirse al receptor mineralocorticoide nuclear en las células del túbulo distal y del conducto colector cortical, activando la Na-K-ATPasa basolateral, incrementando la reabsorción de sodio y agua hacia el torrente sanguíneo y secretando potasio a la orina. La aldosterona también regula el canal de sodio sensible a amilorida (ENaCs) en la membrana apical del conducto colector cortical y estimula la secreción de iones hidrógeno por las células intercaladas tipo A.
El conducto colector medular es el último segmento que participa en la excreción urinaria de potasio, permitiendo la eliminación final en condiciones normales de 10 a 15 mEq/día.
Regulación de potasio extrarrenal
La concentración de potasio intra y extracelular es afectada por el estado ácido base. La acidosis incrementa la concentración de potasio plasmático al inducir el intercambio de K intracelular por iones de hidrógeno a nivel extracelular conduciendo a una reducida secreción de potasio a nivel tubular.
La insulina incrementa la captación de potasio a nivel hepático y en las células musculares al estimular a la bomba Na-K-ATPasa; se ha demostrado que el incremento en la concentración sérica de potasio > 1.5 mmol/L estimula la secreción de insulina que promueve el ingreso de potasio a nivel intracelular.
Las catecolaminas (adrenalina, noradrenalina, dopamina) se unen al receptor B2 de las células musculares estimulando a la bomba Na/K-ATPasa e incrementando el potasio intracelular.
Sistema de control feed forward de potasio
Se refiere a un sistema de control que responde a un estímulo específico de manera predefinida; en especial de un reflejo kaliurético referido como un sensor aún en identificación a nivel esplácnico. En modelos animales se ha demostrado que después de una carga oral de potasio, ocurre una excreción significativa de potasio urinario sin cambios en la concentración de aldosterona plasmática, que es mediada por el incremento en número de los canales ROMK, Na-K-ATPasa y ENac.32
Los mecanismos propuestos para este sistema de control son:
Liberación incrementada de insulina que induce de manera rápida en los tejidos sensibles a insulina la captación intracelular de potasio.
La secreción de potasio que promueve la excreción de potasio posterior a la ingesta de alimentos ricos en proteínas.
Un sensor intestinal no identificado que incrementa la excreción renal de potasio.
El glucagón se ha propuesto como efector de este último sistema, aún está pendiente la demostración de su participación en este sistema; esta hormona es secretada con los alimentos ricos en proteínas e incrementa el flujo sanguíneo renal y la tasa de filtrado glomerular.
Patogénesis de la hipercalemia
Los estudios experimentales han sugerido que a medida que progresa la enfermedad renal crónica los riñones se ajustan a la disminución en el número de nefronas incrementando la secreción de potasio en el resto de las nefronas funcionales, mismas que pierden la capacidad de mantener concentraciones normales de potasio con incremento agudo;33,34 mientras se mantenga la homeostasia, las concentraciones séricas de potasio se mantienen dentro de la normalidad hasta que cae la tasa de filtrado glomerular (TFG) a menos de 30 mL/min, las alteraciones en el potasio sérico son mucho más frecuentes en los estadios 4 y 5 de la clasificación de la enfermedad renal crónica.3,34 En estos estadios, los pacientes habitualmente toleran esta elevación de K con pocas alteraciones cardiacas y electrocardiográficas,5 pues se incrementa dos a tres veces la secreción colónica de potasio, efecto mediado por la aldosterona en las células colónicas.35 Sin embargo, cuando la concentración sérica es mayor de 6 mmol/L, ésta se considera una urgencia médica que necesita ser tratada de manera rápida; por ejemplo, en pacientes en hemodiálisis por cada 1 mmol/l de K que se eleva prediálisis, existe incremento en el riesgo de 40% de muerte cardiaca súbita o de arritmia cardiaca.36
Los pacientes con enfermedad renal crónica tienen múltiples comorbilidades, condiciones y factores precipitantes que exacerban la hipercalemia; ésta puede resultar del incremento en el potasio corporal total por una alteración entre la ingesta y la excreción o por una mala distribución entre el espacio intracelular y extracelular.
Ingesta excesiva
En pacientes sin alteración de la función renal se requieren grandes cantidades de potasio para producir hipercalemia; sin embargo, en pacientes con disminución en la tasa de filtrado glomerular baja, especialmente menor de 15 mL/min, aun un pequeño aumento en la cantidad ingerida puede causar hipercalemia.
Alteración en la eliminación de potasio
Lesión renal aguda. Puede estar asociada con un estado hipercatabólico, lesión tisular y elevación aguda de potasio.
Insuficiencia renal crónica. La disminución en la TFG < 15 mL/min y el bajo flujo urinario conducen a la disminución en la excreción renal de potasio. Se ha descrito en pacientes con afección tubulointersticial crónica.
Trasplante renal. Se asocia con la aparición de acidosis tubular o efecto de los inhibidores de calcineurina.
Medicamentos que interfieren con la excreción de potasio urinario. De especial relevancia son los diuréticos ahorradores de potasio (amilorida o espironolactona), ciclosporina, trimetoprim,37 antiinflamatorios no esteroides (AINES), inhibidores de la enzima convertidora de angiotensina (IECAs) e inhibidores del receptor de angiotensina, que pueden causar el decremento en las concentraciones de aldosterona y en la TFG, conduciendo a hipercalemia.38 La administración de bloqueadores adrenérgicos B2 inhibe la producción de renina y decrementa la distribución intracelular, mientras que la administración de heparina está asociada con disminución en la producción de aldosterona y la administración de glucósidos digitales, como la digoxina porque al inhibir la bomba Na/K ATPasa producen hipercalemia.
Hipoaldosteronismo primario (enfermedad de Addison) o secundario (insuficiencia renal crónica). Éste resulta en hipercalemia acompañada del aumento en la eliminación de sodio urinario que conduce a depleción de volumen e hipotensión arterial.39,40 La uropatía obstructiva y la acidosis tubular renal son cuadros similares en algunos pacientes.41
Pseudohipoaldosteronismo. Se refiere a un grupo heterogéneo de enfermedades en el metabolismo de los electrólitos caracterizado por hipercalemia, acidosis metabólica y tasa de filtrado glomerular normal.42 El tipo 1 es autosómico dominante causado por mutaciones en el gen del receptor mineralocorticoide humano y produce alteración en la función del canal epitelial de sodio (ENaC), afectando los riñones, los pulmones, el colon y las glándulas salivales. El tipo II, conocido como síndrome de Gordon, es un raro defecto tubular causado por pérdida de la función en WNK1 o WNK4 y se caracteriza por aumento de volumen, supresión de renina y disminución del aclaramiento renal de potasio que conducen a hipertensión arterial, hipercalemia y acidosis hiperclorémica con TFG normal.43,44
Hiperplasia adrenal congénita. Causada por mutaciones o deleciones en los genes que codifican las enzimas implicadas en la síntesis de cortisol o aldosterona. Más de 90% de los casos se deben a la deficiencia de 21-hidroxilasa.45
Insuficiencia cardiaca congestiva. El tratamiento que interfiere con la excreción de potasio asociado con insuficiencia renal conduce a hipercalemia.46
Estreñimiento. La eliminación enteral de potasio está disminuida y conduce a hipercalemia que reduce el peristaltismo.
Incremento del intercambio del espacio intra al extracelular
Acidosis metabólica. Condiciona la salida de potasio del medio intracelular al extracelular.
Diabetes mellitus. Las concentraciones disminuidas de insulina conducen a la acumulación de potasio en el espacio extracelular.47
Incremento agudo en la osmolaridad secundario a hiperglucemia o administración de manitol.
Lisis celular. El daño celular extenso condiciona liberación de potasio al espacio extracelular. Visto en pacientes con rabdomiólisis, lisis tumoral, sangrado gastrointestinal.
Medicamentos. La digoxina y los betabloqueadores inhiben la Na-K-ATPasa en la membrana basolateral.48
Relacionada con aporte. Transfusión iatrogénica, transfusión masiva.
Parálisis periódica hipercalémica. Enfermedad poco frecuente, en la que se describe mutación del canal muscular de sodio que resulta en episodios de parálisis con hipercalemia.49
Pseudohipercalemia
Secundaria a leucocitosis, trombocitosis, policitemia y hemólisis mecánica.50 En estos casos la hipercalemia no refleja realmente la concentración de potasio sérico y no es necesario tratamiento específico.
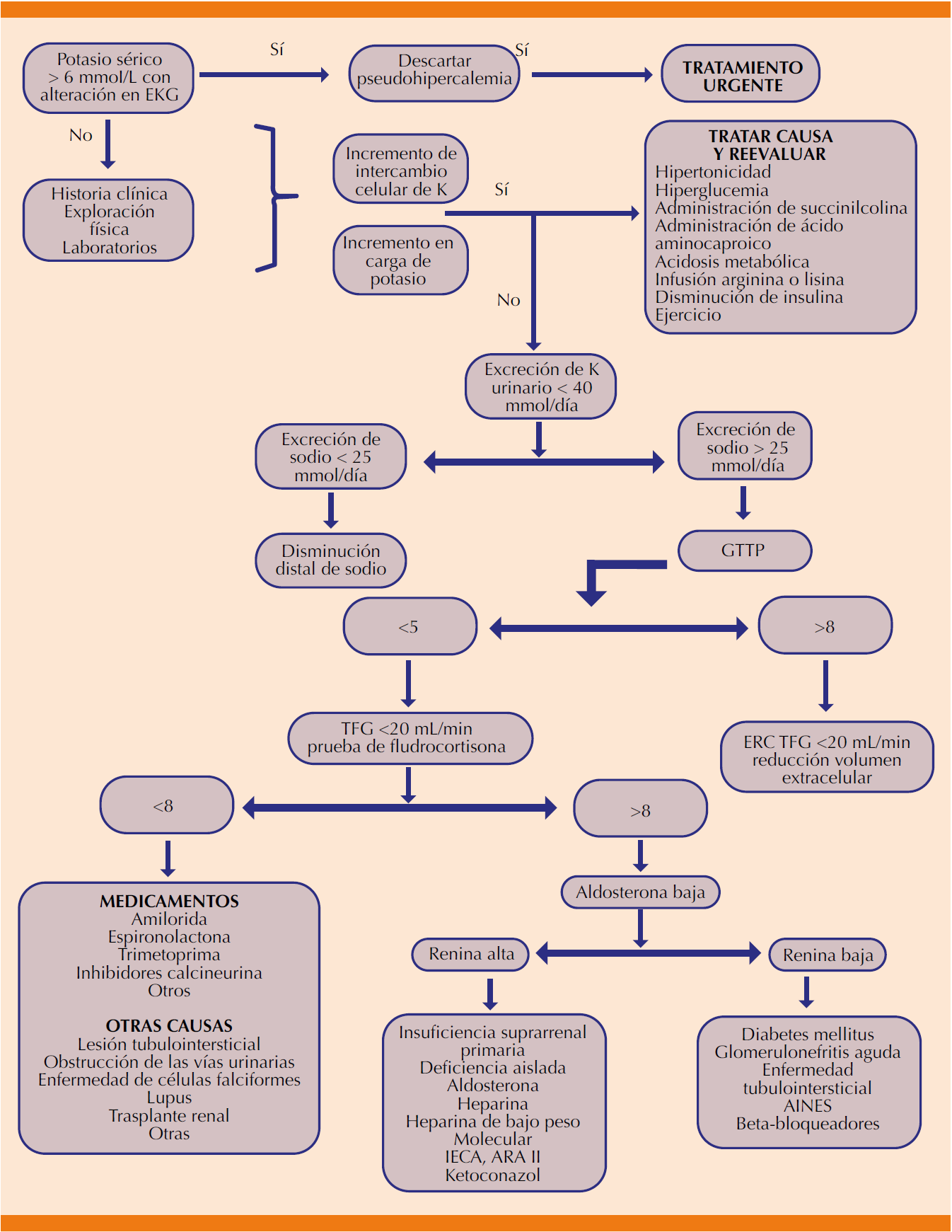
Diagnóstico
La hipercalemia raramente puede manifestarse con síntomas de manera directa; la mayoría de los afectados refiere palpitaciones, náusea, parestesias cuando se trata de hipercalemia leve, mientras que con hipercalemia moderada a severa los síntomas son más específicos e incluyen alteraciones del ritmo cardiaco, como: alteraciones no específicas en la repolarización, onda T picuda y simétrica, ensanchamiento del complejo QRS y depresión del segmento ST.
Con base en las concentraciones de potasio pueden ocurrir las siguientes alteraciones:
De 5.6 a 6.5 mEq: onda T alta y picuda.
De 6.5 a 7.5 mEq: pérdida de la onda P.
De 7 a 8 mEq: ensanchamiento del complejo QRS.
Mayor a 8 mEq: onda sinusoidal, arritmias ventriculares, asistolia (Figura 5).
La valoración inicial debe ser general e integral, incluye la revisión de la función cardiaca, renal y de las vías urinarias, estado de hidratación y evaluación neurológica. Los estudios de laboratorio varían con base en la causa y de rutina deben ser los que se muestran en el Cuadro 5.51
Cuadro 5 Estudios para el abordaje diagnóstico de hipercalemia
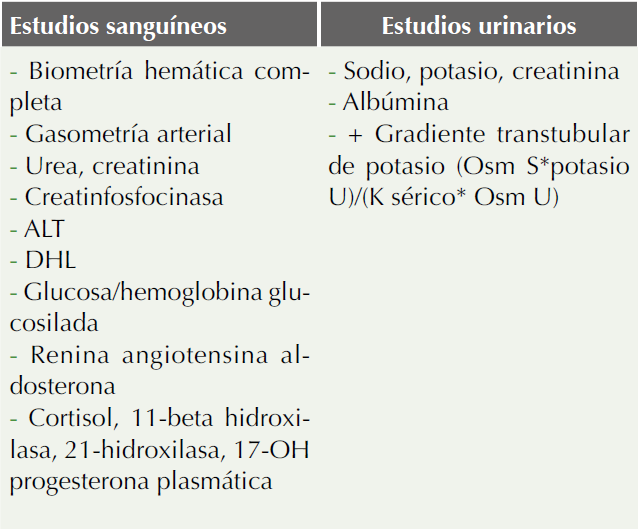
+ GTTP > 10 con función renal intacta. Un valor bajo inapropiado con hipercalemia sugiere hipoaldosteronismo o un defecto del túbulo renal.
Tratamiento
Tratamiento en etapa prediálisis
En términos generales, con base en la progresión de la enfermedad renal crónica, el tratamiento de las complicaciones es bastante complejo, porque aparte de disminuir la progresión de la enfermedad renal crónica deben tratarse otras complicaciones inherentes a la misma enfermedad, como la enfermedad cardiovascular, la hipertensión arterial, la anemia, la acidosis metabólica, las alteraciones óseo-metabólicas y las alteraciones electrolíticas.
Diversas sociedades internacionales han abordado el tratamiento de la hipercalemia en el contexto de la enfermedad renal crónica sugiriendo evitar la misma en estos pacientes, haciendo notar la falta de evidencia derivada de estudios clínicos entre la ingesta de potasio, concentraciones séricas de potasio y el pronóstico clínico, lo que sugiere, por tanto, la necesidad de individualizar el tratamiento de la hipercalemia con base en el contexto clínico (Cuadro 6).
El tratamiento de la hipercalemia suele ser difícil en la práctica clínica; típicamente el tratamiento con medicamentos y la terapia de reemplazo renal se prescriben contra las complicaciones de la hipercalemia aguda, mientras que el tratamiento de la hipercalemia crónica requiere intervención nutricional, administración crónica de medicamentos y la reducción o interrupción en la dosis de diversos medicamentos.
Todo tratamiento debe ser individualizado con base en el grado de hipercalemia, el tipo de hipercalemia (aguda o crónica), el resultado del electrocardiograma y las concentraciones de potasio sérico.59 El tratamiento será más agresivo si las cifras de potasio sérico son más elevadas junto con los cambios detectados en el electrocardiograma; dependiendo de la severidad de la hipercalemia y del estado del paciente, estas alteraciones se tratan con medicamentos que antagonizan los efectos cardiacos del potasio, redistribuyen intracelularmente el potasio y remueven el exceso de potasio corporal.60,61
La hipercalemia aguda se considera una emergencia médica y el objetivo es la estabilización del potencial de membrana con o sin cambios en el potasio sérico. Uno de los primeros tratamientos es la administración intravenosa de calcio, seguida de terapias que redistribuyen de manera intracelular el potasio como insulina intravenosa o los agonistas beta 2. El bicarbonato de sodio intravenoso también puede administrarse con eficacia cuestionable según la causa. Por último, se indican medicamentos que remueven el potasio corporal, como los diuréticos de asa o medicamentos que actúan en el aparato gastrointestinal (Cuadro 7).
Para el tratamiento de la hipercalemia crónica se ha propuesto:
Eliminar las causas corregibles, por ejemplo, eliminar dietas ricas en potasio o suplementos ricos en potasio.
Evaluar los medicamentos que inducen hipercalemia, por ejemplo, los inhibidores del sistema renina angiotensina aldosterona y los inhibidores de la enzima convertidora de angiotensina, suspender los mismos y privar los beneficios cardiovasculares y renales en esta población es tema de discusión.
Corrección de la acidosis metabólica.
Administración de diuréticos de asa.
Administración de resinas de intercambio iónico. Entre ellas tenemos la suspensión de sulfonato de poliestireno sódico, patiromer (Veltassa®) y el ciclosilicato de circonio sódico (ZS-9). Cuadro 8
Tratamiento en terapia dialítica
A diferencia de la enfermedad renal crónica en etapa prediálisis, donde la homeostasia del potasio está preservada manteniendo en rango normal la concentración sérica de potasio cuando el filtrado glomerular es mayor a 30 mL/min, en los estadios 4 y 5 de la enfermedad renal crónica, los pacientes pueden o no tolerar la misma, encontrando pocas alteraciones electrocardiográficas; cada mmol/L de potasio prediálisis incrementa la mortalidad y el riesgo de arritmia hasta en 40%.36
Debido a que en el estadio 5 en terapia dialítica la mayoría de los pacientes pierde la función renal residual, las adaptaciones fisiológicas para eliminar el potasio son limitadas, incluido el incremento en la secreción colónica.35 Por ello, la hemodiálisis y la diálisis peritoneal son los tratamientos a optimizar requeridos.
Al igual que en la enfermedad renal crónica etapa prediálisis, es necesario considerar las causas de hipercalemia en pacientes con terapia dialítica: incremento en la ingesta de potasio en la dieta, remoción insuficiente con la terapia dialítica; liberación de potasio celular: acidosis metabólica, traumatismo, hemólisis, rabdomiólisis; ayuno prolongado, éste provoca la supresión de insulina endógena; secreción intestinal insuficiente, por ejemplo, estreñimiento; medicamentos que alteran la excreción de potasio.
Terapia dialítica
Básicamente la hemodiálisis es el tratamiento de elección ante una urgencia por hipercalemia, aunque la diálisis peritoneal también resulta efectiva. Durante un tratamiento de 3 a 5 horas en hemodiálisis, se remueven 40 a 120 mmol de potasio, el transporte difusivo es el principal responsable con 80% de remoción de potasio extracelular.75,76 La cantidad de potasio en hemodiálisis depende del área de superficie del dializador, duración del tratamiento, prescripción de bicarbonato, concentración de potasio en el dializado, grado de flujo sanguíneo y de diálisis.77
En pacientes ancianos, con antecedentes de arritmias cardiacas, hipertensión arterial, enfermedad arterial coronaria y tratamiento con digital, es recomendable no utilizar bajas concentraciones de potasio; se sugiere, incluso, el perfil de potasio como estrategia de tratamiento78 porque se ha descrito que la disminución abrupta en la concentración sérica de potasio se asocia con hipertensión arterial de rebote y arritmias.79,80
La introducción de las terapias sustitutivas de la función renal en muchos pacientes suele ser irregular, por lo que las intervenciones farmacológicas antes descritas son auxiliares importantes en esta etapa, administradas de manera temporal a fin de: a) antagonizar los efectos de la hipercalemia en la membrana celular; b) redistribución de potasio intracelular; c) eliminación de potasio corporal (Cuadro 9).
Recomendación dietética
Las guías actuales sugieren una ingesta de potasio en la dieta de 4700 mg en sujetos con función renal normal.81 La recomendación para sujetos con enfermedad renal crónica es la ingesta de potasio menor a 1500 mg/día, controlando la ingesta de fósforo, agua, sodio y carbohidratos. Los alimentos como las carnes, pescados y algunas leguminosas contienen hasta tres veces más potasio que otros alimentos,82 por lo que todos los pacientes con enfermedad renal crónica con o sin terapia dialítica ameritarán valoración por un nutriólogo.
Los alimentos ricos en potasio se mencionan en el Cuadro 10.9,83,84
CONCLUSIONES
La hipercalemia es una anormalidad electrolítica que ocurre de manera frecuente en pacientes con enfermedad renal crónica con elevada morbilidad y mortalidad por la existencia de arritmias. Los diversos tipos de tratamiento prescritos hasta el momento han estado disponibles desde hace varios años y continúan mostrando eficacia en el tratamiento de la hipercalemia aguda y disminuyendo también la recurrencia de la hipercalemia crónica; algunos tratamientos requerirán suspenderse a fin de evitar la aparición de hipercalemia, contrarrestando de manera obvia los efectos benéficos ya descritos en los pacientes con enfermedad renal crónica (IECAS, inhibidores del sistema renina angiotensina aldosterona).
El arsenal terapéutico continúa siendo limitado, en el mercado hay nuevos medicamentos que han demostrado disminuir la concentración sérica de potasio, permitiendo mantener, incluso, medicamentos como IECAS e inhibidores del sistema renina angiotensina aldosterona; incluso se han prescrito en otras comorbilidades con buen pronóstico, particularmente en sujetos con insuficiencia cardiaca y enfermedad renal crónica.
Hasta el momento, no hay estudios clínicos que sugieran la concentración ideal de potasio o la ingesta de potasio en pacientes con enfermedad renal crónica; en la práctica clínica, el objetivo principal es disminuir la ingesta de potasio en los pacientes con enfermedad renal crónica que tienen tasa de filtrado glomerular menor a 30 mL/min; porque los pacientes con tasa de filtrado glomerular mayor a 40 mL/min tienen poco riesgo de padecer hipercalemia aun con la administración de inhibidores del sistema renina angiotensina aldosterona o IECAS.
Por último, en los pacientes con terapia dialítica, la hipercalemia contribuye a morbilidad y mortalidad elevadas de manera significativa; la ingesta excesiva de potasio en la dieta y la terapia dialítica inadecuada son las principales causas de hipercalemia en esta población.
Debido a que la terapia de reemplazo renal es el tratamiento definitivo, algunos pacientes se verán beneficiados del tratamiento médico temporalmente para disminuir la concentración aguda o crónica de potasio sérico y con ello mejorar el pronóstico.











 nueva página del texto (beta)
nueva página del texto (beta)