ANTECEDENTES
El tumor primario desconocido es un síndrome clínico heterogéneo complejo que consiste en el diagnóstico histopatológico de cáncer sin un sitio anatómico bien definido a pesar de un extenso protocolo clínico (incluida la adecuada examinación rectal y pélvica), bioquímico (estudios séricos básicos, prueba de sangre oculta en heces, análisis de orina), de imagen (radiografías simples, tomografía computada simple y contrastada, mamografía, tomografía computada por emisión de positrones) e incluso invasivo (en el sistema respiratorio, digestivo, laparotomía protocolizada) sin éxito en la búsqueda del tumor oculto.1 En esta definición se excluyen los pacientes con estudio de metástasis que permitan revelar el tumor primario después de una biopsia.
Un tumor primario desconocido usualmente cursa indolente por largos periodos hasta etapas más tardías con metástasis de diseminación agresiva y progresión rápida.2 Desde el punto de vista molecular se tiene la hipótesis en la que cierta inhibición por parte de las colonias metastásicas es ejercida sobre el tumor primario, limitando su crecimiento y, por ende, su ubicación anatómica precisa. Se estipula que 50 a 80% de estas neoplasias tienen sobreactivada la angiogénesis, sobreexpresión de varios oncogenes en 10-30%, proteínas asociadas con hipoxia en 25%, marcadores de transición epitelio-mesenquimatosa y la activación persistente de genes asociados con el crecimiento y la proliferación celular como AKT y la vías de las MAPK cinasas en 20-35%, compartiendo un fenotipo “común” con otro tipo de cánceres.3,4 Identificar la procedencia del tumor resulta el punto crítico en el manejo de estos pacientes porque permite identificar los pacientes que son aptos para recibir un esquema específico de tratamiento, predecir su respuesta al mismo y tener un margen de supervivencia en algunos casos, los mejores determinantes actualmente en el uso clínico son los reportados por el médico patólogo quien inicialmente permite discriminar o descartar los posibles orígenes del tumor, sin existir al momento marcadores con alta especificidad de la procedencia del tumor primario desconocido, el análisis de microarreglos de ADN y los caracteres epigenéticos se perfilan como los marcadores más prometedores en este aspecto.5
Epidemiología
Sin variantes en los últimos 10 años el tumor primario desconocido representa 3 a 5% de todas las neoplasias, tiene incidencia de 4 a 19 casos por cada 100,000 habitantes, la edad promedio de su diagnóstico ronda en torno a los 60 años.6 Van de Wouw y su grupo7 reportan predilección por el sexo masculino con 6.7 por cada 100,000 hombres en contraste con 5.3 por cada 100,000 mujeres; es extremadamente raro en niños. En términos de pronóstico, 20% tiene un comportamiento favorable, mientras que el 80% restante tiene el peor pronóstico respecto a la mortalidad, porque la supervivencia media es de 8 a 11 meses y según las series 20-25% sobrevive más allá de un año. El Cuadro 1 revela la prevalencia de las estirpes más frecuentes en los reportes internacionales.
Cuadro 1 Origen de los tumores en pacientes con tumor primario desconocido
| Origen | Incidencia (%) |
|---|---|
| Páncreas | 20-26 |
| Pulmón | 17-23 |
| Colon y recto | 4-10 |
| Hígado | 3-11 |
| Riñón | 3-8 |
| Estómago | 4-6 |
| Ovario | 3-4 |
| Próstata | 3-4 |
| Mama | 2 |
| Otro | < 2 |
Tomado de la referencia 6.
En 20% de las variedades favorables suelen encontrarse los de origen en el colon, lo que refleja las altas tasas de respuesta a los nuevos esquemas planteados en estos últimos 20 años. El porcentaje restante suele dividirse en dos grupos: los que tienen un estado funcional favorable y LDH normal y los que no cumplen con éstos, con supervivencia cercana a un año y de tan sólo cuatro meses, respectivamente.8
La supervivencia se ha dividido por sexo, tipo de tumor, periodo de diagnóstico, afectación ganglionar y edad. Fue peor en casos de adenocarcinoma y carcinoma indiferenciado comparado con otros subtipos de la enfermedad; respecto a la edad, las edades avanzadas se han relacionado directamente con el incremento de la mortalidad. No hay diferencias entre el sexo. Los pacientes con daño ganglionar tienen mejor pronóstico que los casos extraganglionares (70 vs 20% a 12 meses, respectivamente). En una minoría de pacientes se han llevado a cabo estudios postmortem donde las autopsias revelaron sólo 55-85% de los tumores primarios, la mayor parte pequeños tumores asintomáticos en el páncreas, el pulmón, el intestino y el riñón. El resto de los pacientes que permanecen con autopsia negativa pudieron beneficiarse de los avances en la tomografía, como la modalidad de emisión por positrones o la resonancia magnética. El promedio de supervivencia de los pacientes con tumor primario desconocido de los estudios a seguimiento es de 6-10 meses y menos de 25% sobrevive más de un año.7,8
En los estudios de seguimiento la mortalidad y la supervivencia se correlacionan directamente con el subtipo histopatológico, como se muestra en el Cuadro 2 de un estudio sueco contemporáneo.9 Todas las tasas de supervivencia se incrementaron una vez que los casos fatales se excluyeron. Para el caso del tumor primario desconocido con sitio extranodal la media fue de siete meses cuando el seguimiento se realizó a partir del tercer mes de diagnóstico.
Cuadro 2 Seguimiento de pacientes con tumor primario desconocido desde el inicio de diagnóstico, a tres y siete meses, respectivamente
| Sitios de metástasis | Inicio de seguimiento | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 0 meses + | 3 meses + | 7 meses + | |||||||
| Casos (%) | Muertes por cáncer | Media de sobrevivencia | Casos (%) | Muertes por cáncer | Media de sobrevivencia | Casos (%) | Muertes por cáncer | Media de sobrevivencia | |
| Nodos linfáticos | 576 | 434 | 8 | 405 | 286 | 15 | 292 | 185 | 28 |
| Axilares | 131 (3.7) | 67 | 74 | 107 (6.2) | 46 | 119 | 92(10) | 33 | . |
| Cabeza y cuello | 202 (5.7) | 167 | 7 | 136 (7.8) | 111 | 12 | 97(10.5) | 77 | 16 |
| Extranodal | 5576 | 4934 | 3 | 2824 | 2479 | 7 | 1523 | 1288 | 11 |
| Hígado | 2650 (74.1) | 2407 | 2 | 1121 (64.5) | 1014 | 7 | 540 (58.4) | 476 | 10 |
| Hueso | 552 (15.4) | 475 | 5 | 344 (19.8) | 296 | 7 | 174 (18.8) | 147 | 14 |
| Mediastino | 40 (1.1) | 33 | 7 | 31 (1.8) | 25 | 14 | 21 (2.3) | 16 | 19 |
Nótese la heterogeneidad en la supervivencia debido a la localización anatómica del sitio de metástasis.
Tomado de la referencia 10.
A pesar de los avances de las técnicas moleculares de diagnóstico, aún no se encuentran factores de riesgo asociados con su desarrollo y su fisiopatología es escasamente entendida. Diversos estudios demuestran que el tabaquismo puede incrementar 1.8 a 3.6 veces el riesgo en fumadores con alto índice tabáquico (> 26 cigarrillos/día) y exponencialmente hasta 4.9 veces cuando las metástasis son pulmonares, con riesgo relativo de 2.03 veces en metástasis hepáticas. En la actualidad no se ha relacionado el consumo del alcohol y los antecedentes heredofamiliares como factores agregados que influyan en su desarrollo, probablemente por tratarse de series de casos y controles de poco poder muestral.11
Fisiopatología
Múltiples investigaciones han demostrado que el tumor primario desconocido raramente activa puertos de mutaciones puntuales en oncogenes o genes supresores de tumores, a pesar de la esperada persistencia de aberraciones en el gen de TP53, la incidencia no es mayor que la reportada para sus correspondientes primarios conocidos, se tiene sobreactivada la angiogénesis en 50 a 80% con perfil de expresión del VEGF aumentada, sobreexpresión de múltiples oncogenes de 10-30%, proteínas relacionadas con la hipoxia en 25%, marcadores de transición epitelio-mesénquima en 16% y tienen activadas vías de señalización intracelular dependiente de tirosina-cinasas como AKT o MAPK en 20-35%.12 Los perfiles recientes de evaluación de microarreglos (microarrays) de ARN no muestran diferencias en la expresión de genes respecto a los tumores primarios conocidos fallando en la identificación del origen del tumor primario desconocido.
En la actualidad se hacen esfuerzos por identificar si más allá de arreglos puntuales en el ADN demuestran asociaciones con el tumor de origen, es decir, ¿qué marcador puede ser la huella que revele dónde se originó tal cáncer? De esto resulta novedoso mencionar que perfiles de expresión epigenética podrían estar asociados con el comportamiento de esta variedad oncológica y con su origen anatómico.
Para evidenciar un potencial candidato a la carcinogénesis se solía comentar la existencia de mutaciones en sus diferentes variedades que representaban potenciales genotipos que probabilísticamente podrían alterar el ciclo celular, los mecanismos de replicación, reparación de ADN y los vinculados con el fenómeno de muerte celular programada; sin embargo, esto ya no resulta suficiente para entender el comportamiento tumoral y predecir sus desenlaces, múltiples modificaciones en el genoma que no involucran secuencias de nucleótidos se han evidenciado alteradas y vinculadas con diferentes tipos de neoplasias, donde caracterizarlas y correlacionarlas sugiere ser prometedor para identificar el comportamiento cancerígeno y desde luego asociarse con el origen tumoral, otorgando una oportunidad significativa al clínico para el abordaje y tratamiento específico. Para un tumor primario desconocido se espera una pérdida considerable de su metilación como ocurre en otros cánceres metastásicos (20-60%).13,14
Clasificación
La estandarización de la enfermedad incluye examinación clínica y paraclínica, la evaluación histológica es la piedra angular en la clasificación de utilidad para el clínico. El 80% de los tumores primarios desconocidos son carcinomas, de los que se reconocen cuatro subtipos mayores: adenocarcinoma, adenocarcinoma moderadamente diferenciado, carcinoma o adenocarcinomas poco diferenciados, carcinoma epidermoide y neoplasias poco diferenciadas (Figura 1).1 El abordaje de un tumor primario desconocido debe plantearse tres objetivos fundamentales al momento de la diferenciación; primero, identificar una de las siguientes variantes: carcinoma, linfoma, sarcoma o melanoma, segundo, reconocer el subtipo, adenocarcinoma, de células germinales, escamoso, hepático, renal o tiroideo y finalmente reconocer el órgano que da origen a la neoplasia.
Historia natural de la enfermedad
Es variable en estos pacientes, comparada con los tumores primarios que muestran la cascada de Correa15 (progresión tipo 1; tejido normal-metaplasia, displasia de bajo grado, displasia de alto grado, carcinoma in situ, carcinoma invasor); el tumor primario desconocido inicia en malignidad y continúa en ella (progresión tipo 2). Más de 50% tiene envolvimiento múltiple, 30% daño de tres sitios al momento del diagnóstico, con base en sus características moleculares particulares lleva una única historia natural, que incluye característicamente diseminación temprana, patrón metastásico impredecible y agresividad del tumor con 80% de los casos de mal pronóstico.6,16 El patrón metastásico impredecible se refiere a las diferencias en la incidencia de los sitios de metástasis del tumor primario desconocido respecto al tumor primario conocido. Por ejemplo, el carcinoma pancreático con presentación de tumor primario desconocido tiene cuatro a cinco veces más incidencia de afectación pulmonar y ósea que el carcinoma pancreático conocido. Hasta ahora podemos reconocer que las metástasis al hígado suelen tener origen en el tubo gastrointestinal, los pulmones y las mamas, mientras que las metástasis pulmonares suelen originarse en el tubo gastrointestinal, las mamas, los riñones o la próstata; éstos resultan sólo sugerentes y desde luego insuficientes para tomar decisiones clínicas; de esta manera, resaltamos la importancia de la complementación con estudios paraclínicos, auxiliares de imagen, inmunohistoquímica y, desde luego, los prometedores estudios moleculares. En el Cuadro 3 17 se describe la clasificación convencional de acuerdo con los grupos de estudios internacionales recientes.
Cuadro 3 Clasificación clínico-patológica del tumor primario desconocido
| Localización-órgano | Tipo | Histología |
|---|---|---|
| Hígado u otros órganos gastrointestinales | No aplicable | Adenocarcinoma (escasamente diferenciado) |
| Mediastinal-retroperitoneal (distribución de la línea media) | Carcinoma (indiferenciado-escasamente diferenciado) | |
| Nódulos linfáticos | Axilar, cervical | Células escamosas (escasamente diferenciado o bien diferenciado) |
| Inguinal | Carcinoma escamoso o mixto (indiferenciado) | |
| Cavidad peritoneal | Carcinoma peritoneal en mujer | Carcinoma papilar o adenocarcinoma bien diferenciado |
| Ascitis maligna de otro origen desconocido | Adenocarcinoma productor de mucina (escasa o moderadamente diferenciado) | |
| Pulmones | Metástasis pulmonares | Adenocarcinoma (o varios grados de diferenciación) |
Tomado de la referencia 17.
El papel de la clínica y los estudios de gabinete básicos
Son indispensables la historia clínica completa y la exploración física exhaustivas. La semiología debe incluir cabeza, cuello, tiroides, exploración pélvica y examen rectal; en mujeres las mamas y la pelvis y en hombres la próstata y los testículos. Inicialmente debe solicitarse biometría hemática y química sanguínea. Debe incluirse radiografía de tórax (aunque no es útil para diferenciar entre enfermedad primaria o metástasis). Como regla general, todo paciente deberá contar con tomografía de tórax, abdomen y pelvis. Si hay signos, síntomas o alteraciones que orienten hacia la localización del tumor primario se realizarán de forma opcional las pruebas diagnósticas que se consideren indicadas.1,2,6,8
La endoscopia de oídos, nariz y garganta con toma de biopsias está indicada en pacientes con daño de ganglios linfáticos cervicales. En los pacientes con carcinoma epidermoide primario desconocido con daño de los ganglios linfáticos cervicales superiores o medios debe sospecharse el origen en la cabeza y el cuello. En estos pacientes la evaluación debe incluir la visualización directa de la orofaringe, la nasofaringe, la laringe y el esófago superior con toma de biopsia de áreas sospechosas.
La broncoscopia está indicada en caso de hallazgos en la radiografía de tórax o en presencia de síntomas. El daño de los ganglios linfáticos cervicales inferiores o supraclaviculares sugiere origen en el pulmón. En ocasiones un cáncer epidermoide tiene como manifestación inicial daño de los ganglios linfáticos inguinales. En estos casos el primario frecuentemente se localiza en el área ano-rectal o perineal.1 En estos pacientes la evaluación debe incluir anoscopia y colposcopia en búsqueda de origen primario en la vulva, el cuello uterino, la vagina, el pene o el ano. Los pacientes con carcinoma poco diferenciado o adenocarcinoma poco diferenciado constituyen un grupo de edad menor generalmente, con tumores comúnmente localizados en el mediastino y los ganglios linfáticos periféricos. En este grupo de pacientes está indicada la realización de tomografía de tórax y medición de alfa-feto-proteína y gonadotropina coriónica humana. Otro grupo especial son las mujeres con metástasis a ganglios linfáticos axilares quienes deben realizarse mastografía. En el Cuadro 4 18 se resume el protocolo básico de abordaje en sospecha de tumor primario desconocido.
Cuadro 4 Investigación requerida para la búsqueda del tumor primario desconocido
Tomado de la referencia 19.
Estudios de imagen especializados
Debido a la naturaleza heterogénea de la enfermedad no existe un patrón de referencia de estudio de imagen específico que ayude a agilizar el diagnóstico del paciente. Lo redituable en estos casos es un estudio de imagen global para su pronta localización. En la práctica diaria la tomografía computada y la resonancia magnética representan los estudios más usados con este objetivo.20 La combinación de tomografía con emisión de positrones (TC-PET) y 18-fluorodesoxiglucosa ha ganado mucha aceptación en el diagnóstico del tumor primario desconocido. Las lesiones pequeñas en los tejidos pudieran no ser detectadas por la tomografía computada o la resonancia magnética; sin embargo, la TC-PET proporciona información metabólica y funcional según las guías internacionales de medicina nuclear; a pesar de lo comentado, la TC-PET no es una herramienta sugerida como necesaria en el abordaje inicial, es más bien complementaria, con un papel relevante inicial sólo para el abordaje en la variedad clínica de carcinoma de células escamosas con ganglio cervical.21
Uso de las técnicas de inmunohistoquímica en el diagnóstico diferencial, tendencias en la clasificación del tumor primario desconocido y perspectivas
El dogma central en la oncología es establecer el diagnóstico de la neoplasia con la ayuda del estudio histopatológico. Tradicionalmente es sencillo realizar el diagnóstico de los tumores primarios y las metástasis de primario conocido; sin embargo, en el caso del tumor primario desconocido las características morfológicas son poco usuales y raramente contribuyen al diagnóstico. Con la microscopia de luz inicialmente se clasificaron los cuatro grandes grupos comentados.
El papel de la inmunohistoquímica es primordial para la correcta subclasificación de las grandes categorías; el patólogo experto sigue los cuatro pasos para su correcta clasificación.6,22,23 El primer paso es identificar de las grandes categorías el tipo de tumor. De resultar un carcinoma un panel de 19 anticuerpos puede ayudar a reclasificar el tipo de tumor (Cuadro 5). El segundo paso es encontrar el perfil de antígeno anti-citoqueratina (anti CK7, CK20) que ayuda a distinguir el mimetismo del tumor primario desconocido de carcinomas primarios, como se ilustra en el Cuadro 6. La aplicación de estos dos marcadores es relevante por encontrarse en 30 a 40% de todos los carcinomas. En el estudio de Dennis y colaboradores24,25 se encontró el diagnóstico correcto en 88% de los carcinomas metastásicos aplicando un algoritmo de 10 marcadores inmunohistoquímicos; esto conduce al tercer paso de la subtipificación del tumor de acuerdo con la línea celular (epitelial, melanocítica, mesenquimatosa, germinal). Los marcadores específicos son Ca 125, CDX2, citoqueratina-7 y 20, receptor de estrógenos proteína 15 del quiste grueso, lisozima, mesotelina, antígeno prostático específico y el factor de transcripción tiroideo (Cuadro 6) de los que derivan al menos otros 13 marcadores inmunoespecíficos que ayudan a mejorar la especificidad y sensibilidad en el diagnóstico de la enfermedad, lo que constituye el cuarto paso definitivo en el diagnóstico.
Cuadro 5 Marcadores inmunohistoquímicos de tamizaje para el diagnóstico de tumor primario desconocido
| Tipo de tumor | Citoqueratina | EMA | LCA | Vimentina | PS 100 | PLAP |
|---|---|---|---|---|---|---|
| Carcinoma | + | + | - | - | - | - |
| Linfoma | - | - | + | + | - | - |
| Sarcoma | - | - | - | + | - | - |
| Melanoma | - | - | - | + | + | - |
| No seminoma | + | - | - | - | - | + |
| Seminoma | - | - | - | - | - | + |
EMA: antígeno de membrana epitelial; LCA: antígeno común leucocitario; PLAP: fosfatasa alcalina placentaria.
Cuadro 6 Perfil de antígeno anti-citoqueratina
| Perfil de citoqueratina | CK20-negativo | CK-20 positivo |
|---|---|---|
| CK-7 positivo |
Cáncer de pulmón (80%, TIF1-positivo) Cáncer de mama (ER, PR, HER2) Cáncer no mucinoso de ovario Cáncer endometrial Cáncer tiroideo Colangiocarcinoma Cáncer de páncreas |
Cáncer pancreático Cáncer vesical Cáncer gástrico Colangiocarcinoma |
| CK-7 negativo |
Hepatocarcinoma Carcinoma de células renales Cáncer de próstata Cáncer gástrico |
Cáncer de colon Cáncer de ovario mucinoso |
CK: citoqueratina; ER: receptor de estrógeno; PR: receptor; TIF1: factor de transcripción tiroideo 1.
Debido al amplio espectro de mutaciones de novo y la conducta insidiosa de los mismos, Varadhachary y su grupo,20 y recientemente Greco y Hainsworth26 propusieron el logaritmo inmunohistoquímico orientativo en la clasificación del tumor primario desconocido, que influye en el tratamiento y los resultados al mismo a largo plazo (Figura 2).
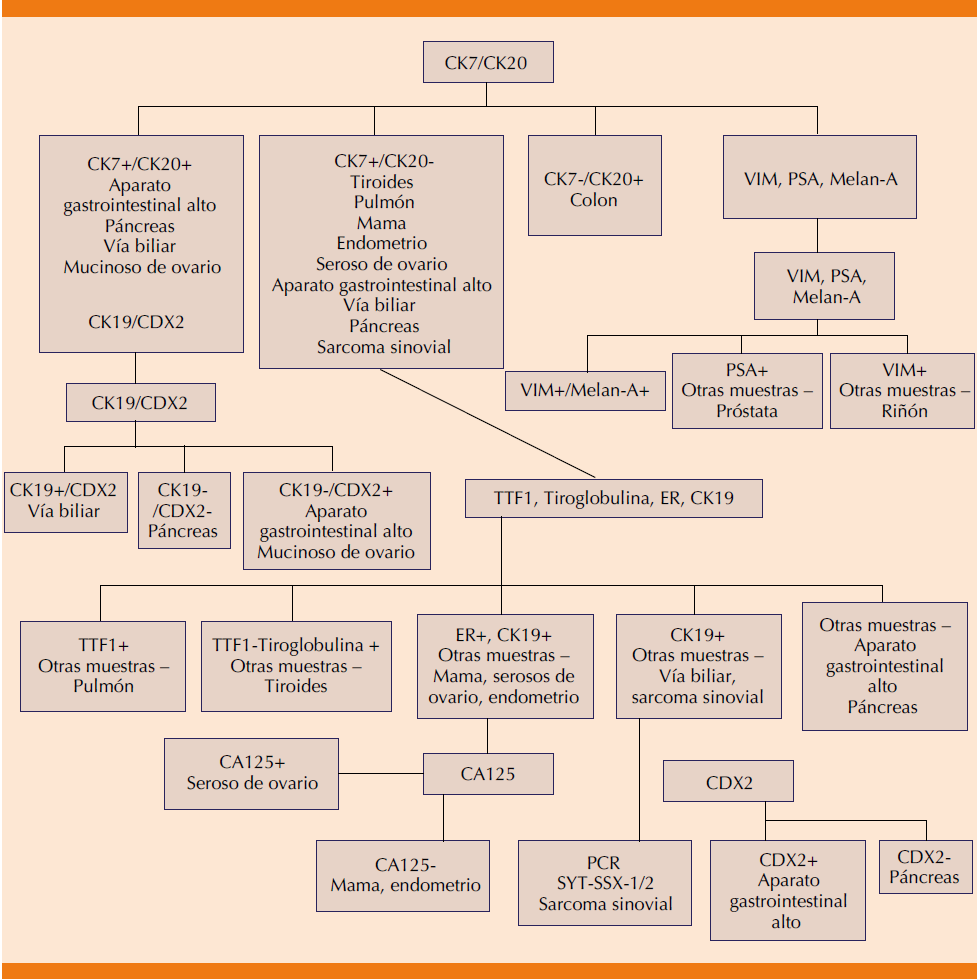
Figura 2 Modelo propuesto por Varadhachary y modificado por Greco y Hainsworth para establecer el fenotipo del tumor primario desconocido.
El uso rutinario de la evaluación de perfiles genéticos también puede ayudar a identificar un tumor primario por medio de un tratamiento sistémico que incluya blancos terapéuticos es, al momento, una realidad. Como dato, las pruebas de expresión genética múltiple que están en desarrollo han mostrado ser una poderosa herramienta en el diagnóstico pronto del tumor primario desconocido. Tothill y su grupo27 describieron un sistema de clasificación basado en la expresión de ensayos de microarreglos que envuelven 79 genes con identificación de cinco tipos de tumores usando bases de marcadores genéticos realizados por Ma y colaboradores. Asimismo, Horlings y su grupo28 desarrollaron un clasificador denominado Cuprint® que envuelve al menos 495 genes encontrados en ciertos lugares de Holanda (Ámsterdam, Agendia) como herramienta de uso diario para la práctica clínica; en contraste con el clasificador Pathwork® TOO Test, que es capaz de identificar 12 estirpes tumorales con al menos 1550 genes; estas herramientas se han validado en estudios multicéntricos que encuentran resultados similares a la clasificación hecha por los cuatro pasos comentados, la ventaja de estos últimos es el tiempo del diagnóstico, debido a que los costos económicos de ambos son similares.
La descripción de las subtipificaciones con base en los múltiples protocolos de la patología molecular divide al tumor primario desconocido en dos grandes entidades desde 2003: favorables y no favorables.29 Las entidades del tumor primario desconocido definidas como fenotipos favorables incluyen el carcinoma de nódulos linfáticos cervicales, adenocarcinoma de nódulos linfáticos axilares en la mujer, carcinoma escasamente diferenciado de retroperitoneo o de mediastino en hombres jóvenes, adenocarcinomatosis peritoneal papilar serosa y los carcinomas neuroendocrinos escasamente diferenciados.
Entre los subtipos denominados no favorables están el adenocarcinoma con metástasis a hígado o a otros órganos, carcinoma escasamente diferenciado, carcinomatosis peritoneal no papilar (adenocarcinoma), metástasis cerebrales múltiples (adenocarcinoma o carcinoma escamoso), metástasis pleurales o pulmonares múltiples (adenocarcinoma), enfermedad ósea metastásica múltiple (adenocarcinoma) y el adenocarcinoma escamoso de cavidad abdominal.
Pronóstico y tratamiento del tumor primario desconocido
El objetivo primordial del protocolo patológico es la búsqueda de subgrupos tumorales tratables (menos de 15% de los pacientes) que pueden lograr una respuesta favorable al tratamiento sistémico o local y obtener un mejor pronóstico. Sin embargo, 85% de los pacientes no entran en los subgrupos favorables y son usualmente tratados con quimioterapia con base en platinados de manera empírica; estos subtipos no son quimiosensibles y el tiempo de supervivencia de estos pacientes es corto.2,6,16,18 En los pacientes que no fueron sometidos a regímenes quimioterapéuticos de los estudios controlados, el promedio varía entre dos y tres meses. Se comentan brevemente los tratamientos de algunos de los subtipos favorables con base en los protocolos internacionales.19
Paciente femenina con adenocarcinoma que afecta un nódulo axilar
Estas pacientes deben ser tratadas con disección axilar completa, radioterapia ipsilateral que incluya la región mamaria seguida de quimioterapia coadyuvante, hormonoterapia dependiendo de los factores de riesgo o ambas. Las pacientes asignadas a este protocolo tienen tasas de remisión de la enfermedad aceptables (40-55%). La supervivencia de las pacientes que reciben radioterapia única versus terapia sistémica coadyuvante es similar en ambos grupos.30
Carcinomatosis peritoneal con componente papilar
Esta población de pacientes (que padecen adenocarcinoma peritoneal) debe tratarse con los esquemas similares al cáncer de ovario estadio III-IV de acuerdo con los protocolos de la Federación Internacional de Ginecología y Obstetricia (FIGO), la cirugía citorreductora seguida de platinados y paclitaxel como tratamiento de elección. La tasa media de respuesta es de 80% con 30% a largo plazo y supervivencia de 36 meses, baja en comparación con la de las pacientes que tuvieron primario de ovario.31
Carcinoma escamoso con linfoadenopatías cervicales
Los pacientes con enfermedad en estadio N1 o N2a sin extensión extracapsular deben tratarse con cirugía únicamente que incluya biopsia por escisión, con disección radical y amigdalectomía bilateral. El control locorregional es de 80 a 90% a cinco años con supervivencia del mismo periodo de 65%. La radioterapia coadyuvante se considera si hay extensión extranodal o una reestadificación N2b, linfoadenopatías fijas a estructuras vitales y bajo estado funcional global. Los campos de irradiación incluyen los relevos ganglionares (65-70 Gy), sitios no afectados adyacentes (50 Gy) y las mucosas (50-60 Gy), la quimioterapia se reserva para estadios N2-N3 con base en platinados.32
Carcinomas neuroendocrinos escasamente diferenciados
Estos pacientes deben tratarse con quimioterapia mediante cisplatino y derivados o cisplatino-taxanos, con respuesta de 55%, respuesta completa de 20% y supervivencia de 15% del primer grupo de pacientes.33
Adenocarcinoma con perfil colónico
Este subtipo debe ser tratado con el esquema quimioterapéutico de un carcinoma colorrectal en estadio avanzado (esquema FOLFOX, ácido folínico, flouracilo y oxiplatino). La tasa de respuesta es de 50% con únicamente 15% de respuesta completa y 35% de respuesta parcial, con supervivencia media de 21-37 meses.19
Subtipos desfavorables
Desafortunadamente este grupo representa 80% de los casos. Las series demuestran tratamientos empíricos sustentados en combinaciones de cisplatino y taxanos. La respuesta a la terapéutica es de 20% con supervivencia de seis meses. La coadyuvancia con anticuerpos antiangiogénicos como erlotinib y bevacizumab logra respuesta terapéutica de 53% e incremento de la supervivencia incluso de 13 meses.34 La administración de bevacizumab y erlotinib en biterapia de segunda línea no es efectiva, con supervivencia media de siete meses y sólo 10% de respuesta al esquema. Además, se han realizado estudios que buscan identificar blancos potenciales a tratar mediante técnicas como FISH y CISH (Cuadro 7);35 sin embargo, se carece de ensayos clínicos que demuestren su eficacia, sustentándose sólo teóricamente.
Cuadro 7 Mutaciones blanco a terapia específica en tumor primario desconocido
| Gen propuesto | Tasa de amplificación | Fármaco a administrar |
|---|---|---|
| cMET | 8/577 (1%) | TKI (inhibidores de tirosin- cinasa) |
| EGFR | 83/490 (17%) | Anticuerpos anti-EGFR |
| HER2 | 42/879 (5%) | Anticuerpos anti-HER2 |
| PIK3CA | 1/7 (14%) | TKI vía PAM |
| TOP2A | 4/151 (3%) | Antraciclinas |
| ALK | 0/108 (0%) | Ceritinibx (TKI) |
| ROS1 | 0/12 (0%) | Crizotinib (TKI) |
Tomado de la referencia 35.
El Cuadro 8 resume el promedio de vida de los denominados subtipos favorables de tumor primario desconocido sometidos a los regímenes estándar de manejo médico-quirúrgico. En el Cuadro 9 se proponen los esquemas de tratamiento de estos subtipos y brevemente se describen las opciones terapéuticas de los no favorables que aumentan la supervivencia.
Cuadro 8 Promedio de supervivencia de acuerdo con el subtipo de tumor primario desconocido reportado en las series internacionales
| Subtipo de tumor primario desconocido | Supervivencia |
|---|---|
| Paciente femenina con adenocarcinoma que envuelve nódulos linfáticos axilares | Media de supervivencia a 5 años: 72% |
| Paciente femenina con adenocarcinoma papilar de cavidad peritoneal | Media de supervivencia a 5 años: 36 meses (2-6 meses menos que el cáncer primario de ovario) |
| Carcinoma escamoso que envuelve nódulos cervicales | Media de supervivencia a 5 años: 60-65% |
| Carcinoma neuroendocrino escasamente diferenciado | Media de supervivencia: 15.5 meses con 2 años 33-50%. Sobrevivencia larga 10-15% |
| Adenocarcinoma con comportamiento de cáncer de colon | Media de supervivencia: 20-36 meses |
Cuadro 9 Pautas terapéuticas del tumor primario desconocido de acuerdo con los grupos de estudio internacionales
| Subtipos de tumor primario desconocido | Tratamiento recomendado de acuerdo con las guías ESMO (European Society for Medical Oncology) |
|---|---|
| Carcinoma neuroendocrino escasamente diferenciado | Quimioterapia combinada de etopósido y platinados |
| Adenocarcinoma peritoneal seroso papilar | Reducción quirúrgica de masa tumoral voluminosa seguida de citorreducción con base en cisplatino y taxanos |
| Metástasis aisladas axilares nodales | Disección nodal axilar radical, mastectomía o radioterapia locorregional más quimio-hormonoterapia coadyuvante |
| Carcinoma escamoso que envuelve nódulos linfáticos cervicales | Disección radical y radioterapia total del cuello en estadios avanzados, quimioterapia de inducción con combinación de cisplatino, quimiorradiación o ambos |
| Adenocarcinoma de perfil colónico | Regímenes de quimioterapia contra cáncer de colon |
| Paciente masculino con metástasis óseas blásticas con expresión de antígeno prostático | Terapia de privación de andrógenos + radioterapia |
| Único deposito metastásico de origen desconocido | Resección, radioterapia local (o ambas) + terapia sistémica |
| Subtipos no favorables | Quimioterapia empírica basada en cisplatino |
CONCLUSIONES
Las limitaciones en el diagnóstico y tratamiento del tumor primario desconocido permanecen en constante cambio en comparación con el resto de los tumores primarios. Los estudios clínicos con distribución al azar en los que se compara la totalidad en la supervivencia y progresión con la quimioterapia empírica versus personalizada pueden definir el estándar de cuidados en estos pacientes. Los ensayos diagnósticos han mejorado en la última década con la introducción de múltiples herramientas moleculares en la patología clásica que ayudan a realizar un diagnóstico temprano del gran espectro que tiene la enfermedad. A pesar de estos avances la mortalidad en los subtipos no favorables no se ha modificado, por lo que se necesita mejor comprensión del sustrato fisiopatológico para aumentar la supervivencia y posiblemente lograr la curación en estos casos. El reto para el clínico avezado es siempre tener la pericia para la sospecha del diagnóstico y conocer el camino para encontrarlo. El perfil epigenético esperado para un tumor que inicialmente se identifica como metastásico promete auxiliar para reclasificar un tumor primario desconocido, considerando que los perfiles de expresión epigenética del ADN son sumamente estables en condiciones de fijación e inclusión en parafina, y se proyectan como susceptibles para su interpretación y análisis de uso clínico, además, estas condiciones permitirán analizar muestras con cierta antigüedad para correlacionar con las datos ya conocidos.











 nueva página del texto (beta)
nueva página del texto (beta)



