JUSTIFICACIÓN
La esclerosis múltiple es una de las principales enfermedades desmielinizantes del sistema nervioso central, que repercute no solo en lo económico, sino también en lo social. Su causa aún no está clara del todo y los síntomas son muy variados, por lo que su diagnóstico exige el cumplimiento de una serie de criterios clínicos y de imágenes de resonancia magnética. No hay curación para la enfermedad, pero sí tratamientos que modifican su evolución.1 El Instituto de Seguridad y Servicios Sociales de los Trabajadores del Estado (ISSSTE) dispone de la mayor parte de ellos y para optimizar su uso, un grupo de neurólogos de la institución se reunió para la realización de un documento sobre aspectos generales de diagnóstico y tratamiento denominado: Consenso para el diagnóstico y tratamiento de la esclerosis múltiple en pacientes del ISSSTE.
OBJETIVO
El objetivo de este documento es recomendar los lineamientos generales para los médicos neurólogos que atienden pacientes con esclerosis múltiple en las unidades del ISSSTE que cuentan con atención neurológica, con el fin de optimizar los recursos de diagnóstico y tratamiento y repercutir favorablemente en la evolución de los derechohabientes del ISSSTE con esta enfermedad.
METODOLOGÍA
Se convocaron dos reuniones a las que asistieron neurólogos adscritos a los servicios de neurología de varios hospitales del ISSSTE, donde se expuso la situación actual de la esclerosis múltiple en esta institución, se designaron grupos de trabajo, que desarrollaron los temas que a continuación se exponen.
Además, se hizo una búsqueda de artículos de revisión de esclerosis múltiple y los diferentes aspectos de su tratamiento de los últimos diez años en los buscadores TRIPDATABASE y PUBMED, para el tratamiento modificador de enfermedad y para el tratamiento sintomático de sus principales manifestaciones.
ANTECEDENTES
Alrededor de dos millones de personas en todo el mundo tienen esclerosis múltiple y, de acuerdo con los datos de la Organización Mundial de la Salud (OMS), la prevalencia promedio estimada de esclerosis múltiple en el mundo es de 33 casos por 100,000 habitantes; la mayor prevalencia se encuentra en América del Norte, de 140 casos por 100,000 y 108 en Europa, mientras que en la región subsahariana de África es de 2.1 y del este de Asia de 2.2.2
Factores de riesgo y ambientales de esclerosis múltiple
Existen factores asociados con la esclerosis múltiple, entre los que están: infección viral, existencia del alelo DRB1*15 que confiere un OR de esclerosis múltiple de 2.7,3 deficiencia de vitamina D, obesidad, detección de anticuerpos anti-EBNA1, mientras que la exposición a otros virus, como citomegalovirus o herpes virus simple no parecen tener relación clara. La conjunción de tres factores de riesgo, HLA-DRB1*15, exposición viral y concentraciones bajas de vitamina D se asocian con riesgo de esclerosis múltiple pediátrica.4,5
Situación de la esclerosis múltiple en el ISSSTE
El ISSSTE cuenta con 14 hospitales regionales/ hospitales de alta especialidad que tienen servicio de neurología y que atienden a pacientes con esclerosis múltiple (Figuras 1 y 2).

CMN: Centro Médico Nacional; HR/HAE: hospital regional/hospital de alta especialidad; HG: hospital general; CH: centro hospitalario; CE: clínica de especialidades; CMFE: clínica de medicina familiar conespecialidades; CMF: clínica de medicina familiar; UMF: unidad de medicina familiar; CAF: consultorio de atención familiar: CMCT: consultorio médico en centro de trabajo.
Tomado delCatálogo único de Unidades Médicas del ISSSTE, diciembre, 2015. http://www.issste.gob.mx/images/downloads/todo-el-publico/umedicas/Catalogo_unico_unidades_medicas_dic_2016final.pdf.
Figura 1 Modelo de atención del ISSSTE.

Datos tomados del Catálogo único de Unidades Médicas del ISSSTE, diciembre, 2015. http://www.issste.gob.mx/images/downloads/todo-elpublico/umedicas/Catalogo_unico_unidades_medicas_dic_2016final.pdf.
Figura 2 Número de hospitales regionales y de alta especialidad que tienen servicio de neurología.
La prevalencia de esclerosis múltiple en México varía entre los hospitales que la reporten, por ejemplo, Alter y Olivares publicaron en 1970 una prevalencia de 1.6 casos por 100,000 habitantes en el Hospital 20 de Noviembre del ISSSTE de la Ciudad de México cuando no existía la resonancia magnética y se omitían diagnósticos; años después, Corona reportó 13 casos por 100,000 habitantes en el Instituto Nacional de Neurología y Neurocirugía en la Ciudad de México,7 mientras que Velázquez reportó 12 casos por 100,000 habitantes en un Hospital del Instituto Mexicano del Seguro Social en Chihuahua, México, y De la Maza reportó 30 casos por 100,000 habitantes en Monterrey, México.
Hasta diciembre de 2018 se capturaron en el Sistema Integral de Abasto de Medicamentos (SIAM), un total de 1299 pacientes con diagnóstico de esclerosis múltiple distribuidos en todo el país,8 lo que representa aproximadamente 20% de la consulta total de neurología (25% en el Centro Médico Nacional 20 de Noviembre), la mayoría de los pacientes del sexo femenino (Cuadros 1 a 4).
Cuadro 1 Tratamiento modificador de la enfermedad en pacientes con esclerosis múltiple. Censo enero de 2019
| Fármaco | Número de pacientes |
|---|---|
| Acetato de glatiramer | 237 |
| Interferón beta 1b 8 millones | 226 |
| Natalizumab | 196 |
| Fingolimod | 192 |
| Teriflunomida | 162 |
| Interferón beta 1 a 22 µg | 155 |
| Interferón beta 1 a 30 µg (6 millones) intramuscular | 87 |
| Interferón beta 1 a 44 µg (12 millones) | 44 |
| Total | 1299 |
Datos tomados del Sistema Integral de Abasto de Medicamentos (SIAM), datos a diciembre de 2018.8
Cuadro 2 Número de pacientes adultos con esclerosis múltiple en 2018*
| Hospital | Ciudad | Núm. de neurólogos (adultos) | Núm. de pacientes consulta neurológica en un mes en promedio (adultos) | Núm. de pacientes con esclerosis múltiple que acuden a consulta por primera vez en un mes en promedio (adultos) | Total de pacientes adultos diagnosticados actualmente con esclerosis múltiple | Núm. de pacientes diagnosticados con esclerosis múltiple primaria progresiva | Núm. de pacientes diagnosticados con esclerosis múltiple remitente recurrente | Núm. de pacientes diagnosticados con esclerosis múltiple secundaria progresiva | Núm. de pacientes adultos diagnosticados con esclerosis múltiple en tratamiento | Tratamientos modificadores de la enfermedad contra esclerosis múltiple con los que se cuenta actualmente para adultos |
|---|---|---|---|---|---|---|---|---|---|---|
| Centro Médico Nacional 20 de Noviembre | CDMX | 6 | 650 | 5 | 275 | 1 | 220 | 55 | 275 | IFN 1b de 6, 8 y 12 millones, AG, TFM, NTZ, FTY, RTX, AZA, MTZ, DMF |
| Hospital Regional Dr. Valentín Gómez Farías | Zapopan | 4 | 900 | 1 a 2 por mes | 80 | 1 | 73 | 72 | IFN de 6, 8 y 12 millones AG, TFM, NTZ, FTY, AZA, MTZ | |
| Hospital Regional Lic. Adolfo López Mateos | CDMX | 4 | ||||||||
| Hospital Regional | Monterrey | 3 | 780 | 2 | 86 | 1 | 85 | 0 | 86 | IFN β 1a 6mio SC e IM, IFNβ 1b 8 mio SC, AG, TFM, NTZ, FTY, MTZ |
| Hospital Regional | Veracruz | 2 | 60 | 0.83 | 12 | 0 | 10 | 2 | 11 | IFN de 8 y 12 millones, AG, FTY, NTZ, AZA, RTX |
| Hospital General Dr. Santiago Ramón y Cajal | Durango | 2 | 120 | 0.083 | 30 | 0 | 24 | 6 | 30 | IFN de 8 y 12 millones: AG, FTY, NTZ, AZA, RTX |
| Clínica Hospital Dr. Miguel Trejo Ochoa | Colima | 1 | 240 | 0.083 | 10 | 0 | 0 | 10 | IFN β1a 6 mio IM, IFN β 1a 6 mio SC, IFN β 1b 8 mio SC, AG, NTZ, FTY, TFM | |
| Hospital General | SLP | 2 | 540 | 0.2 | 33 | 4 | 24 | 5 | 33 | IFN 1a, IFN 1b, IFN 6millones: AG, NTZ, FTY, TFM |
| Total | 24 | 3290 | 8.20 | 526 | 7 | 446 | 68 | 517 | ||
| Porcentaje | 0.25% | 16.0% | 1.3% | 84.8% | 12.9% | 98% |
*Datos proporcionados por los neurólogos que asistieron al consenso (24-25 agosto, 2018).
IFN: interferón; AG: acetato de glatiramer; TFM: teriflunomida; NTZ: natalizumab; FTY: fingolimod; RTX: rituximab; AXA: azatioprina; MTZ: mitoxantrona; DMF: dimetil- fumarato; SC: subcutáneo; IM: intramuscular; mio: millones.
Cuadro 3 Número de pacientes pediátricos con esclerosis múltiple en 2018*
| Hospital | Ciudad | Neuropediatras | Núm. De pacientes consulta neurológica en un mes en promed o (niños) | Núm. de pacientes con esclerosis múltiple que acuden a consulta por primera vez en un mes en promedio (niños) | Total de pacientes pediátricos diagnosticados actualmente con esclerosis múltiple | Núm. De pacientes diagnosticados con esclerosis múltiple primaria progresiva | Núm. De pacientes diagnosticados con esclerosis múltiple secundaria progresiva | Núm. De pacientes diagnosticados con esclerosis múltiple secundaria progresiva | Núm. De pacientes pediátricos diagnósticados con esclerosis múltiple en tratamiento | Tratamientos modificadores de la enfermedad contra esclerosis múltiple con los que se cuenta actualmente para niños |
|---|---|---|---|---|---|---|---|---|---|---|
| Centro Médico Nacional 20 de Noviembre | CDMX | 3 | 200 | 1 | 16 | 0 | 3 | 16 | 16 | IFN 6, 8 y 12 millones, AG, TFM, NTZ, FTY, RTX, AZA, MTZ, DMF |
| Hospital Regional Dr. Valentín Gómez Farías | Zapopan | 1 | 250 | 0.5 | 6 | 0 | 6 | 6 | IFN 6, 8 y 12 millones, AG, TFM, NTZ,FTY, AZA, MTZ | |
| Hospital Regional Lic. Adolfo López Mateos | CDMX | 3 | 350 | 0.17 | 2 | 0 | 2 | 2 | IFN 6, 8 y 12 millones, AG, TFM, NTZ, FTY, RTX, AZA, MTZ, DMF | |
| Hospital Regional | Veracruz | 0 | 20 | 0 | 0 | 0 | 2 | 0 | 0 | |
| Hospital General Dr. Santiago Ramón y Cajal | Durango | 0 | El servicio de neuropediatría se subroga | 0 | 6 | |||||
| Clínica Hospital Dr. Miguel Trejo Ochoa | Colima | 0 | 50 | 0 | 0 | 0 | 0 | 0 | 0 | |
| Hospital General | SLP | 0 | 40 | 0 | 0 | 0 | 5 | 0 | 0 | |
| Total | 7 | 910 | 1.67 | 24 | 0 | 16 | 24 | 24 | ||
| % | 0.18% | 2.6% | 0.0% | 67.5% | 100.0% | 100.0% |
*Datos proporcionados por los neurólogos que asistieron al consenso (24-25 agosto, 2018).
IFN: interferón; AG: acetato de glatiramer; TFM: teriflunomida; NTZ: natalizumab; FTY: fingolimod; RTX: rituximab; AZA: azatioprina; MTZ: mitoxantrona; DMF: dimetilfumarato.
Cuadro 4 Herramientas diagnósticas y de seguimiento por hospital* (continúa en la siguiente página)
| Hospital | Ciudad | Número de nerólogos (adultos) | Neuro-pediatras | Herramientas disponibles en el hospital para el diagnóstico de esclerosis múltiple | ¿Cuenta con resonador? | En promedo, ¿cada cuánto tiempo dan seguimiento a los pacientes con esclerosis múltiple? | Herramientas para el seguimiento de los pacientes. ¿Datos clínicos, de gabinete, algún otro? | Neuropsicología | Otros | Necesidades no cubiertas |
|---|---|---|---|---|---|---|---|---|---|---|
| Centro Médico Nacional 20 de Noviembre | CDMX | 6 | 3 | C, RM, PEV, BOC (sesubrogan),OFT | Sí, cuentancon dos resonadores | Cada mes apacientes con NTZ; el resto cada 2.5 a 3 meses con cita abierta. Centro de referencia nacional | Estudios de laboratorio y gabinete, neuropsicología, rehabilitación, OCT, LOKOMAT | Sí (6 médicos residentes de neuropsicología y 3 médicos de base) | Sala de infusión y monitoreo | No hay área de rehabilitación neuropsicológica, terapia ocupacional, rehabilitación incompleta. No hay rehabilitación ni neuropsicólogos para niños. Bandas oligoclonales propias y no subrogadas. No hay determinación de CD19, JC |
| Hospital Regional Dr. Valentín Gómez Farías | Zapopan | 4 | 1 | C, RM, PEV, BOC, OFT | No, pero se subroga | Cada mes o tres meses: cada mes a pacientes con natalizumab; cada 6 meses los que van de Colima, Zacatecas, Tepic, Aguascalientes, Morelia, San Luis Potosí | Estudios de laboratorio y gabinete, así como neuropsicología | Sí (2 neuropsicólogos) | Rehabilitación, OCT, neurólogos | |
| Hospital Regional Lic. Adolfo López Mateos | CDMX | 4 | 3 | C, RM, PEV y BOC, los cuales se subrogan | Sí | En promedio cada tres meses | Estudios de laboratorio y gabinete, RM, PEV | No | PEV y BOC propios no subrogados; neuropsicología y neurorrehabilitación | |
| Hospital Regional | Monterrey | 3 | 0 | C, RM, PEV, BOC y OFT | Sí | Cada 30 o 60 días | C, RM y gabinete | No | Sala de infusión especial | Neuropsicología |
| Hospital Regional | Veracruz | 2 | 0 | C, RM, PEV | Si | FTY y NTZ mensualmente, IFN y AG cada 3 meses | Estudios de laboratorio y gabinete, PEV, RM, LOKOMAT | No | Las infusiones de medicamentos se realizan en urgencias | Comunicación interinstitucional con farmacia, bandas oligoclonales, neuropsicología: volumetría por resonancia y coherencia óptica. Problemática en el surtido de fármacos. Si los medicamentos no se otorgan en el tiempo indicado, los riesgos de los pacientes son muy altos |
| Hospital General Dr. Santiago Ramón y Cajal | Durango | 2 | 0 | Todos se subrogan | No, pero se subroga | En promedio cada dos meses | Estudios de laboratorio y gabinete. RM subrogada | No | Las infusiones de medicamentos se realizan en urgencias | PEV, BOC y RM propios no subrogados; no hay neurorehabilitación ni neuropsicología (se subrogan) |
| Clínica Hospital Dr. Miguel Trejo Ochoa | Colima | 1 | 0 | C, PEV, RM y BOC se subrogan | No, pero se subroga | En promedio cada dos meses | Estudios de laboratorio y gabinete, RM y BOC subrogados | Solo cuenta con psicólogo | Área especial de infusiones | No hay neurorrehabilitación ni rehabilitación neuropsicológica; RM Falta de medicamentos en ocasiones, no llegan |
| Hospital General | SLP | 2 | 0 | C, RM y PEV se subrogan | No, pero se subroga | Cada mes aproximadamente | Estudios de laboratorio y gabinete, RM | Si | Área especial De infusiones. Neurorrehabilitación | BOC |
* Datos proporcionados por los neurólogos que asistieron al consenso (24-25 agosto, 2018).
C: Clínica; RM: resonancia magnética; PEV: potenciales evocados visuales; IFN: interferón; AG: acetato de glatiramer; BOC: bandas oligoclonales; OFT: oftalmología; NTZ: natalizumab; FTY: fingolimod; TFM: teroflunomida; AZT: alentuzumab; OCZ: ocrelizumab; RTX: rituximab; CDB: cladribina; AZA: azatioprina; CFM: ciclofosfamida; OCT:tomografía de coherencia óptica; LOKOMAT: ortesis de marcha robotizada; JC: virus JC.
Diagnóstico
La esclerosis múltiple suele evolucionar en brotes (exacerbaciones y remisiones) que afectan diferentes regiones del sistema nervioso central, un brote es el episodio de déficit neurológico focal con duración de más de 24 horas, en ausencia de fiebre o infección. En los brotes comúnmente se observan síndromes característicos, como neuritis óptica, manifestaciones sensoriales, motoras o ambas de mielitis transversa parcial y síndromes de tallo, como la oftalmoplejía internuclear.9
En pacientes con un primer episodio agudo o subagudo con síntomas clínicos neurológicos sugerentes de trastornos desmielinizantes inflamatorios, con imágenes de resonancia magnética (IRM) también sugerentes de lesiones desmielinizantes se trata de un síndrome clínico aislado (CIS por sus siglas en inglés).9 No es común que la esclerosis múltiple tenga evolución progresiva, pero lo es, incluso, en 10% de los casos.
El diagnóstico de sospecha de la esclerosis múltiple es esencialmente clínico, pero es necesario hacer exámenes de laboratorio, como el perfil inmunológico y el reumatológico, entre otros, para descartar diagnósticos diferenciales de padecimientos que puedan causar lesiones multifocales en la imagen de resonancia magnética.10,11
Los criterios de McDonald apoyan fuertemente el diagnóstico y son universalmente aceptados,10 en ellos se insiste en que las manifestaciones clínicas y de imagen tengan diseminación en tiempo y en espacio;12 estos criterios fueron re- visados en 2017 y se incluyen en el Cuadro 5.13
Cuadro 5 Revisión de los criterios de McDonald 2017*,13
| Núm. de lesiones con evidencia clínica | Datos adicionales para el diagnóstico | |
|---|---|---|
| Dos o más ataques clínicos | Dos o más | ¿Ninguno? RM* |
| Dos o más ataques clínicos | Una, antecedente claro de un ataque previo con una lesión en una localización anatómica distinta | ¿Ninguno? RM* |
| Dos o más ataques clínicos | Una | DIS demostrada por un ataque clínico adicional en diferente sitio del sistema nervioso central o por resonancia magnética |
| Un ataque clínico | Dos o más | DIT demostrada por un ataque clínico adicional o por RM o la demostración de BOC en el LCR |
| Un ataque clínico | Una | DIS demostrada por un ataque clínico adicional en diferente sitio del SNC o por IRM y DIT demostrada por un ataque clínico adicional o por RM o la demostración de BOC en el LCR |
* Este grupo recomienda complementar el diagnóstico realizando imagen de resonancia magnética.
DIS: diseminación en espacio; DIT: diseminación en tiempo; RM: resonancia magnética; BOC: bandas oligoclonales; LCR: líquido cefalorraquídeo; SNC: sistema nervioso central.
Tomado de la referencia 13
Las lesiones de la esclerosis múltiple afectan la sustancia blanca periventricular predominantemente, pero también el cuerpo calloso, las fibras en U, los lóbulos temporales, el tallo cerebral, el cerebelo y la médula espinal. Estas lesiones suelen ser redondeadas o de forma ovoide y con sentido perpendicular al sistema ventricular (MAGNIMS) y las lesiones de la médula espinal son habitualmente laterales o posteriores, no abarcan más de dos cuerpos vertebrales y debe haber diseminación en tiempo y en espacio. Se habla de diseminación en espacio cuando se encuentran dos o más lesiones (sintomáticas o asintomáticas) en al menos dos de cuatro localizaciones del sistema nervioso central: yuxtacortical, periventricular, infratentorial y médula espinal. Con una sola resonancia que muestre lesiones sin reforzamiento y otras que refuerzan al gadolinio puede diagnosticarse diseminación en tiempo (Cuadro 6yFigura 3).14
Cuadro 6 Criterios de resonancia magnética para diagnóstico de esclerosis múltiple15
| Subtipo de esclerosis múltiple | Diseminación en el espacio | Diseminación en tiempo |
|---|---|---|
| Recurrente-remitente | Una o más lesiones en dos o más localizaciones características*Se consideran todas las lesiones sintomáticas y asintomáticas incluidas las de los síndromes de tallo cerebral y médula espinal | Uno de los criterios siguientes: Nuevas imágenes T2, lesión(es) que captan gadolinio en la IRM de seguimiento (o ambas), independientemente del tiempo de la IRM basal. Lesiones que captan gadolinio con lesiones que no lo captan |
| Primaria progresiva | Dos de los siguientes criterios: Una o más lesiones T2 en cuando menos un área característica de esclerosis múltiple (excluyendo la médula espinal).* Dos o más lesiones T2 en la médula espinal Bandas oligoclonales IgG, índice IgG elevado en el líquido cefalorraquídeo (o ambos) | Un año de progresión de la enfermedad (determinada prospectiva o retrospectivamente) |
*Las áreas para lesiones características de esclerosis múltiple incluyen la fosa posterior, regiones corticales-yuxtacorticales, regiones periventriculares y médula espinal.
IRM: imágenes por resonancia magnética. Modificado de la referencia 15.

Figura 3 Algoritmo diagnóstico de la esclerosis múltiple sugerido por los neurólogos que asistieron al consenso (24-25 agosto, 2018). RM: resonancia magnética; DIS: diseminación en espacio: DIT: diseminación en tiempo; TME: tratamiento modificador de la enfermedad; CIS: síndrome clínico aislado; BOC: bandas oligoclonales; PEM: potenciales evocados motores.
Tratamiento. Generalidades
El tratamiento de la esclerosis múltiple es complejo, porque debe considerarse si el paciente se encuentra en una recaída y la modificación de la enfermedad. El tratamiento puede ser cuando el paciente tiene un brote, para modificar la enfermedad o, bien, sintomático, además, existe la opción de prescribir tratamiento no farmacológico, como es la rehabilitación (Figura 4).
Tratamiento del brote: se recomienda la administración de metilprednisolona 1 g IV/día durante tres a cinco días de acuerdo con la severidad del brote. En caso de brotes muy severos puede requerirse plasmaféresis o inmunoglobulina.
El tratamiento modificador de la enfermedad inició en 1993 y actualmente hay tres generaciones de fármacos disponibles, cuya prescripción ha mejorado considerablemente el pronóstico y la calidad de vida de los pacientes con esclerosis múltiple. La evidencia ha mostrado la importancia del tratamiento temprano.
Tratamiento de los síntomas: la enfermedad puede causar una gran variedad de síntomas y de acuerdo con cada uno se decide el tratamiento.
Las recomendaciones generales son:
-
Iniciar el tratamiento modificador de la enfermedad de manera inmediata:
Una vez corroborado el diagnóstico de esclerosis múltiple sin importar la edad del paciente.
Para individuos con CIS e IRM consistentes con esclerosis múltiple, en quienes se han excluido otras causas posibles.
Para individuos con esclerosis múltiple progresiva que continúan con recaídas, demuestran actividad inflamatoria o ambas situaciones.
-
El tratamiento con un fármaco dado debe continuarse por tiempo indefinido a menos que ocurra alguna de las siguientes situaciones:
El acceso al tratamiento debe darse de manera individualizada, tomando en cuenta la edad, el género y el número de brotes. En los casos de esclerosis múltiple secundaria progresiva debe continuarse con el tratamiento establecido.
La ausencia de brotes durante el tratamiento no es justificación para suspenderlo.
El tratamiento no debe suspenderse porque pone en riesgo al paciente de recurrencia de actividad.
Tratamientos modificadores de la enfermedad en esclerosis múltiple
Los tratamientos modificadores de la enfermedad se incluyeron en el cuadro básico del ISSSTE a partir de 1998, el primer tratamiento fue el interferón beta 1a, posteriormente el interferón beta 1a intramuscular de 6 millones, el interferón beta 1b de 8 millones, el acetato de glatiramer, el natalizumab, el fingolimod, el interferón beta 1a de nueva reformulación y la teriflunomida en 2018 y se espera que para 2019 se incluyan alemtuzumab, ocrelizumab y cladribina (Figura 5).

Figura 5 Terapias modificadoras de la enfermedad contra la esclerosis múltiple en el ISSSTE. Recomendaciones del grupo de neurólogos que asistieron al consenso (24-25 agosto, 2018).
En el Cuadro 7 se describen cuáles son los tratamientos disponibles en la actualidad, aunque no todos están accesibles en México o en el ISSSTE, pero es conveniente conocerlos porque en un futuro pueden estarlo. Se plantea el mecanismo de acción de cada uno, así como sus eventos adversos y precauciones para su prescripción.
Cuadro 7 Tratamientos modificadores de la enfermedad en esclerosis múltiple (continúa en la siguiente página)
| TME | Mecanismo de acción | Eventos adversos | Precauciones |
|---|---|---|---|
| Interferón beta 1-b (IFN β1-b)16 0.25 mg (8 millones) subcutáneo (SC) cada tercer día Indicado en formas recurrentes de esclerosis múltiple secundaria progresiva | |||
| Interferón beta 1ª (IFNβ1a)17,18 22 mg (6 millones) y 44 mg (12 millones) SC 3 veces por semana Indicado en formas recurrentes de esclerosis múltiple | |||
| Interferón beta 1ª (IFNβ1a)19 6 millones 30 mg intramuscular (IM) cada semana Indicado en formas recurrentes de esclerosis múltiple | |||
| Acetato de glatiramer (AG)20 20 mg SC diario o 40 mg SC cada tercer día Indicado en formas recurrentes de esclerosis múltiple | |||
| Natalizumab (NTZ)21*/**/*** 300 mg intravenoso (IV) cada 28 días Indicación: esclerosis múltiple recurrente-remitente altamente activa | |||
| Fingolimod (FTY)22 0.5 mg vía oral (VO) diario Indicado en las formas remitente-recurrente de esclerosis múltiple. Administración pediátrica pendiente por COFEPRIS |
|
||
| Teriflunomida (TF)23 tabletas 7 o 14 mg VO diario. Formas remitentes recurrentes de esclerosis múltiple |
|
||
| Dimetilfumarato24 (DMF) tabletas 120 mg cada 12 h (inicio) 240 mg VO dos veces al día Indicación: esclerosis múltiple recurrente | |||
| Mitoxantrona (MX)25 Frasco ámpula de 20 mg/10 mL 12 mg/m2 IV c/3 meses Dosis acumulada: 140 mg/m2 Aprobado en varios países europeos y en Estados Unidos para el tratamiento de la esclerosis múltiple agresiva, EMSP, EMRP (esclerosis múltiple recidivante progresiva) p inducción 20 mg/mes/6 meses seguido por TME | |||
| Alemtuzumab (ATZ)26 */**/*** 12 mg/día IV por 5 días Un año después 12 mg/ día por 3 días Indicación: esclerosis múltiple recurrente, en casos de falla a dos o más TME |
|
|
|
| Daclizumab */**/***27 150 mg al mes Indicado en esclerosis múltiple recurrente especialmente tras falla a dos o más TME Restricción del fármaco por las agencias regulatorias actuales 201728 |
|
||
| Ocrelizumab (OCZ)29 */**/*** 300 mg/día 1er día: Inducción 300 mg IV 2º día: 300 mg IV Posteriormente 600 mg/ IV cada 6 meses Indicaciones EMRR altamente activa y esclerosis múltiple primaria progresiva (EMPP) | |||
| Rituximab (RTX)30*/**/*** 500 mg-1 g IV cada 6-12 meses. Indicaciones EMRR altamente activa - EMSP, EMPP y neuromielitis óptica (NMO) Indicaciones no aprobadas | |||
| Cladribina (CDB)31 Tabletas 10 mg EMRR altamente activa **/*** |
|
|
|
| Ciclofosfamida32 Indicación no aprobaba Pulsos mensuales de 250- 1500 mg/m2x12 meses, seguido por cursos bimensuales por un año |
* Se recomienda la premedicación con las siguientes terapias: natalizumab, ocrelizumab, alemtuzumab con algún esteroide como metilprednisolona, dexametasona o hidrocortisona; con algún analgésico como el paracetamol; con antihistamínicos como la loratadina o difenhidramina.
** Existe un grupo de pacientes que muestran comportamiento agresivo con deterioro rápido, con rápida acumulación de discapacidad motora y cognitiva a pesar de recibir algún tratamiento modificador de la enfermedad. Distintos autores han propuesto a este subgrupo como esclerosis múltiple altamente activa.
*** Terapias pulsadas: terapias aplicadas en pulsos y que ocasionan una fase de depleción inmunitaria selectiva o no selectiva y una fase de reconstitución, es decir, recuperación inmunitaria, entre los fármacos de aplicación pulsada se incluyen el alemtuzumab, el ocrelizumab y la cladribina.
Descripción de los tratamientos modificadores de la enfermedad en esclerosis múltiple
En los Cuadros 8a15 se describe la información más relevante de natalizumab, alemtuzumab, fingolimod, teriflunomida, dimetilfumarato, ocrelizumab y cladribina, así como los estudios clínicos más relevantes de cada uno.
Cuadro 8 Natalizumab
| Fármaco | Nombre comercial | Aprobación FDA | Aprobación EMA | Aprobación COFEPRIS | Clave institu- cional | Clase | Mecanismo de acción |
|---|---|---|---|---|---|---|---|
| Natalizumab (NTZ) | Tysabri® | Junio 2006 y enero 2008 | Junio 2006 | Mayo 2011 | 10000525700 | Anticuerpo monoclonal humanizado | Bloqueador de integrinas alfa 4 beta 1 y alfa 4beta 7 |
FDA: Food and Drug Administration; EMA: European Medicines Agency; COFEPRIS: Comisión Federal para la Protección contra Riesgos Sanitarios.
| Estudios clínicos de soporte | Descripción | Número de pacientes | Categoría | Dosis | Vía | Administración | Contraindicaciones | Eventos adversos |
|---|---|---|---|---|---|---|---|---|
| SENTINEL33 2003 | NTZ vs NTZ/interferónvs placebo | 1171 | Fase III | 300 mg | Infusión IV | Mensual | Inmunosupresión | Leucoencefalopatía multifocal progresiva |
| AFFIRM34 2006 | NTZ vs placebo | 942 | Fase III | 300 mg | Infusión IV | Mensual | Inmunosu presión | Inmunosupresión |
| GLANCE35 2014 | NTZ + AG vs placebo + AG | 110 | Fase II | 300 mg | Infusión IV | Mensual | Inmunosupresión | Reacción a la in- fusión. Cefalea, brote, nasofaríngeo, sinusitis, dolor lumbar |
| STRATA36 2014 | Estudio de seguridad de NTZ | 1094 | Fase III | 300 mg | Infusión IV | Mensual | Inmunosu presión | Leucoencefalopatía multifocal progresiva |
| TOP37 2014 | Programa de observa- ción de NTZ | Abierto 4821 | Fase IV | 300 mg | Infusión IV | Mensual | Inmunosupresión | Infecciones, reacción de hipersensibilidad, carcinomas, LMP, aborto, elevación de pruebas de función hepática |
| TYGRIS38 2015 | NTZ a largo plazo (cerrado en 2015) | 4938 (76% completaron 5 años) | Fase IV | 300 mg | Infusión IV | Mensual | Inmunosu presión | Infecciones de las vías urinarias, neumonía, LMP, síndrome de reconstitución inmunitaria inflamatoria |
| TOUCH38,39 2016 | NTZ y LMP | Abierto | Fase IV | 300 mg | Infusión IV | Mensual | Inmunosupresión | Aún sin informa-ción |
| STRATIFY 1402011 | Estudio de prevalencia del virus JC en pacientes con natalizumab | Abierto | Fase IV | 300 mg | Infusión IV | Mensual | Inmunosupresión | Prevalencia de JCV 50-60% |
| STRATIFY 241 | Estratificación de riesgo de LMP en pacientes con NTZ | Abierto | Fase IV | 300 mg | Infusión IV | Mensual | Inmunosupresión | |
| STRATIFY JVC Dx42 | Estratificación de riesgo de LMP en pacientes con NTZ | Fase IV | 300 mg | Infusión IV | Mensual | Inmunosu- presión |
NTZ: natalizumab; AG: acetato de glatiramer; LMP: leucoencefalopatía multifocal progresiva; JC: virus JC.
Cuadro 9 Alemtuzumab
| Fármaco | Nombre comercial | Aprobación FDA | Aprobación EMA | Aprobación COFEPRIS | Clave institucional | Clase | Mecanismo de acción |
|---|---|---|---|---|---|---|---|
| Alemtuzumab | Lemtrada® | Noviembre 2014 | Septiembre 2013 | Enero 2014 | Sin clave | Anticuerpo monoclonal humanizada | Bloqueador de antígeno CD 52 de timocitos en células NK (natural killer) y B |
| Estudios clínicos de soporte | Descripción | Número de pacientes | Categoría | Dosis | Vía | Administración | Contraindi- caciones | Eventos adversos |
|---|---|---|---|---|---|---|---|---|
| CAMMSS22343 | Alemtuzumab vs interferón | 334 | Fase II | 12 mg | Infusión IV | Aplicar por 5 días y repetir dosis similar por 3 días, 12 meses después | Precaución en niños | Inmunosupresión Trastornos autoinmunitarios Relacionado con eventos infecciosos se recomienda tratamiento con aciclovir previo y posterior a la primera aplicación |
| Care-MS144 | Alemtuzumabvs placebo | 386 | Fase III | 12 mg | Infusión IV | Alemtuzumab se administró una vez al día durante 5 días al inicio el estudio y una vez al día durante 3 días a los 12 meses | Reacciones asociadas con la infusión, infecciones leves a moderadas, infección por herpes (cutáneo), eventos relacionados con la tiroides | |
| Care-MS245 | Alemtuzumab | 435 | Fase III | 12 mg | Infusión IV | Alemtuzumab se administró una vez al día durante 5 días al inicio del estudio y una vez al día durante 3 días a los 12 meses | Reacciones asociadas con a infusión, infecciones, eventos relacionados con la tiroides |
Cuadro 10 Fingolimod
| Fármaco | Nombre comercial | Aprobación FDA | Aprobación EMA | Aprobación COFEPRIS | Clave institu- cional | Clase | Mecanismo de acción |
|---|---|---|---|---|---|---|---|
| Fingolimod | Gylenia® | Septiembre 2010 | Mayo 2013 | Marzo 2012 | 10000581500 | Inmunosupresor | Antagonista funcional del receptor S1P de los linfocitos |
| Estudios clínicos de soporte | Descripción | Número de pacientes | Categoría | Dosis | Vía | Administración | Contraindicaciones | Eventos adversos |
|---|---|---|---|---|---|---|---|---|
| FREEDOMS I46 | Fingolimod vs placebo | 854 | Fase III | 0.5 mg | Oral | Cada 24 horas | No en embarazo | Bradiarritmia |
| FREEDOMS II47 | Fingolimod vsplacebo | 728 | Fase III | 0.5 mg | Oral | Una vez al día | No en niños | Infecciones |
| TRANSFORMS48,49 | Fingolimod vsinterferón | 849 | Fase III | 0.5 mg/1.25 mg | Oral | Una vez al día | No en cardiopatías | Infecciones, cefalea, bradicardia, hipertensión, edema macular, elevación enzimas hepáticas |
| ACROSS50 | Estudio a largo plazo de fingolimod | 175 | Fase III | Oral | No aprobado en niños | Alteraciones hepáticas, linfomas, LMP |
LMP: leucoencefalopatía multifocal progresiva.
Cuadro 11 Teriflunomida
| Fármaco | Nombre comercial | Aprobación FDA | Aprobación EMA | Aprobación COFEPRIS | Clave ins- titucional | Clase | Mecanismo de acción |
|---|---|---|---|---|---|---|---|
| Teriflunomida | Aubagio® | Septiembre 2012 | Agosto 2013 | Junio 2014 | Sin clave | Inmunosupresor selectivo | Inhibidor de síntesis de pirimidinas (dihidro-orotatodeshidrogenasa) |
| Estudios clíni- cos de soporte | Descripción | Número de pacientes | Categoría | Dosis | Vía | Administración | Contraindi- caciones | Eventos adversos |
|---|---|---|---|---|---|---|---|---|
| TEMSO51 | Teriflunomida vs placebo | 1088 | Fase III | 14 mg | Oral | Cada 24 horas | No en hepatopatías | Pancitopenia |
| TOWER52 53 | Teriflunomida vs placebo | 1169 | Fase II | 7 mg/14 mg | Oral | No en infecciones | Insuficiencia hepática grave | |
| TOPIC54 | Teriflunomida vs interferón en dosis de 7 y 14 mg | 618 | Fase III | 7 mg/14 mg | Oral | No en insuficiencia renal | LMP | |
| TENERE55 | Teriflunomida vs interferón | 324 | Fase III | 7 mg/14 mg | Oral | Cada 24 horas | No en embarazo | |
| TERACLES56 | Teriflunomida vs interferón | 534 (1455 planeados) | Fase III | 7 mg/14 mg | Oral | No en niñas | ||
| TERI-PRO57 | En proceso | Abierto | Fase IV | Desconocido en niños |
LMP: leucoencefalopatía multifocal progresiva.
Cuadro 12 Dimetilfumarato
| Fármaco | Nombre comercial | Aprobación FDA | Aprobación EMA | Aprobación COFEPRIS | Clave institu- cional | Clase | Mecanismo de acción |
|---|---|---|---|---|---|---|---|
| Dimetilfumarato | Tecfidera® | Marzo 2013 | Noviembre 2013 | Diciembre 2015 | 10000604800 | Antipsoriásico, antiinflamatorio y neuroprotector | Posible activador de la respuesta oxidativa |
| Estudios clínicos de soporte | Descripción | Número de pacientes | Categoría | Dosis | Vía | Adminis- tración | Contraindicaciones | Eventos adversos |
|---|---|---|---|---|---|---|---|---|
| DEFINE58 | Dimetilfumarato vs placebo | 1237 | Fase III | 120 mg por 7 días y continuar con 240 mg/ día como sostén | Oral | Cada 12 horas | No en embarazo | Rubicundez, alteraciones gastrointestinales (náusea, dispepsia, epigastralgia, vómitos), linfopenia |
| CONFIRM59 | Dimetilfumarato vs placebo | 1430 | Fase III | 240 mg | Oral | Dos o tres veces al día | Desconocido en niños | Rubicundez, alteraciones gastrointestinales (náusea, dispepsia, epigastralgia, vómitos), linfopenia |
| ENDORSE60 | Estudio de extensión de dimetilfumarato (más de 5 años) | 1736 | Fase III | 240 mg | Oral | Dos o tres veces al día | Infecciones oportunistas, riesgo de LMP |
LMP: leucoencefalopatía multifocal progresiva.
Cuadro 13 Ocrelizumab EMRR
| Fármaco | Nombre comercial | Aprobación FDA | Aprobación EMA | Aprobación COFEPRIS | Clave insti- tucional | Clase | Mecanismo de acción |
|---|---|---|---|---|---|---|---|
| Ocrelizumab | Ocrevus® | Marzo 2017 | Noviembre 2017 | Agosto 2018 222M2018 SSA | - | Anticuerpo monoclonal humanizado | AntiCD20+ |
| Estudios clínicos de soporte | Descripción | Número de pacientes | Categoría | Dosis | Vía | Administración | Contraindica- ciones | Eventos adversos |
|---|---|---|---|---|---|---|---|---|
| OPERA I61 | Ocrelizumab vs interferon beta 1a 44 g | 821/835 | Fase III | 300 mg dosis inicial, a los 15 días 300 mg y posteriormente cada 6 meses | IV | Dosis inicial; a los 15 días y posteriormente cada seis meses | Tuberculosis activa VIH HepatopatíaNo en embarazo No en embarazo | Reacciones dérmicas Hipersensibilidad |
| OPERA II61 | Ocrelizumab vs interferon beta 1a 44 µg | 817/834 | Fase III | 300 mg dosis inicial, a los 15 días 300 mg y posteriormente cada 6 meses | IV | Dosis inicial; a los 15 días y posteriormente cada seis meses | Tuberculosis activa VIH Hepatopatía No en embarazo | Reacciones dérmicas Hipersensibilidad |
Cuadro 14 Ocrelizumab en esclerosis múltiple primaria progresiva
| Fármaco | Nombre comercial | Aprobación FDA | Aprobación EMA | Aprobación COFEPRIS | Clave institu- cional | Clase | Mecanismo de acción |
|---|---|---|---|---|---|---|---|
| Ocrelizumab | Ocrevus® | Marzo 2017 | Noviembre 2017 | Agosto 2018 222M2018 SSA | - | Anticuerpo monoclonal humanizado | AntiCD20+ |
| Estudios clínicos de soporte | Descripción | Número de pacientes | Categoría | Dosis | Vía | Administración | Contraindi- caciones | Eventos adversos |
|---|---|---|---|---|---|---|---|---|
| ORATORIO62 | Ocrelizumab vs placebo | 821/244 | Fase III | 300 mg dosis inicial, a los 15 días 300 mg posteriormente cada 6 meses | IV | Dosis inicial; a los 15 días y posteriormente cada seis meses | Tuberculosis activa VIH Hepatopatía No en embarazo | Reacciones dérmicas Hipersensibilidad Infecciones activas |
Cuadro 15 Cladribina
| Fármaco | Nombre comercial | Aprobación FDA | Aprobación EMA | Aprobación COFEPRIS | Clave institucional | Clase | Mecanismo de acción |
|---|---|---|---|---|---|---|---|
| Cladribina | Revisión -En proceso | Mayo 2017 | En proceso | Análogo sintético de la desoxiadenosina - antimetabolito | Efecto linfocitotóxico a células B y T |
| Estudios clínicos de soporte | Descripción | Número de pacientes | Categoría | Dosis | Vía | Administración | Contraindicaciones | Eventos adversos |
|---|---|---|---|---|---|---|---|---|
| CLARITY63 | Cladribina 3.5 mg y 5.25 mg vs placebo | 1326 | Fase III | 3.5 mg/kg; 5.25 mg/kg | Oral | Cada 24 horas | No se recomienda durante el embarazo ni en TB activa, ni en malignidad. Uso de tratamiento inmunosupresor previo. Pacientes con terapia previa de NTZ determinación de índice JCV | Nasofaringitis Cefalea Linfopenia Neutropenia Trombocitopeni Neoplasia Infección |
| CLARITY EXTENSION64 | Cladribina 3.5 mg y 5.25 mg vs placebo | 806 | Fase III (extensión) | 3.5 mg/kg; 5.25 mg/kg | Oral | Cada 24 horas | No se recomienda durante el embarazo ni en TB activa, ni en malignidad. Administración de tratamiento inmunosupresor previo. Pacientes con terapia previa de NTZ determinación de índice JCV | Nasofaringitis Cefalea Linfopenia Neutropenia Trombocitopenia Neoplasia Infección |
| ORACLE65 | Cladribina 3.5 mg y 5.5 mg vs placebo | 616 | Fase III | 3.5 mg/kg; 5.25 mg/kg | Oral | Cada 24hrs | No se recomienda durante el embarazo ni en TB activa, ni en malignidad Administración de tratamiento inmunosupresor previo. Pacientes con terapia previa de NTZ determinación de índice JCV | Nasofaringitis Cefalea Linfopenia Neutropenia Trombocitopenia Neoplasia Infección |
TB: tuberculosis; NTZ: natalizumab; JCV: virus JC.
Manejo sintomático de la esclerosis múltiple
En la bibliografía se ha reportado que hasta 44.1% de los pacientes tienen varios síntomas iniciales, como las disestesias (47.4%), paresias (37.1%) y problemas visuales, como neuritis óptica (29%) y problemas de equilibrio a la marcha (24.6%); sin embargo, en las formas recurrentes remitentes se encuentran disestesias (48.4%), parestesias (35.8%) y neuritis óptica (30.7%) independientemente del curso de la enfermedad y para las formas primarias progresivas los síntomas predominantes son las paresias (64%), seguidas de problemas de equilibrio a la marcha (32.7%).66
Síntomas en el curso de la enfermedad
Independientemente de la forma de la enfermedad, la fatiga es el síntoma más prevalente, ocurre en 58.1% de los pacientes, seguido de espasticidad (47.5%) y trastornos de los esfínteres (44%), ataxia y temblor (35.7%), dolor (34.2%), deterioro cognitivo (33%) y depresión (32.5%).66 Cuadros 16 a 18
Cuadro 16 Prevalencia de síntomas según el tipo de esclerosis múltiple
| Síntoma | Recurrente remitente (%) | Primaria progresiva (%) | Secundaria progresiva (%) |
|---|---|---|---|
| Fatiga | 57.5 | ||
| Espasticidad | 74.2 | 81.9 | |
| Trastornos de los esfínteres | 31.3 | 61.8 | 72.9 |
| Ataxia/temblor | 26.8 | 49.8 | 56.7 |
| Trastornos sexuales | 9.5% | 18.4 | 20 |
Tomado de la referencia 66.
Cuadro 17 Los diez síntomas más frecuentes en pacientes con esclerosis múltiple
| Síntoma | Prevalencia del síntoma en cada una de las formas de esclerosis múltiple en el curso de la enfermedad (%) | Porcentaje de pacientes que reciben tratamiento farmacológico66 | Porcentaje de pacientes que no reciben tratamiento66 | ||
|---|---|---|---|---|---|
| Remitente recurrentemente | Primaria progresiva | Secundaria progresiva | |||
| Depresión66 | Se manifiesta de manera temprana y durante las recaídas, permanece constante en las formas progresivas67 | 59.6 | 25.5 | ||
| Dolor66 | Afecta considerablemente la calidad de vida y es discapacitante. Su prevalencia varía entre 29 y 86% según su localización, duración y fisiopatología68 | 57.1 | 26.1 | ||
| Ataxia/temblor66 | 26.8 | 49.8 | 56.7 | 8.7 | 43.8 |
| Espasticidad66 | 74.2 | 81.9 | 36.5 | 22 | |
| Fatiga66 | 57.5 | 14.9 | 65.2 | ||
| Deterioro cognitivo66 | Afecta en 30 a 75% de los pacientes con predominio en las formas primaria progresiva y secundaria progresiva, lo que se debe al componente patogénico de la neurodegeneración y a los cambios severos por la atrofia cortical69 | 3.9 | 73.2 | ||
| Trastornos de los esfínteres66 | 31.3 | 61.8 | 72.9 | 31.5 | 44.7 |
| Alteraciones oculomotoras66 | La neuritis del nervio óptico es el trastorno oculomotor más frecuente. Se manifiesta en 70% de los pacientes en el curso de la enfermedad. Los síntomas que sobrevienen son visión borrosa, diplopía, oscilopsia, mareos y fatiga ocular70 | 11.1 | 79.1 | ||
| Trastornos intestinales66(disfunción neurogénica del intestino) | Entre 39 y 73% de los pacientes con esclerosis múltiple pueden padecer trastornos intestinales (estreñimiento e incontinencia fecal), que son el tercer síntoma más común, después de la fatiga y la incoordinación. Los síntomas parecen estar correlacionados con la escala del estado de discapacidad (EDSS, Expanded Disability Status Scale). Se estima que entre menos EDSS mayor es el estreñimiento71 | 31.6 | 50.6 | ||
| Trastornos sexuales66 | 9.5 | 18.4 | 20 | 13.4 | 48.8 |
| Disfunción de la vejiga72 | El 75% de los pacientes tienen disfunción de la vejiga por discinesia del esfínter detrusor a lo largo de la evolución de la esclerosis múltiple72 | ||||
Tomado y adaptado de las referencias 66 a 72.
Cuadro 18 Manejo de los síntomas asociados con la esclerosis múltiple (continúa en la siguiente página)
| Síntoma | Porcentaje de pacientes afectados | Fármaco | Vía deadmi- nistración | Dosis | Cuadro bá- sico ISSSTE | Manejo NO farmacológico | Comentarios |
|---|---|---|---|---|---|---|---|
| Fatiga | 58.166 | Amantadina72-74 Modafinilo72,73 Metilfenidato* | Oral | 200-400 mg/día 200-400 mg/día 10-30 mg/día* | No No Sí | Tomar periodos de descanso | *Recomendación del grupo de neurólogos |
| Espasticidad | 47.566 | Baclofeno72,75 | Oral | 10-75 mg/día | No | Se recomienda aumentar la dosis gradualmente | |
| Baclofeno72,75,76 | Intratecal | 10 mg/día (50 µg/infusión) | No | ||||
| Tizanidina72,75 | Oral | 2-4 mg hasta 36 mg | No | ||||
| Cannabinoides en aerosol (delta-9-tetrahidrocannabinol THC + cannabidiol CBD)72,75,77 | Aerosol | 1-12 disparos (un disparo = 2.7 mg TCH/2.5 CBD mg/etanol 0.04 g/ | No | ||||
| Toxina botulínica A72,75 | IM | Depende del músculo afectado. Dosis máxima: 600 U Onabotulinum; 1000 Abobotulinum; 600 Incobotulinum* | Sí | *Recomendación del grupo de neurólogos | |||
| Gabapentina* | Oral | 300-1200 mg* | No | *Recomendación del grupo de neurólogos | |||
| Clonacepam75 | Oral | 2-8 mg/día | Sí | ||||
| Marcha | Fampridina78,79 | Oral | 10-20 mg/día | No | |||
| Temblor | 35.766 | Propranolol80 | Oral | 20-40 mg/día* | Sí | *Recomendación del grupo de neurólogos | |
| Primidona80 | Oral | 250 mg/día* | Sí | ||||
| Ondansetron80 | Oral | 4-8 mg/día* | Sí | ||||
| Gabapentina80 | Oral | 600-1500 mg/día* | No | ||||
| Isoniacida80 | Oral | Sí | |||||
| Toxina botulínica A80 | Intramuscular | Sí | |||||
| Paroxismos | Antiepilépticos como carbamacepina, valproato, oxcarbacepina, topiramato y gabapentina | Oral | Dosis según prescripción | Todos disponibles, excepto la gabapentina | *Recomendación del grupo de neurólogos | ||
| Dolor neuropático | 29-8681 | Pregabalina81 | Oral | 75-300 mg/día* | Sí | *Recomendación del grupo de neurólogos | |
| Carbamacepina81 | Oral | 200-600 mg/día* | Sí | ||||
| Gabapentina81Antidepresivos tricíclicos81 Duloxetina81,82 | Oral Oral Oral | 300-900 mg/día* Dosis según prescripción*30-120 mg/día82 | No SíSí | ||||
| Deterioro cognitivo | 33 | Donepezilo72 | Oral | 5-10 mg/día* | Sí | *Recomendación del grupo de neurólogos | |
| Memantina72 | Oral | 10-30 mg/día* | Sí | Causa pseudoexacerbación, cefalea, visión borrosa, fatiga, debil dad muscular y marcha inestable secundario al bloqueo de la vías glutaminérgicas*Recomendación del grupo de neurólogos | |||
| Rivastignima* | Subcutánea | 9 y 18 mg* | Sí | *Recomendación del grupo de neurólogos | |||
| Trastornos del ánimo (depresión) | 40-7072 | Inhibidores de la recaptura de serotonina72 | Oral | Ejercicio72 | |||
| Fluoxetina | Oral | 20 mg/día* | Sí | *Recomendación del grupo de neurólogos | |||
| Paroxetina | Oral | 20 mg /día* | Sí | ||||
| Sertralina | Oral | 50 mg/día* | Sí | ||||
| Trastornos del sueño | Amitriptilina* | Oral | 25-50 mg/día* | Sí | *Recomendación del grupo de neurólogos | ||
| Mirtazapina* | Oral | 15- 30 mg/día* | Sí | ||||
| Benzodiacepinas* | Oral | Según benzodiacepina* | Sí | ||||
| Valeriana* | Oral | 500 mg/noche* | No | ||||
| Zolpideno* | Oral | 10-20 mg* | Sí | ||||
| Melatonina72 | Sublingual | 3- 5 mg/día* | No | ||||
| Trastornos digestivos | Medidas higiénico-dietéticas, mayor consumo de agua y en caso de estreñimiento de más de tres días, enemas evacuantes (de fosfato y citrato), medidas mecánicas. Psyllum plantago, polietilentglicol. Bioretroalimentación, irrigación transanal (la mayor evidencia es en pacientes con daño a la médula espinal, pero también se ha demostrado su eficacia en pacientes con esclerosis múltiple); neuromodulación sacra (estimulación de las raíces nerviosas S2-S3, lo que se puede lograr a través de la vía del nervio sacro o periféricamente a través del nervio tibial)71*El grupo de neurólogos recomienda poner más hincapié en estos síntomas, porque institucionalmente se tienen pocas alternativas terapéuticas; sólo se cuenta con laxantes, no hay neuroestimulación ni cirugía intestinal. | ||||||
| Disfagia | |||||||
| Estreñimiento | 5071 | Poca evidencia de la administración de laxantes en esclerosis múltiple71 Prucaloprida (agonista de 5-HT4 altamente selectivo) que ha mostrado ser eficaz en pacientes con estreñimiento crónico71 | Oral | 2 mg una vez al día | |||
| Incontinencia fecal | Afecta alrededor de 50% de los pacientes en algún momento y es un síntoma continuo en un 25%71 | ||||||
| Trastornos sexuales | 50-90% en hombres y 40-80% en mujeres83 | ||||||
| Disfunción eréctil | Sildenafil72,83 | Oral | 50-100 mg* | Sí | *Recomendación del grupo de neurólogos | ||
| Tadalafil84 | Oral | 5 mg/día | No | ||||
| Eyaculación precoz | Gabapentina* | Oral | 300-600 mg* | No | *Recomendación del grupo de neurólogos | ||
| Disminución De la libido, disminución de la lubricación, dispareunia (mujeres) | Psicoterapia, lubricantes vaginales, terapia pélvica72 | ||||||
| Trastornos de la vejiga (urgencia urinaria) | 75 72 | Oxibutinina72 | Oral | 2.5 mg dos veces al día hasta 20 mg al día dividido en 2 o 3 dosis | Sí | ||
| Onabotulinum toxina72 | Inyectada en el músculo detrusor | 200 a 300 unidades | Sí |
Tomado y adaptado de las referencias 71 a 84
El estreñimiento y la incontinencia fecal se manifiestan en 50% de los pacientes con esclerosis múltiple y son los síntomas que más afectan después de la fatiga y la incoordinación, por lo que se recomienda hacer más hincapié porque en el ISSSTE se tienen pocas alternativas terapéuticas. Las Figuras 6 a 8 muestran las causas del estreñimiento y de la incontinencia fecal y la importancia de la individualización del tratamiento.

+/-: puede agregarse o no.
Tomada de la referencia 71.
Figura 8 Importancia de la individualización del tratamiento y combinación de diferentes intervenciones.71
Esclerosis múltiple en niños. Definición, diagnóstico y tratamiento
La esclerosis múltiple pediátrica es una enfermedad desmielinizante inflamatoria crónica que afecta múltiples regiones del sistema nervioso central, al igual que en otros grupos de edad. En términos generales, cerca de 2 a 10% de todos los pacientes con esclerosis múltiple inicia antes de los 18 años y solo 0.3% antes de los 10 años.5 A pesar de la baja incidencia, cuando la enfermedad inicia en la infancia, se asocia con recaídas frecuentes y severas y con alta probabilidad de discapacidad significativa que ocurre dentro de las dos primeras décadas del inicio de la enfermedad.85
Factores de riesgo y ambientales de la esclerosis múltiple pediátrica
Existen factores asociados con la esclerosis múltiple, entre los que destacan: infección viral, existencia del alelo DRB1*15 que confiere un OR de esclerosis múltiple de 2.7,3 deficiencia de vitamina D, obesidad, detección de anticuerpos anti-EBNA1, mientras que la exposición a otros virus, como citomegalovirus o herpes virus simple, no parecen tener relación clara. La conjunción de tres factores de riesgo, HLA-DRB*15, exposición viral y concentraciones bajas de vitamina D se relacionan con riesgo de esclerosis múltiple pediátrica.4,5
Diagnóstico
Los criterios para el diagnóstico de esclerosis múltiple pediátrica toman en cuenta la actividad inflamatoria de la enfermedad en su distribución y en el tiempo en que aparecen las lesiones; sin embargo, los criterios previos eran válidos unicamente para niños mayores de 10 años. En la actualidad los criterios incluyen signos clínicos de afectación del sistema nervioso central, como se describe en el Cuadro 19.
Cuadro 19 Consenso diagnóstico de esclerosis múltiple pediátrica86
| Número de eventos clínicos en el sistema nervioso central de causa inflamatoria o desmielinizante | Edad (años) | Núm. IRM | Primer evento clínico SNC | Periodo entre los eventos | Segundo evento clínico SNC | Diseminación en espacio | Diseminación en tiempo | Nota |
|---|---|---|---|---|---|---|---|---|
| ≥ 1 | ≥ 12 | ≥ 1 | Sin encefalopatía | Sí | Sí | |||
| ≥ 1 | ≥ 2 | Sin encefalopatía | Sí | Sí | Segunda IRM ≥ 1 nueva lesión | |||
| ≥ 2 | ≥ 1 | > 3 días | Sin encefalopatía | ≥ 2 en SNC | ||||
| ≥ 2 | ≥ 2 | Encefalomielitis aguda diseminada | ≥ 3 meses | Sin encefalopatía | Sí | IRM con 2 eventos de diseminación en espacio |
Tomado de la referencia 86.
SNC: sistema nervioso central.
El 97% de los casos de esclerosis múltiple pediátrica se manifiesta con brote-remisión; los niños menores de 11 años tienen síntomas multifocales, 46% son de tipo déficit sensitivo leve (síntomas visuales), mientras que los niños entre 14 y 16 años tienen síntomas más severos, que incluyen manifestaciones del tallo cerebral o déficit motor.87
Una manifestación común de la esclerosis múltiple son las parestesias unilaterales que afectan las extremidades; los trastornos sensoriales generalmente remiten, pero a veces evolucionan a dolor neuropático crónico, que en ocasiones es la primera manifestación de esclerosis múltiple pediátrica.88 El síndrome clínicamente aislado se define como el primer evento monofocal o multifocal con afección al sistema nervioso central que sugiere desmielinización inflamatoria con ausencia de historia clínica de enfermedad desmielinizante del sistema nervioso central, como neuritis óptica, mielitis transversa, síndromes hemiparéticos o afección de tallo, sin cuadro de encefalopatía y en la resonancia magnética basal no se cumplen los criterios de esclerosis múltiple.89
En los niños con sospecha de esclerosis múltiple pediátrica debe realizarse resonancia magnética de cerebro, pero no se solicita de manera rutinaria la resonancia magnética de médula espinal, porque las lesiones medulares en la etapa pediátrica generalmente son silenciosas; sin embargo, contribuyen al diagnóstico de esta enfermedad en 10%, por ello es indispensable solicitarla.5
Evolución
Los pacientes pediátricos tienen mayores índices anuales de recaídas en comparación con los adultos (1.13 vs 0.40). El mayor porcentaje de las recaídas ocurre en los primeros años de la enfermedad; sin embargo, su escala de discapacidad muestra cifras en intervalos menores que en los adultos, lo que es válido al inicio de la enfermedad porque con el tiempo de seguimiento la discapacidad llega a ser mayor en niños que en adultos.90 En estudios de seguimiento se ha visto que 29% de los niños, a pesar de haber recibido terapias modificadoras de la enfermedad, muestran daño cognitivo en distintas áreas, como las funciones ejecutivas, el procesamiento del lenguaje, la integración visuo-motora o problemas de atención.91
Imagen de resonancia magnética en esclerosis múltiple pediátrica
Muchas de las lesiones mostradas en la resonancia magnética en los niños, al igual que en los adultos, son subclínicas. La esclerosis múltiple en el cerebro en desarrollo tiene algunas peculiaridades. Estudios de seguimiento han demostrado que con la evolución de tres años de la enfermedad, el volumen cerebral disminuye en su totalidad más de una desviación estándar con respecto a los controles y que las estructuras que más se afectan son el tálamo y el cuerpo calloso.5
Estudios recientes establecen reducción en el volumen de la sustancia gris en esclerosis múltiple pediátrica después de 3.5 años de seguimiento con resonancia magnética.92
Líquido cefalorraquídeo en esclerosis múltiple
Algunas características del líquido cefalorraquídeo distintivas en los pacientes con esclerosis múltiple menores de 11 años son que pueden mostrar pleocitosis a expensas de polimorfonucleares, sólo 43% tiene bandas oligoclonales detectables durante el ataque, pero esto se incrementa hasta 91% cuando se miden en ataques posteriores. Este grupo poblacional también muestra aumento de síntesis intratecal de IgM y en los niños mayores de 11 años los hallazgos en el líquido cefalorraquídeo son similares a los de los adultos.87
Los anticuerpos contra la proteína básica de mielina se encuentran en alrededor de 25 a 50% de los pacientes pediátricos con síndrome desmielinizante adquirido y únicamente en 22% de los niños con esclerosis múltiple; en cuanto a la respuesta celular, se encuentra aumento en la expresión de interleucina 17, lo que sugiere una respuesta de memoria inmunitaria central en esclerosis múltiple pediátrica.93,94
El diagnóstico clínico de esclerosis múltiple pediátrica se establece cuando el paciente cumple cualquiera de los siguientes criterios:
Dos o más eventos clínicos del sistema nervioso central sin encefalopatía (no como encefalomielitis aguda diseminada), con presunta causa inflamatoria, separados por más de 30 días y que afectan más de un área del cerebro, los nervios ópticos o la médula espinal.
En niños de 2 a 18 años que cumplan los criterios de McDonald de 2010 para diseminación en espacio (mayor o igual a una lesión en T2 en 2/4 localizaciones periventricular, yuxtacortical, infratentorial o en médula espinal) y diseminación en tiempo (imágenes en T1 clínicamente silenciosas con o sin realce de gadolinio) en resonancia magnética basal.
Un evento clínico sin encefalopatía de esclerosis MÚLTIPLE típica demostrada en imagen por resonancia magnética (IRM) o al menos una nueva lesión en IRM 30 días después del ataque inicial.
Un evento inicial que cumpla con los criterios de ADEM seguido por un segundo evento de ADEM no agudo (con intervalo mayor a tres meses entre ambos cuadros), además, se asocia con nuevas lesiones de diseminación en espacio de acuerdo con los criterios de McDonald de 2010.
En la actualidad se establecen los criterios de McDonald 2017, incluido el valor de las bandas oligoclonales en pacientes que cumplan criterios de diseminación en espacio, tomando en cuenta las lesiones atípicas en estudios de resonancia como hallazgos ante evidencia radiológica aislada, también las lesiones corticales y subcorticales para cumplir el criterio de diseminación en espacio, las lesiones sintomáticas y asintomá- ticas para criterios de diseminación en tiempo y espacio, porque en los criterios de McDonald 2010 no se tomaban en cuenta cuando un paciente tenía un brote en el tallo o la médula.95 En la Figura 9 se muestra el diagnóstico diferencial de la esclerosis múltiple pediátrica.
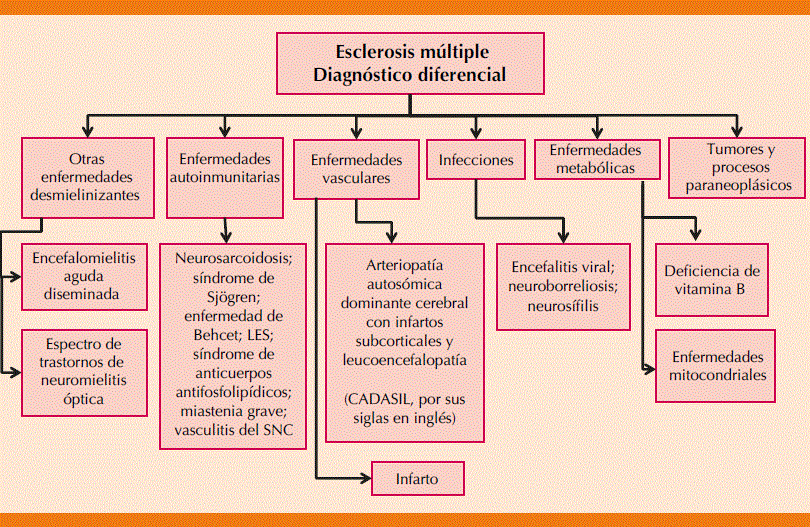
LES: lupus eritematoso sistémico; SNC: sistema nervioso central. Adaptada de la referencia 96.
Figura 9 Diagnóstico diferencial de la esclerosis múltiple pediátrica.96
Tratamiento
Las modalidades de tratamiento incluyen tres apartados: a) tratamiento en evento agudo; b) terapias modificadoras de la enfermedad y c) tratamiento sintomático. El tratamiento de la esclerosis múltiple pediátrica es multidisciplinario e incluye no solo al neurólogo pediatra, sino también a psicólogos, oftalmólogos, fisioterapeutas y paidopsiquiatras. El objetivo de la terapia es modificar el curso natural de la enfermedad.
En los niños con esclerosis múltiple son frecuentes las recaídas, sobre todo en el primer año del diagnóstico, alta carga lesional y un severo componente inflamatorio, lo que justifica la administración de terapias modificadoras de la enfermedad, incluso en los menores de 12 años de edad.97
El tratamiento del evento agudo incluye: esteroides, inmunoglobulina intravenosa y plasmaféresis.
Metilprednisolona (MTP): en exacerbaciones agudas se recomienda el siguiente régimen: MTP IV 20-30 mg/kg/día (máximo 1 g/día) durante 3 a 5 días, seguido de prednisona oral 1 a 2 mg/kg/ día durante una o dos semanas y reducción en un periodo de dos a seis semanas. Debe combinarse con vitamina D, calcio y un neuroprotector gástrico. Sus eventos adversos incluyen trastornos del humor, insomnio, hipertensión, disgeusia, pirosis, Úlcera péptica, sangrado gastrointestinal, intolerancia a la glucosa, retención de sodio y líquidos, edema, exantema, aumento de presión intraocular, ansiedad y su administración prolongado causa retardo en el crecimiento y osteoporosis.98
Inmunoglobulina (IgG IV): cuando no hay respuesta al esteroide puede prescribirse IgG IV a dosis de 0.4 mg/kg/día durante 5 días o 1 g/kg/ día durante dos días. Los eventos adversos son cefalea, dolor precordial, mialgias, náuseas, fatiga, trombosis venosa o arterial, anafilaxia, que es mayor si hay atopia o deficiencia hereditaria de IgA.98
Plasmaféresis: la finalidad es remover los anticuerpos y citocinas inflamatorias circulantes. Se recomienda en pacientes pediátricos con recaídas severas, recaídas consecutivas en un periodo de dos a tres semanas, o respuestas terapéuticas incompletas.98
Terapia modificadora de la enfermedad
Primera generación: interferón beta-1 a y b, acetato de glatiramer.
Segunda generación: natalizumab, mitoxantrona, fingolimod, teriflunomida, azatioprina, rituximab y dimetilfumarato.
El interferón beta y el acetato de glatiramer se han probado en estudios fase IV en alrededor de 600 pacientes tratados con interferón y seguidos durante al menos dos años, y se ha corroborado su eficacia y seguridad.
Interferón β 1a. Existen varias presentaciones de 6, 8 y 12 millones, que se administran vía intramuscular (IM) una vez por semana y las presentaciones de 22 y 44 µg se administran vía subcutánea (SC) tres veces a la semana. Recientemente se publicó que los pacientes incluso menores de 10 años pero mayores de 2 pueden recibir esta última presentación de interferón, que tiene buen perfil de seguridad. Los interferones actúan inhibiendo los receptores específicos que regulan la cascada de señalización e inhiben las células T autorreactivas, las citocinas proinflamatorias reducen la migración de linfocitos e inducen mediadores antiinflamatorios.96,97 Al iniciar la terapia con IFN-β, es importante considerar iniciar con 25 a 50% de la dosis recomendada para el adulto, por tres dosis y, si la tolerancia es buena, aumentar la dosis al 100%. La respuesta clínica debe evaluarse cada tres a seis meses, mientras que la evolución radiológica cada 6 a 12 meses. Deberá evaluarse la tolerancia y la seguridad del fármaco de manera periódica cada 3 a 6 meses mediante estudios de biometría hemática, pruebas de función renal y perfil tiroideo.
Ghezzi resumió los eventos adversos que ocurrieron en cinco series de pacientes, dividiéndolos en mayores y menores de 12 años; encontró que los eventos fueron diferentes en ambos grupos. Los eventos adversos incluyen mialgias, cuadro pseudogripal, fatiga, astenia, anormalidades en la biometría hemática, hipertransaminasemia y disfunción tiroidea, que son más frecuentes en los menores de 12 años, mientras que el dolor en el sitio de inyección y la cefalea lo son en los mayores de 12 años. En estos pacientes está indicado el manejo con ibuprofeno o paracetamol. La administración de este fármaco requiere vigilancia hematológica y de enzimas hepáticas cada mes durante los primeros seis meses y posteriormente cada tres meses. Alrededor de 30% de los pacientes no responden a esta modalidad de tratamiento, por lo que se requiere evaluar el cambio a acetato de glatiramer.96,97 La hipertransaminasemia puede aliviarse al disminuir la dosis y una vez normalizados puede reintentarse el incremento.
Los pacientes tratados con interferón pueden desarrollar anticuerpos neutralizantes (Nabs), lo que reduce la actividad biológica del fármaco e incrementa el riesgo de recaídas, éstos deben evaluarse cada 12 a 24 meses después de iniciado el tratamiento si hay evidencia de actividad de la enfermedad y repetirse cada tres a seis meses para decidir el cambio de tratamiento modificador de la enfermedad.97
Acetato de glatiramer (20 mg SC cada 24 horas). Tiene estructura parecida a la de la proteína básica de mielina. Actúa como señalador de los anticuerpos producidos localmente, como los linfocitos T y son neutralizados antes de ocasionar lesiones en el sistema nervioso central. Se ha reportado reducción de 29% de las recaídas, con eficacia similar a la de IFN-β en la imagen de resonancia magnética. Ha demostrado buena tolerancia y los eventos adversos sobrevienen en 30%, como reacción en el sitio de inyección, reacciones sistémicas transitorias, incremento en las enzimas hepáticas y anormalidades en el recuento sanguíneo. Se recomienda vigilancia de las enzimas hepáticas los primeros seis meses de tratamiento. La Figura 10 resume el tratamiento de la esclerosis múltiple pediátrica.
Terapias de segunda generación
El natalizumab es un anticuerpo monoclonal que actúa en la alfa-4 beta1-integrina y bloquea la migración de los linfocitos T y B en la barrera hematoencefálica. Se recomienda en formas agresivas de la enfermedad con gran carga lesional o con falla a fármacos de segunda línea. Se administra en infusión mensualmente a dosis de 3-5 mg/kg o 300 mg. Este fármaco disminuye la actividad de la enfermedad y el índice de recaí- das en 68%. Entre sus eventos adversos están la leucoencefalopatía multifocal progresiva (LMP) e hipersensibilidad e infecciones. Hay pocas series con la administración de natalizumab en población pediátrica.89,96
La mitroxantrona en un agente quimioterapéutico que se administra cada tres meses a dosis de 10 a 20 mg (dosis máxima 200 mg.). Se prescribe en formas agresivas de la enfermedad (secundariamente progresiva). Los eventos adversos más comunes son cardiotoxicidad, leucopenia, náusea, infección, alopecia, fatiga y amenorrea.96
El fingolimod representa una terapia oral interesante en niños a dosis de 0.5 mg/d. ACTÚA en el receptor de esfingocina 1 fosfato de los linfocitos y previene su depósito en los nódulos linfáticos. Sus eventos adversos incluyen bradicardia, que puede observarse durante las primeras 6 horas de su administración, misma que revierte, por lo que está contraindicado en pacientes con problemas cardiovasculares, edema macular, leucopenia e infecciones virales.96,99
La teriflunomida es otro fármaco oral de 7 y 14 mg que se administra una vez al día y cuyos eventos adversos incluyen alopecia y hepatotoxicidad. Los estudios en población pediátrica aún están en desarrollo.96
La azatioprina es un fármaco que antagoniza el metabolismo de las purinas y cuya dosis es de 2.5 a 3 mg/kg/día. Sus eventos adversos son: exantema, síntomas gastrointestinales, citopenias, toxicidad hepática y el riesgo de cáncer.96
La ciclofosfamida es un inmunosupresor con efectos citotóxicos. Se prescribe a población pediátrica y sus efectos adversos incluyen: vómito, amenorrea, alopecia transitoria y osteoporosis.96
El rituximab es un anticuerpo monoclonal quimérico que actúa en receptores CD20, donde reduce la circulación de células B de memoria preservando las células plasmáticas maduras que no expresan CD20 en su superficie. Se ad- ministra a dosis de 208-584 mg/m2 en infusión (máximo 1 g), iniciando con 50 mg por hora e incrementando 50 mg por hora cada 30 minutos, hasta llegar a 400 mg por hora, con intervalos de dos semanas. Se recomienda la premedicación con acetaminofén 15 mg/kg (máximo 650 mg) y difenhidramina 0.5 mg/kg (máximo 50 mg) 30 minutos antes de iniciar la infusión; en algunos casos se recomienda la dexametasona IV 0.2-0.5 mg/kg (máximo 50 mg) como pretratamiento. Reduce las recaídas en adolescentes. Existen pocos casos de LMP reportados en pacientes con lupus eritematoso. No existen estudios pediátricos que recomienden su administración en estas edades.96,100
El dimetilfumarato promueve las actividades antiinflamatorias y citoprotectoras mediadas por la vía Nrf2. Reduce las citocitonas y la actividad migratoria de las células inmunes a través de la barrera hematoencefálica. Se administra a dosis de 120 a 240 mg dos veces al día. Sus eventos adversos más comunes incluyen: náusea, vómito, dolor abdominal, prurito, rubicundez, diarrea, linfopenia reacción alérgica, exantema, problemas visuales, linfopenia, encefalopatía multifocal progresiva y urticaria.96
Propuesta de definición de trabajo para la respuesta al tratamiento inadecuado en la esclerosis múltiple pediátrica:
Y al menos uno de los siguientes:
Aumento o ninguna reducción en la tasa de recaídas, o una nueva T2 o con aumento de lesiones con contraste en la resonancia magnética en periodo de pretratamiento.
Dos o más recidivas (recaídas clínicas o imagen de resonancia magnética) en un periodo de 12 meses o menos.
En los casos de respuesta inadecuada al tratamiento, las opciones para cambiar los tratamientos incluyen el cambio entre las terapias de primera línea (interferón beta y acetato de glatiramer) o cambiar a un agente de segunda línea, como el natalizumab y la ciclofosfamida. La metilprednisolona puede prescribirse por periodos cortos (6 a 12 meses) en pacientes con respuesta inadecuada al tratamiento.
Existen consideraciones futuras que pueden ser válidas para la población pediátrica, entre ellas tener un fenotipo clínico de la enfermedad de acuerdo con los criterios de Lublin de 2014, el papel del nervio óptico en pacientes pediátricos como inicio de la enfermedad, así como el papel de las lesiones atípicas como el síndrome radiológico aislado y las lesiones inflamatorias solitarias en pediatría. Para ello, se tendrán futuras áreas de investigación relacionadas con validar los criterios de McDonald de 2017 en las diversas poblaciones, incluidas áreas pediátricas, utilidad de los anticuerpos anti-MOG, criterios de resonadores de mayores teslas en la definición de otras lesiones y de la atrofia cerebral que se ha establecido y la utilidad de otros biomarcadores diagnósticos que no sean de imagen.











 nueva página del texto (beta)
nueva página del texto (beta)






