Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Acta botánica mexicana
versión On-line ISSN 2448-7589versión impresa ISSN 0187-7151
Act. Bot. Mex no.77 Pátzcuaro oct. 2006
Estructura y composición florística de las sabanas de la región de Nizanda, Istmo de Tehuantepec (Oaxaca), México
Structure and floristic composition of the savannas of Nizanda region, Isthmus of Tehuantepec (Oaxaca), México
Liliana I. López-Olmedo, Eduardo A. Pérez-García y Jorge A. Meave
Universidad Nacional Autónoma de México, Facultad de Ciencias, Departamento de Ecología y Recursos Naturales, Circuito Exterior s/n Ciudad Universitaria, 04510 México, D.F. lilianaitze@gmail.com, eapg@fciencias.unam.mx, jamdc@fciencias.unam.mx
Recibido en agosto de 2005.
Aceptado en junio de 2006.
RESUMEN
El conocimiento sobre la vegetación de sabana en México es aún incipiente y está marcado por un debate sobre el origen primario o antropogénico de estas comunidades. En este estudio se caracterizó la estructura y la composición florística de las sabanas de la región de Nizanda (Oaxaca, México) a partir de un muestreo realizado en 20 sitios de 15 m2 cada uno (300 m2 en total). Se encontraron 135 morfoespecies (86 determinadas a nivel de especie) distribuidas en 29 familias y 68 géneros. Las familias Leguminosae, Poaceae y Asteraceae tuvieron la mayor riqueza taxonómica. La cobertura fue de 200.7 m2, de la cual 69% correspondió a gramíneas y ciperáceas. A pesar de la clara dominancia estructural de Trachypogon spicatus (índice de Berger-Parker = 0.82), la comunidad tuvo una diversidad relativamente alta (índice de Shannon log2 = 3.64). En el espectro biológico prevalecieron las camefitas y hemicriptofitas. Si bien en la región existen áreas considerables de vegetación secundaria, la virtual ausencia de elementos exóticos en las sabanas, junto con la presencia de especies endémicas y la identidad de la planta dominante son fuertes indicios de la naturaleza primaria de esta comunidad vegetal.
Palabras clave: Chivela, estructura de la vegetación, florística, México, Nizanda, Oaxaca, pastizal, sabana, Trachypogon spicatus.
Abstract
Current knowledge about savanna vegetation in Mexico is still incomplete, and it is dominated by an ongoing debate over their natural versus anthropogenic origin. In this paper we provide a detailed structural and floristic description of the savannas of the Nizanda region (Oaxaca, S Mexico). Vegetation was sampled in 20 sites of 15 m2 each (totaling 300 m2). A total of 135 morphospecies were encountered, 86 of which could be determined to species level; they were distributed in 29 families and 68 genera. Leguminosae, Poaceae and Asteraceae were the families with the largest taxonomic richness. Total community cover was 200.7 m2, of which 69% was accounted for by grasses and sedges. Despite a clear dominance of Trachypogon spicatus (Berger-Parker Index = 0.82), this community had a relatively large diversity (log2 Shannon Index = 3.64). Life form spectrum showed a dominance of chamaephytes and hemicryptophytes, indicating a harsh environment. Notwithstanding the widespread occurrence of secondary vegetation and ruderal species in the region, the virtual lack of exotic species in these savannas, together with the presence of some endemics and the identity of the dominant species, strongly support the primary nature of this plant community.
Key words: Chivela, floristics, grassland, Mexico, Nizanda, Oaxaca, savanna, Trachypogon spicatus, vegetation structure.
INTRODUCCIÓN
Beard (1953) definió a las sabanas neotropicales como aquellas comunidades tropicales donde existe un estrato continuo dominado por hierbas más o menos xeromórficas (Poaceae y Cyperaceae, principalmente), con arbustos esparcidos, árboles o algunas veces palmas. Incluso con una definición tan completa como ésta, existe la dificultad para identificar las características que son representativas y únicas de dicho tipo de vegetación, sobre todo cuando no resulta fácil distinguirlas de las comunidades secundarias dominadas por pastos (Sarmiento y Monasterio, 1975; Sarmiento, 1983).
Los primeros registros de la existencia de sabanas en el mundo son muy anteriores a la aparición de los seres humanos flenley, 1979; van der Hammen, 1983). Esto proporciona uno de los mejores argumentos para suponer que las sabanas conforman un tipo de vegetación básicamente natural y no de origen antrópico, aunque actualmente su extensión sea atribuible, en cierta medida, a las actividades humanas (van der Hammen, 1983). Se considera entonces que las sabanas son de origen natural, denominadas también como primarias, pero también se reconoce la existencia de comunidades parecidas de origen antrópico, llamadas estas últimas sabanas secundarias (Richards, 1996) o pseudo-sabanas (Gómez-Pompa, 1965).
Dos preguntas fundamentales sobre la ecología de las sabanas son: por qué éstas se presentan en ciertas regiones y en otras no, y por qué las formaciones arbóreas cerradas no avanzan sobre estas comunidades (Lüttge, 1997). Aunque no hay una hipótesis general aceptada para explicar estos hechos, existen varias posibilidades que podrían responder dichos cuestionamientos. Una de las explicaciones más ampliamente aceptadas sobre la estabilidad de las sabanas en el trópico americano es que se encuentran en áreas con suelos extremadamente oligotróficos, por lo que no pueden sostener ninguna comunidad arbórea continua (Sarmiento, 1983; Kellman, 1989; Medina y Silva, 1991; Lüttge, 1997). Al respecto, Kellman (1984) propuso la hipótesis de que existen relaciones sinérgicas entre el fuego y la baja fertilidad del suelo en algunas sabanas neotropicales. Con base en sus estudios realizados en las sabanas de Belice (América Central), postuló que la vegetación en suelos infértiles es inherentemente más propensa al fuego que la de suelos más fértiles.
En México, a pesar de ser un componente importante de la vegetación en diversas regiones, las sabanas no han sido ampliamente estudiadas. Algunos autores sostienen que su origen es de carácter antropogénico (Miranda, 1952; Sarukhán, 1968; Puig, 1972; Reyes y Zamora, 1973; Gómez-Pompa, 1978; Leopold, 1990). En contraste, Miranda (1958) sugirió que en algunos casos las sabanas tienen un origen primario, como en la Península de Yucatán, donde los suelos que sustentan las sabanas son la etapa final de un proceso de emersión dinámica o eustática de terrenos pantanosos o lacustres que se fueron erosionando, formando planicies con suelos deficientes en drenaje.
Las sabanas más prominentes se encuentran en el sureste del país, en Tabasco, Chiapas y Veracruz, así como en la región de Los Chenes en Campeche y Yucatán (Miranda y Hernández-X., 1963; Rzedowski, 1978; flores y Espejel, 1994). Las condiciones en que se encuentra esta comunidad vegetal en el sureste de México son muy semejantes a las descritas en Centroamérica, las Antillas y el norte de Sudamérica (Rzedowski, 1978).
Otras regiones con extensiones significativas de sabanas se presentan en la franja costera del Pacífico sur de Oaxaca y del sureste de Guerrero. A diferencia de las sabanas de la planicie costera del Golfo de México, éstas se desarrollan sobre laderas de cerros, con pendientes a veces bastante pronunciadas y con suelos que no son de drenaje lento, por lo que Rzedowski (1978) las agrupó bajo el término "vegetación sabanoide". Ejemplos de estas comunidades se presentan, de manera discontinua, en la región del Istmo de Tehuantepec. Tal es el caso de las sabanas localizadas en la región de Nizanda (Oaxaca), para las que Pérez-García et al. (2001) citan algunas especies que se presentan exclusivamente en este tipo de vegetación.
En México las sabanas están pobremente representadas en términos de área, a una escala nacional; por lo tanto, los principales estudios sobre el tema realizados en el país no han profundizado en el conocimiento de las mismas. Tomando en cuenta que los estudios detallados de las sabanas en México han sido escasos (e.g. Puig, 1972; Reyes y Zamora, 1973) y con el fin de contribuir al conocimiento de este tipo de vegetación, en el presente trabajo se ofrece una caracterización de las sabanas de la región de Nizanda en términos florísticos y estructurales.
ZONA DE ESTUDIO
Las comunidades de estudio están ubicadas en el Istmo de Tehuantepec, en los alrededores de los poblados de Nizanda y Chivela (Fig. 1). Aunque los dos pertenecen al municipio de Asunción Ixtaltepec, una porción de la región de trabajo se ubica en el de Ciudad Ixtepec, ambos del Distrito de Juchitán (Oaxaca). Esta comarca es parte de la vertiente pacífica del Istmo de Tehuantepec y se localiza donde inician las serranías del mencionado istmo, mientras que al sur de la región de estudio se encuentra la Planicie Costera de Tehuantepec (Fig. 1).
En la carta de efectos climáticos correspondiente a la estación de lluvias (Anónimo, 1985a), el área estudiada se ubica entre las isoyetas de 800 y 1,200 mm, mientras que en la época de secas, de acuerdo con la carta de efectos climáticos (Anónimo, 1985b), se encuentra entre las isoyetas de 50 y 150 mm de precipitación. Además de la estacionalidad tan pronunciada, los fuertes vientos que generalmente soplan en la región son particularmente notorios en las sabanas por estar ubicadas en las partes altas de los lomeríos.
En la región predominan rocas del Mesozoico, particularmente filitas y calizas (Anónimo, 1981). En cuanto a los suelos, se pueden encontrar Litosoles, Feozems háplicos y Regosoles eútricos (Anónimo, 1981). Los lomeríos de filitas tienen alturas que van desde 130 hasta 300 m (con pendientes de 8-35°) y son característicos de la zona de estudio junto con una serie de afloramientos de roca caliza (Pérez-García et al., 2001). Las sabanas se encuentran en las cimas y laderas altas de estos lomeríos, donde el suelo es muy somero, muchas veces con el material parental expuesto.
Pérez-García et al. (2001) describieron para la región de Nizanda los siguientes tipos de vegetación, ordenados del más al menos extenso: selva baja caducifolia, sabana (11% de la zona; Colín-García, 2003), matorral espinoso, matorral xerófilo, bosque de galería, selva mediana subcaducifolia y subperennifolia, vegetación acuática y subacuática; además de vegetación secundaria y agrosistemas. Dichos autores mencionan que aparte de la selva baja caducifolia, solamente la sabana forma grandes manchones, y que las transiciones entre los manchones de sabana y su vegetación circundante, en particular con la selva baja caducifolia, son generalmente abruptas y no han modificado sus bordes desde hace por lo menos 40 años.
De acuerdo con el estudio florístico hecho por Pérez-García et al. (2001), en las sabanas de Nizanda dominan las familias Poaceae (26 especies), Cyperaceae (11), Asteraceae (15) y Fabaceae (25). Estos autores encontraron que en el mosaico vegetacional de la región varias especies se presentan exclusivamente en las sabanas, destacando en dicho grupo todas las del género Polygala.
MÉTODOS
En la zona de estudio existen áreas de sabana de diversos tamaños y formas, mismas que pueden ordenarse de manera arbitraria, en conjuntos de acuerdo con su distribución y cercanía entre sí. Meave y Pérez-García (2000) distinguieron a partir de la ubicación del poblado de Nizanda tres áreas de sabanas: (1) las ubicadas al norte, en las faldas del cerro Naranjo, denominadas en este trabajo con las letras NB, junto con otros dos grupos de sabanas aisladas situadas cercanas a las faldas de dicho cerro, denominadas NC y ND; (2) las que se encuentran al sur, en las inmediaciones de la vía del ferrocarril transístmico (SF), y (3) las sabanas pequeñas del sureste, rodeadas por matorral espinoso (SE). En este estudio se incluyó adicionalmente un conjunto de sabanas, localizadas más al norte, en los terrenos de Chivela (NA).
Con base en las diferentes extensiones de estos manchones, se tomaron muestras en dos puntos en las sabanas rodeadas por matorral espinoso, dos más en las cercanas a las vías del tren, tres en las de Chivela, y el resto (13) en las ubicadas en las faldas del cerro Naranjo, lo que dio un total de 20 unidades de muestreo.
Las unidades fueron definidas como áreas de 15 m2 repartidas en 15 parcelas de 1 m2 cada una. Estas últimas se distribuyeron a intervalos de 5 m a lo largo de tres líneas paralelas, separadas a su vez por una distancia de 5 m. En todas las parcelas se midió la cobertura de cada planta enraizada en su interior, a excepción de la de los pastos y de las ciperáceas (hierbas graminoides), la cual fue evaluada mediante estimaciones porcentuales. Además, tanto para las plantas individuales como para las coloniales se registraron sus alturas (López-Olmedo, 2001).
Se siguió la nomenclatura de la vegetación y la flora utilizada por Pérez-García et al. (2001) para la región de Nizanda.
Con el fin de obtener un espectro biológico, a cada especie se le asignó una forma de vida de acuerdo con la clasificación de Raunkiaer (Mueller-Dombois y Ellenberg, 1974). Para tal fin se utilizaron tanto observaciones de campo como datos incluidos en descripciones botánicas.
La cobertura (A) se estimó a partir de los diámetros (d1 y d2) registrados para cada planta, aplicando la fórmula del área de una elipse. Se calcularon valores de importancia relativa (VIR) para todas las especies o morfoespecies en cada sitio utilizando la siguiente fórmula:
VIR = Cr + Fr
donde Cr representa la cobertura relativa y Fr representa la frecuencia de la especie. La cobertura y frecuencia relativas se calcularon como:
Fr = f/ft
Cr = c/ct
donde f = frecuencia de la especie, ft = máxima frecuencia de una especie, c = cobertura relativa de la especie, ct = cobertura total de las especies.
Para el cálculo del valor de importancia no se tomó en cuenta la densidad relativa, ya que en las sabanas la mayoría de las plantas son clonales y no se pueden diferenciar los individuos. Por la misma razón, para obtener el índice de diversidad de Shannon y el de dominancia de Berger-Parker, se utilizaron los valores de cobertura total de las especies en las unidades de muestreo. Se usaron las siguientes fórmulas:
Índice de Shannon = - Ʃ(ci/C) log2(ci/C)
Índice de Berger-Parker = cimáx/C
donde: ci = cobertura de la iava especie, C = cobertura total de todas las especies, y cimáx= cobertura de la especie con el máximo valor para esta variable.
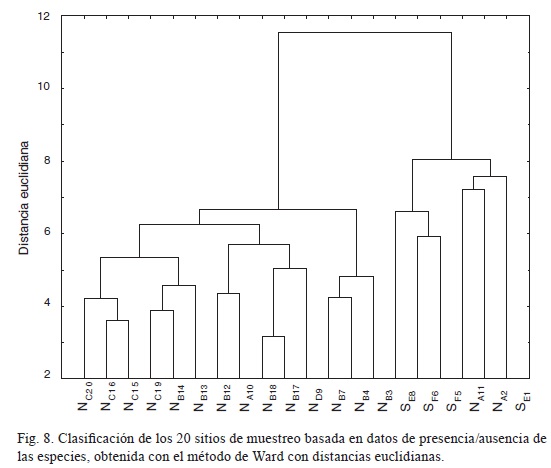
Se realizó una clasificación numérica de los sitios utilizando datos binarios de presencia-ausencia de las especies, mediante el método de Ward (van Tongeren, 1995), utilizando como medida de diferencia a las distancias euclidianas. Lo anterior se llevó a cabo con la finalidad de averiguar si existían grupos delimitados por su composición florística y, de ser así, si tales grupos coincidían con los distinguidos inicialmente de acuerdo con su localización geográfica.
RESULTADOS
Composición florística y espectro biológico
En los 20 sitios de muestreo se encontraron 135 morfoespecies. De éstas, 86 (64%) fueron determinadas hasta el nivel de especie, 10 más (7%) hasta género y otras 23 (17%) hasta el nivel de familia. En total, las determinaciones incluyen 86 especies, 68 géneros y 29 familias. Sólo 15 morfoespecies (11°%) no fueron determinadas a ningún nivel taxonómico y por lo tanto quedaron clasificadas como especies desconocidas (Apéndice).
Las familias mejor representadas, tanto por el número de géneros como por el de especies, fueron Leguminosae (16 géneros y 32 especies), Poaceae (13 y 19) y Asteraceae (8 y 9). En cuanto a la riqueza de especies por género, sobresalieron Polygala, por contener cinco (este número podría ascender a ocho si se incluyeran las morfoespecies), y Bulbostylis, que tiene cuatro. En contraste, 15 familias, las cuales constituyen casi la mitad de las registradas en el muestreo, tuvieron un solo representante (Fig. 2).
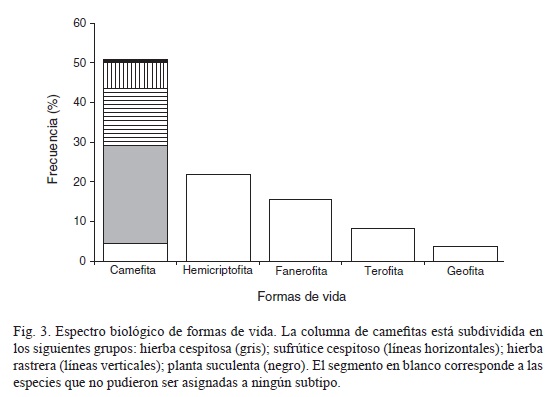
Del total de especies encontradas, sólo a 105 (78.5%) se les pudo asignar una forma de vida (Apéndice). La forma camefita fue la predominante (56 especies), y le siguieron hemicriptofita (23), fanerofita (12) y terofita (9); mientras que la forma geofita, con sólo cuatro especies, tuvo la representación más marginal (Fig. 3). Las hemicriptofitas correspondieron principalmente a gramíneas, mientras que entre las fanerofitas destacaron las pocas especies arbóreas y arbustivas. Las geofitas incluyeron plantas pertenecientes a las familias Amaryllidaceae, Iridaceae, Asclepiadaceae y Orchidaceae, y entre las terofitas se concentraron hierbas pequeñas de los géneros Polygala y Schizachyrium (Apéndice). Tomando en cuenta una clasificación más desglosada para la forma de vida camefita, se encontraron cuatro subtipos. Al de las hierbas cespitosas correspondió el mayor número de especies (27, por ejemplo Diodia teres), seguido por el subtipo sufrútice cespitoso (16, e.g. Zornia megistocarpa), el subtipo hierba rastrera (7, e.g. Galactia argentea) y el subtipo suculenta (con tallo suculento), este último con un único representante (Melocactus ruestii). Sólo cinco especies camefitas no pudieron ser asignadas a ningún subtipo.
Riqueza y diversidad
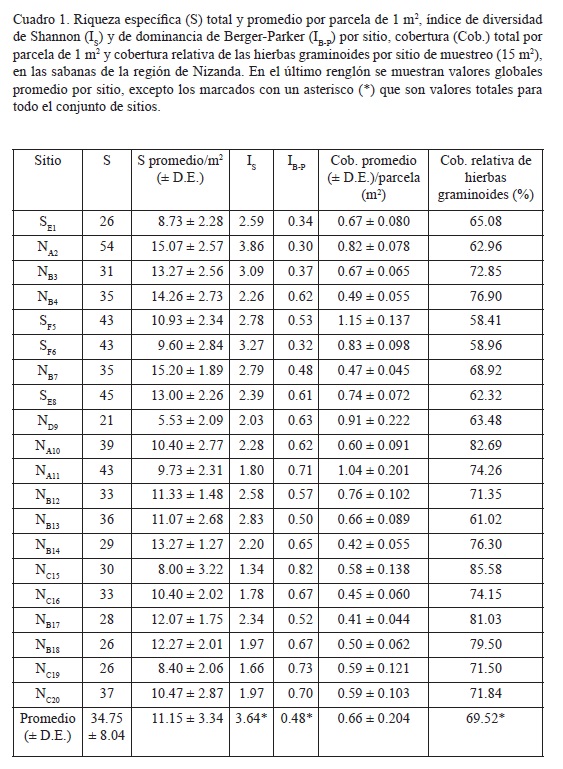
De acuerdo con el índice de Shannon (log2), la diversidad de toda la comunidad de sabana muestreada tuvo un valor general de 3.64 (Cuadro 1). No obstante, analizando los sitios por separado, los valores que toma el índice varían considerablemente. El sitio NA2 fue el más rico, con 54 especies, cifra que representa más que el doble de la riqueza del sitio más pobre (ND9 con 21 especies) y equivale a 40% de todas las especies que aparecieron en el muestreo. Además, el valor del índice de Shannon (3.86) hace de éste el sitio más diverso, debido a que tal cifra incluso superó a la obtenida para toda la comunidad. En el otro extremo, la menor riqueza del sitio ND9 no coincidió con la diversidad más baja, ya que para este lugar se calculó un valor de diversidad de 2.03, el cual fue más alto que el obtenido para el sitio NC15 (1.34), en el que aparecieron 30 especies.
El índice de Berger-Parker mostró que las sabanas de Nizanda tienen una fuerte dominancia a nivel local, ya que en 15 sitios de muestreo la especie con mayor cobertura tuvo 50% o más de la cobertura total. Solamente los sitios SEI, NA2, NB3 y SF6 presentaron valores < 0.40 para este índice y el más alto (0.82) correspondió a un sitio dominado por Trachypogon spicatus (Cuadro 1).
Estructura horizontal y vertical de la vegetación
En los 300 m2 muestreados se registraron 200.7 m2 de cobertura vegetal, lo que equivale a alrededor de dos tercios de dicha superficie. Entre los 20 sitios de muestreo el valor máximo fue de 17.2 m2 y el mínimo de 6.37 m2, es decir, el porcentaje de cobertura vegetal varió entre 114.8% y 42.5%. En general, dentro de cada unidad de muestreo no hubo mucha variación en la cobertura entre las parcelas de 1 m2, lo cual se ve reflejado en los valores bajos de desviación estándar en todos los sitios (Cuadro 1).
Un porcentaje alto (69.5%) de la cobertura vegetal total correspondió a las gramíneas y ciperáceas, grupo denominado en conjunto como hierbas graminoides. No obstante, este número varió individualmente entre 58.4% y 85.6% (Cuadro 1).
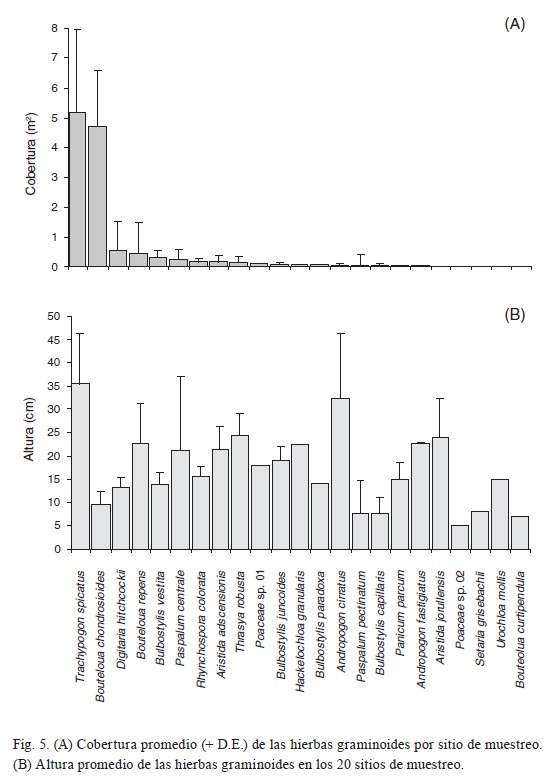
Menos de 10% de las plantas no clonales (7,570 individuos) tuvieron una cobertura mayor de 0.016 m2, y 59.9% de ellas presentaron una cobertura ≤ 0.002 m2 (Fig. 4). Los valores más altos entre las hierbas graminoides correspondieron a Trachypogon spicatus y Bouteloua chondrosioides, ambas con promedios cercanos a 5 m2 (Fig. 5A). La cobertura promedio del resto de las especies fue menor de 1 m2; entre éstas, las que tuvieron una variación mayor fueron Digitaria hitchcockii, Bouteloua repens y Paspalum pectinatum.
La altura general de la vegetación fue de cerca de 35 cm, que corresponde a la talla de la especie con mayor cobertura (Trachypogon spicatus). No obstante, la distribución de frecuencias de clases de altura (Fig. 6) muestra que más de la mitad de los individuos (51.8%) se ubican entre 2.1 y 8.0 cm. Menos de 16% de los individuos midieron >16.1 cm, y sólo uno alcanzó la altura máxima de 117 cm.
Trachypogon spicatus y Andropogon cirratus fueron las hierbas graminoides más altas, cuyas alturas promedio sobrepasan 30 cm (Fig. 5B), mientras que las especies de este grupo con los valores medios más bajos fueron Paspalum pectinatum, Bulbostylis capillaris, Bouteloua curtipendula, Poaceae sp. 02 y Bouteloua chondrosioides, todas ellas con una altura media < 10 cm.
Valores de importancia relativa
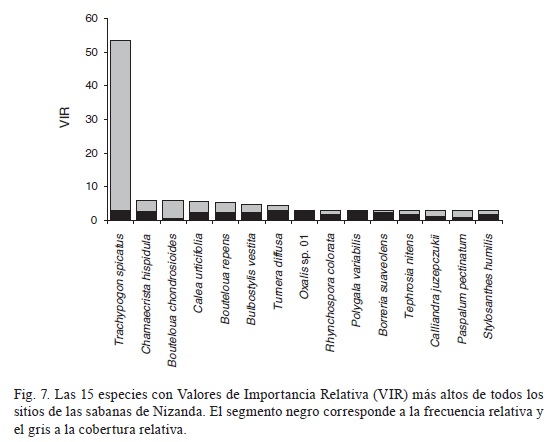
Trachypogon spicatus tuvo el VIR más grande (146.2), debido a que presentó la mayor cobertura relativa (fig. 7). para el resto de las especies el Vir estuvo dado principalmente por la frecuencia relativa y sólo en algunas como Turnera diffusa, Chamaechrista hispidula, Calea urticifolia, Bouteloua repens y Bulbostylis vestita la cobertura relativa contribuyó de manera considerable a su VIR. En 18 sitios, Trachypogon spicatus tuvo el VIR más alto, mientras que en los dos sitios restantes la primera posición correspondió a Turnera diffusa y Bouteloua chondrosioides.
Clasificación de los sitios
En el dendrograma basado en los datos de presencia-ausencia de las especies se distinguen dos grandes grupos en un nivel de distancia euclidiana de 10 (fig. 8). El primero se encuentra conformado por los sitios sE1, sF5, sF6, NA11, NA2 y SE8, y en él se incluyen a todas las unidades de muestreo localizadas en la parte sur de Nizanda (designadas con las letras SE y SF), así como dos de las cercanas al poblado de Chivela (NA). El segundo conjunto contiene al resto de las unidades de muestreo, todas situadas al norte de Nizanda, e integra a las que se ubicaron en las faldas del cerro Naranjo (NB), en los manchones aislados (NC) y en Chivela (NA).
DISCUSIÓN
Riqueza y composición florística
La lista de plantas de los 20 sitios incluye 135 morfoespecies, lo que representa 75% del total de especies registradas para las sabanas en el inventario florístico regional (Pérez-García et al., 2005). El conjunto está conformado por una variada gama de taxa con diferentes amplitudes de distribución en la región. Un grupo reducido que incluye a Turnera diffusa, Setaria grisebachii y Waltheria indica, también se presenta en otros tipos de vegetación. Asimismo, llegaron a encontrarse de forma esporádica individuos juveniles de árboles o arbustos propios de comunidades aledañas, como Cochlospermum vitifolium, las cuales no parecen ser capaces de llegar al estado adulto en las sabanas. por el contrario, existe una proporción mucho más grande de especies totalmente circunscritas a las sabanas.
Respecto a la distribución de las especies exclusivas de las sabanas, éstas presentaron patrones espaciales muy variados en el sistema estudiado. La mayoría de ellas mostraron distribuciones más o menos restringidas; sólo 11% de las especies tuvieron una frecuencia ≥ 70% (Apéndice), entre las que destacan Trachypogon spicatus y Oxalis sp. 01. En contraste, plantas como Melocactus ruestii, Waltheria indica, Bouteloua chondrosioides, Pseudosmodingium multifolium, Melampodium sericeum, Metastelma lanceolatum y M. multiflorum sólo aparecieron en las sabanas del sur. Esta distribución limitada es congruente con la información derivada del inventario florístico global de la región, ya que otras especies como Cheiloplecton rigidum (Sw.) Fée (Pteridaceae), Amphipterygium adstringens (Schltdl.) Standl. (Julianiaceae) y Bursera bicolor (Willd. ex Schltdl.) Engl. (Burseraceae), que no aparecieron en el muestreo, sólo han sido recolectadas en esa área.
De la misma manera, en las sabanas ubicadas al norte de Nizanda fueron registradas de forma exclusiva otras especies, destacando las particularmente abundantes Calliandra juzepczukii, Polygala variabilis, Eriosema crinitum, Bulbostylis juncoides, además de Polygala leptocaulis, Bulbostylis paradoxa, Habenaria trifida, Zamia loddigesii y Croton repens. De nuevo, este patrón se confirma por la presencia de plantas como Bletia coccínea La Llave et Lex., Sacoila lanceolata (Aubl.) Garay (Orchidaceae) y Manfreda pubescens (Regel et Ortgies) Verh.-Will. ex Piña (Agavaceae), recolectadas en esas comunidades independientemente del inventario realizado para este estudio.
La clasificación numérica de las unidades de muestreo coincidió en general con la diferenciación florística entre áreas del norte y del sur de las sabanas, ya que ambos conjuntos se unen sólo al llegar a valores muy altos de distancia euclidiana (i.e. similitud muy baja). Un resultado similar fue dado a conocer por Pérez-García et al. (2005) y Pérez-García y Meave (2006) para la misma región, obtenido a partir de un conjunto diferente de datos y con otra metodología. Los mencionados autores mostraron que la diferenciación norte-sur entre estas sabanas, la cual inclusive se mantiene al hacer el análisis para niveles taxonómicos superiores, puede ser de la misma magnitud que la detectada entre la selva baja caducifolia y el matorral espinoso.
Caracterización general de la fisonomía y estructura de las sabanas de estudio
El espectro de formas de vida obtenido para las sabanas estudiadas muestra la predominancia de las camefitas, pero señala también que el conjunto formado por las hemicriptofitas y las fanerofitas incluye muchas especies, mientras que las geofitas y las terofitas son un componente escaso. Las hemicriptofitas en su mayoría están representadas por gramíneas y las geofitas por hierbas de talla pequeña pertenecientes a diversas familias; se ha sugerido que estas especies son las que mejor resisten la herbivoría, pero sobre todo el fuego (Richards, 1996). A pesar de que la forma de vida terofita apareció en los sitios con una frecuencia alta, en realidad son pocas las especies que la presentan, lo que implica que la mayoría de las plantas de esta comunidad viven por periodos de más de un año. En general, el espectro biológico indica que se trata de una vegetación establecida en un ambiente con fuertes restricciones para el crecimiento de las plantas, posiblemente de modo particular las de tipo hídrico, ya que la gran proporción de camefitas, junto con las geofitas y las hemicriptofitas, sugiere que muchas protegen sus yemas de perennación de la desecación debajo de la cobertura de las hierbas graminoides.
El análisis estructural mostró que los valores de importancia en estas sabanas están dados principalmente por la cobertura. A diferencia de otras comunidades, en las cuales la densidad ha sido un elemento útil para determinar la importancia relativa de las especies que las conforman, la gran abundancia de plantas clonales impidió la realización de un análisis de densidad y por lo tanto el uso de esta variable. A pesar de dicha limitación, es interesante que 49 de las 135 especies hayan estado representadas en el muestreo por un solo individuo, lo cual es un indicio de que las densidades de muchas de ellas parecen ser muy bajas y apunta hacia una fuerte prevalencia de unas pocas.
De acuerdo con los valores de importancia, Trachypogon spicatus es el componente predominante de las sabanas estudiadas debido principalmente a su gran cobertura. Por ello, ésta es precisamente la especie que conforma mayoritariamente la cubierta vegetal protectora de las plantas pequeñas. Por otro lado, entre las no clonales existen especies como Turnera diffusa y Oxalis sp. 01, las que a pesar de su escaso tamaño, se presentan con una frecuencia muy alta en los sitios, haciendo de ellas un componente constante en la composición del estrato bajo.
A pesar del predominio de Trachypogon spicatus, la variedad de alturas y coberturas encontradas muestra que las sabanas de Nizanda poseen una estructura relativamente compleja, no obstante que la mayoría de las plantas tienen tamaños muy reducidos en relación con la escala humana. Esta "condición miniatura" de la vegetación puede estar relacionada con la capacidad de las plantas para llegar a la madurez en un ambiente caracterizado por la escasez de nutrientes y de agua en el suelo, que son los dos factores principales en la determinación de las características morfológicas y fisiológicas de las plantas de las sabanas (Mistry, 2000).
Tipificación de las sabanas de Nizanda y comparación con otras regiones
La caracterización estructural de las sabanas de la región de Nizanda permite catalogarlas como sabanas abiertas, de acuerdo con la clasificación propuesta por Sarmiento (1983), debido principalmente a la casi total ausencia de cobertura del estrato arbóreo.
En Nizanda, las familias importantes en cuanto a número de especies fueron Leguminosae y Poaceae. Este resultado es consistente con observaciones realizadas en otras sabanas neotropicales por diversos autores (Rzedowski, 1978; Sarmiento, 1983; Richards 1996; Mostacedo y Killeen, 1997; Furley, 1999). En el mismo sentido, Rzedowski (1978), Sarmiento (1983) y Richards (1996) reconocen como familias de importancia subsecuente a aquellas que tienen representantes arbóreos típicos, como Malpighiaceae (representada por Byrsonima crassifolia) y Dilleniaceae (Curatella americana). Beard (1953) agrega como características a Asteraceae, Convolvulaceae, Malvaceae, Polygalaceae y Melastomataceae. Todas estas familias están bien representadas en las sabanas aquí estudiadas, con la notable excepción de Dilleniaceae y Melastomataceae. La ausencia de Melastomataceae probablemente se deba a que sus especies son propias de ambientes más húmedos o de mayor altitud (Gentry, 1988). La tercera familia importante es Asteraceae, que es una de las mejor representadas en la región de Nizanda (Pérez-García et al., 2001).
La especie con mayor VIR en este estudio también alcanza los primeros valores en otras sabanas americanas. En la región de Los Llanos de Venezuela, Trachypogon spicatus (citado como T. plumosus) ocupa el tercer lugar en las sabanas definidas como naturales y el segundo en las antiguamente perturbadas (Lovera y Cuenca, 1998). Esta especie también es dominante en las sabanas de Guyana, Guayana Francesa, en la Gran Sabana de Venezuela (Beard, 1953) y en parte del cerrado de Bolivia (Mostacedo y Killeen, 1997).
Las sabanas de Nizanda: ¿antropogénicas o de origen natural?
En las sabanas de estudio, aun cuando existen sistemas aledaños de vegetación secundaria como los potreros, y a pesar de que el ganado en la búsqueda de alimento transita frecuentemente entre éstas y tales agostaderos, no se encontraron plantas introducidas como componentes importantes de la vegetación. La escasez de especies exóticas muestreadas, aunada a la presencia de elementos endémicos (Zornia megistocarpa, Zamia loddigesii), constituye un fuerte indicador de su origen natural. En algunas sabanas cubanas, la existencia de especies endémicas de palmas también ha sido interpretada como evidencia de su caracter primario (Huber, 1987). Por otro lado, a pesar de existir un cierto régimen de fuego, el número tan bajo de geofitas hace pensar que las sabanas de estudio no son de génesis reciente, ni que están sometidas, al menos en algunas porciones, a disturbios muy frecuentes e intensos. Otro indicio que apoya la idea del origen natural de las sabanas de Nizanda es el hecho de su gran semejanza, al menos a nivel estructural, con otras comunidades neotropicales no antropogénicas en las que Trachypogon spicatus también es importante o dominante.
CONCLUSIONES
Los resultados de este estudio permiten concluir que las sabanas de la región de Nizanda están básicamente conformadas por Trachypogon spicatus; que se trata de sabanas abiertas con escasos elementos arbóreos y arbustivos; y que a pesar de la altura tan reducida de la vegetación en comparación con la escala humana, su estructura vertical es relativamente compleja, existiendo un verdadero estrato bajo conformado por un gran número de especies de plantas miniatura, muchas de ellas muy raras.
A pesar del fuerte predominio de Trachypogon spicatus, hay una diversidad importante que se ve reflejada en una riqueza relativamente alta de especies. Más importante aún, la mayor parte de esta profusión está dada por taxones que no se comparten con otros tipos de vegetación presentes en la región, ni siquiera con los sistemas secundarios como los potreros.
Las características florísticas y estructurales de las sabanas estudiadas llevan a concluir que son comunidades de origen natural, típicas de la región centroamericana, a pesar de mostrar cierto grado de perturbación humana. Estas comunidades constituyen un escenario ideal para investigar las complejas relaciones entre las plantas y un medio físico tan restrictivo, y por lo tanto tan selectivo, como éste.
AGRADECIMIENTOS
El fondo sectorial CONACyT-SEMARNAT (C01-0267) y la CONABIO (L085) proporcionaron financiamiento para la realización de esta contribución. Se agradece a la familia Reyes-Manuel y a los pobladores de Nizanda y Chivela por las facilidades brindadas en el trabajo de campo. E. Lebrija-Trejos, M. Romero-Romero y P. Guadarrama-Chávez colaboraron en el muestreo de la vegetación. Liliana I. López-Olmedo agradece al CONACyT por la beca otorgada.
LITERATURA CITADA
Anónimo, 1981. Atlas nacional del medio físico. Secretaría de Programación y Presupuesto. México, D.F. 223 pp. [ Links ]
Anónimo, 1985a. Carta de efectos climáticos regionales (mayo-octubre) 1:250,000. Juchitán E15-10 D15-1. Secretaría de Programación y Presupuesto. México, D.F. [ Links ]
Anónimo, 1985b. Carta de efectos climáticos regionales (noviembre-abril) 1:250,000. Juchitán E15-10 D15-1. Secretaría de Programación y Presupuesto. México, D.F. [ Links ]
Beard, J. S. 1953. The savanna vegetation of northern tropical America. Ecol. Monogr. 23: 150-215. [ Links ]
Colín-García, M. 2003. Evaluación de los cambios de la cobertura vegetal y del riesgo de las especies de plantas en la región de Nizanda (Oaxaca, México). Tesis de maestría (Ciencias Biológicas). Facultad de Ciencias, Universidad Nacional Autónoma de México. México, D.F. 71 pp. [ Links ]
Flenley, J. 1979. The equatorial rain forest: a geological history. Butterworths. Londres. 162 pp. [ Links ]
Flores, J. e I. Espejel. 1994. Tipos de vegetación de la Península de Yucatán. Etnoflora Yucatanense. Universidad Autónoma de Yucatán. Mérida. 135 pp. [ Links ]
Furley, P. A. 1999. The nature and diversity of neotropical savanna vegetation with particular reference to the Brazilian cerrados. Global Ecol. Biogeogr. 8: 223-241. [ Links ]
Gentry, A. W. 1988. Changes in plant community diversity and floristic composition on environmental and geographical gradients. Ann. Mo. Bot. Gard. 75: 1-34. [ Links ]
Gómez-Pompa, A. 1965. La vegetación de México. Bol. Soc. Bot. Méx. 29: 76-120. [ Links ]
Gómez-Pompa, A. 1978. Ecología de la vegetación del estado de Veracruz. Instituto de Investigaciones sobre Recursos Bióticos A.C. Xalapa. 91 pp. [ Links ]
Huber, O. 1987. Neotropical savannas: their flora and vegetation. TREE 2: 67-71. [ Links ]
Kellman, M. 1984. Synergistic relationships between fire and low soil fertility in neotropical savannas: a hypothesis. Biotropica 16: 158-160. [ Links ]
Kellman, M. 1989. Mineral nutrient dynamics during savanna-forest transformation in Central America. In: Proctor, J. (ed.). Mineral nutrients in tropical forest and savanna ecosystems. Blackwell Scientific Publications. Oxford. pp. 137-151. [ Links ]
Leopold, A. 1990. Fauna silvestre de México: aves y mamíferos de caza. Instituto Mexicano de Recursos Naturales Renovables. Fauna Silvestre de México. México, D.F. 608 pp. [ Links ]
López-Olmedo, L. I. 2001. Estructura y composición florística de las sabanas de la región de Nizanda y Chivela, Istmo de Tehuantepec (Oaxaca), México. Tesis de licenciatura. Facultad de Ciencias, Universidad Nacional Autónoma de México. México, D.F. 74 pp. [ Links ]
Lovera, M. y G. Cuenca. 1998. Arbuscular mycorrhizal infection in Cyperaceae and Graminae from natural, disturbed and restored savannas in La Gran Sabana, Venezuela. Mycorrhiza 6: 111-116. [ Links ]
Lüttge, U. 1997. Physiological ecology of tropical plants. Springer Verlag. Berlín. 384 pp. [ Links ]
Medina, E. y J. F. Silva. 1991. Savannas of northern South America: a steady state regulated by water-fire interactions on a background of a low nutrient availability. In: Werner, A. (ed.). Savanna ecology and management: Australian perspectives and intercontinental comparisons. Blackwell Scientific Publications. Oxford. pp. 59-69. [ Links ]
Meave, J. y E. A. Pérez-García. 2000. Estudio de la diversidad florística de la región de Nizanda, Istmo de Tehuantepec, Oaxaca. (Proyecto L085/97). Informe final presentado a la Comisión Nacional para el Conocimiento y Uso de la Biodiversidad. México, D.F. 61 pp. [ Links ]
Miranda, F. 1952. La vegetación de Chiapas. Ediciones del Gobierno del Estado. Tuxtla Gutiérrez. 334 pp. [ Links ]
Miranda, F. 1958. Estudios acerca de la vegetación. In: Beltrán, E. (ed.). Los recursos naturales del sureste y su aprovechamiento. Instituto Mexicano de Recursos Naturales Renovables. México, D.F. pp. 215-271. [ Links ]
Miranda, F. y E. Hernández-X. 1963. Los tipos de vegetación de México y su clasificación. Bol. Soc. Bot. Méx. 28: 1-179. [ Links ]
Mistry, J. 2000. World savannas: ecology and human use. Prentice Hall. Londres. 344 pp. [ Links ]
Mostacedo, B. y T. Killeen. 1997. Estructura y composición florística del cerrado en el Parque Nacional Noel Kempff Mercado, Santa Cruz, Bolivia. Bol. Soc. Bot. Méx. 60: 25-43. [ Links ]
Mueller-Dombois, D. y H. Ellenberg. 1974. Aims and methods of vegetation ecology. John Wiley & Sons. Nueva York. 457 pp. [ Links ]
Pérez-García, E. A. y J. A. Meave. 2006. Coexistence and divergence of tropical dry forests and savannas in southern Mexico. J. Biogeogr. 33: 438-447. [ Links ]
Pérez-García, E. A., J. A. Meave y J. A. Cruz-Gallardo. 2005. Diversidad β y diferenciación florística en un paisaje complejo del trópico estacionalmente seco del sur de México. In: Halffter, G., J. Soberón, P. Koleff y A. Melic (eds.). Sobre diversidad biológica: el significado de las diversidades alfa, beta y gamma. Sociedad Entomológica Aragonesa. Zaragoza. pp. 123-142. [ Links ]
Pérez-García, E. A., J. Meave y C. Gallardo. 2001. Vegetación y flora de la región de Nizanda, Istmo de Tehuantepec, Oaxaca, México. Acta Bot. Mex. 56: 19-88. [ Links ]
Puig, H. 1972. La sabana de Huimanguillo, Tabasco, México. Memorias de Symposia del I Congreso Latinoamericano y V Mexicano de Botánica. Sociedad Botánica de México. México, D.F. pp. 389-411. [ Links ]
Reyes, R. y C. Zamora. 1973. Estudio de una sabana de montaña localizada en las estribaciones de la Sierra Madre del Sur. Ciencia Forestal 1: 36-64. [ Links ]
Richards, P. W. 1996. The tropical rain forest. Cambridge University Press. Cambridge. 599 pp. [ Links ]
Rzedowski, J. 1978. Vegetación de México. Limusa. México, D.F. 432 pp. [ Links ]
Sarmiento, G. 1983. The ecology of neotropical savannas. Harvard University Press. Cambridge. 235 pp. [ Links ]
Sarmiento, G. y M. Monasterio. 1975. A critical consideration of the environmental conditions associated with the occurrence of savanna ecosystems in tropical America. In: Golley, F. B. y E. Medina (eds.). Tropical ecological systems. Trends in terrestrial and aquatic research. Springer-Verlag. Nueva York. pp. 223-250. [ Links ]
Sarukhán, J. 1968. Los tipos de vegetación arbórea en la zona calido-húmeda de México. In: Pennington, T. D. y J. Sarukhán (eds.). Árboles tropicales de México. Manual para la identificación de campo de los principales árboles tropicales de México. INIF y FAO. México, D.F. pp. 3-46. [ Links ]
van der Hammen, T. 1983. The paleoecology and palaeogeography of savannas. In: Bourlière, F. (ed.). Tropical savannas. Elsevier. Amsterdam. pp. 19-35. [ Links ]
van Tongeren, O. F. R. 1995. Cluster analysis. In: Jongman, R. H. G., C. J. F. ter Braak y O. F. R. van Tongeren (eds.). Data analysis in community and landscape ecology. Cambridge University Press. Cambridge. pp. 175-203. [ Links ]
Zar, J. H. 1999. Biostatistical analysis. Prentice Hall. Upper Saddle River. 663 pp. [ Links ]