Introducción
Los humedales de la costa peruana son producto del surgimiento de aguas subterráneas y, en menor medida, del aporte de aguas superficiales. Cumplen con el importante rol de servir de refugio a numerosas especies animales y vegetales, así como también de brindar servicios ecosistémicos (Arana y Salinas, 2003; García y Lleellish, 2011). Por otro lado, las lagunas o humedales ubicados en la costa central peruana en Lima están siendo perturbados por las poblaciones aledañas mediante acciones como incendios, forraje para animales (Aponte et al., 2015), contaminación con metales pesados (Fajardo et al., 2017), y el avance de especies invasoras con la consecuente fragmentación de la vegetación (Aponte y Cano, 2013; Aponte y Ramírez, 2014). Sin embargo, también se puede observar que donde la actividad ganadera no es intensa, aún se tienen áreas intactas con abundante vegetación nativa (Aponte y Ramírez-Huaroto, 2011).
León et al. (1996) y Alonso y Crespo (2008) mencionan que dentro de las especies de amplia distribución que habitan estos ecosistemas resaltan Batis maritima L., Ruppia maritima L., Salicornia spp. y Sesuvium portulacastrum (L.) L. De las especies mencionadas, se decidió estudiar el comportamiento de Sarcocornia neei (Lag.) M.Á. Alonso & M.B. Crespo (basiónimo: Salicornia neei Lag.), principalmente debido a que, como mencionan Alonso y Crespo (2008), esta especie puede tener una amplia variación morfológica en las diferentes zonas en las que se distribuye, agregando que se ignora si estos cambios están relacionados con adaptaciones fisiológicas. También se desconoce la expresión de proteínas de respuesta al estrés salino de S. neei, como sí lo reportan Chiconato et al. (2019), Guo et al. (2019) y Pérez-Labrada et al. (2019) en plantas de caña de azúcar, de Suaeda salsa (L.) Pall. y de tomate, respectivamente, sometidas a salinidad.
La importancia de S. neei radica en que esta especie podría ser empleada en la alimentación humana como una verdura (Riquelme et al., 2016), gracias a que es una herbácea áfila de tallos suculentos. Sin embargo, se debe tener precaución porque esta especie acumula Pb (Riquelme et al., 2016). Por otro lado, se podrían utilizar sus semillas de la misma manera que se hace con Sarcocornia ambigua (Michx.) M.Á. Alonso & M.B Crespo, del sur de Brasil, cuyas semillas oleaginosas pueden ser utilizadas como alimento para animales o como biocombustible (D’oca et al., 2012; Costa et al., 2014). De la misma forma, Salicornia bigelovii Torr., Salicornia pérsica Akhani y Sarcocornia fructicosa (L.) A.J. Scott poseen una buena calidad de aceites en sus semillas y son regadas con agua de mar (Ventura et al., 2011; Lonard et al., 2012). Gracias a que los humedales de la costa central de Lima son Áreas de Conservación Regional, S. neei no tiene problemas de conservación.
Por lo tanto, S. neei tiene un gran potencial en la alimentación humana o de animales, o como especie promisoria en la descontaminación de suelos salinos contaminados con plomo. Sin embargo, aún se desconocen aspectos básicos de su biología. Por eso nos planteamos como objetivo estudiar la ecofisiología de esta especie, bajo condiciones de invernadero y de laboratorio, viendo la posibilidad de ser cultivada fuera de su ambiente natural.
Materiales y Métodos
El material biológico así como de tierra fue traído de dos humedales: A) Humedal de Ventanilla, ubicado en la Provincia Constitucional del Callao, Distrito de Ventanilla (11°52'40.9"S, 77°09'02.4"W) y B) Humedal de Paraíso, ubicado en el distrito de Huacho, provincia de Huaura, Región Lima (11°12'27.2"S, 77°35'43.1"W) (Fig. 1).
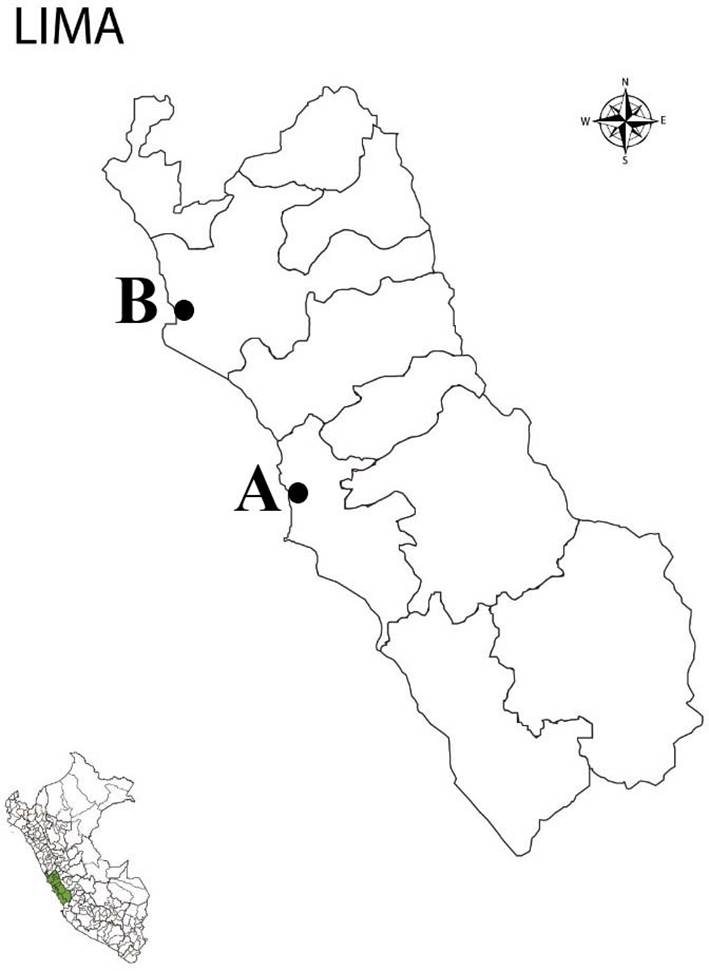
Figura 1: Mapas de las zonas de muestreo en Lima, Perú. A. Área de Conservación Regional Humedales de Ventanilla, ubicado en la Provincia Constitucional del Callao, Distrito de Ventanilla, el punto de muestreo corresponde a 11°52'40.9"S, 77°09'02.4"W; B. Hacia el Norte, Área de Conservación Regional Humedal “El Paraíso”, ubicado en la Provincia de Huaura, Distrito de Huacho, el punto de muestreo corresponde a 11°12'27.2"S, 77°35'43.1"W (Anthoncode, 2020).
El trabajo de laboratorio se realizó entre abril y noviembre 2015, tanto en el invernadero del Laboratorio de Anatomía y Farmacognosia Vegetal, como en el Laboratorio de Biología Molecular de la Facultad de Ciencias Biológicas de la Universidad Nacional Mayor de San Marcos, Lima, Perú. La especie S. neei fue determinada y su voucher depositado en el Herbario USM de la Universidad Nacional Mayor de San Marcos.
Germinación
Para realizar la prueba de germinación se recolectaron diez ramas con frutos maduros de aproximadamente 30-40 cm de longitud, provenientes de 10 individuos de ambos humedales. A partir de esos frutos se extrajeron 600 semillas. Éstas fueron sometidas a diferentes concentraciones de NaCl (0 M, 0.1 M, 0.3 M y 0.58 M). Se propuso la máxima concentración de NaCl (0.58 M), porque a esa concentración se tiene una fuerza iónica similar al agua de mar (Bustos-Serrano, 2017).
Cada tratamiento tuvo tres repeticiones y cada repetición se realizó con 50 semillas. La evaluación de la germinación fue diaria por un periodo de 15 días. Las placas Petri, donde se realizó la prueba de germinación, fueron cubiertas con papel aluminio, con la finalidad de disminuir la intensidad luminosa y las semillas fueron colocadas sobre papel toalla humedecido con agua o con solución salina según el tratamiento.
Por cada fecha de evaluación se calculó el porcentaje de germinación ((número de semillas germinadas/número de semillas sembradas) × 100), el índice de velocidad de germinación (IVG) (número de semillas germinadas/número de días en el cual germinaron). Al final se realizó la sumatoria de todas las divisiones (Maguire, 1962). Para la comparación de medias se empleó la prueba de Tukey con un nivel de confianza de 95% y su análisis se realizó con el complemento estadístico del programa Excel 2016.
Propagación por esquejes
Se colectaron 36 esquejes de 6 cm de longitud, en promedio, provenientes del humedal Paraíso. Se plantaron tres esquejes en cada uno de los 12 recipientes de plástico de 250 ml de capacidad, dispuestos para su propagación. Los recipientes se situaron a un lado del invernadero. El sustrato utilizado consistió en tierra del mismo lugar de colecta para permitir una mejor aclimatación. Los esquejes se regaron con una solución nutritiva hidropónica y se mantuvieron con luz solar directa hasta su aclimatación. Se consideraron aclimatados cuando se observó crecimiento longitudinal, situación que se dio a los 15 días. Pasado ese periodo los esquejes se colocaron en bolsas de plástico con sustrato sólido (humus y tierra agrícola (1:1)), con tres esquejes por bolsa y con el mismo tratamiento salino que el de la prueba de germinación (0 M, 0.1 M, 0.3 M y 0.58 M); se mantuvieron en el mismo lugar y con luz solar directa durante cuatro meses bajo las siguientes condiciones ambientales: temperatura mínima de 17.7 °C, máxima de 21.7 °C y temperatura media de 19.7 °C.
En un diseño completamente aleatorio, con tres repeticiones y para la comparación de medias, se empleó la prueba de Tukey con un nivel de confianza de 95% y su análisis se realizó con el complemento estadístico del programa Excel 2016.
Estudio histológico
De la evaluación anterior se tomaron ramas jóvenes que estuvieron sometidas a diferentes concentraciones salinas y se les hicieron cortes a mano alzada. Se usó una modificación de la técnica de coloración directa con safranina, se clarificaron los cortes con hipoclorito de sodio al 2.5% por 15 min. Posteriormente se lavaron tres veces con agua destilada durante 10 min. La muestra fue fijada con alcohol 70° por 24 horas para luego ser lavada tres veces con agua destilada durante 10 min. La tinción se realizó con safranina diluida (1:1) por un minuto, se retiró el exceso de colorante con glicerina diluida (1:1) por 40 segundos, se adicionó una gota de glicerina diluida en una lámina, y encima de esa gota se dispuso el corte histológico. Finalmente, se añadió una gota de gelatina líquida para el sellado de la lámina. La observación de los tejidos se realizó en un microscopio Leica (DM 750, Wetzlar, Alemania) con cámara incorporada ICC50 HD y se promediaron las medidas de los tejidos en 10 secciones de tallo.
Estudio de niveles de proteína
Cuantificación de proteínas
Se tomó, por tratamiento, 1 g de tejido de los tallos secos, se homogenizó en 20 ml de buffer Tris-HCl 0.05M pH 7.5 a 4 °C, para luego ser centrifugado a 6000 rpm durante 15 minutos en una centrífuga (Pro-Research K241R, West Sussex, Reino Unido) y las proteínas fueron cuantificadas a partir del sobrenadante mediante el método de Bradford (1976).
Purificación de proteínas
Se empleó el método de precipitación en metanol-cloroformo (Wessel y Flügge, 1984). Para este fin, a partir de 1 ml de muestra se agregaron 4 ml de metanol puro, 1 ml de cloroformo y 3 ml de agua destilada. Se mezcló y posteriormente se centrifugó a 6000 rpm por 30 min. De forma cuidadosa, se extrajo el sobrenadante y se agregaron 4 ml de metanol. La muestra se centrifugó a 6000 rpm por 30 min, se descartó el sobrenadante y se secó el pellet a 37 °C por 30 min. Finalmente, el pellet fue resuspendido en buffer de carga para PAGE-SDS.
Separación de proteínas
Se hicieron geles de poliacrilamida al 12% en condiciones desnaturalizantes, las cuales fueron mezcladas con buffer compuesto de SDS 0.1%, DTT 1 mM y azul de bromofenol. La electroforesis fue realizada a 100 V por 1 hora. Posteriormente, el gel fue teñido con Azul Brillante de Coomassie durante 30 minutos, decolorado con una mezcla de metanol, ácido acético y agua, y finalmente las bandas resultantes fueron analizadas visualmente.
Resultados
Germinación
Se puede observar que la germinación se incrementa conforme aumenta la concentración salina, pero solo hasta 0.3 M, ya que a los 0.58 M hay un descenso del porcentaje de germinación (Cuadro 1). Esto es corroborado con el dato de índice de velocidad de germinación (IVG) (Cuadro 2), donde se puede ver que la velocidad de germinación disminuye a la máxima concentración de NaCl, aunque no la detiene completamente.
Cuadro 1: Porcentaje de germinación de las semillas de Sarcocornia neei (Lag.) M.Á. Alonso & M.B. Crespo en diferentes concentraciones de NaCl y en diferentes días después de la siembra (dds). Letras iguales significan que no hay diferencias y letras distintas que las diferencias son significativas (p≤0.05), también se incluyen los datos de la Desviación Estándar.
| NaCl | 7 dds | 9 dds | 17 dds | |||
|---|---|---|---|---|---|---|
| 0 M | 14.7±3.4 | a,b | 16.0±3.3 | a,b | 34.0±5.9 | a,b |
| 0.1 M | 18.0±5.9 | a,b | 18.7±6.6 | a,b | 38.0±14.0 | a,b |
| 0.3 M | 23.3±7.4 | a | 27.3±3.4 | a | 51.3±5.7 | a |
| 0.58 M | 4.7±3.8 | b | 5.3±4.7 | b | 11.3±10.4 | b |
Cuadro 2: Índice de velocidad de germinación (IVG) de las semillas de Sarcocornia neei (Lag.) M.Á. Alonso & M.B. Crespo en diferentes concentraciones de NaCl. Letras iguales significan que no hay diferencias y letras distintas que las diferencias son significativas (p≤0.05).
| NaCl | IVG |
|---|---|
| 0 M | 2.9a,b |
| 0.1 M | 3.4a,b |
| 0.3 M | 4.7a |
| 0.58 M | 1.0b |
Propagación por esquejes
No se observan diferencias significativas (p≥0.05) en el crecimiento de los esquejes, entre las diferentes concentraciones de NaCl y en todas las fechas evaluadas; es decir, los tallos de S. neei pueden crecer incluso si son regadas con el agua de mar (Cuadro 3).
Cuadro 3: Incremento de la longitud (cm) de esquejes de Sarcocornia neei (Lag.) M.Á. Alonso & M.B. Crespo en diferentes concentraciones de NaCl y en diferentes días después de plantados (ddp). Letras iguales significan que no hay diferencias y letras distintas que las diferencias son significativas (p≤0.05), también se incluyen los datos de la Desviación Estándar.
| NaCl | 0 ddp | 30 ddp | 120 ddp | |||
|---|---|---|---|---|---|---|
| 0 M | 5.4±1.0 | a | 11±2.5 | a | 23.0±1.0 | a |
| 0.1 M | 5.5±1.2 | a | 11.7±2.1 | a | 26.7±1.3 | a |
| 0.3 M | 5.1±1.0 | a | 10.7±2.4 | a | 26.3±2.9 | a |
| 0.58 M | 5.8±1.1 | a | 12.2±1.9 | a | 25.0±2.8 | a |
Estudio histológico
Los cortes transversales de los tallos regados sin NaCl presentan los siguientes tejidos: epidermis monoestratificada con células de 33 µm en promedio y estomas del tipo paracítico (Fig. 2A); un parénquima subepidérmico con células alargadas (210 µm de largo), la cual incluye además haces xilemáticos que llegan hasta la epidermis (Fig. 2B); éstos son ramas del tejido vascular más interno. En la región medular se ubica un tejido parenquimático, caracterizado por células grandes y esféricas (50 µm de diámetro). Esta misma anatomía se encontró para todos los tallos que fueron regados con diferentes concentraciones de NaCl, con la principal diferencia de que la cantidad de ramas de xilema cortical aumentó con la concentración salina, así como también la cantidad de tejido esclerenquimático se incrementó en la zona medular (Figs. 3A, B). Además, en los tallos que se encuentran en estructura secundaria se aprecia un tejido aerenquimático en la zona cortical (Fig. 4).

Figura 2: Corte transversal de tallo joven de Sarcocornia neei (Lag.) M.Á. Alonso & M.B. Crespo. A. epidermis con estomas del tipo paracítico; B. los vasos xilemáticos corticales llegando hasta la epidermis. 400×.

Figura 3: Comparación de corte transversal de tallo Sarcocornia neei (Lag.) M.Á. Alonso & M.B. Crespo, mostrando las variaciones del esclerénquima en la zona medular. A. tratamiento sin NaCl; B. tratamiento 0.58 M de NaCl. 100×.
Estudios de niveles de proteína
Cuantificación de proteínas
No se observan diferencias significativas entre los tratamientos (p≥0.05), a los 120 días después de plantado, en los tallos de S. neei sometidos a diferentes concentraciones de NaCl (Cuadro 4).
Purificación y separación de proteínas
Después de purificar y separar las proteínas en gel de poliacrilamida se observó un incremento de proteínas de bajo peso molecular en el tratamiento con la más alta concentración de NaCl (Fig. 5).

Figura 5: Patrón de SDS-PAGE de las proteínas de Sarcocornia neei (Lag.) M.Á. Alonso & M.B. Crespo, bajo diferentes concentraciones de NaCl. Los marcadores moleculares de masa (1), y las muestras respectivas a diferentes concentraciones 0, 0.1, 0.3, 0.58 M de NaCl (2 a 5). MW=Peso molecular. En el último carril se observan algunas de las bandas de proteínas de bajo peso molecular expresadas en mayor proporción (flecha amarilla).
Discusión
Sarcocornia neei es una especie halófita que presenta adaptaciones tanto anatómicas, como es la ausencia de hojas, pues sus tallos son suculentos fotosintetizadores, como también histológicas, pues se observa disposición de vasos xilemáticos debajo de la epidermis. Por otro lado, la especie presenta la capacidad de germinar en concentraciones de cloruro de sodio tan altas como la equivalente al agua de mar, así como la posibilidad de elongar sus ramas a esa misma concentración salina, pero con un incremento de proteínas de bajo peso molecular. Todo esto nos hace pensar que su forma de sobrevivir es permitiendo el ingreso del cloruro de sodio desde la raíz para luego transportarlo vía el xilema hacia todo su cuerpo, y el excedente liberarlo al ambiente a través de los estomas caulinares. Para poder mantener su homeostasis hace uso de proteínas de bajo peso molecular.
La germinación de las semillas de Sarcocornia neei disminuye con la concentración de NaCl (0.58 M), que es equivalente a la concentración de NaCl del agua de mar, aunque no llega a ser inhibida (Cuadros 1, 2). Sin embargo, a la concentración de 0.3 M se encuentra el mayor porcentaje de germinación, a los 17 días después de sembrado (Cuadro 1). Este es un comportamiento característico de muchas especies de la familia Amaranthaceae en donde más de la mitad de sus especies son halófitas (Glenn y Brown, 1999). Sucede de manera similar en la germinación de Chenopodium quinoa Willd. (Jacobsen et al., 1997; Chilo et al., 2009; Hariadi et al., 2011) y en Sarcocornia perennis (Mill.) A.J. Scott, Atriplex portulacoides L., Sarcocornia fruticosa (L.) A.J. Scott, Salicornia ramosissima J. Woods, Arthrocnemum macrostachyum (Moric.) K. Koch, Salsola vermiculata L. y Sarcocornia alpini (Lag.) Castrov. (Muñoz-Rodríguez et al., 2017). Sin embargo, no todas las especies de esta familia presentan esta característica, es el caso de Kalidium caspicum (L.) Ung.-Sternb. (Qu et al., 2008) o el de Chenopodium pallidicaule Aellen (La Rosa et al., 2016), cuya germinación es inhibida totalmente a concentraciones de NaCl entre 0.2 M y 0.5 M, respectivamente.
Los esquejes de Sarcocornia neei muestran que esta especie puede crecer en altas concentraciones de NaCl (Cuadro 3), lo cual se debe a que bajo condiciones salinas se activan proteínas que están relacionadas con la obtención de energía, a fin de reforzar su tolerancia y evitar que el estrés salino detenga su crecimiento tal como sucede en Salicornia europaea L. (Wang et al., 2009), caña de azúcar (Chiconato et al., 2019), Suaeda salsa (Guo et al., 2019) y tomate (Pérez-Labrada et al., 2019).
La concentración de proteínas en sus tallos se mantiene constante en todos los tratamientos de NaCl, así como el incremento de fibras esclerénquimáticas conforme esta última aumenta. Esto resulta en que S. neei sea una especie promisoria para ser domesticada y ser usada como verdura para consumo humano o animal, y porque en Perú no figura como especie amenazada, tal como se hace con algunas especies de Salicornia y de Sarcocornia que ya son usadas para consumo humano (Ventura y Sagi, 2013), aunque cuidando que el entorno de las raíces no esté contaminado con metales pesados (Riquelme et al., 2016; Meza et al., 2018). Por esta razón es muy importante conocer la fisiología y la bioquímica de las especies halófitas (Shuyskaya et al., 2014).
La suculencia de los tallos estaría dada por un ingreso de la sal en las células parenquimáticas con la finalidad de diluir su concentración, tal como sucede con Salicornia fruticosa (Duarte et al., 2013), aunque Kosová et al. (2013) afirman que debido a que la eliminación de Na+ no es suficiente, este ión es introducido a las células mediante el “secuestro vacuolar”; o también, que los niveles de K+ pueden disminuir, tal como en S. europaea (Wang et al., 2009; Wang et al., 2015). De esta forma se puede disminuir el potencial hídrico de la planta y absorber agua (Wang et al., 2015).
La histología muestra que los tallos de esta especie presentan adaptaciones importantes, como la presencia de una cutícula delgada sobre la epidermis, con estomas paracíticos (Fig.2 A), característica propia del género (De la Fuente et al., 2015), que le permiten no solo vivir en ambientes salinos, sino también en ambientes inundados.
Otro hecho importante es el número de vasos xilemáticos que salen del sistema vascular interno del tallo y que llegan hasta la zona subepidérmica (Fig. 2B). Éstos podrían expulsar el exceso de sal a través de los estomas, debido a la ausencia de glándulas salinas, a diferencia de otras Amarantáceas que sí presentan estas glándulas, como es el caso de Chenopodium quinoa (La Rosa et al., 2008). Además, las glándulas salinas también servirían como una estructura de defensa frente a los herbívoros (LoPresti, 2014), aunque Fahn (1988) afirma que las glándulas salinas no están conectadas a los haces vasculares.
Los tallos jóvenes y los que tienen estructura secundaria (Figs. 3A, B) no presentan un tejido colenquimático, que sí está presente en otras Amarantáceas halófitas como Salsola soda L. (Milić et al., 2013) o Suaeda maritima (L.) Dumort (Polić et al., 2009). Además, se observa una mayor formación y lignificación de vasos xilemáticos en los tallos de las plantas bajo salinidad, lo que favorecería el flujo dirigido por la transpiración y la acumulación de la sal como se observa en Salicornia europea L. (Wang et al., 2009) o el incremento del desarrollo de los vasos xilemáticos por la síntesis de la enzima metionina sintasa en las hojas de Halogeton glomeratus (M. Bieb.) Ledeb. (Wang et al., 2015).
Finalmente, se observó que el tejido aerenquimático está en la zona cortical (Fig. 3) y no en la zona medular como ocurre en Allenrolfea patagonica (Moq.) Kuntze (Pérez y Hermann, 2014), lo que nos indica que S. neei puede vivir en suelos sobresaturados de agua.
Si bien no hay diferencias significativas en la concentración de proteínas totales entre los diferentes tratamientos de sal (Cuadro 4), sí podemos observar el incremento de la banda correspondiente a las proteínas de bajo peso molecular (alrededor de 20 KDa) (Fig. 5), como consecuencia de las altas concentraciones de NaCl (0.58 M), que son sintetizadas para poder sobrepasar la condición estresante; revelando así, la actividad de las plantas tolerantes (Kosová et al., 2013). Estas proteínas pueden ser, por ejemplo, las que se sintetizan para contrarrestar la actividad de las especies reactivas de oxígeno (ROS) que se forman por un estrés oxidativo (Duarte et al., 2013). También puede ser la presencia de proteínas del tipo LEA que funcionan como osmoprotectores (Kosová et al., 2013), o la síntesis de chaperonas de la familia HSP (Wang et al., 2009), o para mantener los niveles de fijación de CO2 constantes (Fan et al., 2011).
Conclusiones
Sarcocornia neei es una halófita que para poder vivir en este ambiente extremo modifica su anatomía y fisiología, ya sea incrementando la suculencia o aumentando el crecimiento de vasos xilemáticos para llevar el exceso de sales al exterior de la planta. Además, contrarresta los efectos negativos de la salinidad haciendo uso de proteínas de bajo peso molecular.
De acuerdo con las respuestas de propagación de la especie, ya sea por semillas o por esquejes en condiciones de invernadero, podemos afirmar que S. neei puede ser cultivada en terrenos calificados como salinos. También podemos afirmar, por los datos histológicos y de proteínas, que podría ser consumida tanto por humanos como por animales o como planta fitoremediadora.











 nueva página del texto (beta)
nueva página del texto (beta)




