Introducción
Las asociaciones micorrízicas (AM) son relaciones simbióticas entre las raíces de las plantas y los hongos del suelo. La evidencia muestra que esta asociación es muy antigua, surge en el Devónico temprano, y fue uno de los factores que permitió que las plantas colonizaran el medio terrestre (Brundrett et al., 2018; Strullu-Derrien et al., 2018). Las AM se encuentran en todos los ecosistemas terrestres, desde los polos hasta los desiertos, y se estima que más de 80% de las plantas presentan este tipo de asociación (Brundrett, 2004; Ma et al., 2018).
Por su estructura, las micorrizas se clasifican en dos grupos principales: endomicorrizas y ectomicorrizas (Smith y Read, 2010). Las endomicorrizas son aquellas donde el micelio penetra tanto intra como intercelularmente en las células corticales de las raíces (Fig. 1F), p. ej., los hongos micorrízicos arbusculares del Phylum Glomeromycota (Brundrett, 2004). Por otro lado, las ectomicorrizas presentan un micelio que envuelve la raíz y forma un manto (Fig. 2G), p. ej., algunos hongos de los Phyla Basidiomycota, Ascomycota y Mucoromycota (Smith y Read, 2010).
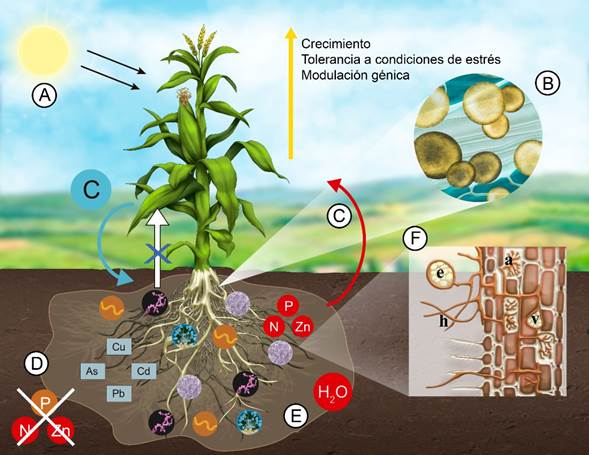
Figura 1: Micorrizas arbusculares y su papel en la nutrición de las plantas. A. Las plantas sintetizan carbono (C) por vía fotosintética, una parte de este es transferido en forma de carbohidratos al hongo a través de las raíces (flecha azul); B. El micelio coloniza la raíz (F), comienza a crecer y aumenta la superficie de absorción de nutrientes de la planta; C. A cambio, el hongo micorrízico arbuscular (HMA) aporta agua y nutrientes como fósforo (P), nitrógeno (N) y zinc (Zn) (flecha roja); D. Los nutrientes pueden estar fuera del alcance de la raíz (elementos tachados); E. Esta asociación en conjunto con el microbioma (p. ej. Rhizobium Frank), tiene una función bioacumuladora de metales (cuadros grises) como plomo (Pb), arsénico (As), cobre (Cu) y cadmio (Cd), además de transportar agua; F. Estructuras características de los HMA distinguibles en un corte longitudinal de raíz: espora=e, vesícula=v, arbúsculo=a, hifas=h. La asociación con micorrizas arbusculares también puede promover la expresión de algunos genes del HMA involucrados en la mejor adaptación de la micorriza al suelo. Ilustración de Gustavo Armando Rodríguez Sánchez.
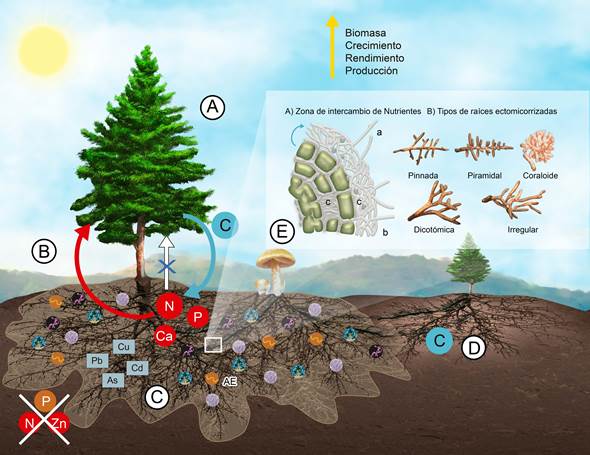
Figura 2: Los hongos ectomicorrízicos y su papel en la nutrición de las plantas. A. Los árboles transfieren carbohidratos (C en círculo azul) producto de la fotosíntesis al hongo ectomicorrízico (HEM) a través de las raíces (flecha azul); B. A cambio el árbol recibe (flecha roja) principalmente fósforo (P) y nitrógeno (N), pero también calcio (Ca), elementos obtenidos a través de “minar” el suelo; C y D. Las plantas micorrizadas, también pueden tener una función bioacumuladora de metales (cuadros grises) como plomo (Pb), arsénico (As), cobre (Cu) y cadmio (Cd), y permitir la transferencia de nutrientes con otras plantas ectomicorrizadas a través de las conexiones miceliares; E. El intercambio de nutrientes entre la planta y el hongo esta mediado por la actividad enzimática (AE) y se realiza en la periferia de la raíz (recuadro E, inciso A) mediante las siguientes estructuras: hifas extrarradicales (a), manto o vaina del micelio (b) y red de Hartig (c). Las raíces al ser colonizadas por HEM presentan variaciones morfológicas (recuadro E, inciso B). La asociación ectomicorrízica también promueve la expresión de genes tanto del hongo como de la planta involucrados en la mejor adaptación de la micorriza al suelo, lo que favorece la producción de esporas de los HEM. Ilustración de Gustavo Armando Rodríguez Sánchez.
La función principal de esta asociación simbiótica es el intercambio de nutrientes. Por un lado, la planta le da al hongo carbono adquirido vía fotosintética y por otro, el hongo ofrece principalmente nitrógeno y fósforo (Smith y Read, 2010). Es importante destacar que las plantas asignan entre 5 y 20% del carbono asimilado vía fotosintética, para formar exudados radicales y así mantener a los simbiontes de las raíces (Chapin et al., 2011). Para la planta es menos costoso mantener a los simbiontes que producir raíces (Koide, 1991). Además, las plantas micorrizadas presentan ventajas sobre las no micorrizadas en términos del forrajeo de nutrientes en el suelo, la protección contra patógenos y la reducción del estrés ambiental (Smith y Read, 2010). Sin embargo, la asociación no es tan simple como parece, ya que el sistema suelo es un ambiente complejo. Por ejemplo, una planta puede formar AM con varios tipos de hongos y un hongo puede hacer simbiosis con muchas plantas, lo que vuelve muy complejas las posibles combinaciones (Simard, 2018). Además, se forman redes micorrízicas comunes (Common Mycorrhizal Networks), que son uniones del micelio con distintas plantas (Simard y Durall, 2004), que influyen en el establecimiento de las plántulas, en la competencia entre plantas y en la diversidad y dinámica de la comunidad vegetal (van der Heijden et al., 1998).
Por otra parte, el papel ecológico que juega la simbiosis tiene implicaciones temporales asociadas con la etapa sucesional de un bosque y con el estado de desarrollo de la planta (Andrade-Torres et al., 2015; Oros-Ortega et al., 2017). En zonas degradadas por el cambio de uso de suelo, las AM juegan un papel importante en la recuperación ecológica. Por ejemplo, se ha demostrado que los hongos micorrízicos participan activamente en la fitoestabilización y en la fitoextracción de metales pesados en suelos de jales mineros (González-Chávez et al., 2005).
Para entender la importancia y complejidad de estas asociaciones es necesario usar métodos de estudio adecuados; estos deben incluir la identificación, aislamiento, cultivo y manejo en vivero de los hongos micorrízicos. También es deseable conocer su importancia económica y ecológica tanto para el mejoramiento de plantas cultivadas, como para la rehabilitación de suelos perturbados y contaminados. En esta revisión se abordan los aspectos generales de las asociaciones micorrízicas y se hace énfasis en el manejo en vivero de las endo y ectomicorrizas, así como en los géneros Pinus L., Quercus L., y Juniperus L., debido a su distribución en el país, su factibilidad de producción en vivero y su utilidad en posibles nuevas estrategias para la recuperación ecológica. Se refieren los géneros de micorrizas mas utilizados en trabajos experimentales en vivero, y los que con mayor frecuencia se inoculan directamente en campo, tanto en plantas de interés económico como de interés ecológico, en México, y se revisa el uso potencial de las ectomicorrizas en la recuperación de suelos dañados por la actividad minera.
El objetivo principal de este trabajo fue revisar aspectos generales del manejo de la simbiosis micorrízica de especies nativas de México con el fin de usarlas como una herramienta potencial para la recuperación de suelos.
Materiales y Métodos
Se hizo una revisión exhaustiva de 140 artículos sobre asociaciones micorrizicas publicados entre 1984 y 2019. De esos, 37 presentaron información de trabajos realizados en México con especies nativas, 18 aportaron información referente a los métodos de inoculación mas utilizada. Las citas restantes (102), se incluyeron por presentar conceptos ecológicos importantes de la simbiosis micorrízica. La búsqueda incluyó tanto trabajos experimentales como de revisión, los cuales fueron recuperados de las bases de datos bibliográficas SCOPUS (2019), Web of Science (WoS, 2019), Crop Protection Compendium Database (CROP, 2019), Forest Science Database (FSD, 2019), PubMed (2019) y SciELO (2019). Las consultas se hicieron de marzo a mayo de 2019. Para las búsquedas se usaron las palabras clave: “mycorrhizae”, “endo and ectomycorrhizae”, “ectomychorrhizae and Pinus”, “ectomychorrhizae and Quercus”, “mycorrhizae inoculation”, “ectomychorrhizae and ecological restoration” y “ectomychorrhizae and Mexico”. También se incluyeron trabajos en español, como protocolos de investigación, empleando las palabras clave: “micorrizas” y “México”.
Resultados y Discusión
Para cumplir con el objetivo de este manuscrito de revisión, la información revisada fue estructurada en seis apartados: 1) se resumen las características generales de las asociaciones micorrizícas, micorrizas arbusculares y ectomicorrizas; 2) se plantean los métodos generales de inoculación micorrízica; 3) se expone la complejidad simbiótica; 4) se discuten los efectos e impactos de la micorrización en plantas de los géneros Pinus, Quercus y Juniperus, con fines de restauración de bosques templados; 5) se sugieren los aspectos a tomar en cuenta para el establecimiento de la simbiosis con plántulas de bosques templados degradados, y 6) se presentan ejemplos de la utilización de hongos ectomicorrízicos y micorrizas arbusculares en bosques templados degradados.
1) Características de las asociaciones micorrízicas
Las asociaciones micorrízicas se clasifican en seis tipos de micorrizas: arbusculares, orquideoides, arbutoides, monotropoides, ericoides y ectomicorrizas (Smith y Read, 2010). Las más importantes por su abundancia y distribución en los ecosistemas son las micorrizas arbusculares y las ectomicorrizas. Si bien ambas asociaciones facilitan el uso eficiente de los nutrientes disponibles en el suelo, cada una se especializa en el intercambio de distintos nutrientes, lo que impacta en la conservación del suelo y del ambiente (Smith y Read, 2010; ver Cuadro 1).
Cuadro 1: Principales características diferenciales entre micorrizas arbusculares y ectomicorrizas. Cuadro elaborado a partir de la información tomada de Smith y Read (2010) y Strullu-Derrien et al. (2018).
| Características | Micorriza arbuscular | Ectomicorriza |
|---|---|---|
| Plantas a las que coloniza | La mayor parte de las plantas (herbáceas, árboles, antoceros y hepáticas, etc.) | Coníferas, angiospermas (arbustos, árboles) y algunas hepáticas. |
| Phyllum de hongos asociados | Glomeromycota | Basidiomycota, Ascomycota y Mucoromycota (Endógeno) |
| Estilo de vida | Biotrofos obligados | Saprótrofos facultativos |
| Nutrientes que distribuye | Principalmente fósforo | Principalmente nitrógeno |
| Estructuras de intercambio de nutrientes | Arbúsculos | Red de Hartig |
| Tamaño | Microscópico | Macroscópico |
Hongos micorrízicos arbusculares
Los hongos micorrízicos arbusculares (HMA) son organismos microscópicos que pertenecen al Phylum Glomeromycota (Schüßler y Walker, 2010) con 342 especies descritas (Shuessler, 2021). Los HMA son biotrofos obligados; es decir, requieren de la planta para completar su ciclo de vida y colonizan 80% de las plantas terrestres (Smith y Read, 2010). Su ciclo presenta dos fases: la intraradical y la extraradical.
La primera comienza cuando el micelio forma un apresorio y penetra las células corticales de las raíces de la planta. Al establecerse la asociación se forman los “arbúsculos” (Fig. 1-F, letra a), que son las estructuras características de este grupo y que, además, se encargan del intercambio de nutrientes entre el hongo y la planta (Giovannetti, 2000; Smith y Read, 2010). Otra estructura presente dentro de la raíz son las “vesículas intraradicales”, las cuales son globulares, de pared gruesa y almacenan aceites (Fig. 1F, letra v) (Giovannetti, 2000; Bonfante y Genre, 2008; Smith y Read, 2010). La fase extraradical ocurre cuando el micelio comienza a salir de la raíz y explora el suelo en búsqueda de nutrientes y agua (Giovannetti, 2000). El micelio extraradical es vasto y cenocítico (sin septos), además contiene cientos de núcleos y produce esporas multinucleadas grandes, en promedio de 40 a 600 (m (Bagyaraj y Stürmer, 2012). Estas esporas presentan paredes gruesas de quitina, son de color hialino a negro y con textura superficial de lisa a altamente ornamentada (Akiyama et al., 2005). Su germinación o ramificación hifal requiere de un diálogo químico coordinado, dinámico y complejo entre moléculas producidas por las plantas, como las estrigolactonas que aumentan la posibilidad de la colonización (Besserer et al., 2006), y la liberación de moléculas metabólicas fúngicas, como el factor MyC que actúa como regulador del crecimiento de la raíz (López-Ráez y Pozo, 2013).
Los HMA se especializan en proporcionar agua y nutrientes minerales, que no están disponibles en el suelo por su mala difusión, como el fósforo (Smith y Read, 2008; Wang et al., 2017a). La extensión del micelio extraradical a través de las partículas del suelo permite que aumente la superficie absorbente de la raíz hasta 10 veces mas (Smith y Read, 2010). Debido a su mayor tasa metabólica, los HMA captan, acumulan y controlan el flujo de otros macronutrientes, además del fósforo, como son el nitrógeno, potasio, calcio, y micronutrientes como el zinc, cobre y molibdeno. Estos son movilizados del suelo a la planta hospedera; a cambio de esto, obtienen diversos carbohidratos (Baum et al., 2015; Wang et al., 2017a). Este control nutrimental de los HMA ayuda a resolver la deficiencia de estos nutrientes en la planta y participa indirectamente en su tolerancia a factores de estrés abióticos y bióticos (Fig. 1; Turk et al., 2006).
Por otra parte, los HMA contribuyen a mantener la estabilidad de los agregados, ya que secretan una proteína asociada con la glomalina (Glomalin-related soil protein) que tiene un efecto cementante para las partículas minerales y evita su erosión (Rillig, 2004). Además, esta proteína puede encontrarse a diversas profundidades del perfil edáfico y sus tasas de descomposición son lentas, lo que contribuye al almacenamiento de carbono orgánico en el suelo (Wang et al., 2017b).
Ectomicorrizas
Los hongos ectomicorrízicos (HEM) son organismos macroscópicos que pertenecen principalmente a los Phyla Ascomycota, Basidiomycota y, algunos a Mucoromycota (Brundrett y Tedersoo, 2018). Los organismos de este grupo, además de ser simbiontes son saprótrofos facultativos, ya que oxidan la materia orgánica del suelo para obtener carbono, aunque no de forma tan eficiente como los hongos saprótrofos (Lindahl y Tunlid, 2015). Los HEM presentan una estructura típica llamada red de Hartig, que transfiere nutrientes entre las células fúngicas y las vegetales (Fig. 2-E, letra c) y está conectada a las hifas o agregados hifales.
El desarrollo adecuado de la asociación micorrízica modifica la morfología de las raíces de las plantas formando los “tips”, que son engrosamientos de las puntas de las raíces micorrizadas. Este engrosamiento es regulado por la expresión génica de la planta, que puede facilitar la susceptibilidad de la raíz a ser colonizada (Kohler et al., 2015; Gehring et al., 2017). Durante el establecimiento de la asociación micorrízica ocurren cambios que influyen en el éxito de ambos simbiontes, p. ej., en la actividad metabólica de la planta y en las interacciones competitivas entre dos o mas especies de hongos ectomicorrízicos o al asociarse a una planta (Courty et al., 2010), o con otros simbiontes (Simard et al., 1997).
A diferencia de los HMA, las hifas de los HEM crecen y no penetran las células corticales y más bien las envuelven. Entonces, se forma un manto o vaina de micelio que engrosa las células vegetales (“tips”), las cuales pueden ser bifurcadas, nodulares o coraloides (Fig. 2 E, letra b) (Smith y Read, 2010). El manto que se forma alrededor de las puntas de las raíces permite que el micelio se extienda. Al extenderse accede a un mayor volumen de suelo y aumenta considerablemente el área de superficie efectiva para la absorción de nutrientes, en contraste con las raíces desnudas (Agrios, 1985; Bonfante y Perotto, 1995; Anderson y Cairney, 2007).
La relación biológica entre los HEM y las plantas es muy importante en ecosistemas templados y boreales. El revestimiento de micorrizas es característico de la gran mayoría de los árboles de estas regiones y se estima que entre 10,000 y 60,000 especies de plantas son ectomicorrizadas con 20,000 a 25,000 especies de hongos ectomicorrízicos (Rinaldi et al., 2008). Estas asociaciones se forman con 2% de las coníferas, aunque también pueden darse en las angiospermas (Corrales et al., 2018). Sin embargo, ecológicamente la asociación es importante porque cubre grandes extensiones de bosques templados (Policelli et al., 2020). Esta simbiosis contribuye a mantener la biodiversidad de microorganismos en los suelos y el correcto mantenimiento de los ecosistemas por la transferencia de agua y nutrientes, principalmente el nitrógeno, hacia los árboles asociados (Read y Perez-Moreno, 2003).
2) Métodos generales de inoculación micorrízica
Hongos micorrízicos arbusculares
Los métodos de inoculación de HMA se componen de los siguientes pasos (Figs. 3A-G): A) Colecta de esporas y B) propágulos micorrízicos, C) aislamiento e identificación, D) lavado y desinfección de esporas, E) propagación de esporas en laboratorio, F) producción masiva de la fuente de inóculo y, G) inoculación y producción en plantas de viveros. Los detalles de cada paso varían en relación con la especie de hongo y de la planta de interés a inocular (Bagyaraj y Stürmer, 2012).
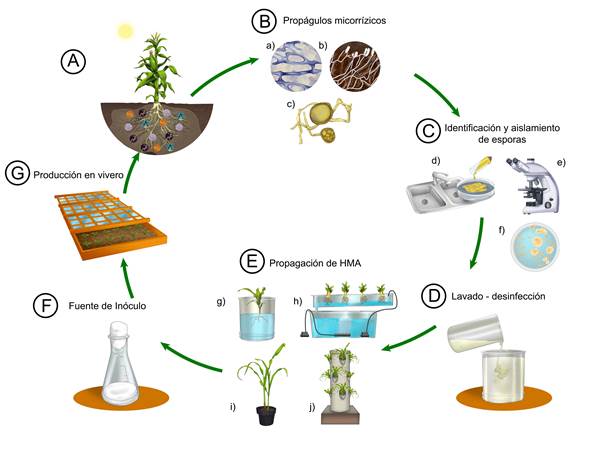
Figura 3: Esquema de producción de hongos micorrízicos arbusculares (HMA) para su propagación y uso en campo. A. El inóculo proviene directamente de muestras de suelo traídas de campo; B. Los propágulos micorrízicos son a) raíces colonizadas, b) micelio, c) esporas; C. Las esporas de HMA se se identifican y aíslan en tres pasos d) extracción, e) identificación, f) cultivo, y se obtiene la fuente de inoculo (esporas); D. Las esporas se lavan y se desinfectan; E. Una vez lavadas, las esporas son propagadas en diferentes medios que pueden ser g) cultivo en medio acuoso (hidropónico); h) cultivos aeropónico; i) cultivo trampa, j) cultivos en sustrato sólido; F. El inóculo recuperado, se lleva al vivero para su propagación; G. La propagación se realiza en plantas que son susceptibles a la micorrización o también puede llevarse directamente a campo como una fuente de inóculo adicional en suelos que han sido perturbados. Ilustración de Gustavo Armando Rodríguez Sánchez.
Los HMA no producen cuerpos fructíferos y las esporas se producen sobre el micelio en el suelo, o dentro de las raíces (Figs. 1A, B) (Smith y Read, 2008). El aislamiento del inóculo se realiza a partir de esporas que se extraen directamente de muestras del suelo obtenidas en campo (Fig. 1A). Primero, se hace un lavado del suelo y este se pasa a través de tamices con diferente apertura de malla (p. ej., 150, 100 y 35 (m). Lo que se recupera de cada tamiz se lava con agua para quitar las partículas de suelo y se mezcla con una solución de sacarosa al 50%, la cual se agita y se centrifuga. El sobrenadante es transferido a un tamiz más fino (35 (m) y se enjuaga varias veces para retirar el exceso de sacarosa (Fig. 1C). Después del enjuague la muestra se pasa a una caja de Petri para observar las esporas al microscopio, posteriormente se separan y se recuperan los morfotipos de interés (Trejo-Aguilar, et al., 2008; Bagyaraj y Stürmer, 2012).
Una vez separados los morfotipos, las esporas se desinfectan con métodos establecidos para cada especie de hongo, ya que estos presentan distinta susceptibilidad al proceso (Fig. 1D). Por ejemplo, la desinfección de esporas de Glomus mosseae T.H. Nicolson & Gerd. (Cepa INCAM 2) y Glomus sp. 1 (Cepa INCAM 4) se realiza con una mezcla de cloramina T-cefaxalina, que mejora la tasa de germinación de las esporas en soluciones líquidas. Este procedimiento se ha utilizado con éxito para la micorrización de la zanahoria (Fernández et al., 2005).
La propagación de esporas se lleva a cabo utilizando plantas o cultivos trampa (Fig. 3 E, letra i). Este método consiste en inocular una pequeña cantidad de las esporas aisladas en plantas que propagan rápidamente estos hongos, como las gramíneas y algunas leguminosas (Aguilar-Ulloa et al., 2016). Asimismo, los cultivos trampa pueden llevarse a cabo en diversos sustratos como turba, perlita, vermiculita, arena, arcilla, arcilla calcinada, materiales vegetales o forestales y las mezclas de algunos de ellos (Morton y Redecker, 2001); se sugiere que estos cultivos sean limitados en fósforo para favorecer la asociación simbiótica (Johnson et al., 2010). Después de tres a seis meses bajo condiciones controladas, se obtiene la colonización de raíces nuevas, lo que favorece el crecimiento del hongo y su multiplicación. Posteriormente, tras un cambio en las condiciones ambientales se induce la esporulación (Brundrett et al., 1996) y se obtiene el suelo o sustrato con esporas, el cual se coloca en bolsas de plástico (Fig. 3F). El inóculo puede ser utilizado inmediatamente o ser almacenado a 4 °C; sin embargo, se debe considerar que conforme pase el tiempo se reduce la viabilidad de las esporas (Rincón et al., 2001).
Existen otros métodos más sofisticados de producción de esporas; entre ellos, el de medios hidropónicos y el cultivo aeropónico (Figs. 3E, letras g, h). En el primero, se colocan las plantas con sus radículas previamente colonizadas con un hongo micorrízico deseado en una solución nutritiva que se mantiene en aereación continua y manteniendo un pH regulado en el medio para evitar alteraciones ácido/base causadas por los exudados de la planta (Elmes et al., 1984; Fernández-Félix, 2003). El cultivo aeropónico, por otro lado, logra un crecimiento masivo y homogéneo de los HMA y evita la presencia de patógenos presentes en el suelo (Hung y Sylvia, 1988; Sylvia y Jarstfer, 1992). En este método las raíces de una planta, previamente micorrizadas, se colocan en una cámara oscura y son directamente irrigadas a través de un dosificador con una solución nutritiva. Posteriormente, las raíces y propágulos micorrízicos se remueven de la cámara, se cortan segmentos de 1 cm y las esporas se aíslan por tamizado (Fig. 3-C), para su posterior uso (Fernández-Félix, 2003). A pesar de lo innovador y sofisticado de los métodos anteriores, la propagación de inóculo a partir de esporas y cultivos trampa (Figs. 3-E, letra i) es el método más empleado, porque es la forma más cercana a la naturaleza biológica del hongo; además requiere menos implementos técnicos (Baum et al., 2015).
Para evaluar cuál es el método de propagación más adecuado, es importante estimar la densidad de esporas por gramo de inóculo. Este parámetro es importante porque aumenta las posibilidades de la micorrización, lo que se refleja en el crecimiento y desarrollo de la planta micorrizada (Gianinazzi et al., 1990). Para evaluar si la micorrización fue exitosa, se mide el porcentaje de colonización a partir de la segunda semana de inoculación. Para esto, se tiñen las raíces (generalmente se utiliza el colorante azul tripano) y se observan al microscopio en busca de hifas, vesículas y arbúsculos (Figs. 1-F, letras a, h, e, v) (Trejo-Aguilar et al., 2008). Un ejemplo de la importancia de la densidad de esporas es el que se ha observado en plantas de Cucumis sativus L. (pepino) sometidas a estrés salino (75 y 100 mM de NaCl), las cuales fueron inoculadas con diferente densidad de esporas (1 × 103 y 2 × 103). Los resultados mostraron que con el tratamiento de mayor densidad de esporas (2 × 103) aumentaron la biomasa de la raíz y el peso de los frutos, en ambos tratamientos de estrés salino. En cambio, con la menor densidad (1 × 103 esporas) aumentaron la biomasa de las raíces y de la parte aérea, pero no la de los frutos. Estos resultados muestran el efecto positivo que tiene la inoculación sobre el crecimiento de la planta en condiciones de estrés salino, pero el efecto deseado dependerá de la densidad de esporas empleadas (Haghighi et al., 2017).
Además de los inóculos utilizando una sola especie de HMA, se ha evaluado el efecto de inóculos de varios morfotipos de HMA sobre una planta. Por ejemplo, en cultivos de invernadero de cebolla (Allium cepa L.) crecidos en suelos deficientes de fósforo, las plantas aumentaron al doble su biomasa aérea cuando se utilizaron alguna de las siguientes especies Funneliformis caledonium (T.H. Nicolson & Gerd.) C.Walker & A. Schüßler, F. mosseae (T.H. Nicolson & Gerd.) C.Walker & A. Schüssler, Rhizophagus manihotis (R.H. Howeler, Sieverd. & N.C.Schenck) C.Walker & A.Schüßler , R. irregularis (Błaszk., Wubet, Renker & Buscot) C. Walker & A. Schüßler, Paraglomus occultum (C. Walker) J.B. Morton & D.Redecker, Racocetra fulgida (Koske & C. Walker) Oehl, F.A. Souza & Sieverd. y Acaulospora spinosa C. Walker & Trappe; pertenecientes a Glomeraceae (Gosling et al., 2016). De las combinaciones inoculadas, la de Glomeraceae tuvo mayor impacto en el crecimiento y la absorción de nutrientes en la planta, mientras que la inoculación con Acaulospora spp. y Racocetra Oehl, Souza & Sieverd, no tuvo impacto significativo comparado con los efectos observados en el tratamiento con Glomeraceae (Gosling et al., 2016). Estos resultados sugieren que el éxito de las inoculaciones se debe a la diversidad funcional del inoculo más que a la de la especie fúngica (López-Gómez et al., 2015).
Hongos ectomicorrízicos
La inoculación con ectomicorrizas en especies forestales como pinos y encinos, es de gran importancia para lograr su supervivencia y/o establecimiento de estos últimos en el campo (Agarwal y Sah, 2009). La simbiosis es importante para incrementar la supervivencia y tasa de crecimiento de especies de interés como se ha visto en Pinus greggii Engelm. ex Parl. y Pinus patula Schltdl. & Cham. (Carrera-Nieva y López-Ríos, 2004), Pinus pringlei Shaw (López-Gutierrez et al., 2018) y Pinus montezumae Gordon & Glend. (Barragán-Soriano et al., 2018; Rodríguez-Gutiérrez et al., 2019). La micorrización se realiza en los viveros durante la producción de la planta. A pesar de que en México existe escasa información documentada sobre métodos de obtención y aplicación de inóculos para obtener HEM en vivero, se ha logrado la inoculación de diferentes especies vegetales con ectomicorrizas a partir de distintos métodos (Arteaga-León et al., 2018; ver referencias de los Cuadro 2 y 3).
Cuadro 2: Plantas huésped de bosques templados mexicanos, que forman asociaciones con hongos ectomicorrízicos. HEM=hongos ectomicorrízicos, OTU=Unidad Taxonómica Operativa, ano habían sido previamente reportadas en esa zona de estudio; bno se habían reportado, encontradas en propágulos.
| Planta huésped | HEM asociado | Métodos de identificación | Referencia |
|---|---|---|---|
| Abies religiosa (Kunth) Schltdl. & Cham. | Turbinellus floccosus (Schwein.) Earle | Caracterización morfológica y anatómica de las puntas de raíz (tips) micorrizadas; amplificación de ARN de genes ribosomales | Lamus et al., 2015 |
| Pinus culminicola Andresen & Beaman | 18 géneros y 25 especies de HEM. 27 cepas incluidos: Genea hispidula Berk. ex Tul. & C. Tul. Rhizopogon sp. Sclerogaster sp. Tuber sp. | Caracterización morfológica macro y microscópica de muestras obtenidas en campo, cultivo a partir de aislamiento en muestras de suelo y cuerpos fructíferos | Garza et al., 2002 |
| Pinus greggii Engelm. ex Parl. | Pisolithus tinctorius E. Fisch. | Caracterización morfológica macro y microscópica de 30 cuerpos fructíferos | Carrera-Nieva y López-Ríos, 2004 |
| Pinus hartwegii Lindl. | 14 morfotipos distintos incluidos: Byssocorticium Bondartsev & Singer Piloderma olivaceum (Parmasto) Hjortstam Cortinarius diasemospermus Lamoure Cortinarius mucosus (Bull.) J. Kickx f. Hydnellum concrescens (Pers.) Banker Russula aff. betularum Hora Sebacina vermifera Oberw. Sistotrema confluens Pers. Pseudotomentella Svrček | Caracterización morfológica de raíces micorrizadas, amplificación y secuenciación de la región ITS (rDNA internal transcribed spacers), e identidad taxonómica por similitud nucleotídica en base de datos (GenBank) | Baeza-Guzmán et al., 2017 |
| Pinus montezumae Lamb. | Atheliaceae sp. 1 y sp. 2 Clavulina sp. Inocybe praetervisa Quél. Inocybe sp. 4 Russula abietina Peck Russula sp. 1 Sebacinaceae sp. 1 y sp. 3 Thelephoraceae sp. 2 y sp. 3 Tomentella sp. 1 | Identificación directa en campo, muestras de suelo, identificación molecular de OTU | Reverchon et al., 2012 |
| Pinus montezumae Lamb. | 27 especies que incluyen a: Cadophora finlandica C.J.K. Wang & H.E. Wilcox Geopora sp. a, b Hebeloma albocolossum M.M. Moser Hebeloma helodes J. Favrea, b Hebeloma leucosarx P.D. Ortona, b Hebeloma mesophaeum (Pers.) Quél. Laccaria trichodermophora G.M. Muell Peziza sp. 1 Peziza aff. ostracoderma Korf. Pezizaceae sp. 1a, b; sp. 2a, b; sp. 4a, b | Caracterización morfológica de muestras obtenida en campo y caracterización genética de esporas de muestras de suelo | Garibay-Orijel et al., 2013 |
| Pulvinula constellatio (Berk. & Broome) Boud.b Sebacina sp. 1b, sp. 2b Sordariales sp. 1b, sp. 2b Suillus tomentosus Singer, Snell & E.A. Dick Tuber separans Gilkey b | |||
| Pinus patula Schltdl. & Cham. | Laccaria bicolor (Maire) P.D. Orton | Identificación directa en campo, caracterización morfológica macro y microscópica | Carrera-Nieva y López-Ríos, 2004 |
| Pinus pseudostrobus Gordon & Glend. | Laccaria proxima (Boud.) Pat. | Caracterización morfológica macro y microscópica de muestras de esporomas | Carrasco-Hernández et al., 2010 |
| Pinus culminicola Andresen & Beaman | 18 géneros y 25 especies de HEM. 27 cepas incluidos: Genea hispidula Berk. ex Tul. & C. Tul. Rhizopogon sp. Sclerogaster sp. Tuber sp. | Caracterización morfológica macro y microscópica de muestras obtenidas en campo, cultivo a partir de aislamiento en muestras de suelo y cuerpos fructíferos | Garza et al., 2002 |
| Pinus hartwegii Lindl. | 14 morfotipos distintos incluidos: Byssocorticium Bondartsev & Singer Cortinarius diasemospermus Lamoure Cortinarius mucosus (Bull.) J. Kickx f. Hydnellum concrescens (Pers.) Banker Piloderma olivaceum (Parmasto) Hjortstam Pseudotomentella Svrček Russula aff. betularum Hora Sebacina vermifera Oberw. Sistotrema confluens Pers. | Caracterización morfológica de raíces micorrizadas, amplificación y secuenciación de la región ITS (rDNA internal transcribed spacers), e identidad taxonómica por similitud nucleotídica en base de datos (GenBank) | Baeza-Guzmán et al., 2017 |
| Quercus glaucescens Bonpl. Quercus sapotifolia Liebm. | Lactarius subplinthogalus Coker Lactarius trichodermoides Montoya Bandala & M. Herrera | Caracterización morfológica macroscópica de basidiomas y descripción de ectomicorrizas obtenidas en campo., amplificación de ITS (ITS1-5.8S-ITS2) y análisis filogenético | Herrera et al., 2018 |
| Quercus sp. | Boletus rubropunctus Peck | Caracterización morfológica macro y microscópica de peridios, raíces ectomicorrizadas, y pustulas; amplificación de ITS (ITS1-5.8S-ITS2) y análisis filogenético | Smith y Pfister, 2009 |
Cuadro 3: Especies más utilizadas de hongos ectomicorrízicos para inocular plántulas del género Pinus L. en viveros forestales, en México. En el cuadro se señalan los métodos a partir de los cuales se obtiene el inóculo y las respuestas de las plantas a la inoculación. Ha=Hebeloma alpinum (J. Favre) Bruchet, Ll=Laccaria laccata var. laccata (Scop.) Cooke, Lt=Laccaria trichodermophora G.M. Muell., Lv=Laccaria vinaceobrunnea G.M. Muell., Pt=Pisolithus tinctorius (Mont.) E. Fisch., St=Scleroderma texense Berk., Tt=Thelephora terrestris Ehrh. (↑)=Incremento en la respuesta de la planta. N=nitrógeno, P=fósforo, Mg=magnesio, K=potasio, Zn=zinc y Fe=hierro.
| Planta huésped | HEM empleado | Métodos de inoculación | Respuesta de la planta al inóculo | Referencias |
|---|---|---|---|---|
| Pinus montezumae Lamb. | Laccaria bicolor (Maire) P.D. Orton | Inóculo esporal a partir de cuerpos fructíferos crecidos en vermiculita y turba usando medios de cultivo; inoculación líquida directa en plántula | Formación exitosa de micorrizas | Santiago-Martínez et al., 2003 |
| Pinus montezumae Lamb. | Geopora sp. Hebeloma helodes J. Favre Hebeloma leucosarx P.D. Orton Peziza sp. 1 Peziza. aff. ostracoderma Korf Pezizaceae Dumort. sp. 1, sp. 2, sp. 4 Pulvinula constellatio (Berk. & Broome) Boud. Sebacina sp. 1, sp. 2 Sordariales sp. 1, sp. 2. Tuber separans Gilkey | Inóculo proveniente de suelo con banco de esporas recolectadas; inoculación directa de suelo en la plántula | Formación exitosa de la micorriza | Garibay-Orijel et al., 2013 |
| Pinus montezumae Lamb. | Laccaria trichodermophora G.M. Muell. Suillus tomentosus Singer, Snell & E.A. Dick | Inóculo esporal (concentración 106 esporas) procedente de hongos frescos; inoculación directa en plántulas | Formación de ectomicorriza con ramificación coraloide de las raíces de cada planta sin rizomorfos | Galindo-Flores et al., 2015 |
| Pinus montezumae Lamb. | Laccaria trichodermophora G.M. Muell. Laccaria bicolor (Maire) P.D. Orton Laccaria laccata var. laccata (Scop.) Cooke Laccaria vinaceobrunnea G.M. Muell. | Inóculo obtenido a través de píleos deshidratados y molidos manualmente; inoculación directa en plántulas | Las especies simpátricas (Ll y Lv) mostraron mayor crecimiento y eficiencia en la absorción de nutrientes | Rodríguez-Gutiérrez et al., 2019 |
| Pinus montezumae Lamb. | Hebeloma mesophaeum (Pers.) Quél. | Inóculo a partir de esporomas deshidratados y macerados en un molino; inoculación directa en plántulas | (↑) Calidad fisiológica (↑) Clorofila a y b Mejora el efecto en la interacción con bacterias | Barragán-Soriano et al., 2018 |
| Pinus ayacahuite C. Ehrenb. ex Schltdl. | Helvella cf. lacunosa Afzel. Hebeloma mesophaeum (Pers.) Quél. | Inóculo esporal (concentración 106-108 esporas) a partir de esporomas recolectados en campo; inoculación directa en la plántula, en forma líquida | (↑) Peso total (↑) Contenido de N, P, Mg y Fe en la planta | Arteaga-León et al., 2018 |
| Pinus patula Schltdl. & Cham | Laccaria laccata (Scop.) Cooke Suillus pseudobrevipes A.H. Sm. & Thiers Boletus clavipes Pilát & Dermek Laccaria spp. Hebeloma spp. | Inóculo esporal (concentración 106 esporas) a partir de cuerpos fructíferos macerados; inoculación directa a la plántula, en forma líquida; inóculo esporal a partir de esporomas deshidratados | (↑) Altura, diámetro y peso total de la planta (↑) % de colonización de raíces (↑) Crecimiento de micelio extramatricial (↑) Diámetro (↑) Biomasa total de la planta (↑) Peso seco del follaje (↑) Peso seco de la parte aérea de la planta | Carrera-Nieva y López-Ríos, 2004 Perea-Estrada et al., 2009 |
| Pinus hartwegii Lindl. | Laccaria spp. Hebeloma spp. | Inóculo esporal a partir de esporomas deshidratados; inoculación directa a la plántula, en forma líquida | (↑) Biomasa tota de la planta (↑) Peso seco del follaje Raíces cortas | Perea-Estrada et al., 2009 |
| Pinus greggii Engelm. ex Parl. | Suillus pseudobrevipes A.H. Sm. & Thiers. | Inóculo esporal a partir de esporomas deshidratados; inoculación directa a la plántula, en forma líquida | (↑) Peso seco de la parte aérea de la planta (↑) Crecimiento de micelio extramatricial | Carrera-Nieva y López-Ríos, 2004 |
| Pinus devoniana Lindl. Pinus pseudostrobus Gordon & Glend. | Pisolithus tinctorius (Mont.) E. Fisch. Scleroderma texense Berk. | Inóculo esporal de Pt (concentración 107) y St (concentración 106) a partir de esporomas en sustrato de turba y vermiculita; inoculación directa a la plantula a partir del sustrato | (↑) % de colonización de raíces (↑) Volumen de la planta (↑) Biomasa total de la planta | Valdés et al., 2010 |
| Pinus pringlei Shaw | Hebeloma alpinum (J. Favre) Bruchet. Laccaria trichodermophora G.M. Muell. Thelephora terrestris Ehrh. | Inóculo esporal a partir de píleos deshidratados y molidos Ha y Lt; en Tt, se utilizó sustrato infectado previamente con esporomas del hongo | (↑) Crecimiento y contenido de nutrientes Traslocación de K, Fe y Zn a los vástagos | López-Gutierrez et al., 2018 |
En general, la inoculación con HEM se realiza mediante esporas o micelio obtenidos de los cuerpos fructíferos o de muestras de suelo recolectadas en el campo con la ectomicorriza de interés (Fig. 4, A, B). Una vez que se identifica el HEM se cultiva en el laboratorio. La inoculación se realiza a partir de un cultivo previo en monocepa o multicepa de esporas, los cuales utilizan una planta susceptible a la ectomicorrización. Este cultivo de esporas presenta un balance adecuado de nitrógeno y fósforo, y se deja crecer hasta que el hongo produce esporas; de ahí se inocula a la planta de interés (Cerrato y Alarcón, 2001). A continuación, se presentan los tres principales métodos de inoculación en HEM:
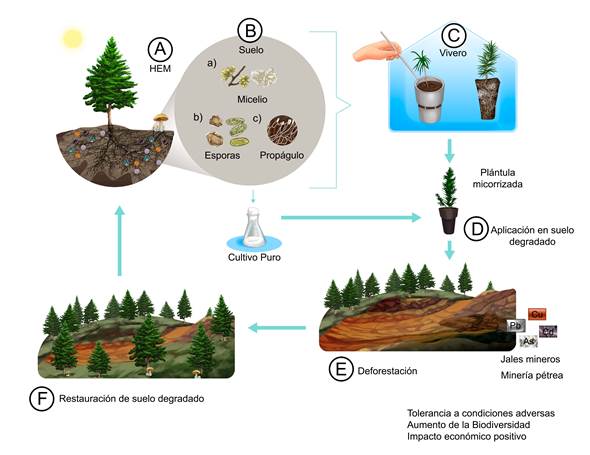
Figura 4: Aplicación de las ectomicorrizas con fines de recuperación ecológica. A. Las especies de hongos micorrízicos se extraen de campo; B. Se identifican las estructuras del hongo asociado a la especie arbórea de interés (conífera nativa) y se realiza una caracterización de las estructuras microscópicas (a=micelio, b=esporas, c=propágulo) de las muestras de suelo; C. El inóculo se aplica directamente sobre la plántula de interés; D. Una vez que la planta es micorrizada se transplanta a macetas con suelo degradado como una forma de aclimatación; E. Una vez que la planta se adapta a esas condiciones se trasplantan en zonas degradadas (p. ej., áreas deforestadas o jales mineros donde hay presencia de metales pesados como plomo (Pb), cobre (Cu), arsénico (As) o cadmio (Cd); F. La recuperación del suelo por árboles micorrizados ya establecidos también tiene beneficios para el ecosistema, pues ayuda con la restauración del suelo degradado. Ilustración de Gustavo Armando Rodríguez Sánchez.
(1) Inoculación esporal. En este el inóculo es una suspensión de esporas maduras preparadas por trituración de carpóforos o esporomas maduros y limpios. Es un procedimiento económico y su preparación es relativamente sencilla. Se emplea en hongos que tienen una producción elevada de esporas, como son los géneros Suillus Micheli, Scleroderma Pers., Rhizopogon Fr. y Pisolithus Alb. & Schwein; también, cuando las esporas toleran períodos largos de almacenamiento a 4 °C (Rincón et al., 2001). El uso de este método requiere conocimientos micológicos mínimos para cosechar los carpóforos cuando las esporas están maduras e inocularlos en las especies vegetales más adecuadas (Quiroz et al., 2009). Se recomienda inocular el sustrato al momento de la siembra y volver a inocular al menos cuatro o cinco veces más, para asegurar la germinación de las esporas y el desarrollo del micelio (Gómez-Hernández et al., 2019). Este es el sistema de inoculación más recomendado para los HEM (Arteaga-León et al., 2018). Una variante de la técnica es el remojar las raíces podadas en una suspensión esporal homogenizada (16 × 108 esporas) (Valdés et al., 2010) y trasplantarlas a recipientes con sustrato previamente esterilizado (Alarcón y Ferrera-Cerrato, 1999; Quiroz et al., 2009).
La inoculación esporal ha mostrado buenos resultados con plantas de Pinus devoniana Lindl. y P. pseudostrobus Gordon & Glend. inoculadas con Pisolithus tinctorius (Pers.) Coker & Couch y Scleroderma texense Berg. (Valdés et al., 2010). En ensayos de vivero se han inoculado hasta siete millones de plantas de Pseudotsuga menziesii (Mirb.) Franco, utilizando el sistema de riego con esporas de Rhizopogon vinicolor Smith (Castellano y Trappe, 1985). Las plántulas de P. greggii Engelm. ex Parl micorrizadas en invernadero mejoraron su crecimiento en altura y diámetro cuando fueron inoculadas con Geastreum minimum Schwein, Boletus barrowsii Thiers & Smith y Suillus caerulescens A.H. Sm. & Thiers; mientras que cuando fueron inoculadas con Russula xerampelina Schaeff., la biomasa aumentó (Casique Valdés et al., 2019).
(2) Inoculación miceliar o vegetativa. Este método requiere de un inóculo obtenido a partir de un cultivo puro del hongo micorrízico de interés. El inóculo se obtiene mediante el aislamiento de hifas o micelio de hongos que crecieron en medios de cultivo específicos (p. ej., papa dextrosa, extracto de malta, etc.), en un sustrato de turba de musgo humedecido, o por explantes de tejido vegetativo. Es, posiblemente, el método más efectivo; sin embargo, algunos hongos muestran dificultad para crecer de forma aislada o tienen baja viabilidad después de su aislamiento (Santiago-Martínez y Galindo-Flores, 2003). Por ejemplo, Rhizopogon vinicolor Smith es un hongo que crece bien en el medio de cultivo, pero no coloniza las raíces de Pinus radiata D. Don, cuando se utiliza como inóculo vegetativo (Molina y Trappe, 1994). El éxito de la micorrización con hongos ectomicorrízicos se puede distinguir y cuantificar a partir de las modificaciones morfológicas de las raíces micorrizadas (Fig. 2, recuadro E inciso b).
(3) Inoculación a partir de suelo. Consiste en utilizar como inóculo o propágulos muestras colectadas directamente del suelo, sin hacer una separación previa. El suelo contiene propágulos, que son las estructuras que conforman al hongo (micelios rizomorfos, esporas, esclerocios o trozos de raíces micorrizadas (Fig. 4B)); sin embargo, puede contener organismos patógenos o semillas de especies vegetales no deseadas (Quiroz et al., 2009). En general, el método presenta buenos resultados, pero es variable en función del sitio de donde se obtiene el inóculo, ya que no se tiene un control sobre los otros agentes que pueda contener el suelo, además de los HEM deseados (Fig. 4 A-D). Por otra parte, la extracción de suelo para obtener el inóculo no puede ser considerada como parte de una práctica de manejo sustentable, pues implica la remoción de un recurso no renovable. Por lo anterior, se recomienda utilizar métodos que promuevan la conservación del suelo, como el manejo del inóculo dentro del sitio a través de plantas propagadoras.
3) Complejidad simbiótica
Entre la planta y el suelo existe una interfase muy específica conocida como micorrizósfera, que es la zona en la que se da la interacción entre el suelo, las raíces de las plantas y las hifas de los hongos (Linderman, 1988). La micorrizósfera es una zona muy compleja y dinámica donde se concentran los exudados de las raíces y de los hongos, los cuales son aprovechados por microorganismos que viven en el suelo (Barea et al., 2002). Las interacciones que se llevan a cabo promueven el ciclaje, la disponibilidad y la captura de nutrientes y esto tiene repercusiones sobre el crecimiento, la salud de la planta y la calidad del suelo (Azcón-Aguilar y Barea, 2015).
La señalización entre los hongos, las plantas y los microorganismos del suelo se lleva a cabo a través de señales químicas liberadas entre los participantes y el desarrollo de estructuras fúngicas especializadas (Brundrett, 2004; López-Ráez et al., 2011). Estas últimas, como se había mencionado, son los arbúsculos y junto con la red de Hartig se especializan en la transferencia de nutrientes y la comunicación química (Brundrett, 2004; Futai et al., 2008; Mello et al., 2013). Luego de que esta se establece, el micelio fúngico se extiende en el suelo formando vías de señalización, entre hongos, plantas de la misma especie, plantas de distintas especies y microorganismos (Jansa et al., 2013), conocidas como “redes micorrízicas comunes” (RMC) o “common mycorrhizal network” (Simard et al., 2012). Las RMC tienen gran importancia ecológica y evolutiva debido a sus efectos positivos en la supervivencia de hongos, microorganismos y plantas vinculadas (Teste et al., 2009; Tedersoo et al., 2010; Smith et al., 2011; Kennedy et al., 2012; Gorzelak et al., 2015). Sin embargo, también importa el contenido de nutrientes en el suelo (Johnson et al., 2010), el tipo de suelo, y las interacciones con otros organismos (Tedersoo et al., 2010; Smith et al., 2011). En estas redes micorrízicas, su contribución principal consiste en transportar los nutrientes de la interfase suelo-planta y con ello favorecer la dinámica nutricional de los ecosistemas. Por ejemplo, los aminoácidos adquiridos por un simbionte fúngico pueden moverse a través del micelio de la red y dispersarse entre plantas vecinas unidas por las RMC (Simard et al., 1997; Smith y Read, 2010). Otro ejemplo es el carbono que se filtra al suelo mediante la rizodepositación y que es capturado por las hifas y llevado a otra planta (Bending et al., 2002). En las plántulas de Pseudotsuga menziesii (abeto de Douglas), se ha observado una ganancia neta de carbono de 6%, producto de estas conexiones miceliales (Simard et al., 1997).
Sin embargo, la formación de estas RMC es un proceso complejo, lo cual se debe, por una parte, a que existe cierta preferencia y especificidad de la planta huésped por diversas comunidades de hongos (Kiers et al., 2011) y microorganismos (Rutten y Gómez-Aparicio, 2018), y por otra, a la organización de las comunidades microbianas del suelo que modifican a su vez las características, diversidad y dinámica de la vegetación (Friesen et al., 2011; van der Putten et al., 2013; van der Heijden et al., 2015). Una vez formada la RMC, se promueve la interacción, retroalimentación y adaptación entre las comunidades de plantas y el microbioma edáfico, que favorece procesos ecosistémicos tales como el ciclaje de nutrientes y la formación del suelo (Bauman et al., 2016; Erktan et al., 2018; López-García et al., 2018).
La biocomplejidad de las interacciones ecológicas, como la expuestas, son analizadas por modelos ecológicos que buscan entender ¿Qué factores determinan la presencia de ciertas especies para conservar las funciones de un ecosistema? (Johnson et al., 1996). Los modelos que incluyen la presencia de las asociaciones micorrízicas muestran un aumento en la diversidad de especies tanto vegetales como de hongos, lo que puede tener repercusiones en los procesos y/o funciones del ecosistema, como es el caso de la productividad vegetal, p. ej. biomasa, contenido de clorofila, etc. (Hart et al., 2001). La biomasa vegetal, aumenta entre 10 y 75% cuando se manipula la riqueza de plantas hospederas (Klironomos et al., 2000), mientras que un aumento en la riqueza de hongos micorrízicos promueve un mejor establecimiento de las plántulas, ya que aumenta la variación genética interespecífica y se favorece la colonización de las raíces (Hart et al., 2001; Young, 2015).
Las interacciones bajo el suelo dependen del contexto ecológico, pues la respuesta de la planta huésped al hongo es variada. Los HMA obtenidos de suelos de diversas ubicaciones geográficas pueden ser inoculados en una planta y cuando esta es trasplantada en otros suelos (con variaciones en textura, pH y niveles de nutrientes) la asociación simbiótica puede generar interacciones positivas o negativas, que pueden reflejarse en un aumento o disminución de la biomasa vegetal (Ji et al., 2013).
Por lo tanto, la búsqueda de mejores alternativas para recuperar terrenos degradados por el cambio de uso del suelo debe considerar la planta, sus simbiontes y las características físicas del suelo (pH, condiciones hídricas; Ji et al., 2013). Por ejemplo, en plantas de Pinus montezumae, de un año, que fueron inoculadas con Hebeloma mesopaeum Pers. y bacterias promotoras de crecimiento, se observó que su contenido de clorofila a y b aumentan, y su calidad fisiológica mejora (Barragán-Soriano et al., 2018). Esto ha sido señalado por revisiones recientes para el caso de la restauración de zonas mineras a partir del uso de HMA (Wang, 2017) o la utilización de organismos nativos adaptados a este tipo de zonas degradadas (Koziol et al., 2018). Para lograr esto se vuelve necesario conocer, identificar y aplicar la microbiota adecuada a cada sistema de estudio.
4) Importancia de los géneros Pinus, Quercus y Juniperus en la restauración de bosques templados
En México, el deterioro de recursos forestales, particularmente de los bosques templados, y la erosión de los suelos, son fenómenos asociados con el cambio de uso de suelo (p. ej., prácticas silvopastoriles inadecuadas, minería o contaminación química), lo que hace necesario implementar programas de restauración y/o recuperación ecológica. Estos programas deben optimizar el re-establecimiento de la cubierta vegetal, con el fin de recuperar suelos degradados, o bien, utilizarlos para un manejo comercial sostenible (Calva-Soto y Pavón, 2018).
En los bosques templados de México, los géneros Pinus, Juniperus y Abies Mill. son las coníferas más representativas dentro de las gimnospermas. Su importancia radica en que presentan un alto nivel de endemismo (Rzedowski, 2006): de las 94 especies de coníferas registradas en el país, 43 son endémicas, lo que equivale a 46% del total; el género Pinus (Pinaceae) tiene 22 especies endémicas; Juniperus, 16 y Abies, 5 (Gernandt y Pérez-de la Rosa, 2014). Por otro lado, la angiosperma dominante y de notoria diversidad en estos bosques pertenece al género Quercus (Fagaceae), con alrededor de 160 especies en México (González-Espinosa et al., 2012), lo que representa 32% de la diversidad mundial.
Pinus, Juniperus, Abies y Quercus presentan una gran afinidad por la asociación micorrízica; las raíces y copas de sus especies generan las condiciones propicias para el crecimiento de los hongos, ya que mantienen la humedad necesaria para favorecer su desarrollo (Nixon, 2006; González-Espinosa et al., 2012). Particularmente los juníperos y los pinos se reconocen como especies pioneras que recolonizan el suelo gracias a sus características de rápido crecimiento y de adaptación a condiciones edáficas nutrimentalmente pobres (Dvorak et al., 1996; Martínez et al., 2007). Ambos son micorrízicos y representan un enorme potencial para utilizarse en programas de reforestación y/o recuperación de sitios degradados (Carrera-Nieva y López-Ríos, 2004; Garibay-Orijel et al., 2013; Jacobs et al., 2015). Sus principales ventajas radican en su mayor capacidad para absorber nutrientes y agua, y mayor supervivencia y resistencia a patógenos; además, la biomasa generada bajo el suelo por el crecimiento del micelio favorece la formación y retención del suelo (Koele et al., 2009; Turpault et al., 2009; Adams, 2014).
Debido a que numerosas especies de HEM cuentan con esporomas de interés culinario, esto puede representar una estrategia para crear bosques comestibles o alimenticios (Sousa et al., 2012; Boroujeni y Hemmatinezhad, 2015; Gómez-Romero et al., 2015; Peña-Becerril et al., 2016; Gómez-Hernández et al., 2019). Además, Pinus patula y Pinus greggii son especies forestales de gran importancia económica en México (Dvorak et al., 1996). Lo anterior es relevante en el sentido de promover o propiciar el manejo de especies de importancia económica para la restauración.
A pesar de la importancia de estas especies, tanto plantas como simbiontes potenciales, hay poca investigación con respecto a las HEM que se encuentran en el campo y que se aplican en los viveros para la supervivencia de especies de coníferas. A continuación, se presentará información de: 1) los efectos de las HEM en los bosques templados degradados y 2) ejemplos de la utilización de HEM en bosques degradados.
5) Consideraciones para el establecimiento de la simbiosis en bosques degradados
En la mayoría de los suelos muy alterados no es posible recuperar la vegetación original. Se puede inducir el desarrollo de especies vegetales, preferentemente nativas, que sirvan de protección y sobre todo que permitan conservar y aumentar la fertilidad del suelo. Esto puede hacerse mediante la siembra de plantas micorrizadas previamente y producidas en vivero. También puede lograrse vía la inoculación directa de propágulos micorrízicos en las plántulas creciendo en el bosque (Figs. 3, 4).
Primero, hay que seleccionar correctamente los hongos ectomicorrízicos para la inoculación de las plántulas. Este paso es importante porque si la cepa no es la conveniente, o las especies no son compatibles, se puede afectar negativamente el crecimiento y biomasa de las plántulas (Barroetaveña et al., 2012). En un experimento en el que se utilizaron especies de hongos y plantas simpátricas se observa una mayor eficiencia en la acumulación de nutrientes y biomasa que en especies alopátricas (Rodríguez-Gutierrez et al., 2019).
Por otro lado, también debe tomarse en cuenta la capacidad intrínseca de las plantas para establecer asociaciones simbióticas con la microbiota endógena o con propágulos micorrízicos en zonas con remanentes de bosques conservados (Aradottir y Hagen, 2013). Como se mencionó en la sección tres, la asociación simbiótica es compleja y depende del hospedero, los simbiontes potenciales y las características del suelo (Ji et al., 2013).
Además, es necesario considerar la presencia de propágulos micorrízicos en zonas con un grado de deforestación o cercanos a la matriz del bosque. Aún en terrenos dónde se ha eliminado la cobertura vegetal y se ha perdido la mayor parte del suelo, se han encontrado diversos propágulos micorrízicos (González-Chávez, 2005). Estos propágulos, al estar sometidos a condiciones de estrés presentan ventajas porque ya están adaptados a estas condiciones (González-Chávez et al., 2005; Koziol et al., 2018).
Finalmente, el uso de hongos potenciales para colonizar plantas forestales debe considerar la capacidad de los hongos para colonizar sus raíces, así como los efectos positivos hacia las plantas (Brundrett, 2004; Kjøller, 2006).
La consecución de estas plantas micorrizadas en vivero y su uso probado (Cuadro 2 y 3) muestran que el éxito de los programas de inoculación con ectomicorrizas en plantas forestales debe basarse en especies nativas, tanto de hongos como de plantas (Policelli et al., 2020). Lo anterior está relacionado con un aumento en la supervivencia y las tasas de crecimiento de los árboles, condición necesaria para que el trasplante y supervivencia en campo se vuelva factible en términos de recuperación ecológica (Cruz-Ulloa, 1999).
Por ello, es importante definir las especies nativas de hongos de los bosques degradados, susceptibles de recuperación. El tener opciones de inóculo de especies nativas, representa uno de los mayores retos en la investigación en el área de micorrizas, no solo en México, sino a nivel mundial (Molina et al., 2005). Si esto no es considerado, se presenta el riesgo de que el hongo inoculado in vitro o en vivero, una vez en el campo, sea desplazado por otros más adaptados al medio, debido a las complejidades de la interacción micorrízica ya mencionada (Molina et al., 2005).
6) Ejemplos de la utilización de hongos ectomicorrízicos y micorrizas arbusculares en bosques templados degradados
La riqueza de HEM nativos es una cualidad positiva para las plantas. En Pinus rudis Endl. y P. ayacahuite C. Ehrenb. ex Schltdl., se identificaron 13 géneros que micorrizados favorecen su cultivo en vivero (Bran et al., 1998). Por otra parte, se ha observado que P. culminicola Andresen & Beaman presenta una gran diversidad endógena de HEM en sus raíces, como es el caso de ascomicetos productores de esporomas muy pequeños, los cuales han sido identificados a través de unidades taxonómicas operacionales (OTUs, por sus siglas en inglés) (Garibay-Orijel et al., 2013). En la práctica silvícola de P. culminicola se han recuperado y almacenado diversas estructuras fúngicas (p. ej., carpóforos; Garza et al., 2002), con las que se podrían realizar otros estudios de efectividad micorrízica (Garibay-Orijel et al., 2013; Cuadro 2).
En condiciones de vivero se han obtenido y propagado plántulas de algunas especies de Pinus con HEM (ver referencias en Cuadro 3) donde el inóculo esporal es el método más empleado, porque favorece la supervivencia y el desarrollo de las plántulas en etapas tempranas, pues facilita la absorción y el transporte de nutrientes y agua. Los HEM que se obtienen de vivero pueden ser reintroducidos directamente al hábitat degradado, y así mejorar la supervivencia de las plantas en el campo, o bien las plántulas, una vez micorrizadas pueden ser trasplantadas, ya que están mejor adaptadas a las condiciones ambientales locales (Ortega-Larrocea, 2015).
El éxito del uso directo de esporas de HEM con fines de recuperación ecológica dependerá de su longevidad y resistencia. Por ejemplo, las esporas provenientes de sitios degradados tienen mayor capacidad de reintegrarse al ecosistema porque están mejor adecuadas a las condiciones (Buscardo et al., 2010). En el caso de los ascomicetos, a pesar de producir esporomas pequeños, subepígeos o hipógeos, estos son resistentes y longevos (Garibay-Orijel et al., 2013). Sin embargo, no se debe olvidar la estructura cambiante de las comunidades arbóreas. El crecimiento, edad y tamaño de los árboles, modula la riqueza, diversidad, composición y abundancia de esporas de HEM sean nativos o introducidos (Bonet et al., 2004; Fernández-Toirán et al., 2006).
Los efectos benéficos de la reinserción, en áreas perturbadas, de ectomicorrizas propagadas en viveros ya han sido descritos. Franco y colaboradores (2014) observaron un mayor crecimiento de plántulas de Pinus pinaster Ait. inoculadas con Laccaria sp., Rhizopogon sp., Suillus bovinus Gray y Pisolithus Alb. & Schwein. Los inóculos de estas especies de HEM fueron obtenidos cinco años después de reforestar áreas quemadas. Estos resultados indican la persistencia de estas micorrizas aún después del evento de fuego, y de su capacidad de fomentar la presencia de otras comunidades de HEM además de las inoculadas.
Otro ejemplo de la utilización de HEM, es la que se lleva a cabo en suelos contaminados con metales. En lugares conocidos como “presas de jales” (residuos de la explotación minera) se presentan elementos potencialmente tóxicos (EPT; por ej., arsénico y plomo, entre otros), con efectos nocivos tanto para la salud humana como para las plantas. Los EPT presentes en los residuos o presas de jales impiden que se establezcan o desarrollen las plantas (Ortega-Larrocea, 2015). Estos lugares pueden ser estabilizados mediante la reforestación de plántulas con micorrizas que toleran tales condiciones adversas. Lo anterior permite recobrar parte de la cobertura vegetal del lugar, a partir de la colonización de plantas micorrizadas y, reducir los efectos adversos causados por la minería, ya que se promueve la formación de suelo (Ortega-Larrocea, 2015). El micelio de los hongos micorrízicos es capaz de acumular altas concentraciones de metales como el cobre y el arsénico, lo cual significaría menor toxicidad para la planta huésped (González-Chávez et al., 2005; Ortega-Larrocea, 2015).
En otro experimento, se inocularon especies de Pinus densiflora Siebold & Zucc. y Quercus variabilis Blume, separadamente con tres especies de HEM (Pisolithus sp., Cenococcum geophilum Fr., Laccaria laccata (Scop.) Cooke), y se trasplantaron a jales mineros con altas concentraciones de cobre; se demostró que después de seis meses las plántulas inoculadas mostraban altas tasas de supervivencia y crecimiento, absorbieron más nutrientes, y acumularon más cobre y zinc en las raíces que en los brotes (Zong et al., 2015). Estos datos demuestran la importancia de las ectomicorrizas para mejorar la supervivencia y el rendimiento, en general, de plántulas del género Pinus en condiciones de contaminación del suelo, como son las presas de jales mineros (Zong et al., 2015).
Las especies del género Juniperus también se han utilizado en labores de restauración; sin embargo, se han estudiado poco las asociaciones micorrízicas que establecen. Entre las especies utilizadas destacan Juniperus comitana Martínez y Juniperus deppeana var. gamboana (Mart.) R.P. Adams., que también son especies endémicas y vulnerables en México, de acuerdo con la Unión Internacional para la Conservación de la Naturaleza (UICN, 2022). Otro grupo de especies son las que se encuentran en zonas de vegetación secundaria en jales mineros como Juniperus deppeana Steud., Juniperus flaccida Schltdl. y Cupressus lindleyi Klotzsch ex Endl., las cuales también aportan materia prima a pobladores locales (Zamora-Serrano et al., 2012).
A pesar de la importancia de estas plantas en labores de restauración, durante la búsqueda de información para este trabajo no se encontraron investigaciones detalladas en México de especies de hongos nativos que formen asociaciones micorrízicas con Juniperus para emplearse en estrategias de recuperación ecológica. Sin embargo, para España, trabajos con Juniperus oxycedrus L. en simbiosis con una mezcla de HMA Glomus intraradices N.C. Schenck & G.S. Sm., Glomus deserticola Trappe, Bloss & J.A. Menge y Glomus mosseae (T.H. Nicolson & Gerd.) Gerd. & Trappe, demostraron una estimulación en el crecimiento y en los contenidos de nitrógeno y fósforo en los brotes. Además, se incrementó la actividad de las enzimas peroxidasa y superóxido dismutasa, indispensables para la eliminación de peróxido de hidrógeno y del radical superóxido; esta mayor actividad de enzimas antioxidantes podría contribuir a tolerar condiciones de estrés hídrio (Alguacil et al., 2006).
Estos resultados muestran la importancia de identificar especies nativas de hongos micorrízicos que pudieran estar asociados con especies de plantas mexicanas, como J. comitana y J. deppeana var. gamboana. Por otra parte, la presencia de estas especies en condiciones ambientales adversas permitiría su utilización como potenciales remediadoras (Fig. 4 E-H).
Conclusiones
La complejidad de la asociación simbiótica hace necesario identificar las especies que forman micorrizas de manera natural en el campo.
El método de inoculación por esporas tanto de endo como de ectomicorrizas es uno de los más efectivos. Otra práctica común es el uso directo de suelo; sin embargo, esta práctica tiene repercusiones negativas sobre los ecosistemas.
La variedad de las especies de HEM y sus efectos en la planta son específicos, por lo que se sugiere seguir evaluando métodos que sean más adecuados para cada especie. El éxito de la asociación y de su producción en viveros requiere el uso de ténicas adecuadas.
La búsqueda de nuevas metodologías con la finalidad de obtener técnicas de inoculación específicas y adecuadas, permitirán un manejo efectivo y sostenible, que presente los mejores resultados en viveros forestales. De este manera, las micorrizas obtenidas tendrán mayor potencial de utilización en la repoblación forestal y recuperación ecológica.











 nueva página del texto (beta)
nueva página del texto (beta)



