Introducción
La disminución contemporánea de la diversidad no tiene precedentes (Walters y Scholes, 2017). La destrucción y degradación de los hábitats, asociadas principalmente a las actividades antrópicas, son las principales amenazas para la biodiversidad del planeta (IPBES, 2019). La fragmentación de bosques, asociada a cambios en el uso de la tierra (p. ej., ganadería, cultivos, infraestructura urbana, entre otros), es una de las causas principales del aislamiento y de la disminución del tamaño del hábitat original de las especies (Fahrig, 2003; Fletcher et al., 2023). Lo anterior reduce progresivamente el tamaño de las poblaciones y acarrea el riesgo local de extinción al llevarlas a un umbral por debajo del mínimo viable (Fahrig, 2003). Así mismo, el aumento de la distancia entre los fragmentos de bosque dificulta el intercambio genético entre los individuos aislados, lo que deteriora el reclutamiento de las especies (Fahrig, 2003; Santos y Tellería, 2006). En este sentido, la fragmentación puede afectar la reproducción de las especies y por lo tanto la estabilidad poblacional (Bartomeus et al., 2018; Serna‐González et al., 2022).
Un ejemplo de ello es la familia Magnoliaceae, que se encuentra entre los grupos de plantas vasculares que actualmente son prioridad de conservación a nivel mundial (Rivers et al., 2016; IUCN, 2023). Cuenta con alrededor de 350 especies en todo el mundo, la mayoría en alto riesgo de extinción (Rivers et al., 2016). Solo en los bosques de los Andes de Colombia se concentra la mayor riqueza de Magnolias del Neotrópico (41 especies) (Rivers et al., 2016; Rodríguez-Duque et al., 2022; Montoya-López y Bota-Sierra, 2023). Sin embargo, resulta preocupante que 86% de estas especies enfrentan una amenaza inminente de extinción, principalmente a causa de la fragmentación y degradación de su hábitat (Linsky et al., 2022a). Este problema se agrava debido a la distribución restringida de estas especies y a la presencia de poblaciones notablemente reducidas, llegando en algunos casos a limitarse a unos pocos árboles aislados (Rivers et al., 2016; Rodríguez-Duque et al., 2022; Serna‐González et al., 2022).
Si bien la densidad poblacional de las especies permite entender los patrones de distribución de las especies en su hábitat y su interacción con variables ambientales, no siempre refleja la viabilidad de la población (Santos y Tellería, 2006). Recientemente Suárez-Castro et al. (2020) han propuesto que la estabilidad del rango de funciones proporcionadas por una comunidad depende más de la diversidad de sus rasgos funcionales que de la riqueza y/o abundancia relativa de especies. Además, Santos y Tellería (2006), Zambrano et al. (2019) y Suárez-Castro et al. (2020) reportan la incidencia negativa de la fragmentación en parámetros biológicos, tales como la fisiología, la demografía y los rasgos funcionales. Sin embargo, los modelos de distribución ajustados a partir del número de individuos de una especie por unidad de área generalmente no contemplan los efectos producidos por los efectos de borde y la distancia entre fragmentos sobre la calidad del hábitat y la distribución de las especies (Fahrig, 2003; Santos y Tellería, 2006).
Las variables climáticas asociadas a la altitud, que mejor describen la distribución natural, desarrollo poblacional y tasas de crecimiento de las plantas son la temperatura y la precipitación en eventos extremos, ya que determinan el déficit o exceso de agua (Aubry-Kientz et al., 2015; Gaviria et al., 2017). A pesar de su importancia, no siempre es posible encontrar información climática detallada para las zonas en las que se distribuyen las especies, razón por la cual los esfuerzos de modelación bioclimática como WorldClim (Hijmans et al., 2017) permiten la obtención de variables climáticas en estos sitios.
Por su parte las variables bioclimáticas, con base en la temperatura y la precipitación, permiten representar tendencias anuales, estacionales y eventos extremos que pueden ser limitantes para las especies y por ello suelen emplearse en los modelos de distribución de especies. Los modelos matemáticos y estadísticos se presentan como alternativas importantes en el análisis de los patrones de distribución espacial de las especies en un contexto regional y de cambio climático (Shi et al., 2021). Adicionalmente, permiten la predicción de áreas idóneas o con alta probabilidad de presencia de una especie (Franklin, 2013), predicción que puede ser empleada para investigar su origen, distribución y evolución, así como también realizar búsquedas focalizadas de nuevos individuos, especialmente en especies con tamaños poblacionales pequeños (Franklin, 2013; Shi et al., 2021).
Un primer paso en la modelación de distribución de especies es el reconocimiento de las variables susceptibles de ser utilizadas (Phillips et al., 2006). En el caso de especies de Magnolia L. es fundamental entender las características de su hábitat, en términos de variables ambientales y uso del suelo, para realizar modelos que permitan localizar nuevos individuos y seleccionar sitios de conservación in situ (Phillips et al., 2006; Linsky et al., 2022b). Sin embargo, la información de rangos de distribución para las especies de Magnolia colombianas es limitada.
Para ampliar nuestra comprensión sobre la distribución de Magnoliaceae, optamos por estudiar dos especies: Magnolia jardinensis M. Serna, C. Velásquez & Cogollo, En Peligro Crítico (CR) y M. yarumalensis (Lozano) Govaerts, En Peligro (EN), endémicas del bosque altoandino y cuya distribución está restringida al noroccidente de Colombia (Fig. 1; Rivers et al., 2016; Serna‐González et al., 2022; IUCN, 2023). Esta investigación busca dar respuesta a las siguientes preguntas: 1) ¿En cuáles rangos climáticos se distribuyen M. jardinensis y M. yarumalensis?, 2) ¿En qué tipo de coberturas se encuentran M. jardinensis y M. yarumalensis? Se espera identificar su distribución a nivel local/regional con base en el tipo de cobertura y condiciones climáticas. Esta información es necesaria para realizar interpretaciones ecológicas, contribuir a la evaluación de su estado de conservación y establecer estrategias de conservación.
Materiales y Métodos
Área de estudio
Nuestra área de estudio se ubica en bosques montanos del noroccidente de los Andes colombianos, en tres localidades del municipio Jardín, departamento de Antioquia (localidad 1: 5°29'27.38'' N, 75°53'21.26'' O; localidad 2: 5°31'11.82'' N, 75°51'56.96'' O; localidad 3: 5°33'58.66'' N, 75°47'29.49'' O), entre 2000-2800 m s.n.m. (Fig. 1). Las localidades se sitúan en un paisaje con una matriz de pastos limpios y bosques medianamente intervenidos, en los que confluyen especies de los géneros Nectandra Rol. ex Rottb., Geonoma Willd., Ladenbergia Klotzsch y Eschweilera Mart. ex DC. La zona de vida predominante es bosque muy húmedo montano bajo (bmh-MB sensuHoldridge, 1947). La precipitación promedio anual es de 2478 mm y la temperatura media anual de 20 °C (Harris et al., 2020). Aunque la precipitación mensual multianual en el sitio presenta dos picos marcados de lluvia (marzo y octubre), todos los meses son húmedos; es decir, sin déficit hídrico (precipitación >100 mm/mes) (Harris et al., 2020).
Trabajo de campo
Se realizaron diez visitas de campo a las tres localidades entre febrero y mayo de 2023. Se efectuaron recorridos de 2.2 km en los que se registraron individuos de M. jardinensis y M. yarumalensis encontrados a 10 m de los senderos en fragmentos de bosques, con un área recorrida aproximada de 4.5 ha. Cada individuo fue georreferenciado con un GPS 76CSx marca Garmin® (George Town, Islas Caimán). Se midió el diámetro a la altura del pecho (DAP) utilizando una cinta de fibra de vidrio HFMT8330 marca INGCO® (Suzhou, China) y se estimó la altura total; las variables se registraron en el software Memento database v. 5.1.0 (MementoDB Inc., 2023).
Otros registros
Se visitaron los herbarios Gabriel Gutiérrez Villegas de la Universidad Nacional de Colombia sede Medellín (MEDEL), Joaquín Antonio Uribe del Jardín Botánico de Medellín (JAUM) y de la Universidad de Antioquia (HUA), en búsqueda de los metadatos registrados en las colecciones botánicas: georreferenciación, altura total, DAP y tipo de cobertura (Fig. 2A, C). Esto permitió conformar una base de datos de sitios de presencia de las especies. La información obtenida fue complementada con los registros del Global Biodiversity Information Facility (GBIF, 2023). Se curaron taxonómicamente los ejemplares y la información digital. Adicionalmente, se revisó la calidad de los datos de presencia por lo que se descartaron registros duplicados, sin georreferenciación o aquellos en los que no fue posible verificar la fuente de información.

Figura 2: Registros de las especies estudiadas: A. registro de herbario de Magnolia yarumalensis (Lozano) Govaerts; B. ejemplar en campo con flor de M. yarumalensis; C. registro de herbario de Magnolia jardinensis M. Serna, C. Velásquez & Cogollo; D. ejemplar en campo con flor de M. jardinensis. Créditos: A, C. Marcela Serna González; B. Juan Pablo Santa Ceballos; D. Alejandro Arango.
Variables ambientales y análisis de datos
Se utilizaron los productos proporcionados por WorldClim en formato ráster, con resolución espacial de 30 segundos (~1 km2), de las siguientes variables bioclimáticas (Hijmans et al., 2017): Temperatura máxima del mes más cálido (Tmax), Temperatura mínima del mes más frío (Tmin), Precipitación anual (PPT), Precipitación del trimestre más húmedo (PTH) y Precipitación del trimestre más seco (PTS). Adicionalmente, se utilizó el modelo digital del terreno de Colombia, con resolución espacial de 30 m provisto por el Instituto Geográfico Agustín Codazzi (IGAC, 2011). Con la herramienta de geoproceso “Pendiente” del software QGIS v. 3.26.3 (QGIS Development Team, 2022), se realizó el cálculo de pendientes a partir del ráster de elevación y se organizaron según la clasificación de pendientes de la FAO (2009). Para caracterizar los tipos de bosques donde se registraron las especies de este estudio, se emplearon las capas del nivel tres de coberturas de la tierra “Corine Land Cover” a escala 1:100000 para el año 2018 proporcionadas por Instituto de Hidrología, Meteorología y Estudios Ambientales (IDEAM, 2021).
Para cada una de las variables mencionadas se calcularon la media, la varianza y la desviación estándar y se generó un diagrama de violín. Se evaluó la normalidad de las variables mediante la prueba de Shapiro-Wilk (Shapiro y Wilk, 1965)) Con base en los resultados, se realizó una prueba no paramétrica, prueba de Wilcoxon (1945), para establecer diferencias significativas en los rangos de distribución de las especies. Todos los análisis estadísticos se realizaron mediante el software R v. 4.2.2 (R Core Team, 2022). Finalmente, mediante el uso de la herramienta GeoCAT (Bachman et al., 2011), se calculó la extensión de presencia de ambas especies de acuerdo con los criterios definidos por la IUCN (IUCN, 2022).
Resultados
Distribución espacial
Se registró un total de 135 individuos, incluyendo registros de GBIF (2023), registros de herbario y registros de campo: 33 individuos de M. jardinensis en una extensión de presencia de 37 km2 y 102 individuos de M. yarumalensis en una extensión de presencia de 8562 km2. Del total, los recorridos de campo aportaron 28 registros para M. jardinensis y 53 para M. yarumalensis.
La distribución de ambas especies se encontró restringida a la cuenca hidrográfica del Rio Cauca. Magnolia jardinensis presentó una distribución restringida sobre el flanco oriental de la cordillera occidental, dentro de los límites del municipio Jardín en el departamento de Antioquia. Por otra parte, M. yarumalensis presentó dos grupos de poblaciones separadas, uno hacia el sur de la cuenca con individuos en el flanco oriental de la cordillera occidental a lo largo del departamento de Risaralda y al suroeste del departamento de Antioquia, y otro sobre el flanco occidental de la cordillera central en municipios del norte y oriente del departamento de Antioquia (Fig. 1). Los dos grupos poblacionales se encuentran separadas por una distancia aproximada de 100 km.
Rangos de distribución
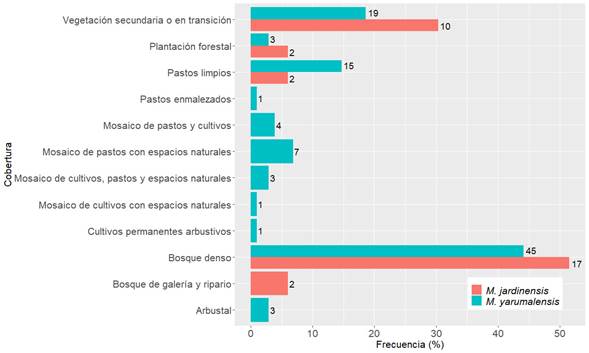
Magnolia jardinensis se registró en sitios con precipitación anual y altitud promedio de 2363.94 mm y 2330.52 m s.n.m. respectivamente (Cuadro 1). Magnolia yarumalensis se presentó en condiciones de precipitación y altitud medias de 2464.88 mm y 2236.31 m s.n.m. respectivamente (Cuadro 1). Las temperaturas máximas del mes más cálido oscilaron entre 17.60 y 21.00 °C para M. jardinensis y entre 15.90 y 27.80 °C para M. yarumalensis (Fig. 3D). Las temperaturas mínimas del mes más frío oscilaron entre 9.00 y 11.90 °C para M. jardinensis y entre 7.50 y 15.90 °C para M. yarumalensis (Fig. 3C). Ambas especies se distribuyen en ambientes sin déficit hídrico, con precipitaciones mayores a 100 mm/mes en los meses menos lluviosos. Se encontraron diferencias significativas entre las especies en la distribución de las variables de precipitación (PTH, PTS y PPT, valor p<0.05). Ambas especies se registraron en ambientes con pendientes desde muy escarpadas hasta planas (Fig. 3B). En cuanto a las coberturas registradas, 19 individuos (58%) de M. jardinensis se encontraron en bosques densos (17) y bosques de galería y riparios (2), mientras que los 14 individuos restantes (42%), en áreas con vegetación secundaria que corresponde a rastrojos altos y bajos (30%, n=10), pastos limpios (6%, n=2) y plantaciones forestales (6%, n=2) (Fig. 4). Solo 45 individuos (44%) de M. yarumalensis se registraron en bosques densos, mientras que los 57 individuos restantes (56%) se encontraron principalmente en vegetación secundaria (19%, n=19), pastos limpios (15%, n=15), mosaicos de pastos y bosques (cobertura dominada por pastos con una superposición de pequeños fragmentos de bosque, 7%, n=7) y otras combinaciones de coberturas asociadas a intervenciones antrópicas (16%, n=16) (Fig. 4).
Cuadro 1: Resumen estadístico de las variables ambientales seleccionadas para definir la distribución de Magnolia jardinensis M. Serna, C. Velásquez & Cogollo y M. yarumalensis (Lozano) Govaerts. Tmax: temperatura máxima de mes más cálido, Tmin: temperatura mínima del mes más frio, PPT: precipitación anual, PTH: precipitación del trimestre más húmedo y PTS: precipitación del trimestre más seco.
| Magnolia jardinensis M. Serna, C. Velásquez & Cogollo | Altitud (m) | Pendiente (°) | Tmax (°C) | Tmin (°C) | PPT (mm) | PTH (mm) | PTS (mm) |
| Media | 2330.52 | 22.35 | 19.78 | 10.92 | 2363.94 | 752.33 | 384.73 |
| Desviación estándar | 105.24 | 9.95 | 0.73 | 0.70 | 94.35 | 40.03 | 37.25 |
| Máximo | 2667.49 | 33.85 | 21.00 | 11.90 | 2545.00 | 828.00 | 444.00 |
| Mínimo | 1995.46 | 3.49 | 17.60 | 9.00 | 2173.00 | 721.00 | 308.00 |
| Magnolia yarumalensis (Lozano) Govaerts | |||||||
| Media | 2236.31 | 20.27 | 20.90 | 11.61 | 2464.88 | 814.21 | 356.25 |
| Desviación estándar | 265.76 | 10.50 | 2.60 | 2.00 | 215.97 | 109.09 | 56.26 |
| Máximo | 2759.59 | 44.47 | 27.80 | 15.90 | 3074.00 | 1125.00 | 470.00 |
| Mínimo | 1648.05 | 1.72 | 15.90 | 7.50 | 2062.00 | 650.00 | 246.00 |
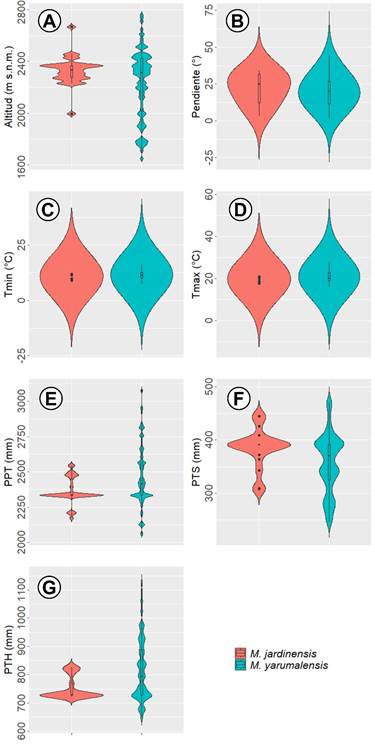
Figura 3: Gráficos de violín de los rangos de las variables ambientales asociadas a la distribución de Magnolia jardinensis M. Serna, C. Velásquez & Cogollo y M. yarumalensis (Lozano) Govaerts. A. altitud; B. pendiente; C. temperatura mínima del mes más frio; D. temperatura máxima del mes más cálido; E. precipitación; F. precipitación del trimestre más seco; G. precipitación del trimestre más húmedo.
Discusión
En la zona en donde se distribuyen ambas especies confluyen diversos esfuerzos de priorización de áreas para la conservación. Parte de ella ha sido categorizada como un área clave para la biodiversidad (KBA: “Key Biodiversity Area”) dentro del hotspot de los Andes tropicales (Myers et al., 2000; Pronaturaleza, 2021). A pesar de esta priorización, los desafíos asociados a la deforestación persisten. Solo 58 y 44% de los individuos de M. jardinensis y M. yarumalensis, respectivamente, se encuentran en coberturas boscosas. Por lo tanto, un alto porcentaje de individuos (42 y 56%, respectivamente) se encuentra en coberturas asociadas a procesos de intervención antrópica, como potreros y vegetación secundaria (rastrojos altos y bajos). Este patrón de distribución suele estar asociado a la actividad agropecuaria y al aprovechamiento de madera (Rivers et al., 2016) y, por lo tanto, este tipo de actividades facilita la degradación, disminución y fragmentación de su hábitat (Calderón et al., 2016b; Rivers et al., 2016).
Magnolia jardinensis presenta un área de distribución geográfica restringida y un alto grado de endemismo asociada al flanco oriental de la cordillera occidental en el municipio Jardín, Antioquia (Serna et al., 2009). Así mismo, algunas poblaciones de M. yarumalensis se distribuyen sobre el flanco oriental de la cordillera occidental, en el suroeste del departamento de Antioquia y el norte del departamento de Risaralda. Los procesos de fragmentación en el área son altos, especialmente por fuera de las áreas protegidas: gran parte de los fragmentos están aislados y tienen un área menor a 100 ha (Calderón-Cano y Benavides, 2022).
La perturbación de los bosques altera procesos bióticos y abióticos que afectan la supervivencia de las especies (Turner, 2010). La alteración de la estructura de los bosques tiene efectos directos sobre el microclima, debido a que genera una mayor incidencia de la radiación solar y altera la regulación térmica del sotobosque (De Frenne et al., 2021). A su vez, en zonas abiertas o altamente perturbadas se registra un aumento de la temperatura máxima y una disminución de la humedad del suelo, en comparación con las condiciones del sotobosque de bosques no perturbados (De Frenne et al., 2021; Zhang y Yi, 2021). Teniendo en cuenta que un alto porcentaje de individuos (42 y 56%) se encuentra en coberturas altamente intervenidas, los cambios en las condiciones ambientales podrían tener efectos directos en el reclutamiento de estas especies. Esto se debe a que, para lograr la germinación exitosa de las semillas de Magnolia, es requerido un entorno húmedo, por lo que su germinación podría reducirse considerablemente con la disminución en la humedad del suelo (Corral-Aguirre y Sánchez-Velásquez, 2006).
Así mismo, las especies de la familia Magnoliaceae han mostrado dependencia de las aves para la dispersión de las semillas y polinizadores altamente especializados (Serna‐González et al., 2022). Teniendo en cuenta que la polinización y la dispersión de semillas mediadas por animales son las interacciones más susceptibles a la perturbación del bosque (Neuschulz et al., 2016), se esperaría que la reproducción y regeneración de especies de Magnolia se vean afectadas por este proceso. Es el caso de M. stellata (Siebold & Zucc.) Maxim., donde la perturbación de su hábitat ha reducido el tamaño de la población y aumentado la separación geográfica entre poblaciones, reduciendo el flujo genético y su éxito reproductivo (Setsuko et al., 2013).
En general, las dos especies estudiadas de Magnolia se asocian a bosques húmedos y muy húmedos entre pisos altitudinales desde el premontano al montano, de acuerdo con la clasificación de zonas de vida de Holdridge (1947). Según nuestros resultados, Magnolia jardinensis se distribuye aproximadamente entre 1995 y 2667 m s.n.m., similar a los rangos reportados de 2000-2700 m s.n.m. por Serna et al. (2009) y 1900-2800 m s.n.m., según Calderón et al. (2016a).
El rango de altitud encontrado para M. yarumalensis, entre 1648 y 2760 m s.n.m., contrasta con el rango altitudinal reportado para esta especie (1800-2800 m s.n.m.) por Calderón et al. (2016b) y por Lozano-Contreras (1994), quienes además restringen su distribución a los bosques nublados del departamento Antioquia, Colombia, a una altitud media de 2450 m. Adicionalmente, se evidencia un aumento de la distribución altitudinal hacia zonas más bajas, por lo que se esperaría que M. yarumalensis sea más resiliente a cambios climáticos, especialmente al aumento de la temperatura media.
Algunos estudios indican que, en el hemisferio norte, la temperatura media mensual en las regiones montañosas ha aumentado más rápido que la temperatura promedio (Rebetez y Reinhard, 2008) y, en general, las regiones montañosas de todo el mundo experimentan cambios de temperatura más rápidos que los ambientes en elevaciones más bajas (Mountain Research Initiative EDW Working Group, 2015). Esto puede provocar cambios significativos en la distribución altitudinal de las especies de bosques nublados y aumentar el riesgo de extinción (Moritz et al., 2008; Menéndez et al., 2014; Rowe et al., 2015; Zu et al., 2021).
El cambio climático puede alterar tanto el rango altitudinal de distribución de las especies de montaña (Rowe et al., 2015), como la contracción de estos rangos, lo que puede aumentar el riesgo de extinciones locales de especies endémicas (La Sorte y Jetz, 2010; Freeman et al., 2018; Zu et al., 2021). Esto es especialmente preocupante para ambas especies de Magnolia dado su limitada área de distribución y su pequeño tamaño poblacional. Aunque Rivers et al. (2016) y Calderón et al. (2016a) reportan para M. jardinensis una población menor a 50 individuos maduros, se desconoce su ubicación y en la plataforma GBIF (2023) solo se registran 18. En este trabajo registramos para esta especie 33 individuos. Por su parte, para M. yarumalensis no se tenía una estimación del tamaño de la población (Calderón et al., 2016b), mientras que nuestro estudio registra 102 individuos, por lo que ambas especies podrían catalogarse como “Especies de plantas con poblaciones extremadamente pequeñas” de acuerdo con Sun et al. (2019).
Conclusiones y recomendaciones
Los registros de presencia de las especies en sus condiciones naturales permiten dar cuenta del rango de variables ambientales entre las cuales puede presentarse. Ambas especies de Magnolia se encuentran asociadas con bosques húmedos y muy húmedos a diferentes rangos altitudinales y se pueden considerar como especies de plantas con poblaciones extremadamente pequeñas.
Adicionalmente, la distribución altitudinal de M. yarumalensis se amplió hacia zonas más bajas en relación con lo reportado en estudios previos. A pesar de los nuevos registros para ambas especies, su distribución espacial sigue siendo altamente restringida, lo que reafirma su grado de amenaza.
Es necesario resaltar que un gran porcentaje de los individuos se encuentra asociado a coberturas no boscosas, por lo cual se pueden ver afectados los procesos asociados a su reproducción tales como su polinización, su dispersión y reclutamiento, como consecuencia de la modificación de su hábitat. El tamaño poblacional, las posibles limitaciones reproductivas derivadas del mismo y la influencia del cambio climático son un agravante del ya estado crítico de conservación de las poblaciones de ambas especies.
Es fundamental realizar investigaciones más exhaustivas sobre la dinámica poblacional de ambas especies, así como examinar detenidamente los cambios históricos en su hábitat. Estos estudios permitirán obtener una comprensión más completa de los factores que influyen en la distribución actual de las poblaciones y en las transformaciones experimentadas por el entorno que habitan a lo largo del tiempo. Así mismo, es importante estudiar cómo los procesos de fragmentación están afectando el flujo genético, para determinar si existe un aislamiento entre las poblaciones remanentes de ambas especies.
Este estudio es un primer paso frente al entendimiento en la distribución de ambas especies de Magnolia con base en variables bioclimáticas por lo que se recomienda el uso de esta información para realizar modelaciones de distribución y entender con más detalle cómo afectan estas variables ambientales a su distribución, para proponer estrategias de conservación que contribuyan a enfrentar los efectos del cambio climático.











 nueva página del texto (beta)
nueva página del texto (beta)