Introducción
Desde el siglo XVIII, la producción de vainilla ha despertado el interés de españoles, franceses e ingleses, quienes llevaron la planta a Europa para cultivarla en invernaderos (Kourí, 2004). En el Perú, algunas de las primeras referencias a esta planta provienen de recopilaciones de los cronistas y de los diarios de viaje de las expediciones científicas del siglo XVIII (Damián-Parizaca, 2020), como la de Ruiz y Pavón (Pupulin, 2012), y del siglo XIX, como la de Humboldt (Browne, 1944), quienes mencionan que las vainas eran especias de común comercio por los indígenas en las regiones de Cajamarca y Huánuco. En 1799, la pintura en óleo “El Quadro de la Historia Natural Civil y Geográfica del Reyno del Perú” hace referencia a las características de la vainilla, documentándola como un arbusto importante para el comercio entre Perú y México con la corona española, para la elaboración de chocolates (Damián-Parizaca, 2020). Fortunato Herrera hace mención de Cristobal de Saavedra (Herrera, 1921), quien en su estudio de especies tropicales de la Amazonia menciona a Vanilla aromatica L., resaltando el agradable olor que logra transmitir; esta sería la primera descripción del género Vanilla Mill. en el Perú.
En sus notas de viajes para su obra “El Perú”, Raimondi (1855) menciona a la vainilla como un producto que podía obtenerse en territorios cercanos a Pangoa (Junín), teniendo 1000 m como límite de distribución altitudinal. Años más tarde, Weberbauer (1945) publicó “El mundo vegetal de los andes peruanos”, donde se mencionan diversos géneros de orquídeas epífitas o semi-epífitas, incluyendo a Vanilla weberbaueriana Kraenzl. Los estudios contemporáneos de Damián y Janovec (2018) culminaron con la publicación de “El género Vanilla en el Perú”. A la fecha, la vainilla es la principal orquídea de interés económico y la segunda especie con mayor precio y alta demanda en el mundo (Hailemichael et al., 2012).
Vanilla se desarrolla inicialmente como una planta de hábito terrestre con un sistema radicular fasciculado que actúa como un órgano de soporte y de absorción de agua y nutrientes (Hernández y Lubinsky, 2011). La distribución de Vanilla es pantropical (Flanagan y Mosquera-Espinosa, 2016). En especial Vanilla pompona subsp. grandiflora (Lindl.) Soto Arenas tiene preferencia por áreas húmedas e inundables como los aguajales en el Valle del Alto Mayo (VAM), presentándose usualmente en poblaciones dispersas con una limitada distribución geográfica y en suelos pantanosos ricos en materia orgánica (Quinteros-Gómez et al., 2023). Ello ha limitado considerablemente la colecta del material botánico y la calidad de los especímenes en el territorio amazónico donde a pesar de ser el centro de diversidad del género, se conoce muy poco sobre su historia natural (Soto-Arenas y Dressler, 2003; Householder et al., 2010). Respecto a su polinización, se sabe que, en su ambiente natural, la flor de la vainilla es polinizada por insectos; para Vanilla pompona subsp. grandifolia, la abeja Eulaema meriana (Olivier, 1789) es la responsable de la polinización (Householder, 2007). Sin embargo, el porcentaje de flores polinizadas naturalmente es muy bajo ya que depende de polinizadores específicos (Gamboa-Gaitán, 2014), lo que no permite alcanzar un alto nivel de producción. Por ese motivo, los productores deben realizar una polinización manual, pero considerando no polinizar demasiadas flores por inflorescencia, ya que la presencia de demasiadas vainas debilita a la planta, lo que puede llevar a que las vainas no se desarrollen adecuadamente e incluso puedan abortar (Rodríguez-Deméneghi et al., 2023).
La cobertura vegetal del departamento San Martín, al norte de Perú, entre 2001 y 2022, ha sido impactada significativamente por actividades antrópicas y por la deforestación, provocando una pérdida estimada de 15% de la cobertura arbórea, haciendo que San Martín sea la región con mayor área proporcional deforestada en Perú (Ríos et al., 2018). Ello ha impactado directamente en la percepción de los integrantes de las comunidades nativas awajún (Huascayacu, Tornillo, Tingana y otras) en el VAM, quienes sostienen que la extracción excesiva y destructiva de vainas de vainilla ha llevado a que en varios territorios la densidad poblacional y la calidad de las vainas haya disminuido en los últimos cinco años (Quinteros-Gómez et al., com. pers.). En estas mismas comunidades, Conservación Internacional (CI), a través de proyectos de intervención, ha intentado la propagación vegetativa de la vainilla, pero con poco éxito debido principalmente al tipo de sustrato utilizado y a lo limitado del material biológico para el desarrollo extensivo de cultivares (Quinteros-Gómez et al., com. pers.). Esto, a la fecha, no permite desarrollar un mercado permanente de la vainilla. El objetivo del presente estudio fue determinar la cantidad óptima de nudos para el crecimiento de esquejes saludables de Vainilla pompona subsp. grandiflora, utilizando sustratos de bajo costo disponibles en territorios cercanos al Área de Conservación Aguajales y Renacales del Alto Mayo “Tingana”.
Materiales y Métodos
Área de estudio
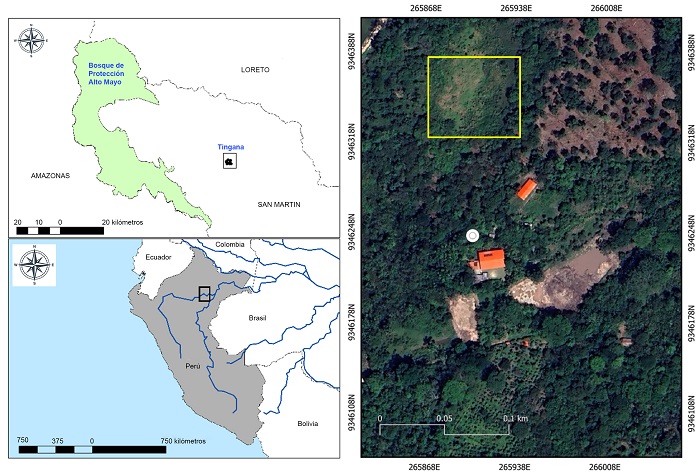
La investigación se realizó en el vivero de la Finca Don Pepito en Tingana, provincia y distrito de Moyobamba, departamento San Martín, Perú (05°54'37.8''S, 77°06'52.0''W; altitud 811 m; Fig. 1). La temperatura y precipitación promedio anual son 22.8 °C y 1265 mm, respectivamente (PEAM, 2004). La concesión para la conservación Tingana se encuentra en el VAM, en el piedemonte andino amazónico a una altitud promedio de 880 m.
Diseño de la investigación
Con el fin de determinar la cantidad óptima de nudos para el crecimiento de esquejes saludables de Vainilla pompona subsp. grandiflora utilizando sustratos de bajo costo, se diseñó un experimento aleatorizado en el que se consideraron cuatro bloques según los tipos de esquejes y cuatro tratamientos para el tipo de sustrato utilizado. Se realizaron 30 observaciones para cada bloque por tratamiento, totalizando 480 observaciones (Cuadro 1). La información fue documentada en fichas de campo y mediante registros fotográficos.
Cuadro 1: Tipos de esqueje, tratamientos de sustratos y factores resultantes de las combinaciones.
| Tipo de esqueje | Tratamiento | Combinaciones | |||
| Tipo A: 0 nudo | Tratamiento 1: 100% musgo | A1 | B1 | C1 | D1 |
| Tipo B: 1 nudo | Tratamiento 2: 100% bagazo | A2 | B2 | C2 | D2 |
| Tipo C: 2 nudos | Tratamiento 3: 50% bagazo 50% musgo | A3 | B3 | C3 | D3 |
| Tipo D: 3 nudos | Tratamiento 4: 75% bagazo 25% musgo | A4 | B4 | C4 | D4 |
Vainilla pompona subsp. grandiflora se encuentra registrada en el Apéndice II de CITES (2023), por lo que para obtener el material biológico se tuvo que: 1) registrar el centro de propagación (vivero de la Finca Don Pepito) ante la Autoridad Regional Ambiental (ARA) y 2) solicitar un plan de colecta ante el Servicio Nacional Forestal y de Fauna Silvestre (SERFOR). Se colectaron 480 esquejes juveniles de Vainilla pompona subsp. grandiflora provenientes de aguajales del Área de Conservación Aguajales Renacales del Alto Mayo “ADECARAM Tingana” (Fig. 2). Se depositaron especímenes físicos de Vainilla pompona subsp. grandiflora en el Herbario USM (siglas según Thiers, 2023) de la Universidad Nacional Mayor de San Marcos (347167). En general, los esquejes fueron obtenidos de plantas juveniles que tuvieron como tutores individuos adultos y saludables de la palmera aguaje, hasta una altura de 8 m.

Figura 2: A. colecta de esquejes de plantas madre de Vanilla pompona subsp. grandiflora (Lindl.) Soto Arenas; B. preparación de sustratos; C. corte de esquejes; D. establecimiento de esquejes en los tratamientos; E. evaluación de los primeros brotes. Fotografías de Dino Cabrera Mestanza.
Los sustratos utilizados (bagazo de caña y musgo) fueron considerados en función a su disponibilidad en el área de estudio. En las instalaciones del vivero de la Finca Don Pepito, 30 × 10 m, se adecuaron las camas almacigueras con un mínimo de 30 cm de cobertura de materia orgánica en proceso de descomposición. La temperatura, humedad relativa y la luminosidad promedio fueron de 23.86 oC, 65% y 55%, respectivamente. La temperatura y la humedad relativa fueron medidas cada 30 minutos utilizando el Smart Thermo-Hygrometer Govee (modelo H5075, Londres, UK). La luminosidad fue medida cada 30 minutos desde las 6:00 hasta las 18:00 horas utilizando el Luxómetro URCERI (modelo MT-912, China).
Análisis de datos
En el diseño de la investigación se consideró la homogeneidad de las unidades experimentales (esquejes) que fueron agrupadas en bloques (tipos de esquejes; factor primario). Los tratamientos fueron los tipos de sustratos (factor secundario). Se utilizó un ANOVA simple para saber si existe alguna diferencia significativa en la activación de las yemas según los tipos de esquejes y los tratamientos. Posteriormente, se utilizó la prueba post-hoc LSD Fisher para determinar dónde se encontraban dichas diferencias en caso de que se presentaran.
Para los esquejes de dos y tres nudos, se realizó un ANOVA para analizar la activación de esquejes según el número de días transcurridos; para los tratamientos se consideraron 10 niveles en periodos de siete días, desde el día 46 hasta el 109. Además, se realizó la prueba de correlación de Pearson entre el número de días transcurridos del experimento (variable independiente) con el número de esquejes con yemas activas (variable dependiente). Para evaluar el estado de salubridad se asignaron a cuatro categorías según las características observadas en los esquejes, como se muestra en el Cuadro 2.
Cuadro 2: Categorías de salud, salubridad y características de los esquejes de Vanilla pompona subsp. grandiflora (Lindl.) Soto Arenas, en vivero en territorios inundables del Valle del Alto Mayo, Perú
| Categorías de Salud | Salubridad | Características |
| 0 | Bueno | Esquejes con yemas saludables (verdes oscuras), sin problemas de hongos y aptos para siembra. |
| 1 | Regular | Esquejes con algunas yemas amarillas, aptos para siembra. |
| 2 | Malo | Esquejes sin yemas e infectados con hongos. Poco viables para siembra. |
| 3 | Muy malo | Esquejes con síntomas de pudrición severos. No viables para siembra. |
Se empleó un ANOVA simple para analizar el estado de salubridad por tipo de esquejes, así como por tratamientos. El análisis de los datos fue realizado mediante el programa estadístico Statgraphics Centurion v. 16.1.03 (Statgraphics Technologies, The Plains, Virginia, EUA).
Resultados
En lo que se refiere a los tipos de esquejes según el tratamiento, las primeras activaciones en las yemas aparecieron en el día 46. En el ANOVA simple se encontró diferencia significativa entre los tipos de esquejes para los cuatro tratamientos (p=0.00). En todos los casos, la prueba LSD de Fisher permitió identificar la formación de dos grupos. El primero fue conformado por los esquejes de cero y un nudo, donde no se observó activación de las yemas, y el segundo grupo consistió en los esquejes de dos y tres nudos donde se reporta la activación de las yemas logrando 67 y 80% de eficiencia, respectivamente. En este sentido, el ANOVA entre ambos tipos de esquejes no reportó diferencia significativa para la activación de las yemas (p=0.055; Levene=0.603). Conforme transcurría el número de días, la activación de las yemas fue mayor para los esquejes de dos y tres nudos (p=0.00), llegando a alcanzar hasta 26 esquejes activados por combinación.
Para la activación de esquejes de dos y tres nudos por días, el ANOVA determinó que existe diferencia significativa según los días transcurridos (p<0.05), llegando a identificarse siete grupos homogéneos. La correlación de Pearson sugiere que existe una muy buena relación (p=0.00; R=0.9515) entre el número de días transcurridos del experimento con el número de esquejes con yemas activas. Es decir, conforme mayor el número de días transcurrido, la activación de yemas será mayor.
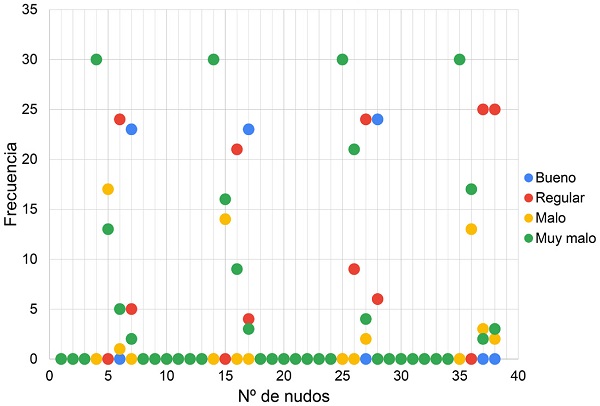
Los esquejes con cero y un nudo tuvieron un estado de salubridad malo y muy malo, respectivamente. De los esquejes, 78.3% de los que poseían dos nudos registraron un estado de salubridad regular, mientras que 91.7% de los esquejes de tres nudos resultaron aptos para siembra por tener buena salubridad (Cuadro 3). Se encontró que existe una diferencia estadísticamente significativa (ANOVA) entre las medias de los cuatro estados de salubridad para los tipos de esquejes (p=0.002). Al contrario, se determinó que no existe una diferencia estadísticamente significativa (p=0.2895) entre la media de salubridad para los tratamientos.
Cuadro 3: Tabla de contingencia para tipos de esquejes y estado de salubridad, en porcentajes.
| Salud | Tipos de esquejes (número de nudos) | |||
| 0 | 1 | 2 | 3 | |
| Bueno | 0 | 0 | 0 | 58.33 |
| Regular | 0 | 7.50 | 78.33 | 33.33 |
| Malo | 0 | 36.67 | 5 | 1.67 |
| Muy malo | 100 | 55.83 | 16.67 | 6.67 |
Se observa la incidencia de la implementación de cada tratamiento con respecto al número de nudos por esquejes y la salubridad que estos presentan (Fig. 3). La dispersión de puntos en el plano cartesiano nos permite visualizar el estado de salubridad considerando la frecuencia del tipo de esqueje y su respectivo tratamiento. Observamos que sin importar el tratamiento los esquejes de dos y tres nudos tienen estado de salubridad regular y bueno, mientras que para cero y un nudo es malo y muy malo, respectivamente.
Discusión
El periodo de brotación inició en el día 46, tres días antes de lo reportado por Martínez-Monter et al. (2022) para V. planifolia Andrews, quienes utilizaron abonos orgánicos y biofertilizantes. Los autores también mencionan que el testigo (sin fertilizantes) tuvo una brotación tardía, recién ocurrida el día 71, 25 días después de lo reportado en el presente estudio. Ello sugiere que las condiciones de sustrato, temperatura, humedad relativa y luminosidad en el vivero de la Finca Don Pepito son ideales para la brotación anticipada de yemas. En efecto, la activación de los esquejes durante el experimento sugiere que respondieron de manera significativa al número de nudos, revelando una eficiencia creciente en la activación a medida que se incrementa el número de nudos en los esquejes. Este hallazgo encuentra respaldo en investigaciones previas, que evidenciaron una activación temprana y un desarrollo óptimo de las yemas a partir de esquejes de V. fragrans Ames y V. planifolia con dos, tres y cuatro nudos (Namirembe-Ssonkko et al., 2005; Umesha et al., 2011; Hailemichael et al., 2012).
Adugna et al. (2015) y Hailemichael et al. (2012) respaldan la relación positiva entre el número de nudos en los esquejes de V. fragrans y V. planifolia con la generación de hojas, brotes y raíces en los individuos resultantes. A medida que aumenta el número de nudos en los esquejes utilizados como material de siembra, disminuye la incidencia de infecciones por hongos (Morera et al., 1990). Los síntomas observados en los esquejes con cero y un nudo fueron similares a los reportados en otros cultivares de vainilla, convirtiéndose en la principal preocupación fitosanitaria para estos esquejes (He, 2007; Pinaria et al., 2010). Por lo general, la aparición de estos síntomas está vinculada a niveles elevados de humedad en el suelo debido a lluvias excesivas, riego desmedido, problemas de drenaje en los lotes, sombreado excesivo, densidades de cultivo elevadas y deficiencias en las prácticas sanitarias, tanto en los cultivos establecidos como en los bancos de propagación (Bhai y Dhanesh, 2008). Lamentablemente los métodos de cultivo de vainilla continúan siendo de carácter tradicional, con bajos rendimientos (Gätjens-Boniche et al., 2018), asociados a pudrición de raíces y tallos causados principalmente por hongos del género Fusarium Link (Pinaria et al., 2010)
Los abonos orgánicos tienen un efecto positivo en la formación de raíces y brotes en esquejes de V. planifolia (Martínez-Monter et al., 2022). Esto permite el desarrollo de yemas saludables y libres de hongos, asegurando su supervivencia y siendo aptos para siembra definitiva en campo. Así ocurrió con los esquejes de dos y tres nudos en el presente estudio, por lo que se sugiere un estudio posterior en el cual se combinen número de nudos con aplicación de abonos orgánicos, esperando obtener mejores resultados.
Las semillas de vainilla tienen limitado poder de germinación (Torres-González et al., 2011), llevando a que la disponibilidad de material biológico (esquejes) sea limitada. En este sentido, la propagación a través de esquejes de dos nudos sería una mejor alternativa para la producción de plantones. De esta manera se plantea el siguiente caso: si en campo tuviéramos disponibilidad de tejido con un total de 1000 nudos y trabajaremos con esquejes de dos y tres nudos respectivamente, tendríamos un total de 500 y 333 esquejes respectivamente. Si consideramos el éxito de la activación de los brotes por tratamiento, los plantones con dos esquejes son una mejor alternativa, ya que tendríamos 442 plantones en lugar de 264 plantones con tres nudos respectivamente, con el tejido disponible. Sin embargo, como fue mencionado en párrafos anteriores, un mayor número de nudos por esqueje (hasta cuatro) asegura esquejes más saludables. En consecuencia, la producción de esquejes de vainilla para trasplante definitivo en campo solo puede ser realizada a pequeña escala debido a la exposición que sufren las plantas donadoras a enfermedades (Pinaria et al., 2010). Todos los factores antes mencionados deben de ser considerados y evaluados por los encargados de los viveros, por lo que se recomienda hacer observaciones permanentes y monitoreos constantes con la finalidad de determinar los mejores tipos de esquejes y tratamientos según las condiciones particulares en cada lugar.
Mediante el presente manuscrito buscamos difundir una alternativa de cultivo en territorios del VAM, de manera que se pueda disminuir la presión extractivista sobre los aguajales y renacales. Esto, considerando aspectos ambientales, económicos y sociales, por lo que representa una alternativa de desarrollo sostenible con participación directa de la comunidad (Paniagua-Vásquez et al., 2013). También fue considerado por Maruenda et al. (2013) quienes sostienen que Vanilla pompona subsp. grandiflora tiene características potenciales que permitirían su desarrollo como un nuevo producto agrícola para el Perú. En este sentido, es importante considerar el establecimiento de redes de cooperación entre los productores vainilleros de manera que puedan posicionarse en la cadena de comercialización del fruto.
La vainilla también destaca por su importancia ecológica, es considerado un producto no maderable del bosque ya que contribuye a la valorización de los ecosistemas nativos a través de estrategias de conservación integrales que pretenden perpetuar los recursos fitogenéticos en bancos de germoplasma (Azofeifa-Bolaños et al., 2014). Desde una perspectiva social, el establecimiento de rodales de vainilla puede beneficiar a pequeños productores y/o asociaciones, otorgándoles ingresos significativos por su participación como agentes productivos en la cadena de comercialización de la vainilla (Jaramillo et al., 2012). Sin embargo, a sabiendas de que la industrialización de las vainas es un negocio prometedor, muchos productores prefieren vender las vainas verdes en lugar de curadas (Watteyn et al., 2022), ya que no cuentan con la capacitación necesaria para realizar un curado efectivo.
La vainilla, al ser un cultivo clonal requiere mejoramiento (debido a su angosta base genética; Gamboa-Gaitán, 2014), ya que se encuentra fuertemente amenazada por actores de estrés tanto bióticos (hongos: Colletotrichum orchidophilum Damm, P.F. Cannon & Crous (Charron et al., 2018), Colletotrichum gloeosporioides (Penz.) Penz. & Sacc. (Guevara-Suarez et al., 2022) y Fusarium (Ramírez-Mosqueda et al., 2019), como abióticos (requerimientos agroclimáticos: temperatura máxima de 32 °C, humedad relativa < 80% y estrés hídrico) (Parada-Molina et al., 2022). Esto es debido a la baja variabilidad genética del cultivo, lo que limita su respuesta a situaciones extremas de estrés, afectando morfo-fisiológicamente a las plantas, culminando con el aborto floral y caída de frutos (Bhai et al., 2006). Existen alternativas para mejorar la cadena de producción y suministro, considerando la diversidad de sistemas de producción y la capacitación de los agricultores para que participen en el curado artesanal de las vainas (potenciando su aroma y sabor; Borbolla-Pérez et al., 2016; da Silva Oliveiro et al., 2022).
La Asociación Vainilla Perú (AVAIPE) viene trabajando en la promoción sostenible del cultivo de vainilla como una línea productiva en la región de San Martín, sensibilizando a las poblaciones amazónicas para la mejora de su calidad de vida con el desarrollo de actividades compatibles con la conservación (Quinteros-Gómez et al., com. pers.). En este sentido, la restauración de ecosistemas y paisajes (incremento de biomasa y desarrollo del dosel) se asocia al cultivo de vainilla, ya que el proceso natural sucesional de los bosques genera las condiciones adecuadas para el establecimiento de plantaciones de vainilla (del Amo et al., 2009). Ello permite la conservación de comunidades vegetales y especies endémicas de la zona manteniendo el equilibrio natural del ecosistema.
La región San Martín y en especial el VAM se encuentran altamente intervenidos por el avance de la frontera agrícola y la expansión de la urbanización (Quinteros-Gómez et al., 2023). Ante esta situación, en febrero 2022, el Gobierno Regional de San Martín (GORESAM) a través de la Ordenanza 02-2022-GRSM/CR (GORESAM, 2022) declaró como prioridad de política pública la reducción de la deforestación desarrollando una serie de estrategias concentrando esfuerzos en el diseño, ejecución y evaluación de proyectos de desarrollo forestal donde se incluya el componente de valoración y aprovechamiento de Productos Forestales No Maderables (PFNM; Aguirre y Aguirre, 2021), especialmente en los territorios tropicales donde las amenazas a la biodiversidad son cada vez más frecuentes (Laurance, 2013). La gran mayoría de los PFNM aprovechados por las comunidades locales no están considerados en el sistema económico formal (FAO, 2020), por lo que no se cuenta con datos exactos sobre su comercialización. Ello sugiere la necesidad de potencializar productos con bajo impacto antrópico en los bosques nativos, integrando estrategias de conservación con el desarrollo socioeconómico de las comunidades (Aguirre y Aguirre, 2021).
Contribución de autores
QGY y CMD concibieron y diseñaron el estudio. MBJ, SLV y SIA colectaron el material genético. QGY realizó los análisis estadísticos. CMD, MBJ contribuyeron a la adquisición de datos y la interpretación. QGY escribió el manuscrito con la ayuda de CMD, MBJ, SLV y SIA. Todos los autores contribuyeron a la discusión, revisión y aprobación del manuscrito final, así como en el levantamiento de observaciones.











 nueva página del texto (beta)
nueva página del texto (beta)