Introduction
Coffea arabica L. se cultiva en Chiapas, México desde mediados del siglo XIX y se ha adaptado a la región del Soconusco (Montoya y Toledo, 2020); se ha convertido en un cultivo estratégico por su importancia social y económica y ha contribuido a la preservación de la biodiversidad mediante su asociación con árboles de sombra en sistemas agroforestales (Reyes et al., 2022). En la actualidad se ha incrementado el número de agricultores que producen café orgánico (Reyes et al., 2020) y este enfoque agroecológico favorece el mantenimiento, equilibrio e interacción de los microorganismos de la rizósfera con las plantas hospedantes (Baldi, 2021). Además de inducir protección en las raíces frente a diversos patógenos (Bhale et al., 2018), las interacciones entre plantas y hongos contribuyen a la sostenibilidad agrícola (Devi et al., 2021) y al funcionamiento de los ecosistemas (Bar-On et al., 2018). Dichas interacciones benefician la supervivencia de las plantas, especialmente en condiciones agroclimáticas desfavorables (Agnolucci et al., 2019), tal como en plantaciones con diferentes grados de erosión del suelo (Lara-Capistran et al., 2021).
Los hongos endomicorrízicos son simbiontes obligados de aproximadamente el 80 % de las raíces de las plantas terrestres (Zou et al., 2021), y esta relación extensa ha generado mutualismo esencial en la distribución e interacción de plantas y hongos (Janowski y Leski, 2022; Tedersoo et al., 2020); sin embargo, los hongos endófitos no presentan especificidad hospedera (Suryanarayanan et al., 2018); no obstante, se demuestra preferencia por ciertas plantas hospedantes (U’Ren et al., 2019) para la adquisición de nutrientes (Bhale et al., 2018; Zou et al., 2021), especialmente fósforo, que es escaso o de baja movilidad en los suelos tropicales (Cogo et al., 2017), y cuya asimilación es especialmente importante como inductor del crecimiento del micelio presimbiótico para iniciar la colonización, tales como los estrigolactones (Duc et al., 2017). Además de lo anterior, se reconoce la fuerte influencia de varios factores ambientales como distribución de la precipitación en el año, el estado fisicoquímico del suelo (Janowski y Leski, 2022) y la edad de la planta (Jefwa et al., 2004).
Coffea spp. presenta alto grado de micotrofía (Hernández-Acosta et al., 2018), como se ha verificado en las regiones tropicales donde se cultiva (Vallejo-Torres et al., 2019), como en el sur de México (Trejo-Aguilar et al., 2018) y el Soconusco, Chiapas (Bertolini et al., 2020).
Diversos autores han citado mayor crecimiento de Coffea spp. y aumento nutrimental con la simbiosis de hongos endomicorrizicos (Ibarra-Puón et al., 2014; Perea et al., 2019); no obstante, al evaluarlos en consorcio o por separado, su efectividad depende del hongo endomicorrízico utilizado y de su compatibilidad con el hospedero (Aguilar-Paredes et al., 2020), registrando inducción diferencial entre los componentes del rendimiento de diversos cultivos (Aguirre-Medina et al., 2020). Con base en lo anterior, se evaluaron aislamientos de hongos endomicorrízicos con diferente origen geográfico en diversas variables fisiológicas y morfológicas del crecimiento de Coffea arabica L. var Catimor y su aportación en el contenido de fósforo en el tejido vegetal.
Materiales y metodos
La presente investigación se realizó en condiciones de vivero de la Facultad de Ciencias Agrícolas de la Universidad Autónoma de Chiapas (UNACH) ubicada en Huehuetán, Chiapas, México, (15° 01´ N, 92° 32´ O) a 44 m de altitud. El clima se clasifica como Am (w”) i g según García (2004), y se define como tropical cálido húmedo con lluvias en verano. La precipitación fue de 2650 mm y las temperaturas máximas y mínimas de 38 º y 15 ºC, respectivamente. La temperatura media, considerada isotérmica, es de 25.4 °C.
Origen, aislamiento y reproducción de los hongos endomicorrízicos
Los aislamientos de los hongos endomicorrizicos fueron obtenidos de tres regiones tropicales del sureste de México (Cuadro 1).
Cuadro 1 Localización geográfica de los sitios de recolecta de los aislamientos, cultivo asociado y características del ambiente.
| Sitio | Cultivo asociado | Suelo | Precipitación (mm) | Denominación |
| Tenampulco, Puebla: 20° 08´ 30´´ N, 97° 30´ 00´´ O, 350 msnm | Vanilla planifolia | Regosol | 2100 | Caracoles |
| San Rafael, Veracruz (20° 08´ 20´´ N, 97° 02´ 57´´ O, 20 msnm | Vanilla planifolia | Cambisol | 1600 | San Rafael |
| Tuxtla Chico, Chiapas (14° 30´ N, 92° 00´ O, 425 msnm | Theobroma cacao | Luvisol | 4250 | Izapa |
| Coffea arabica | Limón | |||
| Vanilla planifolia | Vainilla |
Se colectaron 500 g de suelo rizosférico en cinco plantas y en ese momento fueron separadas raíces y fijadas en FAA (Megías et al., 2023) y en las mismas se verificó la colonización de acuerdo con Phillips y Hayman (1970). El resto del suelo se mantuvo en laboratorio. En cada muestra de suelo, las esporas similares en color, forma y tamaño fueron separadas mediante tamizado en húmedo y decantación (Gerdemann y Nicolson, 1963) para su multiplicación. Las mismas se propagaron durante 90 días en contenedores de 1 L con sustrato de arena de río estéril, utilizando Sorghum bicolor (L.) Moench como planta hospedante. En general, se encontró que las esporas de los aislamientos pertenecen al género Glomus, con esporas globosas y elípticas de color amarillo, amarillo claro, café amarillento o anaranjado fuerte. Este género se ha citado como dominante en otros lugares de América Latina (Lopes et al., 1983) y en la selva tropical de México (Bertolini et al., 2020).
Características del sustrato
El sustrato se conformó con la mezcla de suelo andosol mólico de la Colonia El Triunfo, Municipio de Escuintla, Chiapas, México, al cual se agregó arena de río lavada (1:1 v/v). El sustrato final presentó las siguientes características fisicoquímicas: arena 80.76 %, limo 13.35 %, arcilla 5.88 %, textura arena migajonosa (Bouyucos), 2.63 % de materia orgánica (Walkley-Black), pH 5.78 (solución acuosa 1:2), N 0.13% (Kjelddhall), P 14.1 mg L-1 (colorimetría), K++ 64.20 mg L-1 (espectrofotometria atómica), Na++ 95.50 mg L-1, Mg++ 53.0 mg L-1, Ca++ 469 mg L-1, 5 Meq/100g de capacidad de intercambio catiónico y 0.05 ds/m de conductividad eléctrica (conductímetro). Con dicho sustrato se llenaron bolsas de plástico negro (25 × 35 cm y 6 L de capacidad) y se colocaron en bancales de fierro para su multiplicación.
Siembra y aplicación de microorganismos
Las semillas de Coffea arabica L. var. Catimor fueron germinadas en charolas separadas con los microrganismos (biofertilizantes) adheridos al 4 % del peso de la semilla, mediante la humectación con carboximetil celulosa (Sigma-Aldrich, Saint Louis Missouri, USA). A los 60 días después de sembradas con desarrollo de hojas cotiledonales fueron trasplantadas a bolsas negras de polietileno de 10 × 20 cm, agregando 2.0 g de cada microrganismo, acorde con los tratamientos en el sitio de trasplante.
Tratamientos, repeticiones y diseño experimental
Los tratamientos fueron los cinco aislamientos más el hongo de referencia R. intraradices y el testigo (sin microrganismos). La evaluación se realizó con cinco repeticiones en un diseño completamente al azar en condiciones de vivero (media sombra, riego a capacidad de campo). Los aislamientos a la cosecha presentaron al menos 100 esporas g-1 en suelo con 93 % de colonización de raíces. El microrganismo R. intraradices (Schenck & Sm.) Walker & Schuessler fue adquirido en el INIFAP-Rosario Izapa, Chiapas, México a una concentración de 40 esporas g-1 de suelo y 95 % de colonización de raíces de Brachiaria brizantha (Hochst. ex. A. Rich.) como planta hospedera. Se realizaron cuatro muestreos destructivos cada 28 días y en total se tuvieron 140 macetas. La unidad experimental fue un contenedor con una planta. Las plantas se regaron con agua extraída de pozo profundo.
Variables evaluadas
Se registraron variables morfológicas (altura de planta y número de hojas) y fisiológicas (peso seco de los componentes aéreo y radical) a los 28, 56, 84 y 112 días después del trasplante (ddt). La biomasa seca de los componentes de rendimiento de la raíz y parte aérea se pesaron en balanza semianalítica (Ohaus Adventurer Pro, Parsippany, New Jersey, EUA) después de secarse en estufa de aire forzado a 75-80 ºC hasta peso constante. El área foliar se registró en cm2 con un integrador de área foliar (LI-COR, LI 3100, Lincoln, Nebraska, EUA). Con las variables anteriores se determinó la tasa relativa de crecimiento (TRC) (Milthorpe y Moorby, 1982) y el área foliar específica (AFE) (Hunt, 1982).
El contenido de P se obtuvo mediante análisis foliar con espectrofotómetro (Olsen, Model 400 ¼, Thermo Fisher Scientific, Waltham, Massachusetts, EUA). El porcentaje de colonización se cuantificó utilizando la técnica de Phillips y Hayman (1970) y el número de esporas, de acuerdo con Gerdemann y Nicolson (1963).
Análisis estadístico
Los resultados se evaluaron mediante el programa SAS versión 8.1 (SAS Institute, 1999-2000) basado en un análisis completamente aleatorizado. Las diferencias entre medias de tratamientos se compararon mediante la prueba de Tukey (P ≤ 0.05) y las gráficas se elaboraron con con Sigma Plot (ver. 11.00).
Resultados y discusion
Componentes morfológicos y fisiológicos
De los componentes morfológicos, la altura de las plantas biofertilizadas con los aislamientos superó al testigo a los 84 y 112 ddt con diferencias estadísticas (P ≤ 0.05). La altura máxima fue de 19.7 cm con el aislamiento Limón el cual registró un incremento de 28 % más que el testigo y 11.6 % con respecto a R. intraradices. Entre aislamientos, la altura promedio fue de 19.0 ± 1.9 cm. (Cuadro 2).
Cuadro 2 Crecimiento de Coffea arabica L. var Catimor biofertilizada con diferentes hongos endomicorrízicos del género Glomus del sureste de México. Promedios por planta.
| Tiempo (días) | Tratamiento | Altura (cm) | Número de hojas | Raíz (g) | Tallo + ramas y peciolo (g) | Lámina foliar (g) | Área foliar (cm2) | % Coloni-zación | % P |
| 28 | Testigo | 7.4 a | 2.0 a | 0.042 a | 0.038 abc | 0.002 d | 1.5 cd | 12.2±1.9 | |
| San Rafael | 8.1 a | 2.0 a | 0.038 a | 0.038 abc | 0.007 b | 2.0 bc | 16.8±1.6 | ||
| Caracoles | 7.4 a | 2.0 a | 0.041 a | 0.044 a | 0.008 b | 2.5 b | 25.4±1.8 | ||
| Limón | 8.5 a | 2.0 a | 0.041 a | 0.036 bc | 0.059 bc | 1.7 cd | 22.4±4.7 | ||
| Vainilla | 8.6 a | 2.0 a | 0.036 a | 0.037 abc | 0.004 cd | 1.2 d | 22.2±3.1 | ||
| Izapa | 7.7 a | 2.0 a | 0.037 a | 0.034 c | 0.013 a | 4.0 a | 14.6±2.7 | ||
| R. intraradices | 7.8 a | 2.0 a | 0.039 a | 0.043 ab | 0.011 a | 4.5 a | 29.6±5.5 | ||
| CV (%) | 8.3 | 8.2 | 10.9 | 9.6 | 16.0 | 13.2 | |||
| 56 | Testigo | 8.0 a | 3.6 a | 0.074 c | 0.048 c | 0.064 c | 19.3 b | 23.8±1.5 | |
| San Rafael | 7.8 a | 4.8 a | 0.077 bc | 0.052 bc | 0.104 b | 26.7 a | 28.2±1.1 | ||
| Caracoles | 9.0 a | 3.6 a | 0.109 a | 0.052 bc | 0.098 b | 25.9 a | 35.0±1.0 | ||
| Limón | 8.3 a | 4.0 a | 0.082 bc | 0.065 a | 0.065 c | 26.6 a | 28.8±1.5 | ||
| Vainilla | 8.4 a | 4.8 a | 0.098 ab | 0.059 ab | 0.076 bc | 22.7 ab | 25.2±0.8 | ||
| Izapa | 7.7 a | 4.0 a | 0.097 ab | 0.060 ab | 0.093 bc | 25.7 a | 25.2±0.8 | ||
| R. intraradices | 8.1 a | 4.4 a | 0.094abc | 0.059 ab | 0.019 a | 27.95 a | 59.4±2.2 | ||
| CV (%) | 7.6 | 19.8 | 12.3 | 8.6 | 14.6 | 11.1 | |||
| 84 | Testigo | 10.3 b | 8.0 a | 0.215 c | 0.095 c | 0.253 e | 62.1 d | 28.4±1.0 | |
| San Rafael | 12.6 a | 8.6 a | 0.467 a | 0.142 ab | 0.405 bc | 92.4 c | 37.0±1.5 | ||
| Caracoles | 12.5 a | 8.0 a | 0.285bc | 0.114 bc | 0.311 de | 71.7 d | 36.0±1.2 | ||
| Limón | 12.8 a | 9.6 a | 0.462 a | 0.155 a | 0.465 b | 112.7 b | 41.4±2.0 | ||
| Vainilla | 13.6 a | 9.2 a | 0.313 b | 0.135 ab | 0.366 cd | 91.4 c | 32.6±1.5 | ||
| Izapa | 13.2 a | 9.6 a | 0.410 a | 0.154 a | 0.571 a | 132.5 a | 40.2±1.4 | ||
| R. intraradices | 12.9 a | 8.8 a | 0.405 a | 0.147 a | 0.383 cd | 91.20 c | 63.6±1.5 | ||
| CV (%) | 6.3 | 11.1 | 10.5 | 10.5 | 9.6 | 8.9 | |||
| 112 | Testigo | 14.1 b | 11.0 b | 0.511 d | 0.224 d | 0.80 d | 179.9 c | 27.6±0.7 | 0.16 b |
| San Rafael | 17.6 a | 12.4 ab | 0.852bc | 0.330 c | 1.43 c | 306.8 b | 34.4±1.1 | 0.19 a | |
| Caracoles | 19.2 a | 13.2 ab | 1.116 a | 0.444 ab | 1.67 abc | 362.2 ab | 39.6±1.6 | 0.18 ab | |
| Limón | 19.7 a | 14.0 a | 1.135 a | 0.469 a | 1.81 ab | 383.7 ab | 41.8±1.0 | 0.19 a | |
| Vainilla | 19.5 a | 13.2 ab | 1.072ab | 0.442 ab | 1.74 abc | 379.8 ab | 42.6±2.1 | 0.18 ab | |
| Izapa | 19.0 a | 12.8 ab | 0.872bc | 0.440 ab | 1.81 a | 390.3 a | 39.6±3.1 | 0.19 a | |
| R. intraradices | 14.7 a | 11.6 ab | 0.823 c | 0.376 bc | 1.436 c | 354.6 ab | 54.6±2.8 | 0.20 a | |
| CV (%) | 8.2 | 9.5 | 12.5 | 11.8 | 11.1 | 11.6 | 4.7 |
Los valores con letra diferente dentro de cada columna y factor son estadísticamente diferentes (P ≤ 0.05). CV: coeficiente de variación.
En otras variedades de C. arabica, como en la variedad Garnica, el incremento en altura ha sido citado por Trejo-Aguilar et al. (2018) al inocular hongos endomicorrízicos recolectados en fincas de café en Veracruz, México y por Vallejos-Torres et al. (2019), así como en la variedad Caturra con diferentes hongos endomicorrízicos nativos recolectados en 12 fincas cafetaleras del Perú.
La emisión inicial de hojas en C. arabica cv Catimor a los 28 y 56 ddt no expresó variación importante, pero se incrementó al final de la evaluación (84 y 112 ddt), mostrando diferencias entre tratamientos (P ≤ 0.05). El aislamiento Limón indujo el mayor número de hojas (n = 14), superando con tres hojas a las plantas testigo y el hongo de referencia R. intraradices, resaltando además que en general, los aislamientos indujeron dos hojas más que el testigo y que R. intraradices. En la especie C. canephora (Pierre) ex Froehner las diferencias más contrastantes en el número de hojas fueron observadas de los 112 a 140 ddt (Ibarra-Puón et al., 2014), y este efecto se considera relacionado con la colonización radical a través del tiempo.
El sistema radical presentó variación en la asignación de materia seca en todos los tratamientos a partir de los 56 ddt al mostrar diferencia entre ellos (P ≤ 0.05). El mayor incremento se observó al final de la evaluación y fue con los aislamientos Caracoles y Limón, que tuvieron 54 % más biomasa radical en comparación con el testigo y 26 % en comparación con R. intraradices. En otros aislamientos de hongos endomicorrízicos inoculados a C. arabica var Caturra, Vallejos-Torres et al. (2019) citaron incremento del sistema radical; en cambio, en C. arabica var Oro Azteca biofertilizada con R. intraradices se presentó menor crecimiento inicial de la raíz y un aumento posterior a los 120 ddt (Aguirre-Medina et al., 2011).
El efecto diferencial en la inducción del crecimiento radical parece estar relacionados con el incremento de los exudados radicales, que favorece el aumento de la microbiota (Altomare y Tringovska, 2011); además, la hifa del hongo es más delgada que las raíces de las plantas y puede penetrar a ciertos espacios donde normalmente no lo hacen los pelos absorbentes (He et al., 2020).
En relación con la biomasa seca del tallo más las ramas y peciolo de hojas, se observaron diferencias (P ≤ 0.05) entre tratamientos desde el primer muestreo. Los valores más altos de asignación de materia seca a esta estructura fueron con el aislamiento Limón a los 56, 84 y 112 ddt. La respuesta anterior sugiere abastecimiento nutrimental e hídrico a las plantas hospedantes (Devi et al., 2021). En C. canephora (Pierre) ex Froehner se presenta la misma respuesta al inocularlas con R. intraradices (Ibarra-Puón et al., 2014).
La asignación de materia seca a la hoja de C. arabica L. presenta diferencias estadísticas entre tratamientos (P ≤ 0.05) a partir del primer muestreo. El aislamiento Izapa indujo mayor incremento en todos los muestreos y fue diferente al resto de los tratamientos (P ≤ 0.05). Este hecho fue concomitante con el área foliar. La mayor acumulación de la biomasa en lámina foliar sugiere el beneficio del establecimiento de la simbiosis (Jacott et al., 2017).
En general, la biofertilización de C. arabica L. cv Catimor con hongos endomicorrízicos aumenta significativamente la asignación de materia seca en las diferentes variables morfológicas y fisiológicas en comparación con el testigo, y de manera diferencial, se expresa más con alguno aislamientos a diferente tiempo. Las variables morfológicas fueron poco modificadas por la interacción con los diferentes aislamientos. Los valores más contrastantes se presentaron en las variables fisiológicas y la respuesta más evidente se expresó a diferente tiempo. Este hecho sugiere compatibilidad entre el hongo y la planta hospedante; sin embargo, se debe considerar que existe contraste funcional (Jäderlund et al., 2008) en la producción de metabolitos especializados en la raíz (Devi et al., 2021), como los flavonoides que favorecen la comunicación con otros microorganismos del suelo (Desmet et al., 2021; Singh et al., 2017), y que en algunos casos esto puede influir en la germinación de esporas, crecimiento de hifas y colonización de raíces (Larose et al., 2002).
La menor inducción del crecimiento con algunos aislamientos se puede atribuir a su origen geográfico, debido a las diferencias particulares del ambiente y suelo donde fueron recolectados, como lo citan Hart y Reader (2002); sin embargo, la simbiosis es recíproca y ventajosa con la mayoría de las plantas terrestres y su asociación no es tan específica con la especie (Devi et al., 2021).
Tasa relativa de crecimiento
El efecto en la tasa relativa de crecimiento sugiere cierta compatibilidad entre los aislamientos con la var Catimor (Figura 1); es decir, los aislamientos promueven mayor crecimiento en comparación con el testigo; sin embargo, en ambos casos se presenta una etapa de crecimiento seguida por otra de disminución; es decir, que los estratos de la planta se desarrollaron con una fase de crecimiento exponencial, seguida por un período en que la tasa de ganancia de biomasa en el tiempo declina (Collado-Vides, 1997). La variación en los resultados puede estar asociada con factores intrínsecos del hongo endomicorrízico o con su capacidad de colonización para inducir mayor desarrollo vegetal en la planta hospedante mediante el incremento en la tasa fotosintética (França et al., 2016).
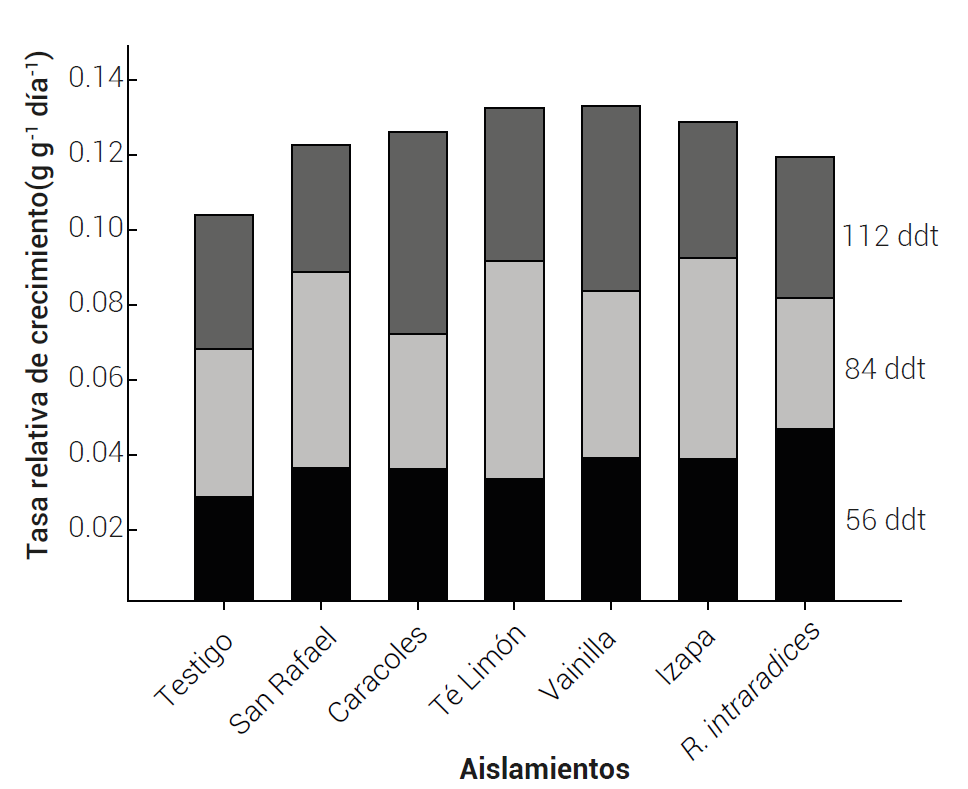
Figura 1 Tasa relativa de crecimiento de Coffea arabica L. cv Catimor biofertilizada con hongos endomicorrízicos (Glomus spp.) aislados de diferente origen geográfico en vivero. Los valores son promedios de cinco repeticiones.
Área foliar específica (AFE)
El AFE inducida por los aislamientos presentó incremento en el primer periodo de muestreo, seguido por otro de disminución de la AFE (Figura 2); después de esta etapa, el AFE se mantuvo de forma general sin cambios en los siguientes muestreos. La diferencia inicial en el aumento o disminución del tejido asimilatorio se atribuye al transporte de nutrientes por los hongos endomicorrízicos (Tajini y Drevon, 2012), resaltando que las plantas testigo no mostraron cambios contrastantes.
Colonización micorrízica
La colonización se observó en todas las plantas de Coffea arabica cv Catimor evaluadas, incluyendo el testigo (posible cepa nativa), y fue mayor en las plantas biofertilizadas en comparación con las plantas sin biofertilizar. Lo anterior confirma la presencia de hongos endomicorrízios en el sustrato regional utilizado; sin embargo, presentan menor capacidad de colonización e inducción del crecimiento, aun cuando Coffea ha sido considerada con alta dependencia micorrízica (Andrade et al., 2009). Entre los aislamientos, el porcentaje promedio de colonización fue de 33.1 % y con R. intraradices 51.8 .
Algunos de los microrganismos aislados como Caracoles, así como R. intraradices aumentaron la colonización durante las etapas iniciales de la evaluación; es decir, a los 28 y 56 ddt, y en los muestreos siguiente la colonización disminuyó en comparación con los otros aislamientos. En el muestreo a los 84 ddt la colonización mostró aumento en los aislamientos San Rafael, Limón e Izapa y, en estos últimos dos, la colonización se mantuvo hasta los 112 ddt. La colonización expresa también una etapa de incremento seguida de un periodo de descanso. Lo anterior puede relacionarse con la suplementación de fuentes de carbono de la planta hospedante hacia el hongo (Adolfsson et al., 2015). La alta capacidad de colonización de R. intraradices se ha citado en otros cultivos, anuales y perennes Aguirre, 2006; (Wright et al., 2005). En general, los resultados mostraron que el incremento en las variables fisiológicas coincide con el aumento de los niveles de colonización; sin embargo, la correlación no es alta entre ambas variables (França et al., 2016).
Contenido de fósforo
El contenido de fósforo aumentó con todos los hongos endomicorrízicos aplicados a C. arabica L. cv Catimor y fueron superiores al control (P ≤ 0.05). La mayor concentración en tejido vegetal fue con los aislamientos San Rafael, Limón, Izapa y R. intraradices. La preferencia de los hongos endomicorrízicos por transportar fósforo ha sido citada por Lebrón et al. (2012), y se debe a la aceleración de la disociación del fosfato insoluble por las raíces colonizadas, resaltando que las plantas se favorecen con la absorción y transporte de P, Zn, Ca, S, Cu y Mg, y sus efectos son más notorios en suelos de baja fertilidad (Zhu et al., 2008).
Conclusiones
La biofertilización de Coffea arabica L. var. Catimor con los diferentes hongos endomicorrízicos induce mayor crecimiento vegetal. El aumento en las variables morfológicas altura de planta y número de hojas se expresan al final del periodo de evaluación, pero en el caso de las fisiológicas, el aumento se expresa desde el inicio. La dimensión del aumento dependió del microorganismo aplicado. El contenido de fósforo se incrementó con la biofertilización de todos los hongos endomicorrízicos











 nueva página del texto (beta)
nueva página del texto (beta)



