Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista internacional de contaminación ambiental
versión impresa ISSN 0188-4999
Rev. Int. Contam. Ambient vol.25 no.3 Ciudad de México ago. 2009
Comparación de cuatro tratamientos fisicoquímicos de lixiviados
Comparison of four physicochemical treatments for leachate treatment
Roger Iván MÉNDEZ NOVELO1, Elba René CASTILLO BORGES1, María Rosa SAURI RIANCHO1, Carlos Alberto QUINTAL FRANCO1, Germán GIÁCOMAN VALLEJOS1 y Blanca JIMÉNEZ CISNEROS2
1 Universidad Autónoma de Yucatán. Facultad de Ingeniería. Av. Industrias No Contaminantes por Periférico Norte, s/n. Tablaje Catastral 12685. Mérida, Yucatán, México. Correo electrónico: mnovelo@uady.mx
2 Universidad Nacional Autónoma de México. Instituto de Ingeniería. Subdirección de Ingeniería Ambiental e Hidráulica. Apdo. Postal 70472. Coyoacán, 04510. México, D.F. Correo electrónico: BJimenezC@iingen.unam.mx
Recibido octubre 2007
Aceptado enero 2009
RESUMEN
Se presentan los resultados de cuatro tratamientos fisicoquímicos aplicados a los lixiviados del relleno sanitario de la ciudad de Mérida: coagulación–floculación, flotación, adsorción y oxidación Fenton. Los procesos coagulación–floculación y flotación consisten en la remoción de partículas suspendidas mediante la adición de sustancias químicas (coagulantes). Ambos resultaron poco eficientes dado que los lixiviados estudiados poseen bajas concentraciones de sólidos suspendidos. No se encontraron en la literatura experiencias exitosas de estos tratamientos y, en concordancia, se comprobó que los lixiviados de los rellenos sanitarios poseen bajas concentraciones de sólidos suspendidos, lo cual explica la baja eficiencia de remoción. La mayor parte de las partículas suspendidas de los lixiviados estudiados tenían tamaños en el rango de 0 a 75 µm, con una media de 23 µm, los cuales corresponden a partículas coloidales que dan color al lixiviado. La remoción de este tipo de partículas se realiza a valores bajos de pH. Por este motivo, las mejores remociones fueron de 40 % a valores de pH < 2 para el proceso coagulación–floculación y de 37 % a pH 2 para la flotación. Con el proceso de adsorción se pueden eliminar sólidos suspendidos y disueltos, por lo que se pueden obtener mejores remociones que con los procesos de coagulación–floculación y flotación, en los que sólo se remueven sólidos suspendidos. No obstante, resulta un proceso costoso debido a la necesidad de regenerar el carbón activado. En la prueba de adsorción, las eficiencias de remoción de la demanda química de oxígeno (DQO) se redujeron de 60 a 30 % durante las primeras 80 horas cuando el tiempo de retención fue de ocho horas, y durante las primeras 60 horas cuando el tiempo de retención fue de cuatro horas. En el proceso de oxidación, la carga contaminante se trata con una combinación de peróxido de hidrógeno y sulfato ferroso (reactivo Fenton), típicamente a presión atmosférica y temperatura entre 20 y 40 °C. Las condiciones óptimas del reactivo Fenton se obtienen a valores ácidos de pH y con ellas se pueden alcanzar altas remociones de los contaminantes orgánicos. Las condiciones y dosis óptimas del proceso de oxidación fueron: tiempo de contacto 20 minutos, pH 4, concentraciones de H2O2 de 600 mg/L y Fe2+ de 1000 mg/L. Las mejores remociones alcanzadas fueron de 78 % para la DQO y 87 % para el carbón orgánico total (COT), por lo que resultó el tratamiento más eficiente entre los probados en el estudio.
Palabras clave: fenton, adsorción, flotación, coagulación–floculación, tratamiento de lixiviados, tamaño de partícula, disposición de desechos sólidos municipales.
ABSTRACT
Results from four physicochemical treatments applied to the leachate of a sanitary landfill of Mérida, México, are presented: coagulation–flocculation, flotation, adsorption and Fenton oxidation. Coagulation–flocculation and flotation processes consist on the removal of suspended particles by means of the addition of chemical substances (coagulants). Both processes were not efficient since the leachates treated had low suspended solids content. No successful applications of these treatments were found in literature since leachates from other landfills also have low suspended solids content, which explains the low efficiency of these treatments. In the leachates studied, most sizes of the suspended particles ranged from 0 to 75 µm, with an average of 23 µm, which correspond to color producing colloidal particles. Removal of these particles is carried out at low pH. For this reason, the best results obtained were 40 % at pH < 2 for the coagulation–flocculation process, and 37 % at pH 2 for the flotation process. Adsorption process can eliminate both suspended and dissolved solids; therefore, better removal rates can be obtained with adsorption than with coagulation–flocculation and flotation processes. Nevertheless, adsorption is expensive due to the regeneration of activated carbon. In the adsorption trial, chemical oxygen demand (COD) removal efficiency decreased from 60 to 30 % during the first 80 hours when retention time was 8 hours, and during the first 60 hours when retention time was 4 hours. In the oxidation process the contaminants are treated with a combination of hydrogen peroxide and ferrous sulfate (Fenton's reagent), typically at atmospheric pressure and at temperature ranging between 20 to 40 °C. Optimal conditions for Fenton's reagent are obtained at acid pH and high removals of organic pollutants can be obtained. Optimal conditions and doses for the oxidation process were: contact time 20 minutes, pH 4, H2O2 concentration of 600 mg/L and Fe2+ concentration of 1000 mg/L. Best removals reached were 78 % for COD and 87 % for total organic carbon (TOC), therefore, Fenton's oxidation process was the most efficient among all the processes tested in this study.
Key words: fenton, adsorption, flotation, coagulation–flocculation, leachate treatment, particle size, landfill, municipal solid waste disposal.
INTRODUCCIÓN
Los lixiviados son el resultado de la percolación de líquidos a través de los desechos en proceso de estabilización; es decir, líquidos que brotan a la superficie o se infiltran hacia el terreno donde se encuentra instalado un relleno sanitario o un vertedero de basura. Una de sus principales fuentes es el agua de lluvia depositada sobre el área de influencia, o el agua de composición y de la humedad de los desechos que drenan y percolan a través de los intersticios y capas de basura, proporcionando a su paso toda suerte de reacciones y procesos fisicoquímicos y biológicos. El color del lixiviado varía entre 3000 y 15,000 unidades de color (UC), en tonos que van del café–pardo–grisáceo cuando están frescos, hasta un color negro–viscoso cuando envejecen. Sus olores altamente fétidos y sus características fisicoquímicas, fuertemente variables en cantidad y calidad, hacen que el lixiviado se clasifique como uno de los desechos más contaminantes y que mayor repugnancia genera sobre la comunidad involucrada y el personal técnico que lo debe manipular.
Desde el punto de vista de calidad, los lixiviados presentan altas cargas de DQO y COT; es decir, cantidades considerables de materia orgánica y sustancias inorgánicas que tienen gran variabilidad. Entre dichas sustancias se encuentran metales pesados (con su potencial efecto sobre el ecosistema acuático), alto contenido de sólidos totales y disueltos, presencia de nitrógeno en su forma amoniacal, alta concentración de cloruros, compuestos orgánicos diversos, así como gran variabilidad de pH. Lo anterior depende de la naturaleza de los desechos (pH, edad, temperatura) y de la fase de estabilización en que se encuentre (Borzacconi et al. 1996a, El–Fadel et al. 2002).
Los lixiviados eventualmente pueden ser removidos del relleno sanitario para tratarlos por métodos fisicoquímicos y biológicos y así evitar la contaminación de acuíferos y de las aguas superficiales. Para analizar e interpretar los resultados de eficiencia de cada proceso de tratamiento de lixiviados, se requiere un conocimiento básico de los mecanismos involucrados en la remoción de fracciones de compuestos orgánicos específicos y metales.
Las opciones de tratamiento incluyen la reutilización de los lixiviados para mantener el contenido de humedad de los rellenos, el tratamiento en el sitio (aerobio, anaerobio o fisicoquímico), la descarga a plantas de tratamiento municipales, o una combinación de las anteriores.
Varios investigadores han estudiado el tratamiento de lixiviados de relleno sanitario, obteniendo resultados promisorios mediante diferentes procesos de tratamiento. Estos resultados indican que las eficiencias de remoción de contaminantes obtenidas en un lixiviado dado están influenciadas por la composición química, la cual a su vez está relacionada con las características y grado de estabilización de la basura o la edad del relleno sanitario (Borzacconi et al. 1996b, Enzminger et al. 1997).
Determinar el tratamiento más adecuado para un lixiviado de relleno sanitario es complicado, ya que se trata de residuos líquidos con alto contenido de sustancias, tanto orgánicas como inorgánicas. Se han realizado vastas investigaciones en busca de tratamientos adecuados para los lixiviados; sin embargo, debido a la heterogeneidad en su composición y a la variabilidad de los volúmenes generados, no se pueden extrapolar directamente los resultados obtenidos con tratamientos de un lixiviado a otro. Por lo tanto, cada lixiviado proveniente de un relleno sanitario debe ser evaluado individualmente y sometido a pruebas de tratabilidad para encontrar el sistema de tratamiento adecuado para su manejo.
Algunos de los procesos que se aplican al tratamiento de lixiviados son los fisicoquímicos. Existen en la bibliografía numerosas referencias de tratamientos fisicoquímicos de lixiviados que presentan los inconvenientes del costo de reactivos químicos y generación de lodos de difícil disposición (Hee Chan et al. 2001, Rivas et al. 2004, Kurniawan et al. 2006, Marañón et al. 2008). Los lixiviados a los cuales se les aplica este tipo de tratamiento son en general viejos, en los cuales el índice de biodegradabilidad (DBO5/DQO) es bajo; por lo tanto, los tratamientos biológicos, ya sean aerobios o anaerobios, serían poco eficientes.
Los procesos de coagulación–floculación y flotación tienen como objetivo eliminar las partículas suspendidas de la fase líquida; a valores bajos de pH remueven las partículas de tamaño pequeño que le confieren color al lixiviado. Los procesos de adsorción y de oxidación Fenton intensiva pueden remover tanto partículas suspendidas como disueltas.
En el presente trabajo se comparan cuatro tratamientos fisicoquímicos aplicados a los lixiviados de la ciudad de Mérida: coagulación–floculación, flotación, adsorción y oxidación Fenton.
MATERIALES Y MÉTODOS
Caracterización de los lixiviados
Se realizaron diecisiete muestreos de los lixiviados entre los meses de mayo 2002 y febrero 2003; se determinaron los siguientes parámetros: pH, DQO (total y soluble), demanda bioquímica de oxígeno (DBO5), COT, nitrógeno amonioacal (N–NH3), nitrógeno Kjeldhal total (NKT), nitrógeno orgánico (N–org), Ptotal, turbiedad, dureza total, alcalinidad, Cl–, sulfuros, sustancias activas al azul de metileno (SAAM), grasas y aceites, redox, sólidos totales (ST), sólidos totales volátiles (STV), sólidos suspendidos totales (SST), sólidos suspendidos volátiles (SSV), Ni, Ag, Fe, Mn, Zn, Na, K, Cd, Pb, Cr y Cu (APHA 1998). Las muestras se colectaron de las lagunas de evaporación del relleno sanitario de Mérida, en las cuales se almacenan los lixiviados de las diferentes celdas del relleno sanitario, por lo que se mezclan lixiviados de diferentes edades.
Determinación de dosis óptima de coagulantes para el proceso de coagulación–floculación
Se realizaron ensayos de jarras con los que se probaron cuatro coagulantes metálicos: policloruro de aluminio a 1 % (PAX–XL–605), sulfato de aluminio a 1 %, cloruro férrico a 1 %, sulfato férrico a 1 % (FERIX–3) y dos polielectrolitos de alta densidad (Optifloc C–1288 a 0.4 % y Optifloc C–1781 a 0.4 %). Para cada combinación de coagulantes se realizaron ensayos de jarras con dosis de 50 a 300 mg/L (50, 100, 150, 200, 250 y 300 mg/L) para los coagulantes metálicos y de 2 a 12 mg/L (2, 4, 6, 8, 10 y 12 mg/L) para los polielectrolitos. Cada ensayo consistió en la realización de tres procesos consecutivos: coagulación mediante una mezcla rápida producida por la agitación a 300 rpm (G = 320 s–1) durante un minuto; floculación con la agitación a 60 rpm (G = 66 s–1) durante 20 minutos y la sedimentación durante 20 minutos (Méndez et al. 2005). Los resultados se analizaron mediante un modelo multifactorial en el que los factores fueron los tipos de coagulantes (metálicos y polielectrolitos) y las dosis de los coagulantes; la variable de respuesta fue la remoción (%) de la DQO.
Determinación de la distribución de partículas
La determinación de la distribución del tamaño de las partículas suspendidas del lixiviado se realizó utilizando un equipo Coulter modelo LS100Q en el que se midieron nueve muestras de lixiviado. El equipo Coulter utiliza el método de dispersión de luz y tiene un rango de detección de 0.4 a 1000 µm.
Ensayos de flotación
Se realizaron ensayos de flotación por aire disuelto (FSD) probando tres presiones diferentes (3, 4 y 5 kg/cm2), con una dosis de coagulante de 300 mg/L de cloruro férrico y tres valores de pH ácido (1, 2 y 3) y tres alcalinos (10, 11 y 12). Estos ensayos se realizaron por triplicado. Cada ensayo consistió en la realización de dos procesos consecutivos: coagulación mediante una mezcla rápida producida por la agitación a 300 rpm (G = 320 s–1) durante un minuto y flotación por aire disuelto (Méndez et al. 2008).
Ensayos de adsorción
Se determinó la isoterma de adsorción que mejor se ajustaba a los lixiviados, probando las de Langmuir, Freundlich y BET. Para este efecto, se realizaron pruebas de acuerdo con la metodología propuesta por Benefield et al. (1982), usando carbón activado granular de la marca comercial Merck, el cual tiene las siguiente características: tamaño aproximado de grano 1.24 mm, residuos de calcinación < 5 %, densidad aparente 40 g/100 mL, densidad real 1.53 g/cm3.
Se construyeron dos columnas de adsorción de 69 cm de altura y 2.5 L de capacidad, que se operaron en paralelo con flujo ascendente. El efluente se monitoreó desde su primera salida y luego cada hora, durante las primeras cinco horas. Debido a la poca variación de la calidad del efluente, se amplió el rango de monitoreo a cuatro horas y finalmente llegó a ser de ocho horas. Se determinó la DQO soluble del efluente de acuerdo con el método de reflujo cerrado referido en Standard Methods (APHA 1998) con una modificación: se utilizaron tubos con reactivos preparados por la compañía HACH, en lugar de preparar los reactivos como lo dicta la técnica. Se probaron dos gastos, 3 y 6 mL/min, a los que correspondieron 8 y 4 horas de tiempo de retención, respectivamente.
Oxidación Fenton
Se determinaron el tiempo, dosis y pH óptimos del proceso, así como la dosis óptima de coagulante para un proceso coagulación–floculación posterior al de oxidación.
Para obtener el tiempo óptimo de reacción se probaron dosis de peróxido de hidrógeno (H2O2 a 30 % w/w, grado reactivo) de 200 y 800 mg/L y de hierro (Fe+2, a partir de Fe2SO4•7H2O grado analítico de Baker) de 250 y 1000 mg/L, respectivamente. Se utilizaron equipos para pruebas de jarras marca Phillips & Bird. Para este efecto, se ajustó el valor de pH del lixiviado a 3, usando H2SO4 concentrado (97 % w/w). Se realizaron ensayos por duplicado en los que se mezclaron los reactivos durante un minuto a 100 rpm y posteriormente se redujo la velocidad de agitación a 30 rpm. Se tomaron muestras de la mezcla cada 20 minutos durante 2 horas y se determinó la concentración de DQO soluble.
Para estimar el valor óptimo de pH y las dosis óptimas para la oxidación, se probaron cuatro dosis del reactivo Fenton, peróxido de oxígeno (200, 400, 600, 800 mg de H2O2/L) y hierro (250, 500, 750, 1000 mg Fe+2/L) como oxidantes del lixiviado, tres valores de pH (2, 3 y 4) y dos repeticiones, haciendo un total de 96 ensayos en pruebas de jarras.
Cada ensayo se realizó de la siguiente manera: se agitó la mezcla correspondiente (con los reactivos) a 100 rpm durante un minuto; posteriormente se redujo a 30 rpm, durante el tiempo que resultó óptimo. A continuación, se tomó una muestra para determinar las concentraciones de DQO y COT solubles.
Para determinar la dosis óptima de coagulación–floculación, se realizaron ensayos de pruebas de jarras al lixiviado sometido al proceso de oxidación avanzada con los valores óptimos de pH y reactivo Fenton. Los resultados fueron evaluados con base en la remoción de materia orgánica medida como DQO soluble. Se probaron tres dosis de coagulante de cloruro férrico (400, 600 y 800 mg de FeCl3/L), evaluadas por duplicado.
RESULTADOS Y DISCUSIÓN
Caracterización
En el cuadro I, se presentan los resultados de la caracterización de los lixiviados.
Debido a la forma de operación del relleno sanitario, en las lagunas de evaporación se mezclan lixiviados de diferentes edades, lo que propicia una gran variabilidad de cada uno de los parámetros presentados y que posean una mezcla de las características de lixiviados producidos durante la fermentación ácida y la fase metanogénica.
El material de cubierta –un tipo de suelo regional denominado sahcab– es de naturaleza caliza y de estructura frágil, por lo que al ser sometido a la compactación durante la etapa de construcción del relleno, se comprime. Lo anterior reduce su porosidad y produce un doble efecto: actúa como filtro reteniendo las partículas de mayor tamaño y propicia una disolución de sus carbonatos.
Puede observarse que la mayor parte de los sólidos se encuentran en forma disuelta: sólo 0.76 % de los sólidos totales están en suspensión, lo que anticipa bajas remociones en el proceso fisicoquímico coagulación–floculación, basado en la remoción de material suspendido. Slomczynska y Slomczynski (2004) reportan porcentajes mayores de sólidos suspendidos respecto a los sólidos totales en lixiviados de seis rellenos sanitarios polacos: 4.73, 14.54,11.20, 6.96, 11.15 y 34.14 %. Este resultado indica que el material de cubierta del relleno sanitario de la ciudad de Mérida (sahcab) retiene mayor cantidad de sólidos suspendidos y, en consecuencia, el proceso coagulación–floculación será poco eficiente.
Concordante con el anterior resultado, puede observarse que la mayor parte de la materia orgánica se encuentra en forma disuelta, medida como DQO soluble (91.56 %). Este valor es similar a los reportados por González et al. (2001) en lixiviados de los rellenos sanitarios en Veracruz y el Distrito Federal, México.
El pH es relativamente alto comparado con otros lixiviados, lo cual se relaciona con la interacción sahcab–lixiviado. Slomczynska y Slomczynski (2004) reportan valores de pH de entre 5.4 y 7 en seis rellenos polacos y dos estadounidenses. La elevada alcalinidad puede deberse fundamentalmente al tipo de material de cubierta que le otorga al lixiviado carbonatos y bicarbonatos de calcio y magnesio. La concentración relativamente alta de nitrógeno amoniacal, sumada a la alcalinidad, le otorga una gran capacidad amortiguadora al lixiviado. Los elevados valores de sodio y potasio, así como la dureza, también se relacionan con la disolución del material de cubierta usado.
Los metales se encuentran en concentraciones importantes, comparados por las reportadas por Jensen y Christensen (1999): el cromo reportado por estos autores fue de 0.064 mg/L como promedio de cuatro muestras de lixiviado, mientras que en el relleno de la ciudad de Mérida se encontraron concentraciones promedio de 6.98 mg/L. La presencia de metales en el lixiviado indica que, durante la fase acidogénica, los valores bajos de pH los solubilizan; al pasar por una capa de material de cubierta, el pH aumenta nuevamente, pero no a valores que precipiten los metales. Esto explica que al mismo tiempo se tengan elevadas concentraciones de metales pesados y de pH.
Coagulación–floculación
Los resultados de los 864 ensayos de la prueba de jarras para la remoción de DQO se muestran en la figura 1. Las eficiencias de remoción de DQO soluble resultaron bajas: de 0 a 47 %, con valor medio de 4 %. Estos valores bajos de remoción de materia orgánica se deben a las características particulares del lixiviado tratado (baja concentración de sólidos suspendidos), por lo que ni aún por acción de barrido (con dosis de 300 mg/L) se obtuvieron buenas eficiencias de remoción de DQO.

Tatsi et al. (2003) obtuvieron remociones de 25 a 38 % de DQO total en lixiviados con dosis de sulfato de aluminio de 3000 mg/L. Con relación a los SST, las mejores eficiencias de remoción que se obtuvieron fueron de 80 %, pero no encontraron relación con el tipo de coagulante ni con la dosis aplicada. Obtuvieron altas remociones de color (97 %) a pH 10 y dosis de 2000 mg/L de cloruro férrico.
En la caracterización de los lixiviados reportados por Tatsi et al. (2003), se pone de manifiesto que poseen mayores concentraciones de SST/ST que los encontrados en el relleno sanitario de Mérida: 4 % contra 0.57 % respectivamente, lo que puede asociarse a las mayores remociones de materia orgánica obtenidas.
No obstante la baja remoción de materia orgánica, se examinaron los resultados mediante un análisis de varianza del modelo multifactorial, donde los factores fueron: tipo de coagulante, dosis de coagulante, tipo de polielectrolito y dosis de polielectrolito; la variable de respuesta fue la remoción de DQO soluble. El resultado fue que únicamente la dosis de coagulante es significativa en la remoción de la DQO.
El rango de tamaños de partículas contenidas en los lixiviados fue de 0.375 a 948.2 µm, con valor medio de 22.97 µm. El mayor número de partículas estuvo en el rango de 0.4 a 75 µm (Fig. 2). Puede observarse que el porcentaje de partículas de tamaño < 10 µm es bajo, aproximadamente 10 %, por lo que la remoción de color esperada del proceso fisicoquímico a pH bajo también será baja.

El tamaño de las partículas coloidales medidas en este trabajo es semejante a lo reportado por Jensen y Christensen (1998), es decir, las mayores concentraciones se encuentran entre 0.001 y 40 µm. Marttinen et al. (2003) indican que de 71 a 84 % de las partículas se encuentran en el rango de 0.1 a 41 µm, lo cual también concuerda con los valores obtenidos en este trabajo. En ambos artículos se indica que la determinación del tamaño de las partículas se realizó utilizando un filtrado secuencial de los lixiviados, en contraste con la determinación por medio del equipo Coulter, el cual permite obtener la distribución de tamaños con mayor precisión.
Flotación
En el cuadro II se presentan los porcentajes de remoción para DQO, SST y ST para pH bajos (1, 2 y 3) y altos (10, 11 y 12). Las mejores remociones obtenidas fueron: para la materia orgánica medida como DQO, 37 % a pH 2 y presión de 5 kg/cm2; para SST, 39 % a pH 1 y presión de 3 kg/cm2; para ST, 30 % a pH 1 y presión de 3 kg/cm2. En general se observan mejores remociones a valores bajos de pH, lo que concuerda con la hipótesis de que se remueven partículas coloidales de tamaño pequeño.

Se realizaron análisis de varianza para determinar la influencia de la presión y el pH (valores altos o bajos) en la remoción de materia orgánica medida como DQO, SST y ST (Cuadro III). Los resultados indican que ambas variables son significativas, excepto el pH para ST a valores de pH bajos (1, 2 y 3).

Adsorción
Ninguna de las isotermas de adsorción se ajustó a los datos experimentales (los coeficientes de correlación para las isotermas de Langmuir, Freundlich y BET fueron 0.39, 0.49 y 0.23, respectivamente), lo que indica que los modelos ensayados no son compatibles con el tipo de adsorción de los lixiviados. Esto se puede explicar porque los modelos utilizados se elaboraron considerando la remoción de una sola sustancia y no una mezcla de sustancias, como es el caso de los lixiviados.
En las figuras 3 y 5 se presentan los porcentajes de remoción de materia orgánica; en las figuras 4 y 6 las gráficas de las curvas de avances, obtenidas para los dos gastos utilizados. Puede observarse que al inicio del experimento se tienen elevadas remociones de DQO (60 – 70 %), pero conforme avanza el proceso, la DQO del efluente incrementa lentamente, por lo que la eficiencia decae de 50 a 20 % en el caso del gasto de 6 mL/min y de 50 a 30 % en el caso del gasto de 3 mL/min.




Las curvas de avance (Figs. 3 y 5) empleando diferentes gastos, el doble una de otra, se comportan de manera muy parecida (se obtienen porcentajes semejantes de remoción de DQO), con la diferencia de que en la columna de mayor gasto (Fig. 5) el proceso es más rápido. Esto podría deberse a que al tener menor gasto se tiene mayor tiempo de contacto del lixiviado con el carbón, dando lugar a que se establezca un equilibrio más rápido y se realice la adsorción de sustancias que en caso contrario no podrían haber sido retenidas. Este comportamiento se observa al comienzo del proceso (Fig. 5), en el que el incremento de la fracción remanente de DQO durante las primeras 100 horas es pronunciado, mientras que en la figura 3 se observa que el crecimiento de la fracción remanente se presenta en las primeras 80 horas. En el primer caso el incremento va de 45 a 80 %, mientras que en segundo caso el incremento va de 35 a 65 %. En ambos casos, después de este incremento pronunciado de la fracción remanente, el incremento se suaviza durante un período largo.
Morawe et al. (1995), trabajando con lixiviados tratados con un proceso biológico, obtuvieron curvas de avance semejantes en columnas de carbón activado con cuatro horas de tiempo de retención, en las que inicialmente obtuvieron buenas remociones de DQO y posteriormente éstas decayeron. Se puede observar que la zona de adsorción es toda la columna, lo que indica que el tiempo de contacto (4 u 8 horas) es inferior al tiempo óptimo para lixiviados. En pruebas adicionales, se verificó que a mayor tiempo de contacto (lixiviado – carbón activado) se tenían mayores remociones de DQO, hasta alcanzar tiempos de contacto de 24 horas. En consecuencia, a tiempos mayores de 24 no se obtenían mejores eficiencias de remoción.
La eficiencia del sistema disminuye de manera progresiva en el proceso; los solutos tienen disponible cierta área para poder ser adsorbidos y conforme éstos se acomodan a lo largo de la columna, van colmatando los poros y dan lugar a que se presente otro tipo de adsorción.
Las eficiencias de remoción de DQO se redujeron de 60 a 30 % durante las primeras 80 horas cuando el tiempo de retención fue de 8 horas (Fig. 3) y durante las primeras 60 horas cuando el tiempo de retención fue de 4 horas (Fig. 5). Si se toma en cuenta que la DQO del afluente era de 6089 mg/L, los efluentes del proceso de adsorción son todavía muy contaminantes, por lo que se requeriría de otro tratamiento (ya sea previo o posterior) para poder disponer de ellos.
Oxidación Fenton
En la figura 7 se graficaron las eficiencias de remoción de DQO en función del tiempo de contacto. El mejor tiempo es a los 20 minutos (de entre los probados); no obstante, es recomendable determinar con mayor precisión este parámetro, que influye en forma determinante en el costo del tratamiento.
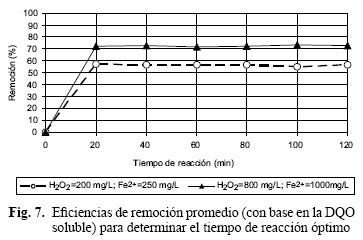
Hee–Chan et al. (2001) llegaron a resultados semejantes trabajando el proceso Fenton en lixiviados. Obtuvieron las eficiencias de remoción que se hacen asintóticas a partir de 20 minutos; sin embrago, otros investigadores han obtenido tiempos de reacción óptimos diferentes como se presentan en el cuadro IV.
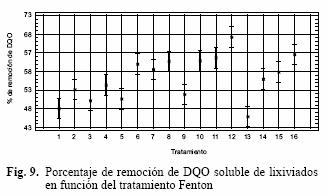
En el cuadro V se presentan los resultados del porcentaje de remoción de la DQO soluble; con éstos se realizó un análisis de varianza y se determinó que el pH y los tratamientos ensayados fueron significativos para la eficiencia de remoción (Figs. 8 y 9). La máxima remoción de DQO alcanzada fue de 72 % a pH 4 y con el tratamiento 12, que corresponde a un reactivo Fenton con 600 mg/L de H2O2 y 1000 mg/L de Fe2+.


Con el proceso de coagulación–floculación posterior al Fenton se pretende eliminar los microfóculos formados. En la figura 10 se muestra que no existe diferencia significativa de la remoción de DQO entre las dosis probadas, y que las mayores remociones obtenidas fueron de 80 %. Rivas et al. (2004) reportaron un incremento de 80 a 90 % en la remoción de la DQO en lixiviados con el proceso coagulación–floculación posterior al Fenton, usando 558 mg/L de Fe+3 como coagulante.

Como se mencionó, en el cuadro IV se presenta un concentrado de resultados del proceso Fenton a lixiviados. Se comparan las remociones con base en la DQO, COT, DBO5 y la variación del índice de biodegradabilidad (DBO5/DQO).
Existe una amplia variación de los tiempos de contacto, valores óptimos de pH y dosis de reactivos Fenton. Los tiempos de contacto varían de 5 a 120 minutos; el pH va de 2.5 a 6 y las dosis de reactivo Fenton de 200 mg/L a 34,000 mg/L de H2O2 y de 275 a 2792 mg/L de Fe2+. La relación entre el agente reactivo y el catalizador [H2O2]/[Fe2+] del reactivo Fenton varía de 0.67 a 60.93.
No obstante que el Fe2+ actúa sólo como catalizador, la relación [H2O2]/[DQO] varía de 0.07 (correspondiente al lixiviado de la ciudad de Mérida) a 4.20 (Rivas et al. 2004). Estas variabilidades del proceso Fenton indican que se requiere de más investigación para determinar las concentraciones óptimas del reactivo Fenton en lixiviados.
Comparación de tratamientos
Como resultado del análisis de caracterizaciones de lixiviados de diferentes rellenos sanitarios, se concluyó que poseen bajas concentraciones de sólidos suspendidos. La mayoría de las caracterizaciones de lixiviados incluyen ST, pero no las fracciones soluble y suspendida de ellos. De entre quienes realizan esta diferenciación, se observó que la fracción de SST se encontraba entre 0.5 y 34 %, correspondiendo el menor porcentaje al de la ciudad de Mérida.
Por otro lado, los tratamientos coagulación–floculación y flotación se basan en la remoción de partículas suspendidas, por lo que la eficiencia esperada en estos tratamientos es baja, incluso en aquellos lixiviados con 34 % de SST. Levine et al. (1991) llegaron a conclusiones similares, en lo referente a tratamientos fisicoquímicos, al estudiar la relación entre la distribución de los tamaños de las partículas contaminantes con la tratabilidad de aguas residuales.
No obstante, se reportan en la literatura algunas experiencias de altas remociones de materia orgánica en lixiviados con procesos coagulación–floculación cuando utilizan dosis elevadas de coagulante. Dae–Hee et al. (2002) obtuvieron remociones de 83 % en DQO usando dosis de 4000 mg/L de coagulante; Duran et al. (2002), usando dosis de 800 mg/L de sulfato férrico y 600 mg/L de sulfato de aluminio, removieron 78 % de la materia orgánica medida como DQO. Las altas dosis de coagulantes favorecen la eliminación de sólidos suspendidos por acción de barrido; sin embargo, no se requieren dosis tan elevadas. En aguas residuales domésticas se obtienen dosis óptimas de coagulantes a valores de 20 a 40 mg/L y en potabilización, cuando se tienen bajas turbiedades en el afluente, se requieren dosis de 80 a 100 mg/L para obtener buenas remociones de turbiedad por acción de barrido. Por lo tanto, el requerir dosis tan elevadas de coagulantes metálicos podría deberse al hecho de que el coagulante reaccione con la alcalinidad y posteriormente reduzca el pH, con lo que alcanzan a removerse partículas coloidales de tamaño pequeño que le confieren color al lixiviado (sustancias húmicas) y por ende, mejorar la remoción.
Las mejores remociones obtenidas en el presente estudio con los procesos flotación y coagulación–floculación se obtuvieron a valores bajos de pH: 37 % de remoción de DQO en el caso de la flotación a pH 2 y 40 % de remoción de DQO a pH 2.5 para el proceso coagulación–floculación.
Los lixiviados de rellenos sanitarios municipales contienen una variedad de contaminantes, incluyendo metales pesados en concentraciones moderadas. Los valores típicos de estos elementos de acuerdo con Ehrig (1983) están en los rangos: cadmio 2–20 µg/L, níquel 100–400 µg/L, zinc 500–2000 µg/L, cobre 20–100 µg/L, cromo 100–500 µg/L y plomo 50–200 µg/L. Parte de esta variación se debe a las diferencias de los tipos de desechos depositados y, en el caso del relleno de la ciudad de Mérida, a su forma de operación y al material de cubierta.
Los lixiviados generados en las celdas del relleno son recirculados a la parte superior; cuando existe exceso, se bombean a lagunas de evaporación. En estas lagunas se combinan y mezclan lixiviados de las celdas del relleno, mismas que tienen diferentes edades; luego de someterse a dilución por las precipitaciones pluviales o a evaporación, son nuevamente recirculados a las celdas, propiciando así que los lixiviados posean características fisicoquímicas asociadas a diferentes edades de relleno.
El material de cubierta, además de someter a un filtrado fino a los lixiviados (propiciando que los SST representen sólo 0.54 % de los ST), reacciona con ellos y hace que mantengan valores elevados de pH (7.9 a 8.5). No obstante, se desarrollan las fases acidogénica y metanogénica en el relleno en los estratos de desechos, pero al pasar el lixiviado nuevamente por los estratos de material de cubierta, se incrementan la alcalinidad y el pH.
Zouboulis et al. (2003) encontraron que existía alta afinidad entre la materia coloidal y los metales pesados; por lo tanto, si se quiere remover eficientemente los metales pesados, es necesario remover también la materia coloidal.
La materia coloidal en los lixiviados está constituida principalmente por materia orgánica y puede ser dividida en dos clases de compuestos: las sustancias no húmicas como proteínas, polisacáridos, ácidos nucleicos etc. y las sustancias húmicas. Las sustancias húmicas son macromoléculas complejas de largas estructuras que le infieren el color de amarillo parduzco a negro a los lixiviados.
Zouboulis et al. (2003) obtuvieron remociones de 99 % de sustancias húmicas en agua sintética que simulaba lixiviado con el proceso de flotación por aire. Utilizaron una columna de 60 cm de altura y 50 mm de diámetro en la que burbujearon un flujo de aire de 250 cm3/min. Los resultados de flotación obtenidos en el estudio muestran remociones relativamente bajas de materia orgánica medida como DQO (37 %) y de SST (39 %) comparadas con otros tratamientos fisicoquímicos, pero mejores remociones de algunos metales pesados (cadmio 85 %, plomo 90 %, zinc 52 %), los cuales –como se ha mencionado– tienen afinidad con las sustancias húmicas: al remover éstas, se remueven también los metales pesados. Se resalta que las mejores remociones de metales pesados con el proceso de flotación se realizan a valores bajos de pH, cuando se elimina parte de las sustancias húmicas.
En los procesos de adsorción y oxidación intensiva se pueden remover no sólo partículas suspendidas, sino también sólidos disueltos. Por esta razón, existen en la literatura especializada reportes de experiencias exitosas de remociones de materia orgánica en muchos tipos de aguas residuales, incluso algunas de tratamiento de lixiviados (Hee–Chan et al. 2001, Lau et al. 2001, Xiao et al. 2002, Kagri y Pamukoglu 2004a, b, Lopes y Peralta 2005, Rivas et al. 2005).
En el cuadro VI se resumen los principales resultados obtenidos con los tratamientos ensayados.
El mejor tratamiento según la remoción de materia orgánica medida como DQO (77 %) fue la oxidación Fenton, dado que se obtienen las mayores remociones en los menores tiempos. Además, los reactivos utilizados son económicos comparados con el carbón activado y el precio de regeneración.
Los resultados de remoción de DQO obtenidos con el proceso Fenton son similares a los reportados en diferentes estudios en lixiviados y otras aguas residuales (Cuadro IV) y superiores a cualquier otro tipo de tratamiento fisicoquímico cuando se utiliza como único tratamiento.
No obstante que se determinaron los mejores tiempos de contacto, valores de pH y dosis del reactivo Fenton, se podrían optimizar estos importantes parámetros del proceso, con lo que se obtendrían mejores eficiencias de remoción y quizá menores dosis de reactivos, en particular del coagulante metálico cuya función como catalizador ha sido poco estudiada.
Resultaría pertinente determinar la eficiencia de remoción de metales pesados y sustancias húmicas por el proceso Fenton y realizar análisis de la distribución de tamaños de las partículas antes y después de efectuado el proceso.
CONCLUSIONES
– El proceso fisicoquímico más eficiente para la remoción de materia orgánica de lixiviados fue el de oxidación Fenton, con el que se obtuvieron remociones de 77 % de DQO.
– El material de cubierta utilizado en el relleno sanitario filtra los lixiviados y reacciona con ellos, propiciando que posean bajas concentraciones de sólidos suspendidos (0.76 %), elevados valores de pH y alcalinidad y que casi toda la materia orgánica medida como DQO se encuentre en forma soluble (96 %).
– La mayor parte de las partículas del lixiviado se encuentran en el rango de 0 a 75 µm, con una media de 23 µm; las sustancias húmicas que le confieren color pueden ser removidas con el proceso coagulación–floculación a pH bajo.
– La mayor parte de los sólidos de los lixiviados se encuentran en forma soluble o coloidal de pequeño tamaño (< 50 µm), lo que propicia que las eficiencias de procesos de clarificación del tipo coagulación–floculación y flotación sean bajas.
– Las condiciones y dosis óptimas del proceso de oxidación fueron: tiempo de contacto de 20 minutos, pH 4, concentraciones de H2O2 de 600 mg/L y Fe2+ de 1000 mg/L.
– En la prueba de adsorción, las eficiencias de remoción de DQO se redujeron de 60 a 30 % durante las primeras 80 horas con un tiempo de retención de 8 horas y durante las primeras 60 horas cuando el tiempo de retención fue de 4 horas.
– No se obtuvieron buenas eficiencias de remoción de materia orgánica, medida como DQO soluble, por el proceso fisicoquímico coagulación–floculación con ninguno de los coagulantes metálicos y polielectrolitos probados (4 % en promedio). Por lo tanto, no se obtuvo una dosis óptima, ni por acción de barrido.
– La remoción máxima en porcentaje de materia orgánica en lixiviados de relleno sanitario, obtenida en las pruebas de flotación, fue 37 % de DQO, 39 % de SST y 30 % de ST.
REFERENCIAS
APHA (1998). Standards methods for the examination of water and wastewater. 20ª ed. American Public Health Association. Washington, EUA. 1325 pp. [ Links ]
Baris C., Bulent M. y Bulent I. (2005). Landfill leachate management in Istanbul: applications and alternatives. Chemosphere 59, 819–829. [ Links ]
Benefield L. D., Judkins J. F. y Weand B. L. (1982). Process chemistry for water and wastewater treatment. Prentice–Hall. Nueva Jersey, EUA. 510 pp. [ Links ]
Borzacconi L., López I. y Anido C. (1996a). Metodología para la estimación de la producción y concentración de lixiviado de un relleno sanitario. XXV Congreso Interamericano de Ingeniería Sanitaria y Ambiental. México D.F. 31 de octubre a 3 de noviembre, 1996. Tomo III. [ Links ]
Borzacconi L., López I. y Arcia E., Cardelino L., Castagna A. y Viñas M. (1996b). Comparación de tratamientos aerobios y anaerobios aplicados a un lixiviado de relleno sanitario. XXV Congreso Interamericano de Ingeniería Sanitaria y Ambiental. México D.F. 31 de octubre a 3 de noviembre, 1996. Tomo I. [ Links ]
Dae–Hee A., Yun–Chul Ch. y Won–Seok Ch. (2002). Use of coagulant and zeolite to enhance the biological treatment efficiency of high ammonia leachate. J. Environ. Sci. Heal. A 37, 163–173. [ Links ]
Ehrig H. (1983). Quality and quantity of sanitary landfill leachate. Waste Manage. Res. 1, 53–68. [ Links ]
El–Fadel M., Bou–Zeid E., Chahine W. y Alayli B. (2002). Temporal variation of leachate quality from pre–sorted and baled municipal solid waste with high organic and moisture content. Waste Manage. 22, 269–282. [ Links ]
Enzminger J.D., Robertson D., Ahlert R.C. y Kosson D.S. (1997). Treatment of landfill leachates. J. Hazard. Mater. 14, 83–101. [ Links ]
González G., Hernández M. y Tejeda M. (2001). Diseño de reactores biológicos para evaluar la influencia de lixiviados en la transformación de la materia orgánica contenida en residuos sólidos. Memorias. Congreso EXPO AMCRESPAC. 14 al 16 de noviembre, 2001. Querétaro, Qro. CD–ROM. [ Links ]
Hee–Chan Y., Soon–Haing Ch. y Seok–Oh K. (2001). Modification of coagulation and Fenton oxidation processes for cost–effective leachate treatment. J. Environ. Sci. Heal. 36, 39–48. [ Links ]
Jensen D. y Christensen T. (1999). Colloidal and dissolved metals in leachates from four Danish landfills. Water Res. 33, 2139–2147. [ Links ]
Kagri K. y Pamukoglu Y. M. (2004a). Repeated fed–batch biological treatment of pre–treated landfill leachate by powdered activated carbon addition. Enzyme Microb. Tech. 34, 422–428. [ Links ]
Kagri K. y Pamukoglu Y. M. (2004b). Powdered activated carbon added biological treatment of pre–treated landfill leachate in a fed–batch reactor. Biotechnol. Lett. 25, 695–699. [ Links ]
Kurniawan T.A., Wai–Hung L. y Chan G.Y.S. (2006). Physico–chemical treatments for removal of recalcitrant contaminants from landfill leachate. J. Hazard. Mater. B 129, 80–100. [ Links ]
Lau I., Wang P. y Fang H. (2001). Organic removal of anaerobically treated leachate by Fenton coagulation. J. Environ. Eng. 7, 666–669. [ Links ]
Levine A.D., Tchobanoglous G. y Asano T. (1991). Size distributions of particulate contaminants in wastewater and their impact on treatability. Water Res. 8, 911–922. [ Links ]
López A., Pagano M., Volpe A. y Di Pinto A. (2003). Fenton's pre–treatment of mature landfill leachate. Chemosphere 54, 1005–1010. [ Links ]
Lopes J. y Peralta P. (2005). Use of advanced oxidation processes to improve the biodegradability of mature landfill leachates. J. Hazar. Mater. B 123, 181–186. [ Links ]
Marañón E., Castrillón L., Fernández–Nava Y., Fernández–Méndez A. y Fernández–Sánchez A. (2008). Coagulation–flocculation as a pretreatment process at a landfill leachate nitrification–denitrification plant. J. Hazard. Mater. 156, 538–544. [ Links ]
Marttinen S., Kettunen R. y Rintala J. (2003). Occurrence and removal of organic pollutants in sewages and landfill leachates. Sci. Total Environ. 301, 1–12. [ Links ]
Méndez–Novelo R.I., Castillo–Borges E.R., Sauri–Riancho M.R., Quintal–Franco C.A., Giácoman–Vallejos G. y Jiménez–Cisneros B. (2005). Physicochemical treatment of Merida landfill leachate for chemical oxygen demand reduction by coagulation. Waste Manage. Res. 23, 560–564. [ Links ]
Méndez N.R., Novelo L.A., Coronado P.V., Castillo B.E. y Sauri R.M.R. (2008). Remoción de materia orgánica y metales pesados de lixiviados por flotación con aire disuelto. Ingeniería12, 13–19. [ Links ]
Morawe B., Ramteke D. y Vogelpohl A. (1995). Activated carbon column performance studies of biologically treated landfill leachate. Chem. Eng. Process. 34, 299–303. [ Links ]
Rivas F.J., Beltrán F., Carvalho F., Acedo B. y Gimeno O. (2004). Stabilized leachates: sequential coagulation–flocculation + chemical oxidation process. J. Hazard. Mater. B 16, 95–102. [ Links ]
Rivas F.J., Beltrán F., Carvalho F., Gimeno O. y Frades J. (2005). Study of different integrated physical–chemical + adsorption processes for landfill leachate remediation. Ind. Eng. Chem. Res. 44, 2871–2878. [ Links ]
Slomczynska B. y Slomczynski T. (2004). Physico–chemical and toxicological characteristics of leachates from MSW landfills. Pol. J. Environ. Stud. 13, 627–637. [ Links ]
Tatsi A., Zouboulis A., Matis K. y Samaras P. (2003). Coagulation–flocculation pretreatment of sanitary landfill leachates. Chemosphere 53, 737–744. [ Links ]
Trujillo D., Font X. y Sánchez A. (2006). Use of Fenton reaction for the treatment of leachate from composting of different wastes. J. Hazard. Mater. B 138, 201–204. [ Links ]
Xiao Y., Wang G., Liu H., Zhao H., Zhang J., Sun C. y Wu M. (2002). Treatment of H–acid wastewater by photo–Fenton reagent combined with a biotreatment processes: a study on optimum conditions of pretreatment by a photo–Fenton process. B. Environ. Contam. Tox. 69, 430–435. [ Links ]
Zhang H., Choi H.J. y Huang C.P. (2005). Optimization of Fenton process for the treatment of landfill leachate. J. Hazard. Mater. B 125, 166–174. [ Links ]
Zouboulis A., Jun W. y Katsoyiannis I. (2003). Removal of humic acids by flotation. Colloid. Surface. A 231, 181–193. [ Links ]














