INTRODUCCIÓN
En Cuba el camarón rosado Penaeus notialis(Pérez-Farfante, 1967, Decapoda: Penaeidae) es la principal especie comercial de peneido (Delgado et al., 2011; Giménez, Gárces, Ventura, Delgado & Alfonso, 2012) representa el 20% de las exportaciones del sector pesquero del Ministerio de la Industria Alimentaria de Cuba (Minal) reportado por el Grupo Empresarial de la Industria Alimentaria (GEIA, 2014). Esta especie ha sido históricamente la más abundante en la plataforma suroriental de Cuba (Guitart, González & Reyes, 1982; Pérez & Puga, 1982; Pérez et al., 1984; Pérez, Puga & Venta, 1981), con más del 98% de las capturas nacionales (Font, Valdés, Martínez & Sánchez, 2008; Giménez et al., 2012). Actualmente la abundancia de la población de esta especie en el Golfo se encuentra deprimida y por consiguiente las capturas comerciales son afectadas (Giménez et al., 2012).
La distribución espacial del desove de Penaeus notialisen el golfo de Guacanayabo no ha sido muy abordada pues solo se cuenta con el estudio de Font et al. (2008). Además, los estudios en la región demuestran que se pesca un alto número de hembras inmaduras (Ventura, Giménez & Delgado, 2014) y que el reclutamiento y la abundancia de juveniles están afectados (Giménez et al., 2012). Esta problemática pudiera encontrarse influenciada por una modificación de la distribución del desove del camarón rosado en esta región por lo que se quiere conocer si han variado las zonas de desove de la especie en este Golfo durante el período 2010-2013.
MATERIALES Y MÉTODOS
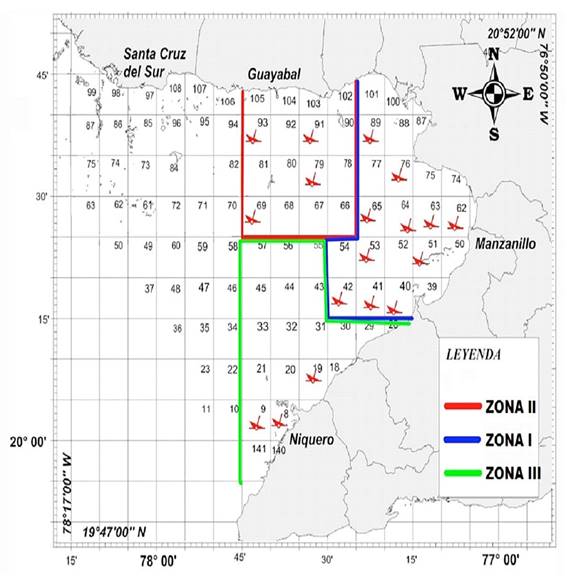
Los muestreos se realizaron aleatoriamente en los cruceros de prospección mensuales por la Empresa Pesquera Industrial de Granma (Epigran) perteneciente al Minal en el período 2010-2013 en el golfo de Guacanayabo que se encuentra en la parte oriental de la plataforma suroriental de Cuba en 20°30 'N 77 °30 'O. Se muestrearon un total de 18 cuadrículas de la red de estaciones de las tres zonas de pesca de camarón rosado en este Golfo perteneciendo 11 de la Zona de pesca I, cuatro de la Zona de pesca II y tres de la Zona III, las cuales se encuentran representadas por las embarcaciones como se muestra en la Figura 1. Los muestreos se realizaron mediante arrastres durante una hora a una velocidad promedio de 3 nudos.
Fuente: Elaboración propia.
Figura 1 Red de estaciones de muestreo biológico del camarón rosado Penaeus notialis en las zonas de pesca de la empresa Epigran en el golfo de Guacanayabo. ( : estación de muestreo).
: estación de muestreo).
Se tomó una muestra aleatoria de 3 kg de la captura total de camarones en cada arrastre, la que oscila entre 8 kg y 25 kg. Los organismos se separaron por sexo, se midieron por el largo y se les determinó el estadio de maduración de las hembras. El sexo se determinó visualmente, se diferenció a los machos por la presencia del petasma y a las hembras por el télico (Guitart, González, Reyes & Fraga, 1988). Se les midió el largo cubano (Centro de Investigaciones Pesqueras [CIP], 1980) con un camaronómetro en centímetros desde la base de la escotadura postorbital hasta la espina dorsal del último segmento abdominal. El grado de madurez gonádica se determinó mediante la escala morfocromática descrita por Guitart et al. (1982). El estadio I representa a una hembra inmadura y muestra una coloración transparente; el estadio II es madura en desarrollo, con un color amarillo-verdoso; el estadio III es madura, de color verde intenso; el estadio IV es de madurez avanzada, de color verde olivo intenso y el estadio V es de desovada, de aspecto traslúcido, con un desarrollo semejante al estadio I.
Se determinó el porcentaje de las hembras maduras por cuadrícula en las tres zonas de pesca del golfo de Guacanayabo para los años 2010 al 2013, tomando en consideración el total de hembras (maduras e inmaduras) y el total de hembras maduras (estadios III-IV). Para graficar la distribución espacial del desove de la región de los años 2010 al 2013 y para todo el período 2010-2013 se utilizó el Sistema de Información Geográfica Mapinfo (12.0). Los porcentajes se mostraron mediante una escala cromática donde el color más claro correspondió al menor porcentaje de hembras maduras y el más oscuro al máximo.
Las pruebas estadísticas se ejecutaron en el programa STATISTICA® para Windows, versión 7.0 (2002). Se comprobó la normalidad mediante la prueba de Shapiro Wilk´s y la homogeneidad de varianza mediante la prueba de Levene y al no cumplirse las premisas de normalidad en todos los casos, se procedió a aplicar estadística no paramétrica. Se utilizó la prueba de Kruskal-Wallis para determinar diferencias entre los años de muestreo en cuanto el porcentaje de hembras maduras por cuadrícula de 2010 a 2013.
RESULTADOS
La distribución temporal del desove de los años 2010 a 2013 mostró que el porcentaje de hembras maduras por cuadrícula de pesca osciló de 1.69% a 26%, 79% de maduración. El año 2010 presentó un valor promedio de 16.54% de hembras maduras, en 2011 fue de 15.42%, en 2012 se observó con 13.46% y en 2013 se obtuvo un 12.36% de maduración (Tabla 1).
Table 1 Valores mínimo, máximo y promedio del porcentaje hembras maduras (Hm) por cuadrícula de 2010 a 2013 de Penaeus notialis en las zonas de pesca del golfo de Guacanayabo
| Años | 2010 | 2011 | 2012 | 2013 |
|---|---|---|---|---|
| Promedio de Hm | 16.54 | 15.42 | 13.46 | 12.36 |
| Mínimo de Hm | 7.08 | 6.44 | 7.49 | 1.69 |
| Máximo de Hm | 24.38 | 24.05 | 17.61 | 26.79 |
Fuente: Elaboración propia.
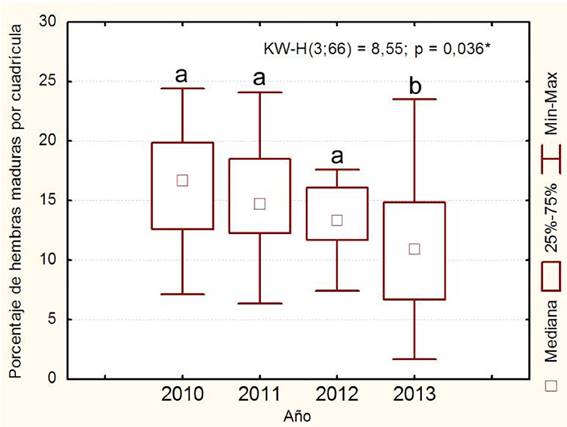
Se observó una tendencia hacia la disminución en el porcentaje de hembras maduras por cuadrícula de 2010 a 2013 y el año 2013 presentó diferencias con respecto al resto (p = 0.036*) (p < 0.05) (p >; F =) como se observa en la Figura 2.
Fuente: Elaboración propia.
Figura 2 Resultados de la prueba de Kruskal-Wallis del porcentaje de hembras maduras de Penaeus notialis por cuadrícula de 2010 a 2013. Letras iguales representan que no hay diferencias estadísticas para p ≥ 0.05.
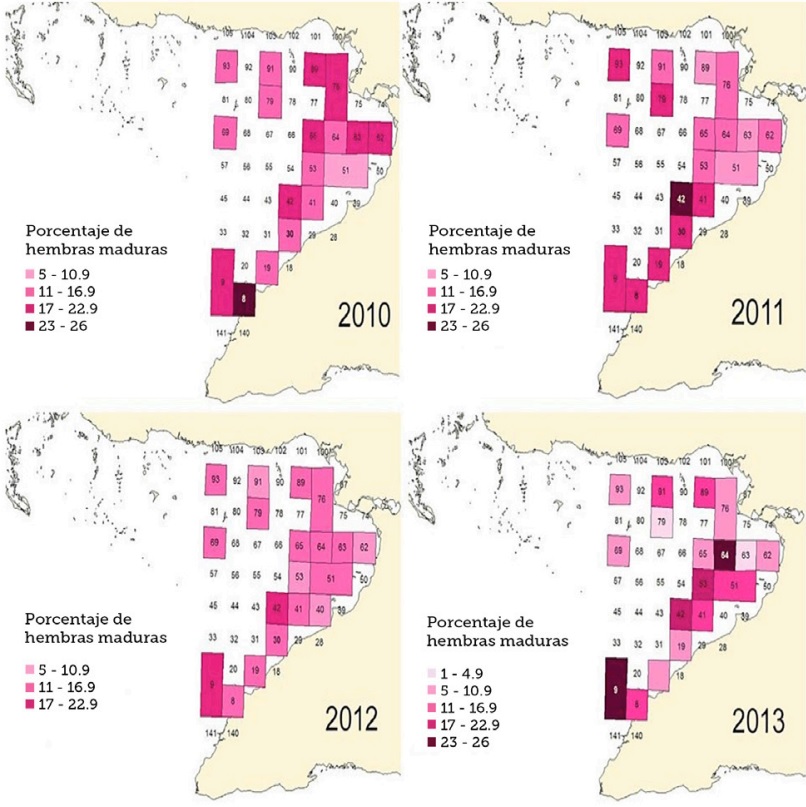
La distribución espacial del desove por años del período 2010-2013 mostró que el porcentaje de hembras maduras no superó el 26.8%. El año 2010 tuvo un máximo de 24.4% de hembras maduras en la cuadrícula 8 en la zona III, en 2011 se alcanzó el mayor valor en la cuadrícula 42 en la zona I con un 24.1%, en 2012 el máximo se observó en la cuadrícula 42 con 17.6% y en 2013 el valor más alto se obtuvo en las cuadrículas 9/21 de la zona III frente a Niquero con un 26.8% de maduración (Tabla 2 y Figura 3).
Table 2 Porcentaje de hembras maduras (Hm) por cuadrícula de 2010 a 2013 de Penaeus notialis en las tres zonas de pesca del golfo de Guacanayabo
| Zona de pesca | Cuadrícula | Porcentaje Hm 2010 |
Porcentaje Hm 2011 |
Porcentaje Hm 2012 |
Porcentaje Hm 2013 |
|---|---|---|---|---|---|
| I | 51/52 | 7.08 | 7.08 | 11.97 | 13.2 |
| I | 53 | 16.71 | 14.38 | 10.81 | 21.27 |
| I | 40a | 8.76 | |||
| I | 41 | 11.15 | 17.37 | 16.85 | 12.38 |
| I | 42 | 17.11 | 24.05 | 17.61 | 18.42 |
| I | 62 | 20.91 | 11.21 | 7.49 | 9.46 |
| I | 63 | 20.39 | 9.54 | 13.27 | 1.69 |
| I | 64 | 16.36 | 13.98 | 11.64 | 23.53 |
| I | 65 | 19.31 | 14.94 | 13.53 | 8.26 |
| I | 76/88 | 19.91 | 19.91 | 15.58 | 6.72 |
| I | 89 | 17.77 | 9.55 | 13.27 | 13.38 |
| II | 69 | 12.55 | 14.63 | 15.12 | 6.57 |
| II | 79 | 12.39 | 22.16 | 12.14 | 2.24 |
| II | 91 | 15.69 | 12.35 | 9.51 | 14.81 |
| II | 93 | 16.12 | 17.07 | 14.59 | 9.09 |
| III | 8 | 24.38 | 18.48 | 16.69 | 11.75 |
| III | 9/21 | 20.99 | 19.49 | 17.4 | 26.79 |
| III | 19/30 | 12.31 | 22.06 | 16.1 | 10.48 |
Fuente: Elaboración propia.
Fuente: Elaboración propia.
Figura 3 Principales áreas de desove de Penaeus notialis en el golfo de Guacanayabo en los años comprendidos entre 2010 y 2013.
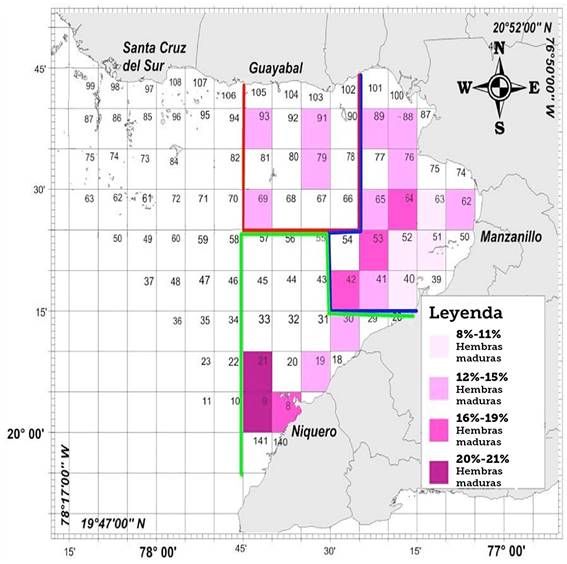
La distribución del desove para todo el período varió de 8% hasta 21% (Figura 4).
DISCUSIÓN
Se encontró poca variación temporalmente en el desove de los años 2010 a 2013 en las zonas de pesca de la empresa Epigran, sin embargo se observó una propensión hacia el descenso en cuanto a la proporción de hembras maduras, la cual se acentuó de manera significativa en el último año, lo que pudiera deberse a la propia disminución en la población de camarón rosado en este Golfo encontrada por Giménez et al. (2012). El máximo alcanzado en el porcentaje de maduración fue en el año 2013, sin embargo al analizar el valor promedio se observa en este mismo año el porcentaje más bajo de los años analizados. Por lo que este máximo de maduración puede considerarse como un caso puntual y no debe interpretarse como un aumento reproductivo de la población.
En cuanto a la distribución del desove en las zonas de pesca se encontró un comportamiento similar entre los años, por lo que se puede analizar a nivel de período 2010-2013. A pesar del bajo porcentaje de maduración las principales áreas de desove se mantienen similares a las determinadas por Font et al. (2008), en las 3 zonas de pesca del golfo de Guacanayabo. Esto demuestra que la especie no ha cambiado las áreas de desove en esta región. No obstante, se observa una afectación en la capacidad reproductiva en este Golfo, debido a que ninguna cuadrícula mostró valores de hembras maduras por encima del 50%, el cual es el considerado como indicador de que está ocurriendo el pico de desove (Sandoval, 1996), además de observarse una tendencia decreciente en el porcentaje de maduración al compararlo entre los años de muestreo. Esta baja proporción de hembras maduras nos induce a pensar que efectos tanto denso-dependientes como independientes de la población de camarón rosado pueden estar actuando en sinergia en el proceso reproductivo, provocando una afectación en este golfo.
Se esperaba que la disminución de la abundancia de la población de Penaeus notialis en el golfo de Guacanayabo (Font et al., 2008) estuviera relacionada con fallos en el proceso reproductivo. El golfo se ha visto afectado en cuanto a la proporción de hembras maduras, que es baja, sin embargo, la distribución de las hembras maduras en la región se mantiene en las mismas áreas de desove. De esta situación se puede derivar que la reproducción de la especie está parcialmente afectada pero se supone que existen además, eventos que influyen de manera negativa en las etapas del ciclo de vida posteriores al desove.











 nueva página del texto (beta)
nueva página del texto (beta)