Introducción
El Guaiacum sanctum L. es una especie de gran importancia en los bosques secos tropicales de Honduras, ya que es de especial interés económico debido a que su madera es una de las más densas, y comúnmente se ha utilizado para la fabricación de propelas para barcos de vapor (Fuchs & Hamrick, 2010). Es una especie arbórea de crecimiento lento que pertenece a la familia Zygophyllaceae y habita en el bosque seco subtropical y tropical. En Centroamérica es conocida como guayacán, palo santo y guayacán real, mientras que en Norteamérica es identificada como lignum vitae (Ferrufino-Acosta et al., 2016). En México, G. sanctum tiene una distribución restringida, crece en matorrales semideciduos y bosques tropicales de hoja perenne en suelos kársticos, en localidades de mínimo 1500 mm anuales de precipitación (López-Toledo et al., 2008).
Para esta especie, la extensa deforestación y degradación forestal que sufren países tropicales en desarrollo se ha convertido en una amenaza (Organización de las Naciones Unidas para la Agricultura y la Alimentación [FAO], 2006), ya que se prevé que alrededor de 3 a 8 millones de especies biológicas, incluida una gran cantidad de especies aún desconocidas, serán eliminadas de la superficie de la tierra al final del siglo XXI si no se ponen en marcha medidas que lo eviten (Kobayashi, 2004). Lo anterior requiere que se tomen medidas urgentes para la recuperación y conservación de G. sanctum, pues ha sido muy explotada, y esto la ha llevado a ser incluida desde el año 1975 en la lista de la Convención Internacional para Comercio de Especies Amenazadas de Flora y Fauna (CITES) dentro del apéndice II, en la cual aparecen especies que podrían estar amenazadas si no se vigila cuidadosamente su aprovechamiento y mercadeo (López-Toledo et al., 2013).
En México, G. sanctum se considera como amenazada, específicamente en la categoría de especies bajo protección especial. Tomando como base un modelaje de nicho ecológico, se obtuvo que se ha perdido su hábitat en un 28.2% en las últimas tres generaciones, así como la extensión de su rango geográfico y el tamaño de la población (95 421.6 km2 y > 10 000 individuos, respectivamente), lo cual excede los límites requeridos para la categoría denominada en peligro. Debido a esto, es probable que haya alcanzado la categoría Amenazada (López-Toledo et al., 2008; Unión Internacional para la Conservación de la Naturaleza [IUCN], 2007).
Se ha reconocido que el estado de conservación de la especie puede ser muy diferente en otros países. En Guatemala y Costa Rica, G. sanctum ha sido evaluada como vulnerable y en peligro, mientras que en El Salvador y Florida se considera en peligro o casi extinto, respectivamente. Por el contrario, las poblaciones cubanas aparentemente son abundantes ( Dertien & Duvall, 2009; Jiménez, 1999; Vivero et al., 2006). También existen importantes diferencias regionales entre las poblaciones mexicanas; por ejemplo, la pérdida de hábitat ha sido mucho mayor en Yucatán, Chiapas y Oaxaca que en las poblaciones centrales de Campeche y Quintana Roo (López-Toledo et al., 2008).
El éxito de las estrategias para conservar esta especie depende del conocimiento detallado de los niveles y la distribución de la diversidad genética dentro y entre las poblaciones, pero lo más importante es proteger grandes fragmentos de bosques remanentes, como la población de G. sanctum en la reserva natural de la Biósfera de Calakmul, Campeche (López-Toledo et al., 2012).
Aunque actualmente existe un interés por establecer plantaciones de especies nativas, la falta de estudios en este campo restringe el desarrollo tecnológico a un pequeño número de especies y evita su producción a gran escala (Valverde-Cerdas et al., 2008).
En el caso de G. sanctum, la regeneración natural no es exitosa, pues, aunque en algunas áreas el suelo se cubre con miles de brinzales, son muy pocos los que logran sobrevivir, considerando que la reproducción por semilla es difícil, donde a veces solo se llega a obtener la germinación de solo el 30%; para lo cual se recomienda utilizar semillas recién cosechadas y un sustrato liviano (tierra, aserrín o mezcla en vez de arena). En cualquier caso, la germinación no suele exceder del 50%. Otra opción para intentar aumentar el porcentaje de germinación es sumergir las semillas en agua a temperatura ambiente por ocho horas antes de sembrar, o intentar la reproducción por estacas, la cual se ha realizado en un trabajo en el Centro Agronómico Tropical de Investigación y Enseñanza (CATIE), donde han logrado reproducir esta especie por estacas enraizadas (Cordero & Boshier, 2003).
Esta especie crece bien bajo sombra y es extremadamente resistente a la sequía (Daley & Zimmerman, 2008). Se ha demostrado que plántulas de G. sanctum tiene una buena supervivencia y crecimiento en claros y sitios parcialmente abiertos (González-Rivas et al., 2009).
Algunos autores mencionan que G. sanctum presenta problemas para su reproducción a causa de la difícil germinación en medio natural. Esto se debe posiblemente a que las semillas de esta familia de plantas presentan dormancia fisiológica (Sánchez et al., 2019).
En la germinación de las semillas de G. sanctum se ha observado que el arilo y la testa la inhiben, pero al momento de removerles estas dos estructuras, las cuales son estructuras que contienen los compuestos inhibidores de la germinación, germinan alrededor del 100% en un periodo de dos a cinco días (Taylor, 1966). Sin embargo, bajo condiciones naturales, en particular en la época lluviosa, con las condiciones ambientales optimas, las semillas pueden germinan rápidamente (Ferrufino-Acosta et al. , 2016). Lo anterior está relacionado con la viabilidad de las semillas, la cual se define como la capacidad que estas poseen para mantener vivo el embrión y lograr la germinación (Ríos-García et al. 2016).
En el trópico, la mayoría de las especies que habitan en los bosques caducifolios tienen semillas con latencia física, para disminuir este efecto y ayudar a mejorar la reproducción de estas especies tropicales. Una alternativa es la escarificación física, química o la aplicación de agua caliente para promover que la testa u otras estructuras sean permeables al agua y aire, de tal modo que estimulen la germinación (Baskin & Baskin 1998; Khurana & Singh 2001). Actualmente se sabe muy poco sobre el proceso por el que emerge el embrión de la semilla para completar la germinación y cómo se bloquea la emergencia del embrión cuando la semillas se encuentra latente (Bewley, 1997).
Por otra parte, se ha identificado que la regeneración de G. sanctum es más alta en lugares disturbados que en zonas menos disturbadas (Ferrufino-Acosta et al., 2016; López-Toledo et al., 2011). Esto posiblemente se debe a que, bajo exposición continua a la luz, la capacidad de germinación de las semillas de G. sanctum fue significativamente mayor cuando se incuba a 20 °C y 25 °C (González-Rivas et al., 2009).
Por lo anterior, el objetivo del presente trabajo fue eliminar la dormancia fisiológica de semillas de G. sanctum mediante tratamientos pregerminativos, evaluado a través del número de plántulas obtenidas, planteando como hipótesis la inexistencia de diferencias estadísticas en la emergencia de plántulas entre tratamientos.
Materiales y Métodos
Sitio de estudio
El experimento se realizó en el vivero forestal del Instituto Tecnológico de Chiná, ubicado en el poblado de Chiná, en el estado de Campeche, México, a 5 km de la capital del Estado, en las coordenadas 19° 45’ 37” N y 90° 29’ 46” O, con una altitud sobre el nivel del mar de 20 m, un clima cálido subhúmedo con lluvias en verano y una temperatura media anual de 27 oC (García, 2004).
Obtención de semillas
Los frutos de G. sanctum se recolectaron de plantas en selva natural en el ejido de Pich, Campeche, México. Estos frutos se obtuvieron a inicios del mes de julio y mediados del mes de agosto del año 2016. Posteriormente, los frutos se pusieron a secar por una semana en sombra y durante quince días al sol para luego obtener las semillas, las cuales se depositaron en bolsas de papel y se almacenaron en refrigeración a 5 °C por aproximadamente cinco meses.
Caracterización de las semillas
Se tomaron 100 semillas, las cuales se pesaron y midieron (largo y ancho) utilizando una balanza y un vernier digitales.
Diseño experimental
El diseño experimental que se utilizó fue completamente al azar, considerando que las condiciones ambientales del vivero fueron homogéneas, cubierta con una malla del 50% de sombra, donde se presentó con un rango de temperatura entre 28 °C y 35 °C. El riego se aplicó de forma manual, manteniendo la humedad del sustrato (Peat Moss®) a capacidad de campo.
Tratamientos
Los tratamientos pregerminativos que se aplicaron fueron seis, con cuatro repeticiones y 30 semillas por repetición. El sustrato que se utilizó fue Peat Moss®, utilizando 720 contenedores de polipropileno con capacidad de 410 ml cada uno, colocando una semilla por contenedor. Los tratamientos consistieron en: un testigo al que no se aplicó ningún tratamiento (T1); inmersión en agua a 100 °C por 3 min (T2); inmersión en agua a 100 oC por 6 min (T3); inmersión en agua a temperatura ambiente por 24 h (T4); raspado de la testa por 10 min en una caja con lija (T5); e inmersión en peróxido de hidrógeno diluido en agua (3 ml L-1) (con una concentración del 3%) durante 15 min y, posteriormente, enjuagadas con agua a temperatura ambiente para eliminar residuos del químico (T6).
Mediciones
Para poder evaluar el tiempo de emergencia de las plántulas, considerando plántula cuando la plúmula aparecía sobre el sustrato, estas se contabilizaron diariamente durante un periodo de 86 días, lo que permitió determinar el porcentaje y el tiempo de emergencia mediante la elaboración de curvas de acumulación del número de plántulas que emergieron por día en cada tratamiento.
Los análisis estadísticos de datos se realizaron utilizando la prueba de T pareadas para identificar diferencias entre tratamientos, para lo cual se utilizó el software estadístico INFOSTAT.
Resultados
Características morfométricas de las semillas
La caracterización de las semillas reveló que el peso de 100 semillas fue de 15.86 g, con un promedio por semilla de 0.16 g ± 0.03 g, un mínimo de 0.09 g y un máximo de 0.23 g. En cuanto al tamaño de las semillas, el largo tuvo un promedio de 8.62 mm ± 0.94 mm, mientras que el ancho fue de 4.82 mm ± 0.7 mm (Tabla 1). Mediante el método de regresión polinómica se obtuvo una ecuación (ecuación 1) (R² = 0.9958) que permitirá estimar el número de semillas que pueden obtenerse en un kilogramo de estas basados en el peso de las semillas (Figura 1):
Tabla 1 Características morfométricas de las semillas de Guaiacum sanctum.
| Variable | n | Media | DE | Var(n) | CV(%) | Mín | Máx |
| Ancho de la semilla (mm) | 100 | 4.82 | 0.7 | 0.49 | 14.58 | 0.16 | 6.1 |
| Largo de la semilla (mm) | 100 | 8.62 | 0.94 | 0.88 | 10.96 | 4.4 | 10.8 |
| Peso de la semilla (g) | 100 | 0.16 | 0.03 | 7.70E-04 | 17.56 | 0.09 | 0.23 |
Fuente: Elaboración propia.
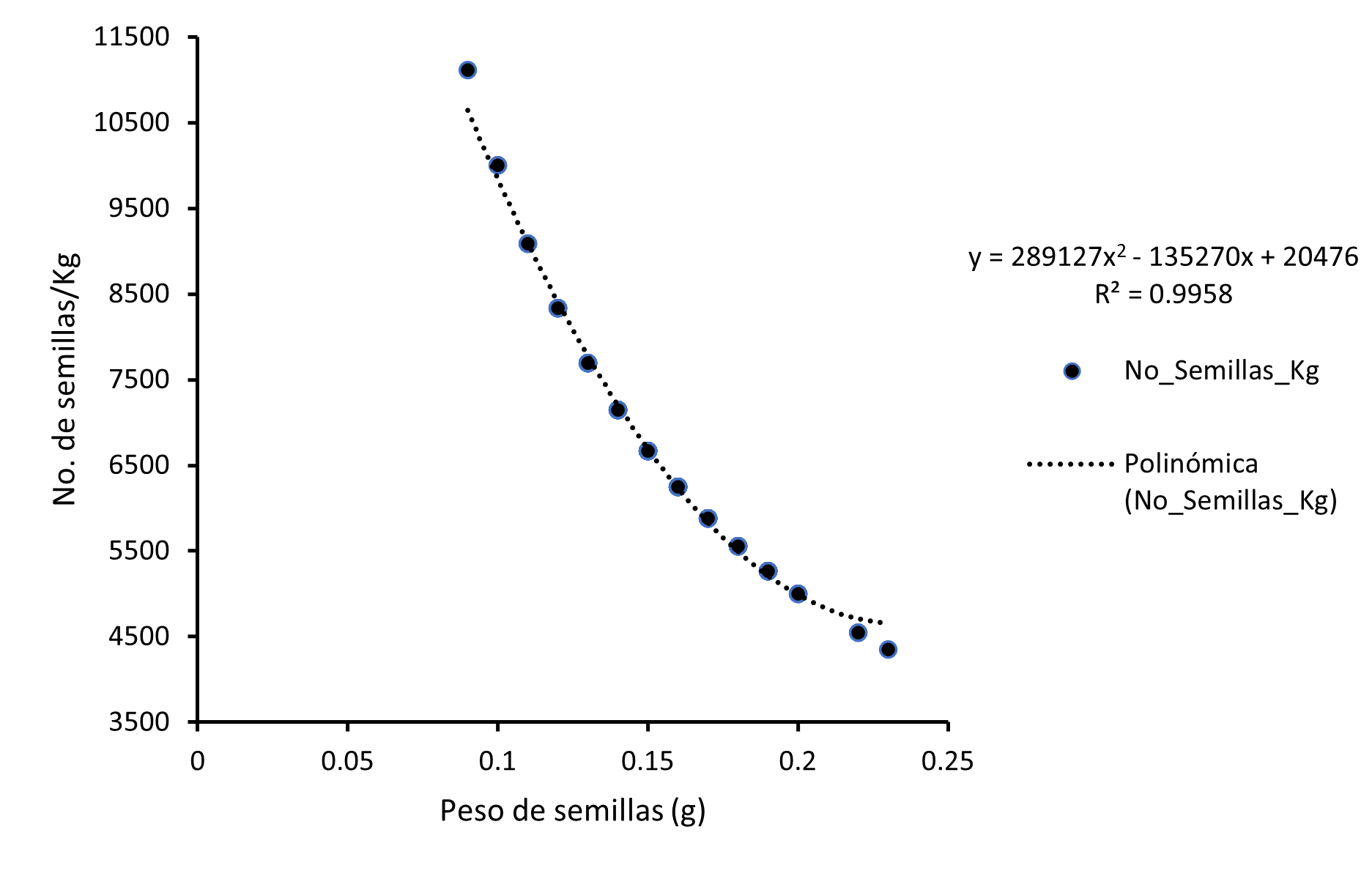
Fuente: Elaboración propia.
Figura 1 Modelo de regresión polinómica para la estimación del número de semillas en un kilo, basados en el peso de la semilla de Guayacum sanctum.
Emergencia de plántulas
El momento en que se inició la emergencia fue a partir del día 19 después de la siembra en el tratamiento cuatro (T4), los análisis estadísticos mostraron diferencias (p < 0.0001) en el número de plántulas que emergieron entre tratamientos; sin embargo, entre los tratamientos T2 y T3 y los tratamientos T4 y T6 no se observaron diferencias.
En cuanto al tiempo de emergencia de las plántulas, para cada tratamiento pregerminativo se observó que el T6 (inmersión en peróxido de hidrógeno diluido en agua [3 ml L-1] [solución al 3%] durante 15 min) en conjunto con T4 (inmersión en agua a temperatura ambiente por 24 h) presentaron el menor tiempo para la emergencia de plántulas, seguidos del testigo (T1). Por otra parte, en los casos de los tratamientos de inmersión en agua a 100 °C por 3 min (T2) y por 6 min (T3), estos presentaron el mismo comportamiento en el tiempo de emergencia, siendo el tratamiento raspado de la testa por 10 min en una caja con lija (T5) el peor tratamiento, ya que este no promovió la germinación y emergencia de plántulas (Figura 2).

Fuente: Elaboración propia.
Figura 2 Comportamiento de la emergencia de plántulas de Guayacum sanctum obtenidas a partir de semillas con tratamientos pregerminativos. T1: testigo; T2: agua a 100 oC por 3 min; T3: agua a 100 oC por 6 min; T4: 24 h remojadas en agua a temperatura ambiente; T5: raspado de la testa; T6: peróxido de hidrógeno durante 15 min (3 ml en un litro de agua) (3%).
El porcentaje de emergencia de plántulas fue similar en los tratamientos T4 y T6, los cuales presentaron el mayor número de plántulas, cada uno con un 30% (36 plántulas) de un total de 120 semillas sembradas por tratamiento. En cuanto a los tratamientos T2 y T3, estos presentaron baja emergencia de plántulas (tres plántulas por tratamiento), mientras que T5 no presentó emergencia de plántulas en un periodo de 86 días de evaluación (Figura 3).
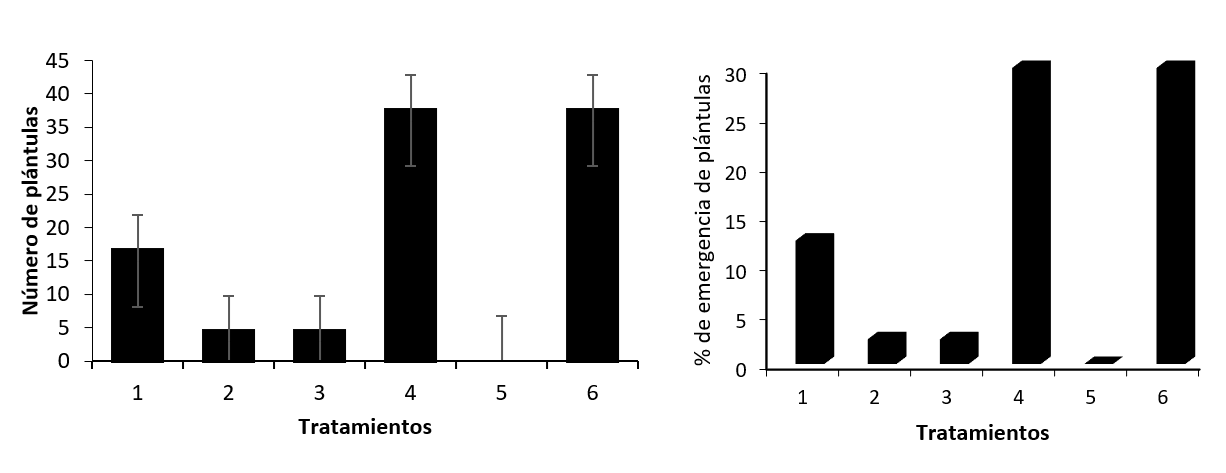
Fuente: Elaboración propia.
Figura 3 Emergencia de plántulas de Guayacum sanctum a partir de semillas con tratamientos pregerminativos. T1: testigo; T2: agua a 100 oC por 3min; T3: agua a 100 oC por 6 min; T4: 24 h remojadas en agua a temperatura ambiente; T5: raspado de la testa; T6: peróxido de hidrógeno durante 15 min (3 ml en un litro de agua) (3%).
Discusión
En cuanto a la caracterización morfométrica de las semillas, García-Díaz (2007) reporta en Costa Rica que la especie G. sanctum presentó un promedio de 9.26 mm en el largo y 4.67 mm en el ancho, lo cual es similar a lo que se obtuvo en este estudio (8.62 mm de largo y 4.82 mm de ancho).
Por otro lado, se ha observado que, bajo exposición continua a la luz, la capacidad de germinación de las semillas de G. sanctum fue significativamente más alta cuando se incubaron a 20 °C y 25 °C que a 15 °C y 35 °C (p < 0.001), lo cual fue diferente cuando se incubó a 30 °C, en donde se obtuvo la germinación del 61% de las semillas en la oscuridad, pero ninguna germinó en la luz. Lo anterior mostró que las semillas germinaron bien tanto en la luz como en la oscuridad, aunque el requisito de luz fue modulado por la temperatura (González-Rivas et al., 2009). Se puede decir que la sensibilidad de las poblaciones de semillas a la temperatura puede interactuar con otros factores ambientales, particularmente la luz, y que algunas especies que requieren luz germinan bien bajo alternancia de temperaturas con amplitudes variables en la oscuridad (Teketay & Granström, 1997). En este experimento no pueden atribuirse las diferencias obtenidas entre tratamientos a la exposición de las semillas a la luz y temperatura, ya que estas dos variables (temperatura entre 28 °C y 35 °C y la exposición a la luz, 50% de sombra) fueron similares en todo el experimento, con lo cual se descarta que la luz y la temperatura hayan tenido que ver en los resultados de emergencia de las plántulas, por lo que se puede atribuir al efecto de los tratamientos pregerminativos aplicados.
En Costa Rica se ha observado que G. sanctum alcanzó 33% en germinación, iniciando la germinación dos días posteriores al establecimiento de las semillas (García-Díaz, 2007).
Una de las posibles razones por las cuales se obtuvo un bajo porcentaje de plántulas en cada tratamiento pudo deberse al tiempo de almacenamiento de las semillas, el cual fue de cinco meses. Esto está relacionado con lo mencionado por Hartmann & Kester (2001), quienes han observado que el envejecimiento de las semillas es un factor que disminuye la viabilidad, además de la calidad de las semillas; la cual disminuye con el transcurso del tiempo, ocasionando su deterioro (Ríos-García et al., 2016), lo que depende de las condiciones ambientales, edad, contenido de humedad y de las condiciones de manejo y almacenamiento (Manjarrez et al., 2017).
El resultado obtenido con el uso del peróxido de hidrógeno (H2O2), que fue uno de los tratamientos que obtuvo el mayor número de plántulas, muestra que este tratamiento puede ser efectivo para la reproducción de especies con problemas de dormancia, considerando lo mencionado por Barba-Espín et al. (2011), quienes encontraron que semillas de guisantes pretratadas con H2O2 germinaron en un 100% a las 36 horas después de su aplicación, comparadas con un testigo que solo obtuvo el 70% de germinación. Lo anterior muestra que el uso del H2O2 para hacer nuevas pruebas con semillas de especies arbóreas es una opción que debe probarse.
Considerando esta problemática, G. sanctum requiere mayor investigación para determinar las condiciones óptimas de germinación, emergencia y crecimiento de plántulas, ya que existe poca información sobre esta especie











 nueva página del texto (beta)
nueva página del texto (beta)



