Introducción
Los elementos potencialmente tóxicos (EPT) pueden llegar al suelo por diversas actividades humanas, entre las que se encuentran la combustión, el uso excesivo de pesticidas, fertilizantes (Zhao et al., 2021), jales de mina y actividades industriales (Ahn et al., 2020). En los residuos de minas, dos de los principales EPT que se encuentran en grandes cantidades son el arsénico (As) y el plomo (Pb), los cuales son considerados de alta toxicidad debido a su persistencia y bioacumulación (Boostani et al., 2021; Zhao et al., 2021). Entre los efectos toxicológicos que puede causar el Pb se encuentra el cáncer, si este se vuelve acumulativo en los humanos a través de las cadenas tróficas, iniciando por el aumento de concentración en el suelo. La exposición al As puede ocasionar lesiones dermatológicas, cardiovasculares, enfermedades vasculares periféricas, trastornos neurológicos, enfermedades respiratorias, deformaciones de las extremidades, problemas oculares y diversas formas de cáncer y muerte (Roy et al., 2015).
Entre los sistemas actuales de biorremediación de suelo que se estudian se encuentran la extracción y estabilización de los EPT mediante el uso de microorganismos o plantas. Los microorganismos usados en biominería son extremófilos, debido a que tienen la capacidad de resistir condiciones extremadamente ácidas (pH 1-3) así como la presencia de concentraciones elevadas de metales (mayores a 100 mgL-1). Las bacterias interaccionan con los metales mediante diferentes procesos, entre los que encontramos absorción, bioacumulación, bioprecipitación, bioreducción y biooxidación (Jerez et al., 2017).
En las bacterias promotoras de crecimiento vegetal (BPCV), se ha encontrado que presentan la capacidad de producir sideróforos para captar hierro (Fe) y otros EPT, así como la producción de ácidos orgánicos para solubilizar fosfatos y promover la captación de fósforo. Las BPCV promueven el crecimiento vegetal mediante los mecanismos de fijación de nitrógeno, solubilización de fosfatos, producción de fitohormonas como el ácido indol acético y producción de la enzima ACC desaminasa (Rajkumar et al., 2012).
En los últimos años se ha tratado de entender en la biorremediación de jales de minas cómo es la interacción bacteria-mineral y la respuesta de estos para poder sobrevivir a estas condiciones extremas (Jerez et al., 2017). El estudio de los EPT en el suelo se ha enfocado fundamentalmente en las concentraciones de estos; sin embargo, para entender los procesos de su estabilización, es necesario estudiar la especiación de estos en los suelos, es decir, su distribución y su redistribución causada por los procesos de interacción con las bacterias, con las enmiendas y con la fitorremediación (Mngadi et al., 2020).
Por lo descrito anteriormente, este estudio está enfocado a conocer cómo es la redistribución de los EPT en el suelo cuando se aplican bacterias promotoras de crecimiento vegetal.
Materiales y métodos
Muestreo
El área de muestreo está ubicada en el municipio de Zimapán, Hidalgo, México, denominada “Jales de Santa María”, en calle Montserrat, colonia Fas, con coordenadas 20° 44' 08.2" N y 99° 23' 56.4" W. En este contexto se recolectaron 10 submuestras en los jales mineros mediante la técnica de zig-zag (Soil Survey Staff, 2014) a una profundidad aproximada de 20 cm. Se utilizó pala de plástico para su extracción y bolsas de plástico de 5 kg para su almacenamiento temporal.
Una vez en laboratorio, se realizó una muestra compuesta de jal y se dejó secar a temperatura ambiente durante 24 h. Posteriormente, la muestra se homogenizó y mediante la técnica del cuarteo se subdividió hasta obtener muestras de 1 kg, aproximadamente; las muestras se tamizaron y se almacenaron en bolsas resellables.
Caracterización fisicoquímica de los jales de minas
La caracterización fisicoquímica de los jales de mina antes y después del tratamiento se realizó de acuerdo con la Norma Oficial Mexicana NOM-021-RECNAT-2000, determinando el porcentaje de saturación, pH, conductividad eléctrica, acidez extractable, capacidad de intercambio catiónico y densidad aparente.
Cepas bacterianas
Las cepas bacterianas usadas fueron Serratia K120, Serratia MC119, Enterobacter K125, Enterobacter MC156 y Klebsiella MC173, aisladas de la rizosfera de jales de mina de Zimapán, Hidalgo, y caracterizadas como bacterias promotoras de crecimiento vegetal (BPCV) (Mendoza-Hernández et al., 2016).
Preparación del inóculo
Las cepas seleccionadas fueron cultivadas en matraces Erlenmeyer de 500 ml en caldo Luria Bertani (LB) a 30 °C, agitación de 800 rpm durante 48 h. Posteriormente, fueron centrifugadas a 11 000 rpm durante 15 min. El pellet fue resuspendido en NaCl 0.9% para ajustar a una densidad óptica de 0.5 Å a 600 nm para obtener aproximadamente 1x109 UFCml-1.
Ensayo de las bacterias con el jal
Se realizó una inoculación de cada cepa bacteriana, 50 ml de la suspensión bacteriana en 100g de los jales de minas, usando dos testigos: (T1) jal y (T2) jal con NaCl 0.9%, y los jales se incubaron 30 °C durante 3 meses.
Análisis químico o extracción secuencial
La extracción secuencial fue realizada acorde a lo reportado por Tessier et al. (1979), Hall et al. (1996), Dold & Fontboté (2001) y Favas et al. (2011). Las fracciones que se consideraron son las siguientes: soluble, intercambiable, enlazada a carbonatos, enlazada a oxihidróxidos de Fe, enlazada a óxidos de Fe, enlazada a materia orgánica, enlazada a sulfuros y fracción residual.
La extracción secuencial inició con la fracción soluble, en donde se pesaron 2 g de jal y se disolvió en 16 ml de agua destilada. Esta suspensión se agitó durante 30 min en un agitador rotatorio a 80 rpm y posteriormente se centrifugó a 8000 rpm durante 20 min. El sobrenadante fue retirado con una pipeta y fue analizado mediante espectrofotometría de absorción atómica (Favas et al., 2011). Para la siguiente fracción se le agregó 16 ml de MgCl2 1 M al jal residual y se agitó durante 1 h; después, se centrifugó a 8000 rpm durante 20 min, y el sobrenadante se analizó como fracción intercambiable.
En la fracción unida a carbonatos al jal separado de la fracción intercambiable se agregó 16 ml de C2H3NaO2 1 M y se agitó durante 10 h; el sobrenadante se separó como el paso anterior para realizar el análisis como fracción unida a carbonatos. En la siguiente fracción, que corresponde a la fracción unida a Fe (III)-Oxihidróxidos, al jal residual se le agregó 80 ml de 0.2 M de (NH4)2C2O4 y se agitó por 1 h en la oscuridad, separando el sobrenadante por centrifugación. Luego, en la siguiente fracción, que corresponde a la fracción unida a Fe (III)-óxidos, al jal residual de la fracción anterior se colocó 40 ml de 0.0 4 M de NH2OH-HCl2, agitándose durante 6 h a 96 °C, y posteriormente se centrifugó durante 30 min, analizando el sobrenadante. Al jal residual de la fracción anterior se agregó 6 ml de 0.02 M de HNO3 más 10 ml de H2O2 y se agitó durante 2 h a 85 °C. Posteriormente, se le agregó 6 ml de H2O2 y se agitó durante 3 h a 85 °C. Después, a lo anterior se le agregó 10 ml de 3.2 M de NH4OOCH3 y se agitó durante 30 min, y se separó el sobrenadante analizándolo como fracción unida a materia orgánica (Dold & Fontboté, 2001; Tessier et al., 1979).
Acto seguido, en la fracción unida a sulfuros se le agregó al jal residual 1.5 g de KClO3 y 10 ml de HCl 12 M, se tapó y agitó en vórtex por 30 min; se agregó 20 ml de HNO3 4 M, se tapó y agitó en vortex durante 20 min a 90 °C; se separó el sobrenadante y se analizó (Favas et al., 2011; Hall et al., 1996). Finalmente, para la fracción residual se agregó al jal residual de la fracción anterior 10 ml de HNO3, 4 ml de HCl y 1 ml de H2O2. Se colocó en microondas a 180 °C por 15 min, y al término se filtró y diluyó la muestra a 50 ml con agua destilada (US Environmental Protection Agency [US-EPA], 1996).
El Pb y el As en todas las fracciones fue analizado mediante espectrofotometría de absorción atómica.
Microscopía electrónica de barrido (MEB)
Las muestras se colocaron en cinta de carbón conductor y se recubrieron con oro en una unidad de pulverización (Denton Vacuum, DESK vSCD-030) antes de analizarla por MEB (JEOL JSM6610LV). Los experimentos se llevaron a cabo utilizando un detector de electrones secundarios (SE) en un sistema de muestra a granel que funciona en modo de alto vacío a 20 kV de voltaje de aceleración. El equipo se encuentra acoplado con un sistema de microanálisis por dispersión de energía de rayos X (EDS).
Difracción de rayos X (DRX)
Los jales mineros se caracterizaron mediante la técnica de difracción de rayos X (DRX, BrukerD8 Discover). Los datos se recopilaron en un difractómetro Bruker modelo D8 Discover utilizando radiación CuKα (λ = 0.5418 nm) y modo de exploración por pasos (rango: 3°-90° de 2θ; tiempo de paso: 0s, 60 s; ancho: 0°,04°).
Análisis estadístico
Un análisis de varianza de un factor se realizó para detectar si al menos un tratamiento fue diferente. Así mismo, para detectar diferencias entre los tratamientos se realizó una comparación de medias usando la prueba de diferencia significativa honesta (DSH) de Tukey, con un nivel de significancia del 95% (α = 0.05). Todos los análisis se realizaron con el software SPSS versión 19.
Resultados
El análisis fisicoquímico de las muestras de jales de minas iniciales y los inoculados con las BPCV indica que se presentó una modificación en el porcentaje de saturación, siendo mayor con una diferencia significativa (p < 0.05) con la presencia de las bacterias con respecto al jal de mina sin inocular, y que hay una disminución del pH de 8.2 a 7.2 con diferencia significativa (p < 0.05) del jal de mina inoculado con bacterias con respecto al testigo sin inocular. La conductividad eléctrica, acidez extraíble, capacidad de intercambio catiónico y densidad real no mostraron cambios significativos con y sin bacterias (Tabla 1).
Tabla 1 Parámetros fisicoquímicos del jal de mina, solo y con BPCV.
| Parámetro | Jal de mina |
Jal, BPCV Enterobacter MC156 |
Jal, BPCV Serratia K120 |
Jal, BPCV Serratia MC119 |
Jal, BPCV Klebsiella MC173 |
Jal, BPCV Enterobacter K125 |
| Porcentaje de saturación | 52.5 ± 0.2* | 62.14 ± 0.1* | 65.78 ± 0.3* | 61.47 ± 0.2* | 60.12 ± 0.2* | 59.26 ± 0.3* |
| pH | 8.2 ± 0.1* | 7.2 ± 0.1* | 7.1 ± 0.2* | 7.5 ± 0.2* | 7.4 ± 0.1* | 7.3 ± 0.2* |
| Conductividad eléctrica | 1.84 ± 0.3 | 1.79 ± 0.2 | 1.78 ± 0.2 | 1.75 ± 0.3 | 1.81 ± 0.2 | 1.78 ± 0.3 |
| Acidez extraíble | 4.4 ± 0.2 | 3.7 ± 0.1 | 3.6 ± 0.2 | 3.8 ± 0.2 | 3.9 ± 0.2 | 3.6 ± 0.2 |
| Capacidad de intercambio catiónico (CmolKg) | 0.56 ± 0.2 | 0.65 ± 0.1 | 0.78 ± 0.1 | 0.63 ± 0.1 | 0.69 ± 0.2 | 0.62 ± 0.2 |
| Densidad real | 0.85 ± 0.1 | 0.82 ± 0.1 | 0.83 ± 0.2 | 0.79 ± 0.2 | 0.77 ± 0.1 | 0.80 ± 0.2 |
*Diferencias significativas (p < 0.05)
Fuente: Elaboración propia.
El análisis EDS de los jales de minas indicó la presencia de oxígeno (O), silicio (Si), calcio (Ca), hierro (Fe), potasio (K), aluminio (Al) y azufre (S) como los elementos más representativos. Los resultados se muestran en la Figura 1.
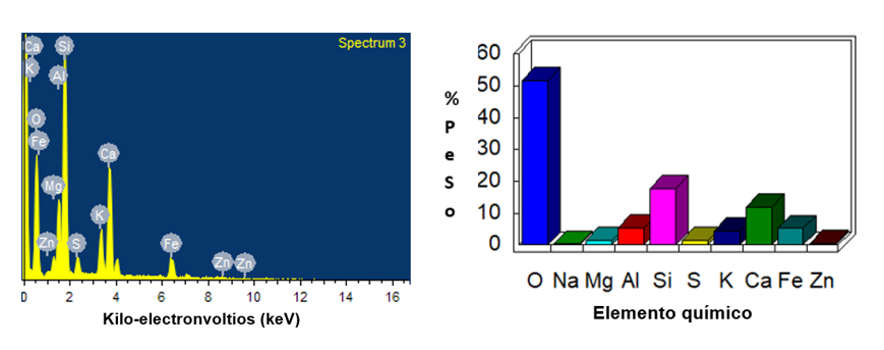
Fuente: Elaboración propia.
Figura 1 Imagen EDS de los elementos químicos detectados en los jales de minas.
Se empleó la técnica DRX para establecer y estudiar la estructura de las fases minerales presentes en la muestra de jales mineros. La Figura 2 muestra los difractogramas que indican que la muestra se compone principalmente por una mezcla de CaCO3 (Calcita, JCPDS-PDF 04-007-8659), SiO2 (Cuarzo, JCPDS-PDF 00-046-1045) y tecto-aluminosilicato de bario, calcio, sodio y potasio (K 0.88, Na 0.10, Ca 0.009, Ba 0.012) (Al 1.005, Si 2.995, O 8) (feldespato ortoclasa, JCPDS-PDF 01-076-0825). Se observan los picos más importantes para la calcita asignados a 2θ = 23.61°, 29.47°, 35.98°, 39.42°, 47.58°, 48.59°, 57.51°, 64.65° y 81.61°. En la misma figura se observan los picos a 2θ = 20.94°, 50.12° y 60.06°, siendo el más intenso en 26.66°, lo que corresponde al cuarzo. Los picos representativos asignados al feldespato ortoclasa se localizan a 2θ = 25.65°, 27.56°, 32.15°, 43.37° y 56.36°.
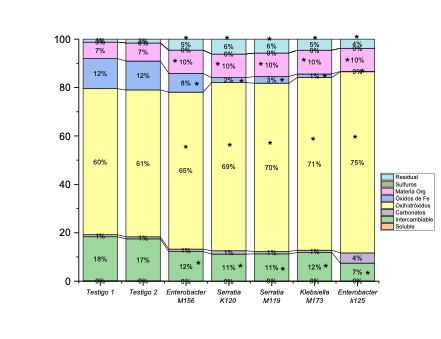
Del análisis de la movilidad del Pb en las diferentes fracciones de los jales de minas usando la biorremediación con BPCV, encontramos que estas influyen disminuyendo significativamente (p < 0.05) con respecto a los testigos el porcentaje de biodisponibilidad (fracción soluble, intercambiable y unida a carbonatos) de este metal en un 10.51% para la bacteria Enterobacter MC156, 13.37% para Serratia K120, 11.05% en Serratia MC119, 11.27% en Klebsiella MC173 y 11.88% en Enterobacter K125; se incrementó de manera significativa (p < 0.05) con respecto a los testigos en la fracción unida a sulfuros en un 5.83% para Enterobacter MC156, 6.47% en Serratia K120, 5.71% en Serratia MC119, 5.6% en Klebsiella MC173 y 7.07% en Enterobacter K125; y finalmente se incrementa significativamente (p < 0.05) en aproximadamente 1% para todas las bacterias en la fracción residual con respecto a los testigos, como se observa en la Figura 3.

* Diferencias significativas (p < 0.05)
Fuente: Elaboración propia.
Figura 3 Porcentaje de distribución de Pb en las diferentes fracciones del suelo con la presencia de BPCV.
La movilidad del As en las diferentes fracciones de los jales de mina en presencia de BPCV fue de la siguiente manera. Se presentó una disminución significativa (p < 0.05) con respecto a los testigos en las fracciones disponibles (soluble, intercambiable y carbonatos) de un 5.93% para Enterobacter MC156, 6.64% para Serratia K120, 6.94% para Serratia MC119, 6.38% para Klebsiella MC173 y 7.52% para Enterobacter K125. En la fracción de oxihidróxidos, se incrementó significativamente (p < 0.05) con respecto a los testigos en un 4.51% para Enterobacter MC156, 9.15% para Serratia K120, 9.23% para Serratia MC119, 10.99% para Klebsiella MC173 y 14.5% para Enterobacter K125. En la fracción de óxidos de Fe se presentó una disminución significativa (p < 0.05) con respecto a los testigos de 4.66% para Enterobacter MC156, 10.41% para Serratia K120, 9.67% para Serratia MC119, 10.98% para Klebsiella MC173 y 12.28% para Enterobacter K125. Para la fracción de materia orgánica se presentó un incremento significativo (p < 0.05), con respecto a los testigos, de 2.77% en Enterobacter MC156, 2.95% en Serratia K120, 2.86% en Serratia MC119, 3.02% en Klebsiella MC173 y 2.77% en Enterobacter K125. Finalmente, para la fracción residual se presentó un incremento significativo (p < 0.05), con respecto a los testigos de 3.31% en Enterobacter MC156, 4.95% en Serratia K120, 4.52% en Serratia MC119, 3-35% en Klebsiella MC173 y 2.54% Enterobacter K125, como se muestra en la Figura 4.
* Diferencias significativas (p < 0.05)
Fuente: Elaboración propia.
Figura 4 Porcentaje de distribución de As en las diferentes fracciones del suelo con la presencia de BPCV.
El índice de evaluación de riesgos (RLAC) para Pb para los testigos está entre el 11% y el 30%, lo que significa un riesgo medio al medio ambiente; sin embargo, después de los tratamientos con bacterias, es menor al 10%, lo que representa un riesgo bajo al medio ambiente. El RLAC para As en los testigos está entre el 11% y el 30%, lo que representa un riesgo medio para el medio ambiente; después de los tratamientos, disminuyó por debajo del 10% para las bacterias Serratia K120, Serratia Mc119, Klebsiella Mc173 y Enterobacter K125, mientras que para Enterobacter Mc156 sí disminuyó, pero no por debajo de 10% (Tabla 2).
Tabla 2 RLAC para Pb y As.
| RLAC Pb | ||||||
| Testigo 1 | Enterobacter MC156 | Serratia K120 | Serratia MC119 | Klebsiella MC173 | Enterobacter K125 | |
| Jales de minas + BPCV | 17.2 | 7.7 | 5.0 | 7.24 | 7.0 | 6.4 |
| RLAC As | ||||||
| Testigo 1 | Enterobacter MC156 | Serratia K120 | Serratia MC119 | Klebsiella MC173 | Enterobacter K125 | |
| Jales de minas + BPCV | 17.1 | 11.1 | 9.7 | 9.4 | 9.8 | 9.6 |
Fuente: Elaboración propia.
Discusión
Las BPCV pueden mejorar la biorremediación actuando por sí mismas o en los procesos de interacción con las plantas por la modificación de la solubilidad de fosfatos, la captación de Fe, la modificación del pH, la secreción de quelantes y la movilidad de los oligoelementos. Por otra parte, el conocimiento de la redistribución de los EPT en los sistemas de biorremediación con BPCV y plantas para hacerlos menos disponibles no se ha estudiado lo suficiente para entenderlo y puede ayudar a comprender el comportamiento del transporte y los riesgos potenciales hacia el medio ambiente y la salud humana (Li et al., 2021).
Las BPCV provocaron una redistribución significativa del Pb, movilizándolo de las fracciones disponibles (soluble, intercambiable y unida a carbonatos) a la fracción de sulfuros, y un poco a la fracción residual, disminuyendo su biodisponibilidad y el riesgo al medio ambiente y a la salud humana (Mngadi et al., 2020), siendo Serratia K120 y Enterobacter K125 las que mejor funcionan. Esto concuerda con lo reportado por Kidd et al. (2009) y Cao et al. (2018) en Pseudomonas fluorescens, donde disminuye el Pb en la fracción unida carbonatos. También coincide con los estudios de Radziemska et al. (2022), quien indicó que las rizobacterias ayudan a la estabilización de los EPT, moviéndoles de la fracción biodisponible a la fracción residual, favoreciendo los sistemas de biorremediación mediante el uso de bacterias que presentan la capacidad de vivir en sistemas con concentraciones elevadas de estos.
La disminución de la biodisponibilidad de los EPT provenientes de aguas contaminadas (Song et al., 2019) por la acción de las bacterias (Azouzi et al., 2019; Álvarez-Ayuso & Abad-Valle, 2021; Boostani et al., 2021) favorecería al crecimiento de las plantas en zonas en donde las actividades industriales generan contaminación por EPT, y en este caso, con BPCV no solo disminuiría la biodisponibilidad de los EPT, sino que también favorecería el crecimiento de las plantas.
Mngadi et al. (2020) han reportado que el As en jales de minas de extracción de oro se encuentra fundamentalmente en la fracción residual (55.4%-80.6%), mientras que en jales de minas de Zimapán donde se realizó el estudio se distribuye en mayor proporción en la fracción de oxhidrilos; y cuando se colocan las BPCV, este se moviliza de las fracciones biodisponibles (soluble, intercambiable y unida a carbonatos) a la fracción orgánica y la fracción residual, disminuyendo al riesgo de medio a bajo para el medio ambiente y la salud humana (Mngadi et al., 2020; Rajkumar et al., 2012), siendo la bacteria Serratia K120 y Enterobacter K125 las que mejor funcionaron, concordando con lo reportado por Bedoya et al. (2021).
Conclusiones
Las BPCV Serratia K120 y Enterobacter K125 contribuyen en la inmovilización del Pb y As de las fracciones disponibles a las menos disponibles, por lo que ayudarían a la estabilización de los EPT y pueden ser usadas para los sistemas de biorremediación de jales de mina, ya que modifican el riesgo al medio ambiente y a la salud humana, volviéndolo bajo.
Conflicto de interés
No existen conflictos de intereses.











 nueva página del texto (beta)
nueva página del texto (beta)



