Introducción
Las especies del género Myriophyllum poseen patrones de crecimiento característicos que les han permitido colonizar los hábitats acuáticos; en particular, Myriophyllum aquaticum (Vell.) Verdc., es una planta perenne herbácea nativa de Sudamérica, cuya forma de crecimiento acontece de acuerdo con las condiciones ambientales y de cultivo que tenga. Presenta dos tipos de hojas, las cuales pueden crecer juntas en la misma planta. Unas emergen del agua y suelen presentar la forma de plumas de ave, de color grisáceo verde, con estomas, una cutícula gruesa cerosa y foliolos cortos cilíndricos, y las otras son hojas sumergidas, de color típicamente anaranjadas a rojas, no presentan estomas ni cutícula foliar y crecen alrededor de los brotes sumergidos (Mason, 1957; Sutton & Bingham, 1973; Godfrey & Wooten, 1981). Esta especie acuática, al presentar dos formas de crecimiento distintas, posee la ventaja de sobreponerse a los cambios hídricos y ser competitiva sobre otras macrófitas sensibles a los cambios en el ambiente (Wersal & Madsen, 2011). Las plantas acuáticas sumergidas se reconocen como especies que presentan una alta plasticidad fenotípica, por lo que la dispersión de M. aquaticum está en función de su capacidad inherente de reproducción vegetativa rápida a partir de fragmentos vegetales (Kane et al., 1991). Asociado a esto, se conoce también que las hojas sumergidas de las angiospermas acuáticas poseen características estructurales que permiten la liberación de compuestos orgánicos (Hutchinson, 1975). Algunos productos del metabolismo secundario de las plantas poseen funciones ecológicas importantes para ellas en su defensa contra patógenos, la herbivoría de vertebrados e invertebrados e incluso algunos se consideran inhibidores del crecimiento del fitoplancton (Nakai et al., 2000). Aunque se sabe que existe una serie de compuestos activos en diferentes macrófitas, la mayoría de éstos aún no están identificados (Gross et al., 2003). Dentro de los compuestos químicos responsables de las interacciones alelopáticas en los sistemas acuáticos se encuentran los compuestos fenólicos, clasificados ampliamente en varios grupos; entre ellos están los fenoles simples y ácidos fenólicos, que han demostrado actividad algicida (D’Abrosca et al., 2006). Los ácidos como el gálico, elágico y pirogálico se han identificado como polifenoles responsables de la actividad algicida de Myriophyllum spicatum Linnaeus sobre cianobacterias y algas verdes (Nakai et al., 2000). Se ha reportado también que no afectan el crecimiento de diatomeas (Nakai et al., 2001). Gopal y Goel (1993) y Gross (1999) mencionan que este tipo de compuestos producen efectos tanto benéficos como perjudiciales que influyen sobre el crecimiento y desarrollo de los sistemas agrícolas y biológicos, por lo que los consideran aleloquímicos que pueden constituir una estrategia adaptativa de las macrófitas sumergidas. Gross et al. (2007) sugieren el empleo de homogenados de plantas o de sus extractos para evaluar dichos efectos; por ejemplo, se incluyen muestras de macrófitas frescas o secas que se utilizan sobre organismos prueba y se establecen bioensayos donde los extractos obtenidos de las plantas presentan fitotoxinas liberadas por ellas. Se han reportado algunos bioensayos de este tipo realizados con extracciones directas de plantas acuáticas de Ceratophyllum demersum Linnaeus, Elodea spp., Myriophyllum spp., Najas marina Linnaeus y Stratiotes aloides Linnaeus (Gross et al., 1996, 2003; Erhard y Gross, 2006; Mulderij et al., 2007). Macías et al. (2008) comentan que existe una serie de características que deben tomarse en cuenta cuando se selecciona un bioensayo para el estudio de los efectos de los extractos de plantas acuáticas; entre esas particularidades se incluyen no solamente a las especies de prueba, sino también su forma de crecimiento y fenología. Callaway y Ridenour (2004) y Morris et al. (2009) recomiendan especies sensibles a los efectos alelopáticos sobre aquéllas que en algún sentido coevolucionaron con ellas. Fletcher y Renney (1963) y Nasir et al. (2005) sugieren emplear especies de interés agronómico que se han empleado en bioensayos destinados a estudios de alelopatía bioquímica. Elakovich y Wooten (1989), Espen et al. (1997), Mishra y Choudhuri (1998) y Tiqua et al. (1996) mostraron que los efectos más evidentes de los compuestos tóxicos de plantas acuáticas resultaron en cuanto a la inhibición en la germinación y el crecimiento radical. Las evaluaciones de la tasa de germinación de semillas y la tasa de elongación radical de diferentes especies vegetales han sido de gran valor en los ensayos de fitotoxicidad; y no obstante que no necesariamente reflejen la complejidad de las interacciones entre los organismos que habitan un cierto ecosistema o nicho, pueden dar información preliminar valiosa. Fletcher et al. (1988), Sharifi et al. (2007), Valerio et al. (2007), Di Salvatore et al. (2008), Chen et al. (2010), Kočí et al. (2010), Ling et al. (2010) y Visioli et al. (2014), reportan que la OECD (Organization for Economic Cooperation and Development), la US-EPA (US Environmental Protection Agency) y la US-FDA (US Food and Drug Administration) recomiendan a Cucumis sativus Linnaeus, Lactuca sativa Linnaeus, Raphanus sativus Linnaeus, Trifolium pratensis Linnaeus, Triticum aestivum Linnaeus y Panicum miliaceum Linnaeus como las especies más sensibles para este tipo de bioensayos. Dado que los cultivos in vitro de plantas acuáticas constituyen sistemas viables para probar los mecanismos que no solamente regulan la regeneración vegetativa tanto de los meristemos preexistentes como del desarrollo de brotes adventicios, éstos permiten también conocer su fisiología. Este trabajo analizó el desarrollo de cultivos de Myriophylum aquaticum bajo condiciones de laboratorio, su asociación con la liberación de compuestos fenólicos y evaluó el efecto que producen sobre la germinación y elongación radical de Lactuca sativa.
Materiales y métodos
Ubicación del sitio de recolecta del material vegetal. El sitio de recolecta de las plantas de M. aquaticum fue la laguna de Salazar; sistema acuático que constituye parte de la cuenca hidrológica del río Lerma y que durante casi todo el año presenta poca profundidad. Se localiza al este de la capital del Estado de México, dentro del Parque Nacional Miguel Hidalgo y Costilla, ubicado en los municipios de Lerma, Ocoyoacac y Huixquilucan, entre las coordenadas 99º 19’ 40” y 99º 23’ 35” de longitud y entre los paralelos 19º 15’ 20” y 19º 19’ 20” de latitud (Arriaga et al., 1997; SEDUR, 2010). Las macrófitas presentes en este ecosistema son Lemna sp., Wolffia sp., Spirodella sp., Eichhornia crassipes (Mart.) Solms, Hydrocotyle sp., Ceratophyllum demersum Linnaeus y Myriophyllum aquaticum. Este cuerpo de agua presenta características químicas medias anuales de O2 (10.85 mg/L), conductividad (113.23 mS), pH (8.43), cloruros (16.5 ppm), NH3 (0.945 ppm), NH4 (1.01 ppm), NO2 (0.147 ppm), NO3 (1.15 ppm), sulfatos (10.5 ppm) y lodos (0.199 ppm) lo que lo caracteriza como un sistema eutrofizado (Hernández, 2013).
Colecta de plantas y establecimiento del cultivo de M. aquaticum. Se recolectaron en la laguna de Salazar, en la época de verano, un total de 60 esquejes aéreos de plantas de M. aquaticum de aproximadamente 20 cm, luego se colocaron en palanganas con agua de la laguna para su traslado al laboratorio. El establecimiento de los cultivos de las plantas de M. aquaticum en el laboratorio partió del lavado de los esquejes colectados con solución jabonosa y enjuague con agua corriente, para después esterilizarse superficialmente con una solución de hipoclorito de sodio al 10 % por 10 s, seguida de enjuagues con agua destilada estéril. Se colocaron 10 plantas de 15 cm de longitud previamente pesadas y marcadas en soportes de unicel (30 x 14.5 x 1cm) perforados con sacabocados de 5 mm de diámetro. Dichas perforaciones se distribuyeron en tres hileras que contenían 10 orificios con una distancia de 1 cm entre cada uno. Se depositaron los soportes con las plantas en acuarios con dimensiones de 30 x 14.5 x 20 cm que se llenaron con 6000 mL de medio EPA (Environmental Protection Agency): 96 mg de NaHCO3 + 60 mg de CaSO4 + 60 mg de MgSO4 + 4 mg de KCl, en un litro de agua destilada (Weber, 2002). Los cultivos se establecieron por cuadruplicado con tres condiciones de crecimiento para la producción de fenoles a los 2, 4 y 6 días, bajo condiciones de iluminación continua con una lámpara de luz fría de 4500 lux (67.5 µmol m-2 s-1) a temperatura ambiente de 22 ± 2 °C. Al final del tiempo determinado, se evaluó el crecimiento considerando como puntos finales de análisis (endpoints) la longitud (cm), el peso fresco (g) y el peso seco (g); el último se obtuvo secando el material vegetal por 24 h en estufa a 70 °C. Asimismo, se determinó la tasa de crecimiento (TC, %), para evaluar el incremento obtenido como reflejo del crecimiento de las plantas, a través de la expresión:
Evaluación de la cantidad de fenoles totales en las plantas de M. aquaticum.Ainsworth y Gillespie (2007) mencionan que el ácido gálico (AG) es un compuesto simple considerado como estándar de comparación y expresión de resultados de fenoles totales. En este ensayo se empleó para la evaluación de éstos en las plantas de M. aquaticum. Se consideró su estrato medio (EM) como el sitio de mayor concentración reportada por Viveros-Legorreta (2016), caracterizado de acuerdo con el color de las hojas y posición en el tallo (Fig. 1a); los estratos están distribuidos en tercios de 10 cm de longitud denominados como: estrato apical (EA), estrato medio (EM) y estrato radical (ER). Se tomaron dos muestras foliares de cada planta y se determinó la concentración de AG empleando el método del reactivo de Folín-Ciocalteu, según Sivaci et al. (2008), con el siguiente procedimiento: se molió el material vegetal con un homogeneizador de tejidos (Potter), donde se adicionaron 2.5 mL de etanol absoluto. Los tubos con los extractos foliares se dejaron en un baño de incubación a 25 °C por 24 h y después de ese tiempo se tomaron alícuotas de 1 mL de cada extracto, que se combinaron con 1 mL de etanol absoluto + 5 mL de agua destilada + 1 mL de reactivo de Folin-Ciocalteu al 50%. Se mezclaron vigorosamente y después de 3 minutos se adicionaron 3 mL de una solución de Na2CO3 al 2%. Los tubos se agitaron vigorosamente y se dejaron por 1 hora a temperatura ambiente para el desarrollo del color azul característico de la reacción con el reactivo de Folin-Ciocalteu. Después de este tiempo, se leyó la absorbancia de cada mezcla a 760 nm en un espectrofotómetro. Los valores se interpolaron en una curva tipo de ácido gálico (0 a 5 mg/mL) y la cantidad de los compuestos fenólicos totales producidos por las plantas de M. aquaticum se reportaron como mg de AG/mg peso fresco foliar.

Figuras 1a-d a) Distribución de los diferentes estratos establecidos para la evaluación de la producción de fenoles en Myriophyllum aquaticum (Vell.) Verdc.; b) Evidencia del crecimiento de las plantas de M. aquaticum en cultivo: 2 días; c) 4 días; d) 6 días. EA: Estrato Apical, EM: Estrato Medio, ER: Estrato Radical.
Evaluación de la liberación de fenoles de plantas de M. aquaticum al medio de cultivo. La evaluación de la liberación de los fenoles de las plantas de M. aquaticum al medio de cultivo también se realizó por el método del reactivo de Folín-Ciocalteu, según Sivaci et al. (2008), con las siguientes modificaciones al método citado: se tomaron alícuotas de 1 mL del medio de cultivo de cada tratamiento. Se añadió 1 mL de etanol absoluto + 1 mL de reactivo de Folin-Ciocalteu al 50%. Se mezclaron vigorosamente y después de 3 minutos se adicionaron 3 mL de una solución de Na2CO3 al 2%. Los tubos se agitaron vigorosamente y se dejaron por 24 h a temperatura ambiente para el desarrollo del color azul característico de la reacción con el reactivo de Folin-Ciocalteu. Después de este tiempo, se leyó la absorbancia de cada mezcla a 760 nm en un espectrofotómetro que se interpoló también en una curva tipo de ácido gálico (0 a 5 mg/mL) y la cantidad de los compuestos fenólicos totales liberados al medio de cultivo por las plantas de M. aquaticum se expresó como mg de AG por 200 mL medio de cultivo, volumen considerado en el que se cultivaron las plantas.
Evaluación del efecto de los fenoles liberados por M. aquaticum sobre la germinación y desarrollo de plántulas de Lactuca sativa. El establecimiento del bioensayo con semillas de Lactuca sativa var. Butter Crunch (Lactuca sativa L. var. secalina (Alef.) Juckenack), se realizó con semillas comerciales certificadas de esta especie, que se desinfectaron con hipoclorito de sodio al 10% por tres minutos y se enjuagaron tres veces con agua destilada estéril. Se depositaron 12 semillas por placa de Petri que contenían papel filtro estéril. Los experimentos testigo solo con 0.7 mL de agua destilada estéril y alícuotas de 0.7 mL de los medios de cultivo de las plantas de M. aquaticum crecidas a los 2, 4 y 6 días, por quintuplicado. Las placas se incubaron a 36 °C por 72 h; transcurrido ese tiempo se determinó el porcentaje de germinación y la medición de la longitud radical. El efecto de los fenoles liberados al medio se observó a través de la evaluación de su fitotoxicidad, empleando los índices del porcentaje de germinación residual normalizado (IGN) y de elongación radical residual normalizado (IER) empleado por Pacheco-Hernández et al. (2015), propuesto por Bagur-González et al. (2011):
Donde Germcult es el porcentaje promedio de las semillas germinadas con las alícuotas de los medios de cultivo colectados a los 2, 4 y 6 días de crecimiento de las plantas de M. aquaticum; mientras que Germtest es el porcentaje promedio de semillas germinadas en agua destilada (testigo).
Donde Elongcult es la longitud promedio de las radículas de las semillas germinadas con las alícuotas de los medios de cultivo colectados a los 2, 4 y 6 días de crecimiento de las plantas de M. aquaticum, y Elongtest es la longitud promedio de las radículas de las semillas germinadas en el agua destilada (testigo).
Estos índices, según Pacheco-Hernández et al. (2015), son herramientas que permiten analizar el efecto fitotóxico de compuestos liberados que inhiben o promueven el desarrollo y, de acuerdo con el índice reportado por Bagur-González et al. (2011), con valores de toxicidad que van desde -1 a > 0, con las siguientes categorías propuestas: A = de 0 a -0.25 baja toxicidad, B = de -0.25 a -0.5 toxicidad moderada, C = de -0.5 a -0.75 alta toxicidad y D = de -0.75 a -1.0, toxicidad muy alta. Estos autores establecen también que los valores del índice > 0 indican que se dio la estimulación del crecimiento de la radícula conocido como hormesis.
Análisis de datos. Todos los datos obtenidos se evaluaron con un análisis de varianza de una vía y se compararon las medias obtenidas a través de una prueba de Tukey-Kramer, empleando el programa estadístico Graph Pad Instat Ver. 2.03.
RESULTADOS
En los tratamientos establecidos para evaluar el crecimiento y producción de fenoles por las plantas de M. aquaticum se observó la promoción de la longitud de las plantas (Fig. 1), con un incremento en las tasas de crecimiento de la biomasa obtenida (%): 17.40 ± 4.13, 41.73 ± 9.2 y 54.17 ± 10.1 a los 2, 4 y 6 días, respectivamente, con diferencias significativas (p <0.001). La producción de fenoles presentó el mismo patrón entre la concentración medida en el estrato medio de las plantas: 0.33 ± 0.08, 0.04 ± 0.05 y 0.05 ± 0.04 mg AG/ mg peso fresco foliar, y la cantidad de fenoles liberados al medio de cultivo: 0.29 ± 0.04, 0.10 ± 0.03 y 0.06 ± 0.02 mg AG/200mL medio de cultivo, a los 2, 4 y 6 días, respectivamente (Figs. 2a y 2b), con diferencias sig nificativas (p <0.01) durante los 6 días del crecimiento de las plantas.
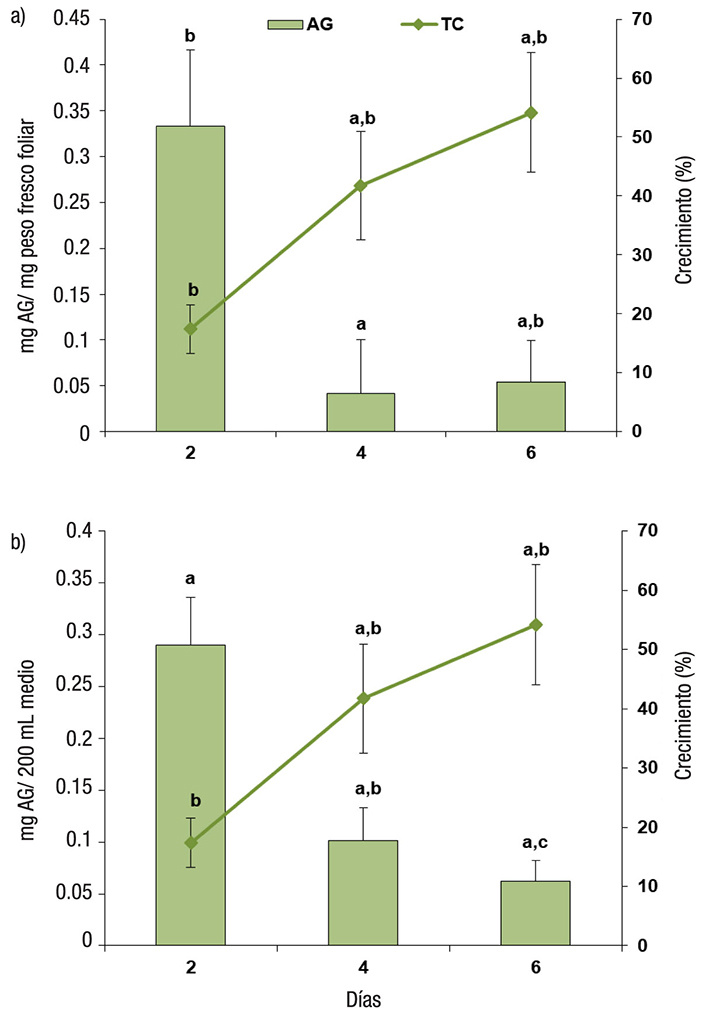
Figuras 2a-b Evaluación de los fenoles producidos y liberados al medio de cultivo y del crecimiento de las plantas de Myriophyllum aquaticum (Vell.) Verdc. en los tiempos seleccionados. a) Tasa de crecimiento y producción de compuestos fenólicos producidos por las plantas; b) Tasa de crecimiento y compuestos fenólicos liberados al medio de cultivo (n = 10, las diferentes letras muestran las diferencias estadísticamente significativas (p <0.001)).
La Figura 3a muestra los resultados de la evaluación del porcentaje de germinación, donde las concentraciones de AG cuantificado en el medio de cultivo no inhibieron la germinación de las semillas de L. sativa en comparación con las semillas germinadas en condiciones normales (testigo: 95 ± 11.1%). Se obtuvieron los valores de 84.9 ± 9.09, 98.32 ± 3.7 y 84.98 ± 10.8%, respectivamente, en las concentraciones de 0.29, 0.10 y 0.06 mg de AG, pero se observa un efecto contrastante sobre la elongación radical que evidenció el efecto promotor de éstas sobre las plántulas de L. sativa con un incremento del 57, 43 y 46% en la longitud radical ante la exposición a las concentraciones de AG probadas (0.29, 0.10 y 0.06 mg AG), comparadas con las plántulas testigo.

Figuras 3a-b Evaluación del efecto de los compuestos fenólicos (AG) producidos y liberados al medio de cultivo por las plantas de Myriophyllum aquaticum (Vell.) Verdc. a) Porcentaje de germinación (n = 60, sin diferencias estadísticamente significativas (p >0.05)); b) Longitud radical de L. sativa (n = 60, con diferencias estadísticamente significativas (p <0.001)).
Discusión
La producción y liberación de fenoles de las macrófitas que incluyen a M. aquaticum han sido estudiadas por diferentes autores (Gross et al., 1996; Nakai et al., 1999). En particular, Hilt et al. (2006) reportan que en la zona apical de las especies del género Myriophyllum se produce una alta cantidad de fenoles. En este estudio, la evaluación de la producción de compuestos fenólicos evidenció una relación directa entre esta especie y su comportamiento bajo cultivo, producto de la plasticidad genética reflejada en su heterofilia. Esto produjo la aceleración en el proceso de liberación de fenoles durante los primeros días de desarrollo, lo que coincide con lo reportado por Lindén y Lehtiniemi (2005), quienes observaron que con el manejo de esquejes de M. spicatum se dio la liberación de una alta concentración de fenoles bajo condiciones de laboratorio. Es importante notar que la heterofilia de M. aquaticum la sugiere como una especie con un impacto significativo de sensibilidad en bioensayos que emplean esta macrófita acuática; de igual manera, el hecho de que las altas tasas de crecimiento de los tallos de las macrófitas anfibias cuando se encuentran sumergidas son resultado de la acción primaria de procesos regulados por fitohormonas endógenas, y solo en parte resultado de la asimilación del carbono vía fotosíntesis, como lo reportan Ebke et al. (2013).
En cuanto a la evaluación del efecto de los compuestos fenólicos liberados por M. aquaticum sobre L. sativa, la comparación de los índices IGN y IER obtenidos a partir de las mediciones del porcentaje de germinación y la longitud radical de las plántulas de L. sativa indicaron que el efecto de las alícuotas probadas de los medios de cultivo que contenían las diferentes concentraciones de AG liberados por las plantas de M. aquaticum sobre la germinación de las semillas, tuvieron un efecto de baja toxicidad, en concentraciones de 0.29 y 0.06 mg AG (IGN, A = -0.10), con un ligero efecto sobre la germinación de las semillas expuestas a la concentración de 0.10 mg AG cuantificado en el medio de cultivo de IGN, E= 0.03, según la escala propuesta por Bagur-González et al. (2011). En este estudio, el índice que mostró más sensibilidad fue el IER, donde, no obstante que no se presentó un efecto fitotóxico de los fenoles presentes en el medio de cultivo de las muestras analizadas, sí se observó un efecto promotor sobre la elongación, según éste índice, con valores de E = 0.56, 0.43 y 0.45, bajo las concentraciones de 0.29, 0.10 y 0.06 mg AG respectivamente, comparadas con las plántulas testigo. Estos resultados se observan en la Figura 4, donde se muestra la apariencia de las plántulas de L. sativa bajo las condiciones establecidas en el bioensayo; pero no se notan cambios visibles en las raíces que muestren daño al compararse con las plántulas testigo. La Figura 5 muestra el comportamiento de las raíces de cada plántula de L. sativa expuestas a las diferentes concentraciones de AG cuantificado en relación con su longitud radical total, donde muestran variaciones muy similares en el crecimiento de las raíces de las plántu las desarrolladas bajo condición normal (testigo) y las expuestas a 0.10 y 0.06 mg AG, pero con mayor longitud radical obtenida en las plántulas expuestas a 0.29 mg AG. Esta respuesta resultó similar a la reportada por Ngoc-Bich y Kato-Noguchi (2012), quienes obtuvieron una relación de dosis-respuesta en el crecimiento radical de Echinochloa crus-galli (Linnaeus) P. Beauv., Lolium multiforum Lamarck, Medicago sativa Linnaeus y Lepidium sativum Linnaeus, expuestas a extractos de Centrostachys aquatica (R. Br.) Baill., Polygonum pulchrum Blume, Hymenachne acutigluma Steud y de Ischaemum hirtum Hack. Éstas reflejaron una respuesta de hormesis, fenómeno que es muy reconocido en estudios de fitotoxicidad en plantas; cuando ocurre se promueve su crecimiento a altas concentraciones al inicio de su desarrollo (Randhawa et al., 2002; Liu et al., 2003; Belz y Hurle, 2004; Ahmed et al., 2007; Belz, 2008).

Figura 4 Evidencia del efecto de hormesis producido por los compuestos fenólicos liberados al medio de cultivo, sobre la elongación radical de plántulas de Lactuca sativa L. T: Testigo; A: 0.29 mg AG/200 mL; B: 0.10 mg AG/200 mL; C: 0.06 mg AG/200 mL.

Figura 5 Comportamiento radical de las plántulas de Lactuca sativa L. producido por los compuestos fenólicos liberados al medio de cultivo por Myriophyllum aquaticum (Vell.) Verdc.
Einhelling y Rasmussen (1978) y Williams y Harland (1982) han reportado efectos aditivos o sinérgicos de diferentes compuestos fenólicos en las interacciones alelopáticas aun en bajas concentraciones. Quayyum et al. (1999) analizaron el efecto de extractos fenólicos acuosos de Myriophyllum verticillatum Linnaeus (200 mg/100 g peso fresco) sobre la germinación y desarrollo radical de L. sativa, con el 75% de la inhibición en su longitud radical.
En este trabajo, la respuesta obtenida con la aplicación de las alícuotas de los medios de cultivo de las plantas de M. aquaticum que contenían los fenoles liberados por éstas no resultó fitotóxica; por el contrario, favoreció la elongación radical en términos de la relación dosis-respuesta: E: 0.56, 043 y 0.45, para las concentraciones de AG de 0.29, 0.10 y 0.06 mg AG, respectivamente.
Pacheco-Hernández et al. (2015) mencionan que la medición de la elongación radical es un parámetro fisiológico importante para la evaluación de la toxicidad de compuestos, ya que durante los primeros días de desarrollo de las plántulas la presencia de una sustancia tóxica puede interferir en su fisiología, como lo reportan también Prati y Bossdorf (2004); Kadioglu et al. (2005) y Sobrero y Ronco (2008). Asimismo, la inhibición o promoción del crecimiento radical se considera como un buen sensor de la respuesta de las plántulas a compuestos activos que bien pueden tratarse de compuestos aleloquímicos (Pellisier, 2013). Por lo tanto, es necesario distinguir entre alelopatía y fitotoxicidad, como mencionan Ellakovich y Yang (1996); ya que no todos los compuestos fitotóxicos son aleloquímicos, aunque algunos aleloquímicos requieren ser fitotóxicos y, en consecuencia, emplear el tipo de bioensayos manejado en este estudio resulta útil para determinar aquellos compuestos activos que no necesariamente demuestran su comportamiento alelopático.
Es importante mencionar también que los biomarcadores de plantas ofrecen ventajas al evaluarse como endpoints. Arts et al. (2008) mencionan que un endpoint se define como una variable que refleja el desarrollo de un organismo prueba durante y después de su exposición a un compuesto tóxico; además de que los criterios de selección que deben tomarse en cuenta son los de relevancia ecológica y sensibilidad toxicológica, expresados como valores de toxicidad y de varianza. La sensibilidad de los endpoints y la varianza alrededor de los niveles de los experimentos testigo no son consideradas como variables independientes, dado que la varianza influye en las desviaciones de las concentraciones más altas a partir de los testigos y, con ello, en la sensibilidad. Por esta razón, la sensibilidad es el criterio más importante; mientras que en el caso de sensibilidades similares, la varianza puede emplearse como un segundo criterio. La selección de los endpoints solamente con base en los coeficientes de variación, sin considerar la sensiblidad, como lo han propuesto Knauer et al. (2006), pueden dar como resultado endpoints que no son en su mayoría sensibles toxicológicamente hablando. Hanson et al. (2003) evaluaron endpoints comparando la sensiblidad toxicológica, el poder estadístico y la relevancia ecológica, con lo que recomiendan el empleo de los endpoints radicales como indicadores de toxicidad. Schmidt y Redshaw (2015) consideran que la evaluación de la longitud radical o la elongación radical es uno de los endpoints más comunes que se emplean o aplican a los estudios de fitotoxicidad, y que los endpoints específicos de la longitud radical y del brote están en función de la longitud y biomasa de las plántulas. De nueva cuenta, se reporta que los efectos más evidentes que producen los compuestos tóxicos sobre las plantas son la inhibición de la germinación (Espen et al., 1997; Mishra & Choudhuri, 1998) y la inhibición en el crecimiento radical (Tiqua et al., 1996). Por esta razón, la tasa de germinación y de elongación radical de las plantas terrestres vasculares se ha empleado con mayor frecuencia en ensayos de fitotoxicidad para evaluar los efectos de compuestos orgánicos e inorgánicos (Reynolds, 1989; Wang y Keturi, 1990; Wang y Williams, 1990; Baudgrasset et al., 1993; Gong et al., 1999; Sharifi et al., 2007; Valerio et al., 2007; Chen et al., 2010; Koči et al., 2010).
Finalmente, como conclusiones de este estudio, el desarrollo de plantas acuáticas con patrones de plasticidad genética tan particulares como el que tiene M. aquaticum de la heterofilia, permite entender cómo este tipo de plantas anfibias se adapta a diferentes cambios en su hábitat, lo que le permite mantenerse en él o incluso colonizar otros sitios. Además de sus adaptaciones químico-ecológicas a través de la producción localizada de compuestos fenólicos en las plantas, bajo condiciones sumergidas, que a través de la aplicación de bioensayos con la evaluación de endpoints de germinación y radicales mostraron el efecto manifiesto de los compuestos fenólicos liberados por las plantas sumergidas de Myriopyllum aquaticum en el desarrollo temprano de plántulas de Lactuca sativa, caracterizados como compuestos bioactivos, al evidenciar su toxicidad baja o nula, de acuerdo con la relación dosis-respuesta.











 nueva página del texto (beta)
nueva página del texto (beta)


