ANTECEDENTES
La frecuencia de aneuploidias en embriones humanos varía de 20 a 80%,1,2es la más alta en comparación con cualquier otra especie. La identificación de anomalías cromosómicas es especialmente importante en embriones de pacientes con mayor riesgo de aneuploidia: edad materna avanzada, fallo de implantación o pérdida gestacional recurrente.3Por lo tanto, el análisis cromosómico del blastocisto es un factor con influencia para determinar si un embrión culminará en un recién nacido sano en casa.
Las técnicas de diagnóstico genético preimplantacional que evalúan aneuploidias, analizan el contenido cromosómico completo de una o varias células con alta sensibilidad y especificidad.4La muestra de partida se obtiene mediante una biopsia e implica mayor costo económico y un procedimiento invasivo para el embrión, por lo que un enfoque más económico y no invasivo resultaría más benéfico para todas las partes involucradas.
Existen avances recientes en este campo, el ADN circulante embrionario se ha identificado en medios de cultivo, su origen en la etapa de blastocisto podría atribuirse a la apoptosis que ocurre durante el desarrollo normal.5 Inicialmente se efectuaron algunos estudios dirigidos a detectar genes específicos, algunos de ellos relacionados con enfermedades monogénicas (MTHFR9, HBA1/HBA210, SRY11). Posteriormente, se llevaron a cabo las pruebas genéticas no invasivas de aneuploidias, con resultados altamente variables en la tasa de concordancia.6-9En este caso, cada patrón cromosómico observado en los medios de cultivo se comparó con el protocolo estándar de análisis de las células de trofoectodermo obtenidas durante la biopsia del embrión en día 5-6 de desarrollo. Sin embargo, la diferencia en los resultados puede relacionarse con las diferentes metodologías de amplificación y detección aplicadas. Además, las tasas de concordancia se definieron de manera diferente en cada estudio; es decir, los resultados aneuploides en los medios de cultivo embrionario y la biopsia de trofoectodermo podrían considerarse concordantes, a pesar de no mostrar los mismos cromosomas aneuploides.
La repercusión de las condiciones de cultivo en la eficacia del enfoque no invasivo la investigaron Hammond y colaboradores.5 Este grupo encontró un nivel muy bajo de contaminación de ADN (mitocondrial y nuclear) en los medios de control de tres tipos diferentes de medios comerciales, que no habían estado en contacto con los embriones. Se cree que el bajo nivel basal de contaminación del ADN es consecuencia del suplemento proteico de los medios de cultivo.
El objetivo de este estudio fue: analizar las tasas de concordancia, falsos positivos y negativos entre el ADN embrionario circulante en medio de cultivo y su relación con los reportes de la biopsia de trofoectodermo.
MATERIALES Y MÉTODOS
Estudio observacional, prospectivo y comparativo, llevado a cabo en el Centro de Reproducción Arcos Nascere en noviembre 2018. Criterio de inclusión: parejas en esquema de fertilización in vitro, con diagnóstico genético preimplantacional de aneuploidias. Criterios de exclusión: pacientes con anomalías estructurales o enfermedades monogénicas. Criterio de eliminación: blastocistos con eclosión asistida. A todos los casos se tomó biopsia de trofoectodermo y los reportes se compararon con un análisis doble ciego con el resultado de ADN circulante liberado por el mismo embrión en el medio de cultivo.
La biopsia del trofoectodermo se efectuó el día 5 o 6 según el desarrollo morfológico del embrión, y la muestra de cultivo embrionario se recolectó inmediatamente después de transferir el embrión a la placa de la biopsia. Después de la recolección de la muestra de cultivo embrionario, las muestras se almacenaron en congelación a -7 oC antes de enviarlas al laboratorio de genética. Los resultados de secuenciación de próxima generación se analizaron con un algoritmo patentado por Igenomix para identificar aneuploidias de cromosomas completos y aneuploidias segmentarias (del/dup> 15 Mb). Este algoritmo fue diseñado con ADNg de líneas celulares (Coriell Institute, NJ, EUA) con aneuploidias conocidas (trisomías 2, 9, 13, 15, 18, 20, 21 y 22). Después de secuenciar las muestras, los umbrales se calcularon con los datos sin procesar. Para este estudio, los umbrales fueron menos de 50% de ADN aneuploide para la euploidia y más menos 50% de ADN aneuploide para la aneuploidia.
Las tasas de éxito de amplificación de ADN (muestras amplificadas con éxito-muestras analizadas totales) se estimaron individualmente para biopsias de trofoectodermo y muestras de ADN circulante embrionario. El porcentaje de falsos positivos se estimó considerando la cantidad de biopsias de trofoectodermo euploides con muestras de cultivo embrionario aneuploide con respecto a los resultados informativos totales para ambos tipos de muestras. Los falsos negativos se calcularon con base en la cantidad de biopsias de trofoectodermo aneuploide con medio de cultivo embrionario euploide con respecto a los resultados informativos totales para ambos tipos de muestras. Para la concordancia cromosómica individual se excluyeron los embriones caóticos (≥ 6 aneuploidias), porque la baja cantidad o calidad de ADN también puede dar lugar a este tipo de perfiles.
La estimulación ovárica controlada y la inducción de la ovulación se llevaron a cabo conforme a la práctica clínica habitual. La recuperación de ovocitos se efectuó con guía vaginal por ultrasonido. Horas después de la captura se denudaron las células del cúmulo antes de la inyección intracitoplasmática de espermatozoides. Inmediatamente después, los ovocitos se lavaron en 0.6 mL de medio de manipulación multipropósito con albúmina de suero humano al 5% y, finalmente, se transfirieron a gotas individuales de 30 μL de medio de cultivo único continuo preequilibrado (CSCM; Irvine Scientific) en aceite mineral (Irvine Scientific). El cultivo de embriones individuales se realizó en una atmósfera humidificada controlada que contenía 5% de oxígeno y 6% de CO2. El día 4, cada embrión o mórula compactada se lavó a fondo en tres gotas secuenciales de 20 μL de medio de cultivo único continuo preequilibrado (CSCM; Irvine Scientific) y, finalmente, se trasladó a una gota individual de 10 μL. Para cada paciente se incluyó una muestra de control negativo de medios que siguieron el mismo protocolo, pero sin estar en contacto con el embrión. Los embriones que alcanzaron la etapa de blastocisto completamente expandido en el día 5 o 6 de desarrollo embrionario se trasladaron a una placa de biopsia y las muestras de medio de cultivo embrionario se recolectaron en tubos de reacción en cadena de la polimerasa mantenidos en hielo. El medio de cultivo embrionario correspondió a medios de cultivo acondicionado recolectados después de un solo día en cultivo (día 4 al día 5) o dos días en cultivo (día 4 al día 6). Se tomó biopsia de los blastocistos en su lugar mediante un método que implica la apertura simultánea de la zona pelúcida y la recuperación de fragmentos de la biopsia de trofoectodermo (Figura 1). No se realizó eclosión asistida, y a todos los embriones que alcanzaron la etapa de blastocisto completamente expandido se les tomó biopsia, independientemente de su calidad morfológica y día de desarrollo.

Figura 1 Ejemplificación del procedimiento para el diagnóstico genético preimplantacional no invasivo.
La comparación de los valores cuantitativos para los resultados de secuenciación de próxima generación de biopsias de trofoectodermo y medio de cultivo embrionario se efectuó con pruebas t de Student de muestra independiente, con un valor dep < 0.05 obtenido para una prueba de dos colas considerada estadísticamente significativa. Con la prueba Shapiro-Wilk se confirmó una distribución normal y con la prueba de Levene para la igualdad de varianzas la homocedasticidad; por esta razón se eligió una prueba paramétrica. Para comparar datos categóricos se realizaron pruebas de χ2 y se aplicaron pruebas exactas no paramétricas de Fisher en casos de bajo número. La p < .05 se consideró estadísticamente significativa. Estos análisis estadísticos se realizaron con el programa SPSS 25.0 (IBM).
Esta investigación fue aprobada por el Comité de Investigación de The American British Cowdray Medical Center, I.A.P., con el código IGX1-NIP-CS-18-02-SUB1.
RESULTADOS
Se analizaron 20 blastocistos de 5 parejas y se obtuvieron resultados informativos en 17 (amplificación global exitosa); 70% en día 5 y el 100% en día 6. La tasa de amplificación global fue de 85% (17 de los 20 medios de cultivo analizados), en día 5 fue de 70% en comparación con el día 6 de desarrollo, en donde la tasa de amplificación fue de 100% de los medios de cultivo analizados. Cuadro 1
Cuadro 1 Comparación de resultados en día 5 y día 6 entre biopsia de trofoectodermo y medio de cultivo
| Resultados (%) | Día 5 | Día 6 | Total | |
|---|---|---|---|---|
| Resultado informativo | Medio de cultivo | 70.0 (7/10) | 100.0 (10/10) | 85 (17/20) |
| Biopsia de trofoectodermo | 100.0 (10/10) | 90.0 (9/10) | 95.0 (19/20) | |
| Concordancia embrionaria | Concordancia entre biopsia de trofoectodermo con medio de cultivo | 42.8 (3/7) | 88.8 (8/9) | 68.7 (11/16) |
| Discordancia embrionaria | Falsos positivos | 42.8 (3/7) | 0 (0/9) | 18.7 (3/16) |
| Falsos negativos | 14.2 (1/7) | 11.11 (1/9) | 12.5 (2/16) | |
| Cantidad de muestras | 10 | 10 | 20 |
Las biopsias de trofoectodermo mostraron tasas similares de amplificación, independientemente del día en el que se tomó la biopsia y las horas de exposición al medio de cultivo. Por el contrario, la tasa de amplificación del medio de cultivo embrionario aumentó significativamente cuando se practicó en el día 6 de desarrollo embrionario en comparación con la recolección de muestras en día 5 (p=.0004). La tasa general de concordancia entre las biopsias de trofoectodermo y los medios de cultivo, en términos de diagnóstico, fue de 68.7%: 42.8% para el día 5 y 88.8% para los blastocistos del día 6 (Figura 2). Los resultados generales de concordancia para el día 6 fueron significativamente diferentes en comparación con el día 5. En cuanto a las discrepancias, sólo se observaron 3 falsos negativos en los medios de cultivo en comparación con la biopsia de trofoectodermo (tasa de falsos negativos de 14.2% para el día 5 y 11.1% para los blastocistos del día 6) (Cuadro 1) sin encontrar diferencias estadísticamente significativas entre ambos casos (Figura 3). Quizá los dos casos fueron el resultado de la contaminación con ADN materno porque en los dos casos solo se observó un cromosoma aneuploide. Por último, se reportaron 3 falsos positivos: 42.8% para el día 5 y 0% para los embriones del día 6. Figura 4
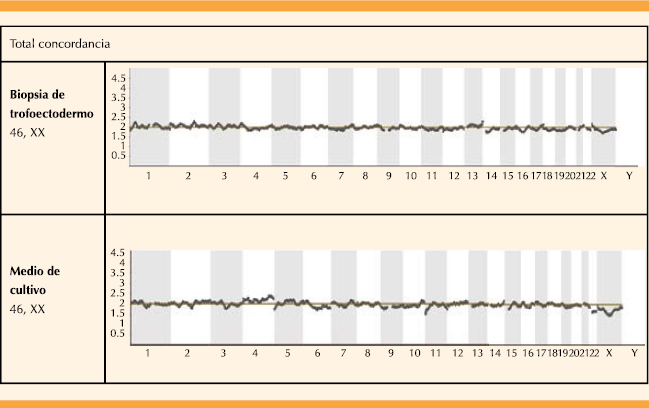
Figura 2 Embrión euploide cromosómicamente normal de sexo femenino en el que se obtuvo una concordancia total en la biopsia de trofoectodermo y muestra de ADN circulante embrionario.

Figura 3 Embrión aneuploide cromosómicamente anormal, de sexo femenino, diagnosticado por biopsia de trofoectodermo que muestra un falso negativo en muestra de ADN circulante embrionario con un resultado 46 XX.
DISCUSIÓN
Este es el primer estudio en México que demuestra la consistencia de las pruebas de aneuploidia con un enfoque no invasivo en comparación con la biopsia de trofoectodermo, avanzando un paso hacia la comprensión del valor clínico agregado de las pruebas genéticas no invasivas de aneuploidias. Con la incorporación de un enfoque no invasivo, nuestro objetivo fue considerar las dos limitaciones principales del análisis de aneuploidias a través del diagnóstico genético preimplantacional actual: i)la invasividad y ii)el costo-beneficio porque al no utilizar material adicional para la toma de una biopsia se disminuye el costo del procedimiento.
La concordancia entre el diagnóstico genético preimplantacional de aneuploidias y la prueba genética no invasiva de aneuploidias ya la reportaron otros grupos, pero con una variación notable.6-10 Sin embargo, estos estudios analizaron el ADN circulante embrionario desde el día 3 hasta el día 5 6,7,8,10 o, incluso, desde el día 1.9 La cantidad de embriones analizados en nuestro estudio fue de 20; además, en nuestro caso, programamos la recolección de medios de cultivo embrionario cultivados en condiciones específicas del día 4 al día 5, y del día 4 al día 6. Nuestro enfoque fue completamente no invasivo porque no se realizó una eclosión asistida o una vitrificación de espermatozoides, óvulos o embriones antes de la biopsia del trofoectodermo en comparación con otros estudios.6-10 A pesar de estas diferencias, nuestra tasa de amplificación global fue de 85% y alcanzó 100% en el medio de cultivo embrionario cuando los embriones se cultivaron 48 horas o más desde el día 4 en adelante. La tasa general de concordancia entre las biopsias de trofoectodermo y los medios de cultivo fue de 68.7% (42.8% para el día 5 y 88.8% para los blastocistos del día 6). Esta diferencia sugiere que 24 horas de exposición adicional al medio pueden conducir a mayor concentración de ADN expulsado y, por lo mismo, a mejores resultados.11,12A pesar de los diferentes criterios utilizados para definir las tasas de concordancia en otros estudios se alcanzó un alto nivel de concordancia sin intervención previa. Solo Xuy su grupo8tuvieron tasas de concordancia más altas (85.7%) pero ellos utilizaron procesos de vitrificación y calentamiento antes de tomar la biopsia, lo que podría propiciar la liberación de ADN circulante.
Cuando se analizaron las discordancias, 18.7% fueron falsos positivos y 12.5% falsos negativos. Esos valores fueron aún mejores cuando se considera en el día 6 la muestra de cultivo embrionario (con una media de 50.8 horas en cultivo desde el día 4) con 0% de falsos positivos y 11.11% de falsos negativos.
Se estudió la repercusión potencial de la calidad del embrión, la edad de la madre y la calidad de los espermatozoides, y no se observó ninguna influencia como lo sugieren otros estudios.13,14Con respecto a la metodología desarrollada para nuestro enfoque, el pequeño volumen de medio utilizado para cultivar los embriones (10 μL) fue una preocupación inicial. Minasi15reportó que un volumen reducido de medio no es perjudicial para el embrión, sino que en realidad mejora su desarrollo a blastocisto. Se cree que esto es una respuesta al aumento de factores autocrinos liberados por los embriones previos a la implantación.
En este estudio se aporta evidencia de que las modificaciones de las condiciones de cultivo, la manipulación de embriones y el protocolo de secuenciación de próxima generación pueden mejorar la tasa de amplificación y las tasas de concordancia y disminuir el efecto de las células de la granulosa en la precisión del diagnóstico. Este fue un estudio prospectivo que probó un nuevo enfoque con diferentes horas de cultivo de embriones en la gota de 10 μL para explorar el tiempo óptimo en cultivo. Se observaron mejores resultados con el tiempo de cultivo desde el día 4 hasta el día 6 en comparación con el tiempo más corto en el medio de cultivo.
Desde antes se han aplicado diferentes metodologías para la amplificación del genoma completo (de sus siglas en inglés WGA “Whole genome amplification”).16 Varios autores utilizaron un solo paso WGA,6-10mientras que Vera-Rodríguez y su grupo6realizaron una doble amplificación. Además, la hibridación genómica comparativa de la matriz fue la tecnología aplicada en algunos estudios,9,10mientras que la secuenciación de próxima generación se ha aplicado en las últimas publicaciones.6,7,8
En este estudio, y en gran parte de los previos, el análisis de muestras de medio de cultivo, falsos negativos y falsos positivos se determinó comparándolos con la biopsia del trofoectodermo, como el criterio estándar. De hecho, las biopsias de trofoectodermo son, seguramente, representativas de errores meióticos. Sin embargo, para la detección de errores mitóticos y la comprensión del mosaicismo, las nuevas fuentes de ADN, como el ADN circulante embrionario que potencialmente es liberado por las células de todo el embrión, podrían proporcionar información valiosa adicional y ayudar a dilucidar la repercusión real del mosaicismo en la clínica.
CONCLUSIONES
Se alcanzaron altas tasas de concordancia con la prueba genética no invasiva de aneuploidias, sobre todo en embriones del día 6. La mayor incidencia de fallas de amplificación y falsos positivos se reportó con análisis de embriones biopsiados en el día 5 de desarrollo embrionario, lo que sugiere que la baja concentración de ADN embrionario en los medios de cultivo se debe a un tiempo limitado de exposición de los embriones al medio de cultivo. Lo aquí expuesto ofrece una herramienta diagnóstica no invasiva en la evaluación genética del embrión en etapa tardía y su potencial de implantación.
Los resultados informativos (muestras amplificadas con éxito-muestras analizadas totales) se estimaron individualmente para biopsias de trofoectodermo y muestras de ADN circulante embrionario. La concordancia embrionaria se determinó por la cantidad de muestras con resultado coalescente entre biopsia de trofoectodermo con medio de cultivo embrionario con respecto a los resultados informativos. El porcentaje de falsos positivos se estimó considerando el número de biopsias de trofoectodermo euploides con muestras de cultivo embrionario aneuploide con respecto a los resultados informativos. Los falsos negativos se calcularon considerando la cantidad de biopsias de trofoectodermo aneuploide con medio de cultivo embrionario euploide con respecto a los resultados informativos.











 nueva página del texto (beta)
nueva página del texto (beta)



