ANTECEDENTES
La endometriosis es la implantación de tejido endometrial fuera de la cavidad uterina1,2 que produce inflamación y dolor pélvico, dismenorrea, dispareunia e infertilidad.3,4 Su incidencia se estima en 6 a 10% de mujeres en edad reproductiva, con importantes consecuencias en la calidad de vida y la fertilidad.5,6
Puesto que la laparoscopia es el procedimiento que confirma la endometriosis se le considera el patrón de referencia. 7 Es un procedimiento mínimamente invasivo, que requiere anestesia general y habilidad quirúrgica con riesgo de complicaciones operatorias. 8,9 Hace poco se demostró la expresión de pequeños RNAs no codificantes denominados microRNAs (miRNAs) que regulan la expresión genética por modulación postranscripcional10,11 que juegan un papel decisivo en la proliferación, diferenciación12,13 y migración celular. 14 Los miRNAs tienen buena estabilidad en diferentes fluidos corporales15,16 lo que ha permitido utilizarlos como biomarcadores de endometriosis. 12,17,18
Ohlsson y colaboradores19 analizaron, en tejido endometrial de pacientes con endometriosis y mediante un procedimiento laparoscópico, la expresión diferencial de 22 miRNAs de los que 14 aumentaron (hsa-miR-145, -143, -99a, -99b, -126, -100, -125b, -150, -125a, -223, -194, -365, -29c, y -1) y 8 disminuyeron su expresión (hsa-miR-196b, -20a, -34c, -424, -142, 200b, -141, y -200a). Los autores demostraron, en ensayos in silico (evaluación con el empleo de modelos de cómputo avanzados), que las pacientes con endometriosis tienen variaciones en la expresión de los miRNAs implicados en la regulación de diversas proteínas asociadas con la migración celular (c-Jun), angiogénesis y expresión epigenética (HDAC4, DNMT3A), y en el crecimiento y proliferación celular (E2F3). 19 Además, está demostrado que estos miRNAs están implicados en la señalización de proteínas de estrés celular, 20 quimiocinas, 21 NFKβ, 22 MAPK, 23 y PKC. 24
Suryawanshi y colaboradores25 evaluaron, en el plasma de pacientes con endometriosis y cáncer de ovario, la expresión de 23 hsa-miRNAs. En las pacientes con endometriosis encontraron aumento en la expresión de 3 miRNAs (hsa-miR-362, -1978, y -4284). Este perfil de expresión cambia en las pacientes con endometriosis y cáncer de ovario (hsa-miR-21, -1977, -4284). Se han asociado tres miembros de la familia del hsa-miR-200 con cáncer de endometrio26 y de ovario. 27,28 La detección de miRNAs circulantes en el plasma y otros fluidos permite utilizarlos como biomarcadores no invasivos para el diagnóstico de endometriosis.
Para este estudio se seleccionaron cuatro hsa-miRNAs asociados con endometriosis y respuesta inflamatoria (hsa-miR-2, -210y -141)proliferación celular y permeabilidad vascular (hsa-miR-21, -210), angiogénesis (hsa-miR-141, -200b) y con cáncer de ovario (hsa-miR-21, -200b). La hipótesis de trabajo fue la existencia de variaciones en los niveles de expresión del hsa-miR-21, -210, -200b y -141 en plasma de las pacientes con endometriosis. El objetivo del estudio fue: analizar y establecer las posibles diferencias entre pacientes con y sin endometriosis.
MATERIALES Y MÉTODOS
Estudio analítico, longitudinal y prolectivo efectuado en pacientes atendidas en la Clínica de Infertilidad del Instituto Nacional de Perinatología Isidro Espinosa de los Reyes de la Ciudad de México entre febrero de 2018 y agosto de 2019. Criterios de inclusión: pacientes con diagnóstico de endometriosis valorado por laparoscopia y clasificadas según las directrices de la American Society for Reproductive Medicine,9 y pacientes sin endometriosis.
Se obtuvo el consentimiento informado firmado de las participantes en el estudio. A cada una se le extrajeron 5 mL de sangre periférica, mediante punción de la vena cefálica y se colectó en tubos de K2-EDTA (BD Vacutainer). A las pacientes con endometriosis se les reprogramó dos días después para la electrofulguración de los focos endometriósicos y vueltas a citar una semana después de este procedimiento para su valoración y toma de 5 mL de sangre. Las muestras de sangre se centrifugaron a 1400 rpm durante 10 minutos, y se separó el suero para la obtención del RNA total.
Criterios de exclusión: pacientes con cualquier proceso inflamatorio, obesas, con alguna intervención quirúrgica no mayor a 12 meses, cáncer, enfermedad autoinmunitaria o algún padecimiento crónico-degenerativo. Criterios de eliminación: pacientes con expediente clínico incompleto.
Obtención del RNA
Se mezclaron 500 µL de suero del reactivo de TRIzol (Invitrogen; Carlsbad, CA, USA) y se prosiguió a la obtención del RNA con las recomendaciones de la casa comercial. Al finalizar el procedimiento, los tubos Eppendorf se incubaron toda la noche a temperatura ambiente y por inversión. Al día siguiente, las muestras se hidrataron con 50 µL de agua milliQ y se determinó la concentración de RNA al medir la relación de A260/280 en el espectrofotómetro (NanoDrop One, Thermo Scientific, Waltham, MA, USA).
Síntesis del cDNA mediante la reacción de la transcriptasa reversa
Para determinar el perfil de expresión de los cuatro miRNA se utilizó el método de transcriptasa reversa. Para la obtención del cDNA se utilizó el equipo Acces RT-PCR System (cat A1250; Promega, Madison WI, USA). En tubos Eppendorf independientes se agregaron 2.5 µL (3 ng) de RNA, 5 µL (1X) buffer AMV-TfI (cat A1260; Promega), 1 µL dNTP (10 mM), 2 µL MgSO4 (50 mM), 10 µL ddH2O, 1 µL AMV RT, y 1 µL (20 pmol) de la secuencia específica de iniciadores: hsa-miR-21 (GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACACAACT), hsa-miR-141 (GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACCCATCT), hsa-miR-200b (GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACTCATCA), hsa-miR-210 (GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACTCAGCC). La mezcla de reacción se incubó a 55 °C durante una hora y, al finalizar la reacción, se inactivó a 70 °C durante 15 minutos. El cDNA se almacenó a 4 °C hasta su amplificación por PCR.
Reacción en cadena de la polimerasa
Se amplificaron mediante PCR 2 μL del cDNA de cada muestra, la reacción se efectuó en tubos de 0.2 mL en un termociclador (Techne Touchgene gradient). La mezcla de reacción contenía 5 μL (1X) buffer AMV-TfI (Promega), 1 μL (20 pmol) de las secuencias de los iniciadores hsa-miR-21 (CCGGCCGATCGAATAG), hsa-miR-141 (CGGCCGTAACACTGTCTG), hsa-miR-200b (CGGCCGTAATACTGCCTGG), y hsa-miR-210 (CGGCCGCTGTGCGTGT), y 1 μL de la secuencia universal (GTGCAGGGTCCGAGGT). Las condiciones de PCR fueron: 94 °C durante 30 segundos y 40 ciclos (94 °C durante 30 segundos, 56 °C durante 30 segundos, 72 °C durante 30 segundos) y una extensión final a 72 °C durante 10 minutos. Los amplificados se mezclaron con Tris-ácido acético EDTA 1X (TAE; Bio-Rad, Hercules, CA, USA) y las muestras se analizaron en geles de agarosa al 4.0% con solución amortiguadora de TAE 1x (TAE; BioRad). Los geles se procesaron a 60 V a temperatura constante durante 40 minutos. Por último, los geles se visualizaron en luz ultravioleta (Gel Doc 2000, BioRad), y se captó la imagen para su análisis. La densidad óptica de cada banda se obtuvo mediante el programa de ImageJ (NIH, USA) y se expresó en unidades arbitrarias.
Los datos demográficos (edad de la madre, índice de masa corporal, concentración de hormonas, y expresión de la densidad óptica de los hsa-miRNAs entre los grupos) se analizaron con t de Student (SigmaStat version 10.0, USA). Los resultados se presentan con media ± desviación estándar; se consideró con diferencia estadísticamente significativa el valor menor a 0.05.
RESULTADOS
De acuerdo con los criterios de inclusión y exclusión, la muestra de estudio se integró con 21 pacientes de las que 11 se asignaron al grupo de endometriosis leve (n = 6) o moderada (n = 5), y el grupo control pacientes sin endometriosis (n = 10). El Cuadro 1 muestra las características demográficas de los dos grupos de estudio. La edad de las pacientes (p = 0.268), índice de masa corporal (p = 0.392) y los valores de FSH (p = 0.275) y LH (p = 0.549) tomados en la fase folicular temprana no mostraron diferencias estadísticamente significativas entre el grupo de endometriosis versus el grupo control (Cuadro 1). En las pacientes con endometriosis se encontraron dos grados de severidad agrupados en tipo I-II (6/11) y III-IV (5/11). En cuanto a la intensidad del dolor pélvico, valorado por la escala visual analógica, se encontró aumento significativo de 2.6-veces en las pacientes con endometriosis versus el grupo control (p = 0.045; Cuadro 1). En estos grupos de estudio se encontraron padecimientos agregados: resistencia a la insulina (p = 0.32; Cuadro 1), hipotiroidismo subclínico (p ≤ 0.001) y síndrome de ovario poliquístico (p ≤ 0.001).
Cuadro 1 Características clínicas de las pacientes estudiadas con y sin endometriosis
| Variable |
Control (n = 5) |
Endometriosis (n = 6) |
P |
| Edad (años) | 32.3 ± 4.2 | 30.1 ± 4.8 | 0.268 |
| IMC (kg/ma) | 25.3 ± 2.6 | 26.5 ± 3.4 | 0.392 |
| Tabaquismo, n | 2 | 0 | ≤ 0.001 |
| Intensidad del dolor (EVA) | 1.7 ± 2.1 | 4.45 ± 3.6 | 0.045 |
| Grado de endometriosis (rASRM stage) I-II, n III-IV, n |
N.A N.A |
6 5 | |
| FSH (mU/mL) | 5.8 ± 3.2 | 5.8 ± 4.8 | 0.275 |
| LH (mU/mL) | 2.7 ± 1.2 | 3.8 ± 3.4 | 0.549 |
| Padecimientos agregados RI n HSC n SOP n |
2 3 4 |
3 6 0 |
0.320 ≤ 0.001 ≤ 0.001 |
IMC: índice de masa corporal; EVA: escala visual análoga, rASRM: revisión de la American Society of Reproductive Medicine; FSH: hormona folículo estimulante; LH: hormona luteinizante; RI: resistencia a la insulina; HSC: hipotiroidismo subclínico; SOP: síndrome de ovario poliquístico. Los datos se presentan como la media ± desviación estándar y la prueba estadística se realizó mediante la prueba de t de Student.
Perfil de expresión de los miRNAs
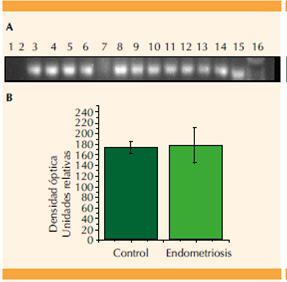
La expresión del hsa-miR-21 y hsa-miR-200b aumentó significativamente 1.3 (p =0.008; Figura 1) y 1.18-veces (p = 0.032; Figura 3) respectivamente en pacientes con endometriosis versus el grupo control. El hsa-miR-141 no fue estadísticamente significativo entre ambos grupos (p =0.149; Figura 2). Por último, el hsa-miR-210 disminuyó 1.26-veces en las pacientes con evidencia de endometriosis, aunque no fue estadísticamente significativo con respecto al grupo control (p =0.073; Figura 4).

Se muestra la expresión diferencial entre el grupo de pacientes sanas (control), y con endometriosis (A). La imagen es representativa y se muestra el control negativo (carril 1), muestras de pacientes del grupo control (carriles 2-9), y la expresión de las pacientes con endometriosis (carriles 10-14), control positivo de carga (carril 15), y marcador de peso molecular (carril 16). La gráfica muestra la densidad óptica (unidades relativas) de las bandas de expresión (B). Se indica la diferencia estadísticamente significativa **p = 0.008.
Figura 1 Expresión de PCR del hsa-miR-21.
Se muestra la expresión diferencial entre el grupo de pacientes sanas (control), y con endometriosis (A). La imagen es representativa y se muestra el control negativo (carril 1), muestras de pacientes del grupo control (carriles 2-9), y la expresión de las pacientes con endometriosis (carriles 10-14), control positivo de carga (carril 15), y marcador de peso molecular (carril 16). La gráfica muestra la densidad óptica (unidades relativas) de las bandas de expresión (B). No se encontró diferencia estadísticamente entre ambos grupos p = 0.149.
Figura 2 Expresión de PCR del hsa-miR-141.

Se muestra la expresión diferencial entre el grupo de pacientes sanas (control), y con endometriosis (A). La imagen es representativa y se muestra el control negativo (carril 1), muestras de pacientes del grupo control (carriles 2 9), y la expresión de las pacientes con endometriosis (carriles 10-14), control positivo de carga (carril 15), y marcador de peso molecular (carril 16). La gráfica muestra la densidad óptica (unidades relativas) de las bandas de expresión (B). Se indica la diferencia estadísticamente significativa
Figura 3 Expresión de PCR del hsa-miR-200b.

Se muestra la expresión diferencial entre el grupo de pacientes sanas (control), y con endometriosis (A). La imagen es representativa y se muestra el control negativo (carril 1), muestras de pacientes del grupo control (carriles 2-9), y la expresión de las pacientes con endometriosis (carriles 10-14), control positivo de carga (carril 15), y marcador de peso molecular (carril 16). La gráfica muestra la densidad óptica (unidades relativas) de las bandas de expresión (B). Se indica la diferencia estadísticamente significativa p = 0.073.
Figura 4 Expresión de PCR del hsa-miR-210.
En las pacientes con diagnóstico de endometriosis a quienes se practicó el procedimiento de electrofulguración (n = 5) se observó disminución significativa de 1.41, 1.10, y 1.10-veces en el hsa-miR-21 (p = 0.002), -141 (p = 0.03), y -210 (p = 0.009), respectivamente, versus las pacientes con endometriosis sin electrofulguración (n = 6; Cuadro 2). Por último, el hsa-miR-200b disminuyó 1.0-veces en las pacientes con fulguración aunque no fue estadísticamente significativo con respecto a las pacientes con endometriosis sin elecrofulguración (p = 0.369; Cuadro 2).
Cuadro 2 Pacientes con endometriosis y con procedimiento de electrofulguración de focos endometriósicos y pacientes sin electrofulguración a lesiones
| hsa-miR |
Electrofulguración (n = 5) |
Sin electrofulguración (n = 6) |
p |
| -21 | 63.5 ± 11.7 | 89.5 ± 9.0 | 0.002 |
| -141 | 174.6 ± 9.9 | 186.6 ± 5.2 | 0.030 |
| -200b | 97.4 ± 6.5 | 101.0 ± 6.0 | 0.369 |
| -210 | 99.0 ± 7.1 | 109.0 ± 2.5 | 0.009 |
Los datos se presentan con media ± desviación estándar y la prueba estadística se realizó con t de Student.
En estas 6 pacientes no se realizó electrofulguración conforme al criterio de cada cirujano, por encontrarse los focos endometriósicos en sitios anatómicos de riesgo para la aplicación de energía: vejiga, recto o vasos sanguíneos.
DISCUSIÓN
Se analizaron el nivel de expresión del hsa-miR-21, -210, -200b, -141 y la endometriosis. Los principales hallazgos fueron: 1) el hsa-miR-21 (Figura 1) y el hsa-miR-200b (Figura 3) aumentaron su expresión en las pacientes con endometriosis con respecto al grupo control; y 2) la fulguración reduce significativamente la expresión del hsa-miRNA-21, -141, y -210 con respecto a las pacientes con endometriosis sin fulguración (Cuadro 2). El hsa-miR-21 y el hsa-mir-200b promueven diferentes vías de señalización involucradas con la endometriosis. Cuadro 3
Cuadro 3 Vías de señalización y blancos moleculares del hsa-miR-21 y hsa-miR210b en la endometriosis
| hsa-miRNA | Regulación | Función en la endometriosis | Ref |
| -21 | VEGF ↑ | Incrementa la permeabilidad vascular y la fosforilación de proteínas de señalización, induce la degradación de la matriz extracelular por la MMP-3 y -9 |
30 |
| HIF-1α ↑ | Incrementa la apoptosis y proliferación celular, metástasis y tumoración |
44, 45 | |
| MMIF ↑ | Activa la respuesta inflamatoria de las células T |
46 | |
| IL-1β ↑ | Modula las células inmunológicas y activa el TNFα de las proteínas degradantes de MMP-3 |
32 | |
| IL-8 ↑ | Recluta células de la respuesta inflamatoria, y promueve la apoptosis en las células endometriales |
32 | |
| TNFα ↑ | Modula la respuesta inmunológica y es un activador degradante del endotelio por la MMP-3, y -9 |
18, 31 | |
| MMP-3 ↑ | Degrada los componentes de colágeno de la matriz extracelular, se asocia con la metástasis y tumores invasivos |
36 | |
| -210 | TEM ↑ | Regula los factores de transición epitelial, y modula la expresión en el epitelio de las proteínas de adhesión celular E-cadherina. |
38, 47 |
| MAPK ↑ | Promueve la fosforilación de las proteínas de señalización intracelular de proliferación celular |
39 | |
| NFKβ ↑ | Promueve la activación de la IL-1β, -8, TNFα, MMPs | 40 | |
| IL-1β ↑ | Activa la respuesta inflamatoria de macrófagos y promueve la expresión de la proteína NOD2 |
41 |
VEGF: factor de crecimiento endotelial vascular; HIF-1α: factor inducido por hipoxia; MMIF: factor inhibitorio de migración de macrófagos; MMP-3: metaloproteasa de matriz extracelular; NOD2: dominio de oligomerización a la proteína 2.
Está reportado, en tejido endometrial29 y en el plasma25 de pacientes con endometriosis el incremento del hsa-miR-21 que modula la función de la proteína ARID1A/BAF250a asociada con la transformación de cáncer ovárico. 30 Se ha determinado que el hsa-miR-21 modula a la proteína Notch1 involucrada con la cascada de señalización inflamatoria. 31 En la población estudiada solo se admitieron pacientes con endometriosis lo que aumentó significativamente la expresión del hsa-mir-21 con respecto al grupo control (Figura 1). Se demostró que el hsa-miR-21 se asocia con la modulación del factor de crecimiento endotelial vascular, 32 la secreción de las IL-8, 18,33 IL-1β, 34 y del TNF-α, 35,36 y la activación de la metaloproteasa de matriz extracelular (MMP). 3,37 Este proceso inflamatorio estimula a las células del estroma endometrial, macrófagos y a las células citotóxicas NK a la producción de IL-1β. 38 En el estudio aquí reportado se demostró que la electrofulguración de los focos endometriósicos disminuye la expresión del hsa-miR-21. Faltó evaluar a las citocinas de la respuesta inflamatoria, lo que se hará en otra etapa del estudio.
Rekker y colaboradores39 demostraron, en el plasma de pacientes con endometriosis, la disminución significativa en la expresión del hsa-miR-200a, -200b, y -141 modificando la transición del epitelio mesenquimal. El modelo de acción entre la familia de hsa-miR-200 y el efecto en el epitelio mesenquimal es mediado por los factores transcripcionales represores (ZEB1, y ZEB2; zinc finger E-box-binding homeobox), y la proteína SIP1 (smad-interacting protein 1). La disminución del hsa-miR200 incrementa la expresión del epitelio mesenquimal al bajar la expresión de la proteína epitelial de tipo cadherina (E-cad) y favorecer la endometriosis. 40,41 Contrariamente en el estudio reportado en las pacientes con endometriosis se encontró aumento significativo del hsa-miR-200b con respecto al grupo control. Está demostrado que la familia del miR-200 se asocia con la regulación de factores de transcripción involucrados con la transición epitelial-mesenquimal (TEM),24,42 la proteína cinasa de activación mitogénica y la vasculogénesis, 43 factor nuclear (NF)-Kβ44 y la producción de IL-1β. 45
Está demostrado que la fulguración reduce las molestias del dolor pélvico. 46,47 En este estudio en las pacientes a quienes se hizo fulguración de focos endometriósicos se observó una reducción significativa de 1.41-, 1.06-, y 1.1-veces en la expresión del hsa-miR-21, -141 y -210, respectivamente, con respecto a las pacientes con endometriosis a quienes no se les practicó ese procedimiento (Cuadro 2). No existen reportes en la bibliografía que indiquen los cambios en la secreción de las proteínas antes y después de la fulguración por lo que será demostrado en otro estudio.
CONCLUSIONES
Con lo aquí descrito se demuestra que las expresiones de hsa-miR-21 y hsa-miR-210b aumentaron significativamente en las pacientes con endometriosis por lo que estos miRNAs podrían utilizarse como posibles biomarcadores no invasivos; se han implicado en diversas vías de señalización inflamatoria, apoptosis y en la diferenciación de la respuesta inmunológica. El mecanismo de acción y la regulación en la expresión de estos miRNAs se tratará en otro estudio.











 nueva página del texto (beta)
nueva página del texto (beta)


