ANTECEDENTES
La fertilización in vitro es una técnica que en la actualidad se ofrece a millones de personas en todo el mundo.1 Consiste en una fase de estimulación ovárica controlada con gonadotropinas exógenas, lo que permite aumentar la cantidad de folículos y ovocitos maduros disponibles, lo que a su vez incrementa la cantidad de embriones de buena calidad disponibles para transferencia y mejora las tasas de embarazo clínico y de nacimiento vivo. 2
Sin embargo, en alrededor de 6% de los ciclos de fertilización in vitro se obtienen menos de 5 folículos maduros a pesar de las altas dosis de gonadotropinas exógenas, 3 lo que se le denomina baja respuesta ovárica. 4 En general, las pacientes con baja respuesta ovárica tienen tasas de embarazo más bajas que quienes tienen una respuesta normal. 3,5 La fisiología detrás de los ovarios que reaccionan mal a la hiperestimulación es una cantidad reducida de folículos sensibles a la FSH, más frecuentemente relacionados con la reserva ovárica disminuida. Sin embargo, en algunos casos, una respuesta deficiente también se asocia con una exposición subóptima a las gonadotropinas; por ejemplo, en mujeres obesas6 o con subtipos de receptores de FSH que hacen que los folículos sean menos sensibles a las gonadotropinas exógenas. 7
La mala respuesta a una estimulación ovárica controlada puede ser difícil de identificar antes de iniciar un ciclo de fertilización in vitro, incluso si se tiene en cuenta la edad de la paciente y la prueba de reserva ovárica. 8 Cuando se tratan pacientes con baja respuesta ovárica durante un ciclo de fertilización in vitro hay tres opciones disponibles. La primera es continuar con la estimulación a pesar de la baja respuesta, y llevar a cabo la recuperación de ovocitos y transferir los embriones disponibles. 9 Existe un riesgo alto de no recuperar ovocitos y de no tener embriones para transferir, lo que debe sopesarse frente a los riesgos de complicaciones asociadas con la captura ovocitaria y la anestesia. Además, tales situaciones podrían ser la fuente de una gran decepción y estrés para la pareja, y deberían ser aconsejados a fondo antes de continuar con la estimulación. La segunda opción es la conversión del ciclo de fertilización in vitro a una inseminación intrauterina en pacientes con al menos una salpinge permeable y parámetros de semen adecuados. 10 La conversión a inseminación intrauterina permite a la pareja beneficiarse de los tratamientos ya administrados, sin el riesgo de una falla en la recuperación de los ovocitos-transferencia de embriones. Por último, la tercera opción es cancelar por completo el ciclo de fertilización in vitro. 11 La decisión de cancelar un ciclo siempre es desafiante porque implica no solo consideraciones clínicas, sino también emocionales y financieras.
En otros estudios se han analizado estas estrategias con desenlaces contradictorios, sobre todo debido a diseños diferentes que, en ocasiones, no han incluido un grupo de comparación10,11,12 o diferente resultado clínico como objetivo primario del estudio porque los autores han utilizado el embarazo clínico como la principal medida de resultado. 13,14 Una revisión sistemática sugirió que la continuación con la fertilización in vitro puede ofrecer mayor probabilidad de lograr un embarazo clínico; 15 sin embargo, la revisión tiene varias limitaciones: 1) no utilizó la tasa de nacido vivo como resultado primario; 2) incluyó estudios efectuados en pacientes con otro diagnóstico además de baja respuesta ovárica; 3) algunos de los estudios incluidos solo analizaron pacientes que alcanzaron la transferencia de embriones, lo que podría tergiversar los resultados a favor de la fertilización in vitro; y 4) no realizó un metanálisis de los resultados
Con base en lo anterior, así como la falta de evidencia sustancial de revisiones sistemáticas que evalúen el papel de la fertilización in vitro frente a la conversión del ciclo a inseminación intrauterina, nos propusimos realizar la primera revisión sistemática y metanálisis con el objetivo de comparar la continuación con una fertilización in vitro vs convertir el ciclo en una inseminación intrauterina en mujeres con baja respuesta ovárica, revisando los mejores datos disponibles hasta la fecha para determinar qué estrategia se asocia con mayor probabilidad de tasa de nacidos vivos.
METODOLOGÍA
El estudio se adhirió a las pautas de informes preferidos para revisiones sistemáticas y metanálisis (PRISMA). 16 El protocolo del estudio se registró en http://www.crd.york.ac.uk/PROSPERO/CRD42020187820 antes de comenzar la revisión. Este estudio estuvo exento de la aprobación de la junta de revisión institucional porque se trata de una revisión sistemática.
Criterios de elegibilidad
El modelo PICO (pacientes, intervención, comparación y resultados) se utilizó para seleccionar la población de estudio. 17 Se incluyeron mujeres-parejas que recibieron una fertilización in vitro que resultó en baja respuesta (≤ 4 folículos) y que se decidió comparar la tasa de nacidos vivos continuando con la captura ovocitaria versus la conversión del ciclo en inseminación intrauterina.
Estrategia de búsqueda
La búsqueda se emprendió en estudios apropiados para la pregunta clínica en MEDLINE, ClinicalTrials.gov, PubMed, Google Scholar y Cochrane Library (http://www.cochranelibrary.com). Se hizo una combinación de términos MeSH o palabras clave relevantes para comparar la tasa de nacidos vivos de fertilización in vitro vs inseminación intrauterina en pacientes con baja respuesta a una estimulación ovárica. Los autores también verificaron citas en la Web of Science y buscaron manualmente las referencias de los artículos. Las búsquedas fueron coordinadas en mayo 2020. Las actualizaciones de búsqueda se efectuaron en agosto 2020. Todos los registros fueron evaluados para la elegibilidad por dos revisores independientes. Se incluyeron todos los artículos originales revisados por pares, independientemente del diseño del estudio.
Las estrategias de búsqueda electrónica en la base de datos incluyeron un modelo combinado de términos: (“Ovulation Induction” o “ovarian stimulation” o “ovarian hyperstimulation” or (COH)OR(COS)) and (“Low respon*” o “Poor ovarian respon*” o “Low Follicle number*”) y (“Fertilization in Vitro” o “in vitro fertilization” o (IVF) o “Reproductive Techniques, Assisted” o “Oocyte Retrieval” o “Egg Collection”) y (“Insemination, Artificial” o “Intrauterine Insemination” o (Insemination) o (IUI)) y (“Live Birth Rate” o “Live Birth” o “Pregnancy Outcome” o “Pregnancy” o “Treatment Outcome” o “Infant, Newborn” o “Birth Rate” o “Live-Birth”).
Selección de estudios
Dos revisores evaluaron de forma independiente los títulos y resúmenes. Las duplicaciones se eliminaron con el programa en línea Zotero y manualmente. Las decisiones finales de inclusión-exclusión se tomaron al examinar los artículos en su totalidad. Las discrepancias se resolvieron mediante discusión y consenso entre los autores, con la participación de otro autor. Para adquirir el mayor nivel de evidencia, los autores seleccionaron ensayos aleatorios y estudios observacionales, incluidos estudios de cohortes y de casos y controles. Los ensayos publicados solo como resúmenes, cartas al editor, editoriales o estudios retirados de la bibliografía después de su publicación se excluyeron. Las revisiones sistemáticas también se excluyeron, pero las referencias se verificaron primero.
Los estudios de intervención fueron elegibles si: 1) eran ensayos controlados aleatorios, no aleatorios, estudios observacionales prospectivos o estudios de cohortes; 2) evaluaron la conversión a inseminación intrauterina vs la continuación con fertilización in vitro; 3) con cualquier tipo de protocolo de estimulación (agonista largo, antagonista, microflare, primming con estrógenos, etc.); y 4) recolectó la tasa de nacidos vivos.
Recolección de datos
Si los registros eran elegibles, dos revisores recopilaron e importaron sistemáticamente los datos en una base de datos electrónica utilizando campos de datos predefinidos y los recopilaron en un formulario de extracción de datos estandarizado. Esto incluyó los siguientes datos: año de publicación, diseño del estudio, periodo de estudio, intervención, cantidad de pacientes (total, intervención y comparador), edad, FSH basal, AMH basal, folículos antrales, concentraciones de estradiol el día de la descarga, grosor endometrial, dosis total de gonadotropinas, días de estimulación, medicamento de la descarga, tasa de embarazo clínico, tasa de nacidos vivos, tasa de aborto, tasa de embarazo múltiple, tasa de embarazo ectópico; y en los casos de fertilización in vitro, tasa de no transferencia embrionaria. Además, para los estudios de intervención también se registraron el ocultamiento de la asignación y el cegamiento. En el caso de publicaciones múltiples, se extrajo la información más actualizada o completa.
El objetivo primario de este metanálisis fue la tasa de nacidos vivos. Como objetivos secundarios se estudiaron la tasa de embarazo bioquímico, la tasa de embarazo clínico, la tasa de aborto, la tasa de embarazo múltiple, la tasa de embarazo ectópico y la tasa de no transferencia embrionaria. Un nacido vivo se definió como cualquier nacimiento de un producto de la concepción vivo mayor de 24 semanas de gestación. La tasa de nacidos vivos se definió como la proporción de nacidos vivos en relación con las pacientes incluidas. Un embarazo bioquímico se definió como la coexistencia en sangre a una concentración mayor de 5 mIU/mL de la fracción beta de hCG posterior a una transferencia de embriones. La tasa de embarazo bioquímico es la proporción de embarazos bioquímicos en relación con las pacientes incluidas. Un embarazo clínico es la visualización de un saco gestacional con latido cardiaco posterior a una transferencia de embriones. La tasa de embarazos clínicos en relación con las pacientes incluidas. Un aborto es la pérdida de un embarazo de menos de 20 semanas de gestación. La tasa de aborto es la proporción de abortos en relación con la cantidad de embarazos confirmados. Un embarazo múltiple es la visualización de 2 o más sacos gestacionales con latido cardiaco posterior a una transferencia embrionaria. La tasa de embarazo múltiple es la proporción de embarazos múltiples en relación con las pacientes incluidas. Un embarazo ectópico es la visualización de un saco gestacional fuera de la cavidad uterina. La tasa de embarazo ectópico es la proporción de embarazos ectópicos en relación con las pacientes incluidas. La no transferencia embrionaria son los ciclos de fertilización in vitro sin embriones disponibles para ser transferidos. La tasa de no transferencia embrionaria es la proporción de pacientes sin transferencia embrionaria en relación con las pacientes incluidas en el brazo que continuaron con fertilización in vitro.
Evaluación de la certeza de la calidad y del riesgo de sesgo
Dos autores evaluaron de forma independiente el sesgo de riesgo de cada estudio. La puntuación de la escala Newcastle-Ottawa (NOS) se usó para evaluar los estudios de casos y controles o de cohortes y el juicio para cada uno se aprobó según tres aspectos: selección del grupo de estudio, comparabilidad entre grupos y la determinación de resultados y exposiciones de interés. 18 Esta escala otorga hasta 9 estrellas a cada estudio y las clasifica en: calidad baja (0 a 4 estrellas), moderada (5 a 6 estrellas) y alta calidad (7 a 9 estrellas). 19
La evaluación la hicieron en forma independiente dos revisores, mientras que cualquier desacuerdo se resolvió mediante discusión entre las dos partes o al incluir un tercer revisor.
Análisis de los datos
Los resultados clínicos se recopilaron como datos dicotómicos. Los resultados de los estudios se combinaron en el metanálisis utilizando un modelo de efectos fijos de Mantel-Haenszel para una razón de momios (odds ratio (OR)) agrupada en el IC95%. Si la información estaba disponible, se efectuaba un subanálisis conforme a la cantidad de folículos observados el día de la descarga ovulatoria: 1, 2, 3 ó 4 folículos. Las gráficas tipo forest plot y la estadística I 2 se calcularon para cada resultado del estudio para cada grupo como forma de cuantificar la heterogeneidad estadística de los estudios incluidos. 20 La I2 se definió como: 0 a 40%: puede que no sea importante; 30 a 60%: heterogeneidad moderada; 50 a 90%: heterogeneidad sustancial; 75 a 100%: heterogeneidad considerable.21,22 Todos los análisis se realizaron con RevMan 5.4 (Review Manager [programa informático], versión 5.4, The Cochrane Collaboration, 2020).
RESULTADOS
Estudios incluidos para revisión y características (Cuadro 1)
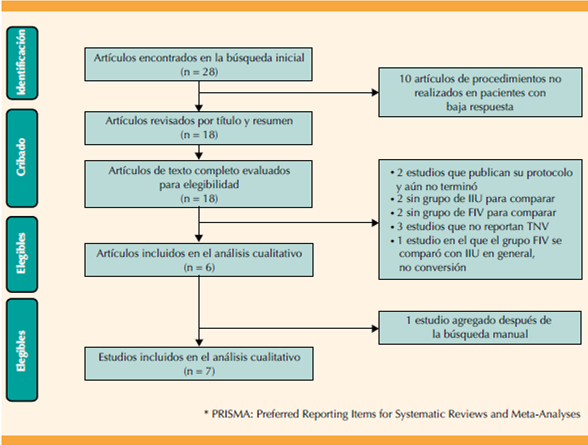
La búsqueda bibliográfica recuperó 28 citas, de las que 18 fueron elegibles para consideración después de la selección de títulos y resúmenes. De estos, 6 estudios cumplieron los criterios de inclusión de la revisión sistemática, publicados entre 2009 y 2014.23-28 La verificación de referencias cruzadas resultó en una inclusión adicional de un artículo: Elzeiny y su grupo29 no se identificó en la búsqueda porque el título refiere que se llevó a cabo en pacientes con infertilidad idiopática o factor masculino leve; sin embargo, al revisar el artículo, solo se incluyeron pacientes con respuesta a la estimulación ovárica convencional de 2 o 3 folículos, que justo es la definición de baja respuesta ovárica, 4 por eso se incluyó en la revisión sistemática (Figura 1). Se analizaron en total 3398 pacientes (fertilización in vitro 2115; inseminación intrauterina: 1283).
Cuadro 1 Características de los estudios que cumplieron con los criterios de inclusión para la revisión sistemática
| Estudio | Diseño del estudio |
Definición de baja respuesta ovárica |
Criterios |
Fertilización in vitro (n) |
Inseminación intrauterina (n) |
Edad fertilización in vitro vs inseminación intrauterina |
FSH basal fertilización in vitro vs inseminación intrauterina |
Día de transferencia |
Pacientes con transferencia de embrión en fertilización in vitro |
| Shahine et al 23 | Retrospectivo | ≤ 4 folículos | ≥ 1 salpinge | 170 | 50 | 40.2 vs 40.4, NS | 13.2 vs 11.5, NS | - | 75.9% (129 de 170) |
| Norian et al 24 | Retrospectivo | ≤ 4 folículos | Primer ciclo, E 2 < 1000, ≥ 1 salpinge, ≥ 5 millones de espermatozoides |
167 | 269 | 36.9 vs 37.0, NS | 12.2 vs 10.2, p < 0.05 |
3, 5 | 91.6% (153 de 167) |
| Nicopoullos et al 25 | Retrospectivo | ≤ 2 folículos | Respuesta ≤ 2 folículos |
807 | 248 | 39.6 vs 39.3, NS | 11.9 vs 11.2, NS | 2, 3, 5 | 64.7% (522 de 807) |
| Shohieb et al 26 | Retrospectivo | ≤ 4 folículos | E 2 < 1000, ≥ 1 salpinge, ≥5 millones epermatozoides |
152 | 68 | 36.3 vs 36.4, NS | 8.2 vs 7.7, p < 0.05 |
3 | - |
| Reichman et al 27 | Retrospectivo | ≤ 3 folículos | ≥ 1 salpinge, ≥ 1 millón de espermatozoides |
624 | 474 | 39.7 vs 39.9, NS | 11.4 vs 11.5, NS | 3 | 90.5% (565 de 624) |
| Quinquin et al2 8 | Retrospectivo | ≤ 2 folículos | ≤ 40 aos, RFA < 7, AMH<1.1 | 184 | 141 | 36.8 vs 36.6, NS | 9.5 vs 10.2, NS | 2, 3 | 56.0% (103 de 184) |
| Elzeiny et al 29 | RCT | ≤ 3 folículos | 1 año de infertilidad, menos de 42 años, primer tratamiento |
11 | 33 | 34.0 vs 33.0, NS | - | 3 | 81.8% (9 de 11) |
*n: tamaño de la muestra; NS: sin significación estadística; RFA: recuento de folículos antrales; esp: RCT: randomized controlled trial.
Descripción de los estudios
De los estudios incluidos, seis son retrospectivos y uno aleatorizado controlado. 29 Tres estudios son de Estados Unidos, 23,24,27 uno del Reino Unido, 25 uno de Arabia Saudita, 26 uno de Australia29 y uno de Francia. 28
La definición de baja respuesta varió entre 2 a 4 folículos, 12 a 16 mm (diámetro medio) el día de la administración de hCG. Se utilizó la definición de menos de 4 folículos en 3 estudios,23,24,26 menos de 3 en 2 estudios27,29 y menos de 2 en 2 estudios.25,28 Dos estudios utilizaron valores de estradiol de 1000 pg/mL como criterios adicionales. Solo un estudio utilizó los criterios de Bolonia para baja respuesta ovárica. 28
Seis estudios informaron la tasa de nacidos vivos como resultado primario y uno como resultado secundario. 29 Tres estudios incluyeron pacientes en protocolo largo de agonista o antagonista,25,26,27 dos estudios incluyeron todos los protocolos de estimulación,23,28 y dos estudios solo de ciclos antagonistas.24,29 Solo cuatro estudios especificaron que al menos una trompa de Falopio tenía que ser permeable para poder sugerir conversión a inseminación intrauterina.23,24,26,27
Riesgo de sesgo en los estudios incluidos
De acuerdo con las guías sugeridas por la Cochrane Collaboration, la calidad de la mayor parte de los estudios incluidos fue moderada.
Comparación de la tasa de nacido vivo
Los siete estudios incluyeron 3398 pacientes-ciclos, con 2115 ciclos de fertilización in vitro y 1238 de inseminación intrauterina. La tasa de nacidos vivos para todos los estudios juntos fue de 9.2% (195 de 2115) en fertilización in vitro vs 3.7% (47 de 1283) en inseminación intrauterina (Cuadro 2). En general, todos reportan una tasa de nacidos vivos más alta en fertilización in vitro que con inseminación intrauterina. Solo hay un estudio prospectivo aleatorizado controlado. Elzeiny y colaboradores29 reportaron una tasa de nacidos vivos en fertilización in vitro de 36.4 vs 6.1% en inseminación intrauterina. Este resultado es el que más peso tiene al ser el único estudio prospectivo con asignación al azar controlado de toda la revisión.
Cuadro 2 Comparación de los resultados clínicos de los estudios incluidos.
|
Tasa de embarazo bioquímico |
Tasa de embarazo clínico |
Tasa de aborto | Tasa de nacido vivo | |||||
|
Fertilización in vitro |
Inseminación intrauterina |
Fertilización in vitro |
Inseminación intrauterina |
Fertilización in vitro |
Inseminación intrauterina |
Fertilización in vitro |
Inseminación intrauterina |
|
| Shahine et al 23 | - | - | 10.0% (17/170) | 8.0% (4/50) | 29.4% (5/17) | 25.0% (1/4) | 7.1% (12/170) | 6.0% (3/50) |
| Norian et al 24 | - | - | 25.7% (43/167) | 5.2% (14/269) | 23.4% (10/43) | 21.4% (3/14) | 19.8 (33/167) | 4.1% (11/269) |
| Nicopoullos et al 25 | 13.0% (105/807) | 4.8% (12/248) | 8.1% (65/807) | 3.6% (9/248) | 16.9% (11/65) | 44.4% (4/9) | 6.7% (54/807) | 2.0% (5/248) |
| Shohieb et al 26 | 9.2% (14/152) | 10.3% (7/68) | 17.1% (26/152) | 10.3% (7/68) | 34.6% (9/26) | 28.6% (2/7) | 11.2% (17/152) | 7.4% (5/68) |
| Reichman et al 27 | 21.6% (135/624) | 7.4% (35/474) | 13.9% (87/624) | 4.6% (22/474) | 43.0% 58/135) | 45.7% (16/35) | 9.3% (58/624) | 3.4% (16/474) |
| Quinquin et al 28 | 16.8% (31/184) | 10.6% (15/141) | 13.6% (25/184) | 9.2% (13/141) | - | - | 9.2% (17/184) | 3.6% (5/141) |
| Elzeiny et al 29 | 45.5% (5/11) | 12.1% (4/33) | 36.4% (4/11) | 12.1% (4/33) | 20.0% (1/5) | 25.0% (1/4) | 36.4% (4/11) | 6.1% (2/33) |
| Todos | 16.3% (290/1778) | 7.6% (73/964) | 12.6% (267/2115) | 5.7% (73/1283) | 32.3% (94/291) | 37.0% (27/73) | 9.2% (195/2115) | 3.7% (47/1283) |
El metanálisis de los estudios incluidos mostró que la continuación con la fertilización in vitro proporciona 3.15 veces más probabilidades de lograr un nacido vivo vs la conversión del ciclo en una inseminación intrauterina (OR combinado 3.15 (IC95%: 2.26 a 4.41)). Figura 2a

Figura 2 Gráfica tipo forest plot de la comparación de continuar con fertilización in vitro vs convertir a inseminación intrauterina en pacientes con baja respuesta ovárica. Análisis: a) Tasa de nacido vivo; b) Tasa de embarazo clínico; c) Tasa de embarazo bioquímico. Figura del autor.
Comparación de la tasa embarazo clínico
Los siete estudios reportaron la tasa de embarazos bioquímicos, que para todos los estudios fue de 12.6% (267/2115) en fertilización in vitro vs 5.7% (73/1283) en inseminación intrauterina. Cuadro 2
La continuación de la fertilización in vitro confiere 2.84 veces más probabilidades de lograr un embarazo clínico vs una inseminación intrauterina (OR 2.84 (IC95%: 2.15-3.74)). Figura 2b
Comparación de la tasa de embarazo bioquímico
Cinco estudios informaron la tasa de embarazo bioquímico,25,29 con un total de 1778 pacientes-ciclos en fertilización in vitro y 964 en inseminación intrauterina (Cuadro 2). La tasa de embarazo bioquímico en Shohieb y coautores26 se reportó más baja que la tasa de embarazos bioquímicos, lo que quizá sea un error. Puesto que la tasa de embarazo bioquímico no fue el resultado primario de este metanálisis, no se intentó contactar a los autores para obtener aclaraciones.
La continuación con fertilización in vitro tiene 2.72 veces más probabilidades de lograr un embarazo bioquímico vs una inseminación intrauterina (OR 2.72 [IC95%: 2.06-3.58]). Figura 2c
Comparación de la tasa de aborto
Seis estudios reportaron la tasa de aborto. 23-27,29 El análisis combinado de los estudios enseña una tasa de aborto de 23.1% (36 de 156) para fertilización in vitro y de 31.6% (12 de 38) para inseminación intrauterina. Cuadro 2
Los datos muestran que la continuación de la fertilización in vitro tiene un 17% menos de probabilidades de terminar en aborto, aunque esto no fue estadísticamente significativo (OR 0.83 [IC95%: 0.48 a 1.43]). Figura 3a

Figura 3 Gráfica tipo forest plot de la comparación de continuar con fertilización in vitro vs convertir a inseminación intrauterina en pacientes con baja respuesta ovárica. Análisis: a) Tasa de aborto; b) Tasa de embarazo múltiple; c) Tasa de embarazo ectópico. Figura del autor.
Comparación de la tasa de embarazo múltiple
Solo 2 estudios reportaron tasa de embarazo múltiple. Norian y su grupo24 reportaron 38.9% de embarazos gemelares en fertilización in vitro vs 21.4% en inseminación intrauterina y Elzeiny y colaboradores29 reportaron 0% en fertilización in vitro vs 25% en inseminación intrauterina (Cuadro 2). Al comparar la probabilidad de un embarazo múltiple, ambas estrategias son similares: OR 1.37 (IC95%: 0.40-4.72). Figura 3b
Comparación de la tasa de embarazo ectópico
De los estudios seleccionados, solo Norian y coautores24 reportaron la posibilidad de embarazo ectópico que fue de 1.2% para fertilización in vitro y de 0% para inseminación intrauterina. No hay diferencia estadísticamente significativa (Cuadro 3) (OR 8.14 [IC95%: 0.39-170.64]) Figura 3c
Cuadro 3 Desenlaces clínicos adversos.
|
Tasa de ciclos con transferencia embrionaria |
Tasa de embarazo múltiple |
Tasa de embarazo ectópico |
|||
|
Fertilización in vitro |
Fertilización in vitro |
Inseminación intrauterina |
Fertilización in vitro |
Inseminación intrauterina |
|
| Shahine et al 23 | 75.9% (129/170) | - | - | - | - |
| Norian et al 24 | 91.6% (153/167) | 34.9% (15/43) | 21.4% (3/14) | 1.2% (2/167) | 0% (0/269) |
| Nicopoullos et al 25 | 64.7% (522/807) | - | - | - | - |
| Shohieb et al 26 | - | - | - | - | - |
| Reichman et al 27 | 90.5% (565/624) | - | - | - | - |
| Quinquin et al 28 | 56.0% (103/184) | - | - | - | - |
| Elzeiny et al 29 | 81.8% (9/11) | 0% (0/5) | 25.0% (1/4) | - | - |
| Todos | 754% (1481/1963) | 31.3% (15/48) | 22.2% (4/18) | 1.2% (2/167) | 0% (0/269) |
Evaluación de la tasa de no transferencia embrionaria
Seis estudios reportaron la cantidad de pacientes que tuvieron una transferencia de embriones.23,24,25,27,28,29 El 70.7% (1387 de 1963) de las pacientes que optaron por continuar con la captura folicular tuvieron transferencia (Cuadro 3). En cuanto a la posibilidad de captura folicular negativa, 4 estudios reportaron este escenario.25,25,27,29 Un 7.1% (116/1609) de las pacientes no obtuvieron ovocitos en la captura.
Evaluación por respuesta folicular
Un folículo
Tres estudios informaron desenlaces según si se observó respuesta monofolicular.24,27,28 Los resultados agrupados mostraron una tasa de nacidos vivos de 3.6% con fertilización in vitro vs 2.7% con inseminación intrauterina (Cuadro 4). El metanálisis de la tasa de nacidos vivos de estos estudios no mostró diferencias entre las estrategias (OR 1.02 [IC95%: 0.37-2.84]). Figura 4a
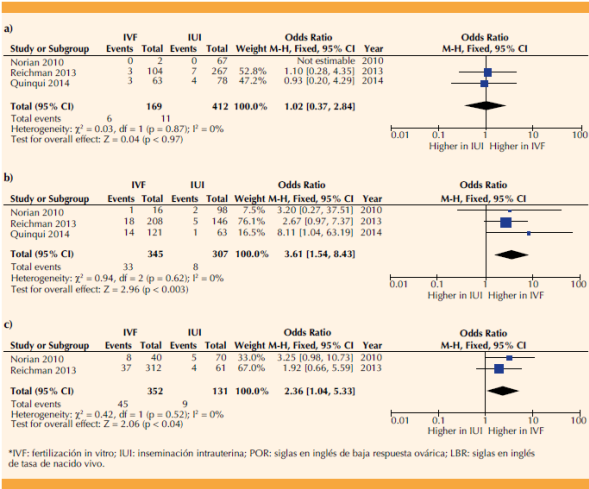
Figura 4 Gráfica tipo forest plot de la comparación de continuar con fertilización in vitro vs convertir a inseminación intrauterina en pacientes con baja respuesta ovárica. Análisis: tasa de nacidos vivos de acuerdo con la respuesta folicular de a) 1 folículo, b) 2 folículos c) 3 folículos. Figura del autor.
Cuadro 4 Tasa de nacido vivo por respuesta folicular, por estudio individual y todos juntos.
| Autor | Tasa de nacido vivo | |||||||
| 1 folículo | 2 folículos | 3 folículos | 4 folículos | |||||
|
Fertilización in vitro |
Inseminación intrauterina |
Fertilización in vitro |
Inseminación intrauterina |
Fertilización in vitro |
Inseminación intrauterina |
Fertilización in vitro |
Inseminación intrauterina |
|
| Shahine et al 23 | Sin resultado | Sin resultado | Sin resultado | Sin resultado | Sin resultado | Sin resultado | Sin resultado | Sin resultado |
| Norian et al 24 | 0% (0/2) | 0% (0/67) | 6.3% (1/16) | 2.0% (2/98) | 20.0% (8/40) | 7.1% (5/70) | 22.0% (24/109) | 11.8% (4/34) |
| Nicopoullos et al 25 | Sin resultado | Sin resultado | Sin resultado | Sin resultado | Sin resultado | Sin resultado | Sin resultado | Sin resultado |
| Shohieb et al 26 | Sin resultado | Sin resultado | Sin resultado | Sin resultado | Sin resultado | Sin resultado | Sin resultado | Sin resultado |
| Reichman et al 27 | 2.9% (3/104) | 2.6% (7/267) | 8.7% (18/208) | 3.4% (5/146) | 11.9% (37/312) | 6.6% (4/61) | Sin resultado | |
| Quinquin et al 28 | 4.8% (3/63) | 5.1% (4/78) | 11.6% (14/121) | 1.6% (1/63%) | Sin resultado | Sin resultado | Sin resultado | |
| Elzeiny et al 29 | Sin resultado | Sin resultado | Sin resultado | Sin resultado | Sin resultado | Sin resultado | Sin resultado | Sin resultado |
| Todos | 3.6% (6/169) | 2.7% (11/412) | 9.6% (33/345) | 2.6% (8/307) | 12.8% (45/352) | 6.9% (9/131) | 22.0% (24/109) | 11.8% (4/34) |
Dos folículos
Tres estudios informaron desenlaces cuando se observaron 2 folículos.24,27,28 La continuación con fertilización in vitro mostró una tasa de nacidos vivos combinada del 9.6 vs 2.6% en la inseminación intrauterina (Cuadro 4). Un metanálisis de estos estudios mostró que la continuación de la fertilización in vitro tiene 3.61 veces más probabilidades de lograr un nacido vivo que la inseminación intrauterina (OR 3.61 [IC95%: 1.54-8.43]) (Figura 4b).
Tres folículos
Dos estudios informaron desenlaces en pacientes con una respuesta de tres folículos24,27 y la continuación de la fertilización in vitro mostró una tasa de nacido vivo agrupada de 12.8% vs 6.9% en inseminación intrauterina (Cuadro 4). El metanálisis de estos estudios mostró que la continuación de la fertilización in vitro tiene 2.36 veces más probabilidades de lograr un nacido vivo que la inseminación intrauterina (OR 2.36 [IC95%: 1.04-5.33]). Figura 4C
Cuatro folículos
Un solo estudio analizó los desenlaces cuando se observaron 4 folículos durante la estimulación, 24 y los autores informaron un 22% de tasa de nacido vivo en fertilización in vitro versus 11.8% en inseminación intrauterina (p = 0.19). Cuadro 4
DISCUSIÓN
Esta revisión sistemática resume la información disponible en relación con la tasa de nacidos vivos en pacientes con baja respuesta a una estimulación ovárica controlada durante una fertilización in vitro. Continuamente nos encontramos con la difícil decisión de aconsejar a una paciente qué hacer cuando se evidencia la baja respuesta a la estimulación. Entre las diferentes variables que deben tomarse en cuenta, la más importante es la posibilidad de éxito al decidirse por un tratamiento. Al analizar, en conjunto, los desenlaces de todos los estudios, se advierte que continuar con la fertilización in vitro confiere una tasa de nacidos vivos de 9.2% vs 3.7% en inseminación intrauterina. Con estos datos es evidente que la continuación a la captura folicular y transferencia de embriones se consideraría la mejor opción desde el punto de vista médico en pacientes con baja respuesta ovárica. El análisis por respuesta ovárica permite ver que, en los casos de respuesta de un solo folículo, la tasa de nacido vivo es similar, por lo que el consejo es convertir el ciclo a inseminación intrauterina porque no implica un procedimiento quirúrgico ni anestesia. Esta información se recopiló de 7 estudios que reunían a 3398 pacientes.
Encontrar una baja respuesta ovárica durante la estimulación siempre es decepcionante en virtud de que el pronóstico cambia de manera muy importante. 3 Con frecuencia nos encontramos ante una paciente con esta situación; realmente no teníamos números específicos para ayudar a guiar a nuestras pacientes. Con los desenlaces de este estudio, ahora puede darse respuesta con probabilidades específicas a una paciente que se encuentra en este escenario.
La siguiente variable a valorar es el costo y el costo-efectividad de una estrategia versus la otra. Desafortunadamente, solo el estudio de Elzeiny y colaboradores29 incluyó un análisis económico. En su estudio, los autores reportaron el costo de un nacido vivo por inseminación intrauterina 4 veces más alto que por fertilización in vitro. 29 Se necesitan más estudios para poder hacer una extrapolación a nuestro medio.
Éste es el primer estudio de revisión bibliográfica que agrupa datos de los desenlaces del embarazo en pacientes con baja respuesta ovárica llevadas a fertilización in vitro. En segundo lugar, se hizo un análisis exhaustivo de la bibliografía y de los datos para minimizar el riesgo de error. En tercer lugar, al analizar por subgrupos se identificó que no en todos los escenarios proceder con la fertilización in vitro es la mejor opción disponible.
Existen limitaciones en los datos analizados en esta revisión. Primero, solo hubo siete estudios que cumplieron con los criterios de inclusión y reportaron la tasa de nacidos vivos, de los que solo uno fue un ensayo controlado con asignación al azar. Si bien la calidad del resto de los estudios es alta (NOS superior a 7), 6 de los revisados son retrospectivos, lo que tiene en cuenta las limitaciones y el sesgo potencial de tal diseño. Los estudios variaron ampliamente en sus métodos y definiciones, lo que condujo a un alto grado de heterogeneidad. Debido a que parte de los criterios de inclusión definidos era el reporte de la tasa de nacidos vivos, se descartaron tres potenciales artículos.
A pesar de estas limitaciones, el resumen de estos estudios aún aporta información valiosa para el médico y la paciente en estas situaciones clínicas difíciles. Se requieren más estudios para determinar si económicamente una estrategia es superior a la otra. Sin embargo, desde el punto de vista médico, la continuación con fertilización in vitro se asocia con mayor éxito clínico.
CONCLUSIONES
Lo hasta aquí revisado sugiere que la continuación con fertilización in vitro conduce a una tasa de nacidos vivos más alta versus la conversión a inseminación intrauterina en pacientes con respuesta baja, con ≤ 5 folículos, excepto en quienes responden con un solo folículo, en mujeres en las que la inseminación intrauterina parece más razonable en virtud de la posibilidad de que el hecho de tener un hijo en casa es similar y no se asocia con los riesgos y costos de un procedimiento de fertilización in vitro.











 nueva página del texto (beta)
nueva página del texto (beta)