Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Sociedad Química de México
versión impresa ISSN 0583-7693
Rev. Soc. Quím. Méx vol.47 no.4 Ciudad de México oct./dic. 2003
Investigación
Síntesis y evaluación del efecto ansiolítico de un nuevo derivado pirimido[1,6-a]pirimidínico
Alejandro Muñoz-Zurita,1 Jesús Sandoval-Ramírez,1* Luis Emilio Espinoza-Moreno,2 Carmen Parra-Cid,1 Luis Alberto Juárez-Leyva,1 Daniel Limón-Pérez de León,1 Gonzalo Flores3
1 Facultad de Ciencias Químicas. Benemérita Universidad Autónoma de Puebla.
2 Departamento de Ciencias Básicas, Ingeniería y Tecnología. Universidad Autónoma de Tlaxcala.
3 Instituto de Fisiología. Benemérita Universidad Autónoma de Puebla. Apartado postal 1742, Puebla, Pue. C.P. 72000. México. Teléfono y fax: 01-222-2295500 Ext. 7382. *E-mail: jsandova@siu.buap.mx
Recibido el 27 de octubre del 2003.
Aceptado el 1 de diciembre del 2003.
Resumen
Se describe la síntesis de la (E)-9-estirilcarboxamido-6,8-dioxo-7-propil-1,3,4,6,7,8-hexahidro-2H-pirimido[1,6-a]pirimidina (9) a partir de 6-aminouracilo (4) utilizando una vía de síntesis quimio- y regioselectiva; además se reporta el estudio fármacobiológico de 9 utilizando el modelo experimental ansiolítico del laberinto elevado en cruz. Adicionalmente, se presenta la relación dosis efecto de 9 sobre la actividad locomotora empleando el modelo de campo cerrado en ratas macho Wistar; la cual concluye que al administrar crónicamente diferentes dosis de 9 se genera un efecto ansiolítico importante y una disminución de la actividad locomotora.
Palabras clave: Antagonistas de receptores de adenosina, quimioselectividad, ansiedad, locomoción, modelo experimental ansiolítico.
Abstract
The synthesis of (E)-6,8-dioxo-7-propyl-9-styrylcarboxamido-1,3,4,6,7,8-hexahydro-2H-pyrimido[1,6-a]pyrimidine (9) from 6-aminouracil (4) using a chemo- and regioselective pathway is described herein. Additionally we report the pharmacobiological evaluation of the compound 9 using the anxiolitic test plus maze elevator and the effect of 9 over the locomotor activity in the Wistar rats. The results suggest that compound 9 exhibit a significant anxiolitic activity with considerable motor depression.
Key words: Adenosine receptors antagonist, chemoselectivity, anxiety, locomotion, anxiolitic experimental model.
Introducción
La ansiedad es un síntoma vinculado a la idiosincrasia de cada persona, su incremento es un componente inevitable en muchos estados emocionales que se asocia generalmente con trastornos psiconeuróticos y puede ser generada por estímulos tanto internos como externos y que no pueden ser fácilmente explicados en términos biológicos ó psicológicos.
A principios de la década de 1960, los trastornos de ansiedad eran tratados con barbitúricos (de fórmula general 1), aunque después cayeron en desuso debido a sus negativos efectos secundarios. Hoy día, los compuestos de elección para el tratamiento de la ansiedad son las benzodiazepinas, como el diazepam (2), aunque se sabe que altas dosis de estos compuestos producen fármacodependencia [1]. Las investigaciones sobre nuevos tratamientos para los estados de ansiedad han arrojado importantes resultados; así, una alternativa son los antagonistas de los receptores de adenosina de tipo A2A y derivados de la 2,4-pirimidindiona [2], por lo que diversos grupos de investigación en el mundo se han encaminado hacia la obtención de nuevas estructuras que permitan una terapéutica ansiolítica con menores efectos secundarios y mayores beneficios.
En 1995, Simo describió la síntesis y caracterización del novedoso agente ansiolítico 3 (Fig. 1) antagonista de los receptores de adenosina, de esqueleto pirimido[1,2,3-cd]purindiónico [3].
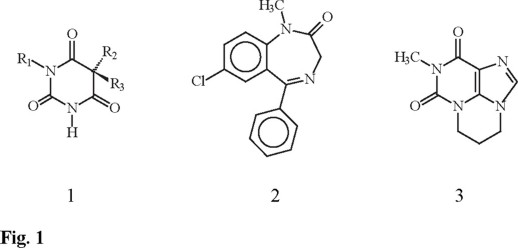
Por otra parte, se ha reportado la participación de los receptores adenosinérgicos de tipo A2A en las conductas motoras y cognitivas [4] y se ha encontrado que compuestos antagonistas de receptores A2A revierten los estados de ansiedad, ya sea naturales o bien inducidos por fármacos. Se sugiere que los antagonistas adenosinérgicos de tipo A2A tienen efectos motores y pueden revertir los estados de ansiedad.
Nos hemos interesado en sintetizar nuevos compuestos antagonistas de receptores de adenosina selectivos [5-7] y probar su eficacia en modelos experimentales ansiolíticos, para desarrollar una terapéutica con menor efecto secundario y mayor beneficio sobre los estados de ansiedad.
Resultados y discusión
La ruta de síntesis del compuesto pirimido[1,6-a]pirimidínico 9 utiliza 6-aminouracilo (4) como material de partida, tal como se describe en la figura 2.
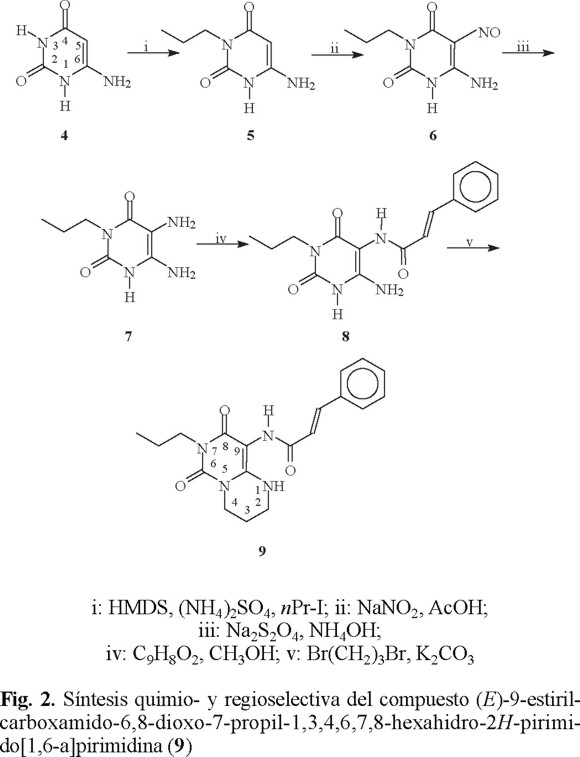
La alquilación selectiva del 6-aminouracilo (4) en posición 3, se llevó a cabo empleando una modificación al método descrito por Müller en 1991 [8], que permite la obtención de un solo regioisómero a través de la formación in situ del derivado trisililado, utilizando cantidades prácticamente equimolares de hexametildisilazano (HMDS). El derivado trisililado no es purificado, sino que rápidamente fue utilizado para la reacción con yoduro de n-propilo; el rendimiento de la reacción de este primer paso fue de 92%. Un análisis del espectro de 1H-RMN permite comprobar que la alquilación se llevó a cabo en N3 y no el N1, ya que la señal de los protones del grupo amino en C6 no sufrieron cambio alguno en su desplazamiento químico pues es sabido que cuando existe alquilación en N1 se presenta un desplazamiento químico hacia campos bajos [8]. La espectroscopía de UV-Vis muestra una banda de absorción hacia 261 nm, característica para un carbonilo α,β-insaturado β-aminosustituido.
La nitrosación quimio y regioselectiva de 5 en C5 se llevó a cabo utilizando nitrito de sodio en medio ácido. Con estas condiciones no se afecta el grupo amino unido a la posición 6 debido a su efecto de resonancia como grupo electrodonador del sistema carbonilíco α,β-insaturado, lo que induce la sustitución electrofílica en C5. Los derivados nitroso son fácilmente reconocibles por su color amarillo-naranja (λmáx320 nm) y por la banda intensa en el infrarrojo hacia 1510 cm−1 correspondiente a la vibración N = O [9]. Adicionalmente, en el espectro de RMN 13C la señal del C5 se encuentra considerablemente desplazada: de δ74.66 hasta δ140.31 lo que indica la presencia de un grupo fuertemente desprotector como lo es el grupo nitroso.
La reducción del grupo nitroso en C5, se efectuó empleando el método que utiliza hidrosulfito de sodio en medio básico; al respecto se realizaron estudios acerca de la influencia de la concentración de la base y la temperatura y encontramos que la concentración de la base no es un factor importante para llevar a cabo la reducción; en cambio, nuestro estudio arrojó que con temperaturas inferiores a 60 EC se debe emplear mayor cantidad de agente reductor y en consecuencia se crea un mayor problema para separarlo, disminuyendo notablemente el rendimiento de la reacción. El producto diaminado 7 es sumamente inestable al exponerlo ante el ambiente y a la luz, por lo que debe someterse de inmediato a la próxima reacción sin necesidad de purificación. La diamina 7 se obtuvo con un rendimiento del 65%.
La obtención de la amida 8 se logró mediante una reacción regioselectiva en donde sólo se formó la amida en C5. El agente de acoplamiento empleado fue el clorhidrato de 1-[3-(dimetilamino)propil]-3-etilcarbodiimida (EDC) con rendimientos cuantitativos.
El grupo amino en C5 es más nucleofílico que el presente en C6 ya que el grupo en C6 actúa como electrodonador del sistema carbonilíco α,β-insaturado. La isomería trans del doble enlace permaneció inalterada, lo que se comprobó al analizar las bandas del espectro de IR (971 cm−1) [10], y al medir las constantes de acoplamiento del sistema vinílico en el espectro de RMN 1H (Jtrans = 15.8 Hz) [10]. El espectro de UV-Vis tiene un máximo de absorbancia en 280 nm característico para una absorción de derivado cinámico.
Finalmente, la reacción entre el compuesto 8 y 1,3-dibromopropano, en presencia de K2CO3 como base y dimetilformamida (DMF) como disolvente permitió formar el nuevo anillo entre las posiciones N1 y la amina en C6 para obtener el compuesto (E)-9-estirilcarboxamido-6,8-dioxo-7-propil-1,3,4,6,7,8-hexahidro-2H-pirimido[1,6-a]pirimidina (9) con un 61% de rendimiento, sin obtener evidencia del producto monocíclico 10 (Figura 3), compuesto que podría formarse sí solamente se efectúa un ataque nucleofílico sobre una parte de la molécula de 1,3-dibromopropano. Al analizar el espectro de RMN 1H se observa que la señal en δ 6.11, que correspondía a los dos protones del grupo amino unido a la posición C6, se encuentra desplazada hasta δ 6.9 y la integración es para un solo protón intercambiable con deuterio. La isomería del sistema vinílico permanece inalterada.
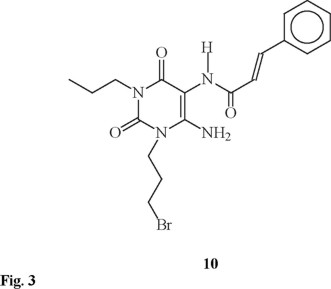
Los datos reportados en la literatura [11] para la obtención de compuestos similares presentan rendimientos para esta última reacción de 57%, rendimiento similar al que se reporta en este trabajo.
Farmacología
Prueba in vivo. Se utilizaron ratas macho de la cepa Wistar, obtenidas del Bioterio de la BUAP, de 250-280 g, los cuales fueron mantenidos en cajas de acrílico bajo las mismas condiciones de agua y alimento, con un ciclo de luz /oscuridad de 12 × 12 h, a una temperatura de 22 ± 3 EC. La evaluación de efecto ansiolítico se realizó utilizando el modelo experimental del laberinto elevado en cruz, el cual consiste en un temor innato de los roedores a los espacios abiertos y altos. En este modelo, un incremento en el número de veces que entra ó permanece en brazo abierto corresponde a un perfil ansiolítico, en tanto que lo contrario corresponde a un efecto ansiogénico [12]. Con el fin de mostrar la actividad depresora del derivado pirimido[1,6-a]pirimidina 9 se estudió la actividad locomotora usando un actímetro computarizado el cual consiste en una caja de acrílico de 20 × 40 × 20 cm con ocho fotodiodos y un contador computarizado de Tecnología Digital de México [13].
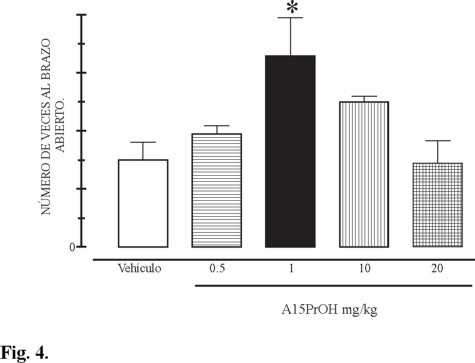
Se administró crónicamente al grupo control el vehículo (etanol: aceite mineral, 1:2) y a los grupos experimentales las diferentes dosis del nuevo derivado pirimido[1,6-a]pirimidina (9) a razón de 0.5, 1.0 y 20 mg / Kg s.c. Al octavo día de administración, a cada animal de cada grupo se sometieron al laberinto elevado durante un tiempo de 10 min / día. Este nuevo compuesto produjo un incremento en el numero de veces al cual entra al brazo abierto (figura 4), aunque que no hubo diferencia significativa a la dosis de 0.5, 10 y 20 mg / Kg. Sin embargo a dosis de 1 a 5 mg / Kg produjo un incremento significativo en el número de visitas al brazo abierto que fue de 1.5 ± 0.3 y 3.2 ± 0.6 SEM. Esto significa un incremento del 113% del grupo con la nueva droga respecto al control. En este rango de dosis el derivado pirimido[1,6-a]pirimidina (9) generó el efecto ansiolítico a través de la interacción con los receptores adenosinérgicos A1 o A2A, receptores involucrados en procesos de ansiedad [5].
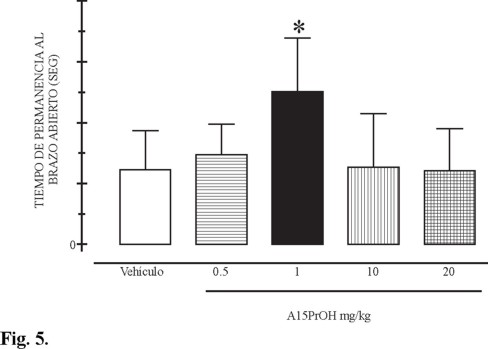
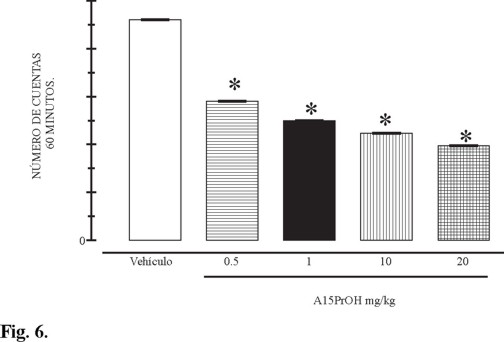
Respecto a la permanencia al brazo abierto encontramos que a dosis de 1 mg / kg los sujetos permanecen mas tiempo en los brazos abiertos 25.14 ± 4.38 seg más respecto al control (figura 5), lo que indica que el incremento es del 100 %, debido a su probable efecto ansiolítico. Para demostrar el efecto depresor del compuesto 9 se administraron diferentes dosis al octavo día de administración se evaluó la conducta motora en el modelo de campo cerrado (descrito anteriormente). Se administró el derivado pirimido[1,6-a]pirimidina 9 a dosis de 0.5, 1.0 10.0 y 20.0 mg / Kg, se introdujo a cada animal a las cajas de actividad motora (figura 6) y se cuantificó el número de veces que el animal interrumpe el haz de luz, lo que se expresa como cuentas acumuladas. Nuestros resultados sugieren que el compuesto 9 produce una considerable disminución de la actividad locomotora en un 37, 46, 52 y 58 % respectivamente en cada dosis. Estos datos ponen de manifiesto que el compuesto (E)-9-estirilcarboxamido-6,8-dioxo-7-propil-1,3,4,6,7,8-hexahidro-2H-pirimido[1,6-a]pirimidina (9) posee un efecto depresor sobre la conducta locomotora, esto probablemente por su efecto sobre núcleos motores centrales o a nivel periférico lo cual se demostró en el modelo experimental de laberinto elevado en cruz y en el de locomoción en campo cerrado.
Parte experimental
Los puntos de fusión fueron determinados en un fusiómetro Melt-temp; se empleó la escala de grados centígrados, utilizando la técnica de capilar abierto y no fueron corregidos. Los espectros de RMN de 1H y 13C se realizaron en un espectrómetro Varian a 400 y 100 MHz respectivamente utilizando DMSO-d6 y CDCl3 como disolventes y las señales de los protones remanentes de los disolventes deuterados se utilizaron como referencia interna. Los espectros de UV-Vis. fueron determinados en un espectrofotómetro Perkin Elmer Lambda Bio 40 empleando soluciones etanólicas al 98 %; las longitudes de onda se expresan en nm. Los espectros de infrarrojo se midieron en un espectrofotómetro Shimadzu FTIR-8400; los datos se expresan en cm−1. Los espectros de masas se determinaron a 70 eV en un espectrómetro Hewlett Packard 5989 A, acoplado a un cromatógrafo de gases Hewlett Packard 5990 serie II; los datos se expresan en relación m/z.
6-amino-3-propiluracilo (5). En un matraz de fondo redondo de 125 mL provisto de refrigerante para reflujo se preparó una suspensión de 6-aminouracilo (2.54 g, 20 mmol), HMDS (6.5 mL, 30 mmol) y (NH4)2SO4 (0.243 g ,1.92 mmol); la mezcla se calentó bajo atmósfera de argón y se agitó magnéticamente hasta llegar a reflujo con lo cual se obtuvo una solución transparente y homogénea. Después de 15 min se disminuyó la temperatura (40-50 1C), se añadió nPr-I (1.9 mL, 20 mmol) y nuevamente se calentó hasta reflujo. La reacción fue seguida por cromatografía en capa fina (usando como eluyentes CH2Cl2:CH3OH 9:1) hasta que desapareció la materia prima (aprox. 3 h). Se dejó enfriar hasta 40 °C y se añadió 10 mL de solución saturada de Na2S2O3 (45 g / 100 mL) con lo cual se obtuvo una suspensión que se agitó durante 30 min y a continuación se agregaron lentamente 20 mL de solución saturada de NaHCO3. Se filtró al vacío, se enjuagó con agua fría, hexano y finalmente con éter dietílico. Rendimiento: 92 %. Polvo blanco amorfo: pf 267-269 EC (lit. 275 1C [9]); UV (EtOH) λmax (ε) 261 (3508) nm; IR (KBr) νmax 2930, 1741, 1631 cm−1; RMN 1H (DMSO-d6, 400 MHz) δ 6.32 (2H, b, -NH2), 4.53 (1H, s, H-5), 3.59 (2H, t, -CH2-N3, J=7.32 Hz), 1.46 (2H, m, - CH2CH3, 7.32 Hz), 0.80, (3H, t, -CH3, J=7.32 Hz); RMN 13C (DMSO-d6, 100 MHz) δ 163.67 (C-4), 154.53 (C-2), 151.92 (C-6), 74.66 (C-5), 21.52 (-CH2CH3), 11.73 (-CH3); EM-IE: m/z (int. rel.): 169 [M]+ (22), 127 (100).
6-amino-5-nitroso-3-propiluracilo (6). En un matraz de 100 mL equipado con embudo de adición se disolvió 5 (5 mmol, 0.84 g) en 20 mL de AcOH al 80 % y se comenzó a agregar NaNO2 (10 mmol, 0.69 g) disuelto en 5 mL de agua, durante 45 min. Al finalizar la adición de NaNO2 se agitó vigorosamente durante 40 min más y se enfrió a 0 °C; con lo cual se formó un precipitado que se filtró al vacío y se lavó con agua fría. Se secó en un desecador al alto vacío. Rendimiento: 85%. Polvo amarillo amorfo: pf > 300 1C; UV (EtOH) λmax (ε) 320 (5920) nm; IR (KBr) νmax 3294, 3185, 1511 cm−1; RMN 1H (DMSO-d6, 400 MHz) δ 11.37 (1H, b, N1-H), 3.79 (2H, t, -CH2-N3, J=7.32), 1.60 (2H, m, -CH2CH3, J=7.32), 0.89 (3H, t, -CH3, J=7.32); RMN 13C (DMSO-d6, 100 MHz) δ 161.84 (C-4), 150.27 (C-2), 145.49 (C-6), 140.31 (C-5), 40.23(-CH2-N3), 21.37(-CH2CH3), 11.76 (-CH3).
5,6-diamino-3-propiluracilo (7). En un matraz de 100 mL, se preparó una solución de 6-amino-5-nitroso-3-propiluracilo (6) (10 mmol, 1.98 g) en 40 mL de NH4OH al 6% aq.; la solución color rojo intenso se calentó hasta que alcanzó una temperatura cercana a los 80 °C y enseguida se comenzó a agregar el Na2S2O4 (3 equivalentes, 0.522 g) en pequeñas porciones durante 10 min al cabo de los cuales la reacción se decolora. Inmediatamente después el crudo de reacción se concentró al vacio y el precipitado cremoso que se obtiene se filtró rápidamente al vacío y se sometió a la próxima reacción debido a su inestabilidad ante el ambiente. Rendimiento: 60-65%. Agujas cristalinas amarillas que descomponen antes de fundir.
(E)-6-amino-5-estirilcarboxamido-3-propiluracilo (8). En un matraz de fondo redondo, se preparó una suspensión de 5,6-diamino-3-propiluracilo (7) (6.5 mmol, 1.19 g), ácido trans-cinámico (6.5 mmol, 1.18 g) y EDC (6.5 mmol, 1.2 g) en 20 mL de CH3OH y se agitó vigorosamente, la reacción se siguió por placa (CH2Cl2:CH3OH 9:1) hasta que se comprobó la desaparición de la materia prima (aprox. 10 h) y la formación de una nueva suspensión, que se enfrió a 0 °C para generar un precipitado, que se filtró al vacío dentro de la campana de extracción y al final se enjuagó con agua fría y con CH3OH helado. Se secó al alto vacío. Rendimiento: 76%. Polvo blanco amorfo, descompone antes de fundir; UV (EtOH) λmax (ε) 272 (6670) nm; IR (KBr) νmax 3318, 3187, 1648 cm−1; RMN 1H ( DMSO-d6, 400 MHz): δ 8.7 (1H, NH estirilamida), 7.41 (6H, m, 5 arom. y BCH=), 6.85 (1H, d. BCH=, J=16.08), 6.11 (2H, -NH2), 3.6 (2H, t, Et-CH2-N, J= 6.2), 1.5 (2H, m, -CH2CH3, J= 7.32), 0.81 (3H, t, -CH3, J= 7.32); RMN 13C (DMSO-d6, 100 MHz): δ 165.58 (C=O estirilamida), 161.15 (C-4), 150.49 (C-6), 150.39 (C-2), 139.44(-CH=), 135.50 (arom.), 130.04 (arom.), 129.55 (arom.), 128.04 (arom.), 122.93 (=CH-), 87.69 (C-5), 40.20 (Et-CH2-N), 21.50 (-CH2CH3), 11.76 (-CH3).
(E)-9-estirilcarboxamido-6,8-dioxo-7-propil-1,3,4,6,7,8-hexahidro-2H-pirimido[1,6-a]pirimidina (9). En un matraz de 100 mL se disolvió 8 (1 mmol, 0.314 g) en 6 ml de DMF, se agregó K2CO3 (2 mmol, 0.27 g) y posteriormente se añadió Br(CH2)3Br (1.5 mmol, 0.15 mL) y se agitó vigorosamente; la reacción se siguió por CCF con el mismo sistema de eluyentes utilizado, hasta que se consumió el material de partida. Se agregó 50 mL de agua destilada, se enfrió a 0 °C y se formó un precipitado blanquecino que posteriormente se filtró al vacío. Una vez seco, se disolvió en 50 mL de CH2Cl2 y se concentró en el rotavapor, se purificó por columna cromatográfica usando un sistema de eluyentes de acetona: hexano (2:3). Se concentró y secó al alto vacío, recristalización en CH3OH caliente. Rendimiento: 61%. Aguja blancas: pf 134-136 °C; UV (EtOH) λmax (ε) 270 (5844) nm; IR (KBr) νmax 3420, 2957, 1696, 1690, 958 cm−1; RMN 1H (CDCl3, 400 MHz): δ 8.2 (1H, b, N-H estirilamida), 7.53 (1H, d, -CH=), 7.3 (5H, m, 5 arom.), 6.9 (1H, N-H), 6.75 (1H, d, -CH=), 3.79 (2H, t, -CH2-N7, J= 6.2), 3.78 (2H, t, -CH2-N1, J= 6.2), 3.34 (2H, t, -CH2-N4, J= 6.2), 1.61 (2H, m, -CH2CH3, J= 7.32), 0.87 (3H, t, -CH3, J= 7.32); RMN 13C (CDCl3, 100 MHz): δ 166.21 (C=O estirilamida), 59.02 (C-8), 150.02 (C-6), 147.3 (C-10), 139.44(-CH=), 134.6 (arom.), 129.9 (arom.), 128.8 (arom.), 127.9 (arom.), 120.18, 141.6 (2C, =CH-), 89.62 (C-9), 43.04 (-CH2-N7), 40.92 (C-2), 39.22 (C-4), 21.33 (-CH2CH3), 11.43 (-CH3); EM-IE: m/z (int. rel.): 354 [M]+ (30.5), 223 (100), 181 (21.3), 110 (24).
Agradecimiento
Los autores agradecen a VIEP-BUAP el apoyo otorgado para el proyecto VIEP II-58G02. A. M-Z. Agradece a CONACYT el apoyo económico a través de la beca-crédito 121993.
Referencias
1. Woods, J. H.; Katz, J. L.; Winger, G. Pharmacolgical Reviews 1987, 39, 251-419. [ Links ]
2. Yacoubi, N. E.; Ledent, C.; Parmentier, M.; Costentin, J.; Vaugeois, J. M. Psychopharmacology 2000, 148, 153-163. [ Links ]
3. Simo, J.; Rybar, A.; Alföldi, J. Synthesis 1995, 837-839. [ Links ]
4. Svenningsson, P.; Le Moine, C.; Fisone, G.; Fredholm, B. B. Prog. Neurobiol. 1999, 59, 355-399. [ Links ]
5. Muñoz-Z., A.; Sandoval-R., J.; Parra-C., C.; Limón-P., D. Rev. Soc. Quím. Méx. 2002, 46, 131-135. [ Links ]
6. Sandoval-R., J.; Müller, C. E. Synthesis, 1995, 1295-1299. [ Links ]
7. Hayallah, A. M.; Sandoval-R., J.; Reith, U.; Schobert, U.; Preiss, B.; Schumacher, B.; Daly, J. W.; Müller, C. E. J. Med. Chem. 2002, 47, 1500-1510. [ Links ]
8. Müller, C. E. Tetrahedron Lett. 1991, 45, 6539-6540. [ Links ]
9. Nakanishi, K.; Solomon, P. H. en Infrared Absorption Spectroscopy, Holden day Inc. New York, 1977. [ Links ]
10. Friebolin, H., en Basic One- and Two-Dimensional NMR Spectroscopy. VCH Publ. New York. 1993. [ Links ]
11. Weyler, S.; Hayallah, A. M.; Müller, C. E. Tetrahedron 2003, 59, 47-54. [ Links ]
12. Pellow, S.; Chopin, P.; File, S. J. Neurosci. Meth. 1985, 14, 149-167. [ Links ]
13. Silva-G., A.; Bermúdez, M.; Quirino, R.; Srivastava, L. K.; Flores, G. Brain Res. 2003, 973, 285-292. [ Links ]














