INTRODUCCIÓN
El ecosistema manglar es reconocido como uno de los más productivos a escala mundial y su productividad ha sido cuantificada principalmente por la cantidad de hojarasca producida por unidad de área y tiempo (Ribeiro et al., 2019). El ecosistema de manglar funciona sobre una base de materia (nutrientes, sedimentos, materia orgánica, agua dulce y salobre), y energía (luz, temperatura, oleaje, mareas y huracanes), de tal forma que estos elementos permiten que el aparato fotosintético produzca una cierta cantidad de biomasa que se expresa en productividad primaria; la cual es variable dependiendo de factores que inciden en el desarrollo del manglar, como la latitud, clima, estacionalidad, precipitación, tipo de suelo, geomorfología y microtopografía (Twilley et al., 2019).
El aporte de hojarasca del manglar a estuarios y lagunas costeras es una fuente importante de materia orgánica al ecosistema, porque sostiene una trama trófica por la vía del detritus y, además, contribuye al reciclaje de nutrientes mediado por microrganismos (Alongi, 2018; Bouillon et al., 2008). La tasa de descomposición de la hojarasca es influenciada por la temperatura del agua, la amplitud de marea y las densidades microbianas (Gladstone-Gallagher et al., 2014; Yang et al., 2018).
Las comunidades bacterianas ayudan al sostenimiento del manglar mediante la mineralización de la materia orgánica, la fijación biológica de nitrógeno, aporte de nutrientes y otras sustancias reguladoras de crecimiento (Holguin y Bashan, 2007); además, se ha observado que en sedimentos de manglares, las bacterias y hongos constituyen hasta 9% de la biomasa microbiana total, las microalgas 7% y los protozoarios 2% (Alongi, 1988; Ruble, 1982; García-Martínez et al., 2021).
Las densidades de bacterias en los sedimentos de manglar varían de acuerdo con la influencia de factores tales como temperatura del agua, textura y tamaño de grano de sedimentos, contenido de materia orgánica de los sedimentos, abundancia y distribución de raíces del mangle (Alongi, 2005); también el pH, la salinidad, el oxígeno disuelto y los metales influyen en la dinámica de las bacterias (Behera et al., 2017; Ceccon et al., 2019). Se ha documentado que las concentraciones de grupos microbianos en sedimentos se incrementan en los periodos con mayor producción de hojarasca (Chen et al., 2016). El comportamiento estacional de las densidades microbianas en los sedimentos de manglar es de interés por cómo incide en la eficiencia de los ciclos biogeoquímicos (Liénart et al., 2020; Reis et al., 2017). Por ejemplo, en el ciclo del nitrógeno, los procesos de nitrificación, fijación de N y desnitrificación son mediados por bacterias (Alongi, 2018; Lai et al., 2022), y el nitrógeno tiende a ser el nutriente limitante para la producción acuática en ecosistemas marinos (Howarth, 1988).
Algunos estudios realizados en manglares asociados a estuarios y a lagunas costeras se han enfocado en conocer cambios en las densidades bacterianas ante disturbios antropogénicos mediante técnicas moleculares no dependientes de cultivo. Por ejemplo, ante la influencia de descargas de aguas residuales urbanas, la densidad bacteriana se incrementa e induce un incremento en las tasas de desnitrificación (Capdeville et al., 2019); también se ha observado que las descargas de aguas residuales acuícolas modifican la proporción N:P en sedimentos de manglar, y cuando esta proporción aumenta, la densidad de bacterias disminuye (Erazo y Bowman, 2021).
Los estudios dirigidos a conocer las respuestas de poblaciones de bacterias ante disturbios de aguas residuales son de gran importancia, pero también es importante conocer la dinámica estacional y los factores ambientales que influyen en las densidades de bacterias en sedimentos de manglares prístinos. Lo anterior es relevante dada la evidencia de la estrecha relación microorganismo-nutriente-planta que funciona como un mecanismo para reciclar y conservar los nutrientes en el ecosistema del manglar (Holguin et al., 2001).
Los manglares asociados a lagunas costeras semiáridas en el Golfo de California están sujetos a un intervalo estacional amplio de la temperatura del agua con valores mayores a 30 °C en verano y menores a 18 °C en invierno, y exhiben un patrón de producción de hojarasca con máximos en verano y mínimos en invierno (Arreola-Lizárraga et al., 2004; Torres et al., 2022). Por lo tanto, se planteó la hipótesis de que, en una laguna costera árida prístina, las densidades de bacterias y su actividad celulolítica en sedimentos de manglar serían mayores en verano dada la asociación con la mayor temperatura del agua y la mayor producción de hojarasca; mientras que en invierno, se observarían las menores densidades de bacterias debido a una menor temperatura del agua y menor aporte de hojarasca. Para probar esta hipótesis se estimaron las densidades de bacterias heterótrofas cultivables asociadas a sedimentos de mangle negro Avicennia germinans, se determinó la producción de hojarasca y se determinaron variables del agua y sedimentos en cada una de las estaciones del año.
OBJETIVOS
El objetivo del estudio fue examinar el comportamiento estacional de las densidades de bacterias heterótrofas y la actividad celulolítica en sedimentos de mangle negro Avicennia germinans y su relación con la producción de hojarasca y variables de agua y sedimento en una laguna costera semiárida subtropical sujeta a conservación ecológica.
MATERIALES Y MÉTODOS
Área de estudio
La laguna El Soldado se localiza en la costa este del Golfo de California, es un área natural protegida con la categoría de zona sujeta a conservación ecológica (Gobierno del Estado de Sonora, 2006). Tiene una superficie de 1.85 km2, una profundidad promedio de 0.60 m y se comunica permanentemente con el Golfo de California por medio de una boca de ~ 50 m de ancho y ~ 2 m de profundidad (Fig. 1). Está ubicada en una costa con marea mixta-semidiurna (Valle-Levinson et al., 2001) y una amplitud de marea de 1 m (Filloux, 1973). En el agua han sido registrados promedios anuales de oxígeno disuelto de 6.7 mg L-1, temperatura de 26.8 °C y 36.2 unidades prácticas de salinidad (UPS) (Ávila-García et al., 2023). De acuerdo con la clasificación de García (2004) el clima de la región es del tipo muy seco, muy cálido y cálido (BW (h’)), donde la tasa de evaporación (2700 mm año-1) excede la tasa de precipitación (230 mm año-1).
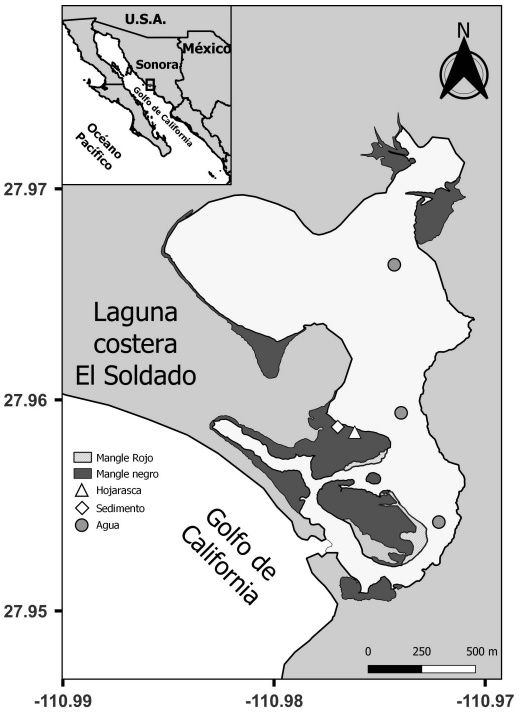
En agua se registraron parámetros fisicoquímicos y se determinaron nutrientes inorgánicos disueltos. En sedimentos se determinaron textura, materia orgánica, nutrientes y densidad bacteriana heterótrofa.
Figura 1 Área de estudio mostrando la cobertura de mangle negro Avicennia germinans y los sitios de muestreo de hojarasca, agua y sedimentos.
Descripción del manglar
En esta región semiárida subtropical del Golfo de California, la vegetación de manglar está compuesta por mangle negro Avicennia germinans, mangle rojo Rhizophora mangle, mangle blanco Laguncularia racemosa y botoncillo Conocarpus erectus, donde el mangle negro tiene mayor cobertura y es la especie dominante (Torres et al., 2022). En esta región, los manglares están influenciados por la alta salinidad del agua intersticial en los sedimentos, debido a los escasos aportes de agua dulce que provienen de las lluvias los manglares se encuentran en un ambiente subóptimo para su desarrollo, lo que resulta en un bajo desarrollo estructural (altura < 2.5 m) y una baja productividad de hojarasca (~4 Mg ha-1 año-1) (Torres et al., 2022). En el estero El Soldado, el manglar tiene una superficie de 32.7 ha, A. germinans cubre 66%, R. mangle 30% y L. racemosa 4%. Este estudio fue dirigido a examinar las densidades bacterianas en sedimentos de la especie de mangle con mayor cobertura en el sistema: A. germinans.
Sitios de muestreo
Los muestreos se realizaron en un mes representativo de cada estación del año, febrero (invierno), mayo (primavera), agosto (verano) y noviembre (otoño), en un solo día, entre las 9 h 00 y las 12 h 00. Se ubicaron sitios de muestreo para agua y sedimentos. Las muestras de agua se tomaron en tres sitios ubicados en el canal principal de la laguna debido a que tiene agua todo el tiempo, aun en los periodos de bajamar en mareas vivas. Las muestras de sedimento se obtuvieron en tres sitios equidistantes ≈ 20 m, las muestras de sedimentos se procesaron para determinar textura, nutrientes y densidad de bacterias.
Variables del agua
Se registraron temperatura, salinidad, oxígeno disuelto y pH in situ en la columna de agua en tres sitios adyacentes al manglar (Fig. 1) utilizando un sensor multiparamétrico YSI modelo 5502. Se recolectaron tres muestras de la columna de agua de 500 mL a una profundidad de 10 cm por encima del sedimento (Fig. 1), se determinaron las concentraciones de nitrito y nitrato (NO2 -, NO3 -), amonio (NH4 +), nitrógeno inorgánico disuelto (NID), ortofosfatos (PO4 -3) mediante la técnica de microplaca (Ali, 2021; Strickland y Parson, 1972).
Variables del sedimento
En el área de muestreo marcada en la figura 1, se seleccionaron tres sitios con una separación de aproximadamente 20 m entre cada uno. En cada sitio se colectaron dos muestras de sedimento con un nucleador de muestreo de 20 cm de alto y 10 cm de ancho. Las muestras se guardaron en bolsas de plástico y se mantuvieron en hielo para su transporte al laboratorio donde se congelaron a -20°C hasta su análisis (Howard et al., 2014).
Las muestras de sedimentos se analizaron para determinar: concentración de materia orgánica (Walkley y Black, 1934), textura de sedimento (Lewis y McConchie, 1984), nitrógeno N-NO2, N-NO3 - (Strickland y Parson, 1972), nitrógeno N-NH4 + (Solórzano, 1969) y el fósforo soluble P-PO4 -3 siguiendo el método de Jackson (1976). Los datos se calcularon basados en peso seco.
Producción de hojarasca
La hojarasca de A. germinans fue colectada mensualmente durante un ciclo anual: junio 2018 a mayo 2019, siguiendo los criterios de Moreno-Casasola y Warner (2009). Se utilizaron tres trampas circulares con un diámetro de 52 cm cada una, estas fueron colocadas debajo del dosel a una altura de 1 m-1.5 m (Fig. 1). Las hojas, flores y frutos fueron separadas, secadas hasta peso constante y pesadas con una precisión de ± 0.001 001 g. La producción de hojarasca fue obtenida por mes, el aporte se estimó para cada estación del año y se expresaron en gramos por metro cuadrado por estación.
Densidad de bacterias heterótrofas aeróbicas
Para el conteo de bacterias se tomaron muestras en tres sitios (Fig. 1), con una separación de aproximadamente 20 m entre cada uno, en cada sitio se recogieron tres núcleos para integrarse en una muestra compuesta (Moriarty y Pollard, 1982). El muestreo se realizó entre las 9 h 00 y las 12 h 00. Las muestras se colectaron con nucleadores de polipropileno de 10 cm de largo, con tapa de rosca. Una vez colectadas las muestras se colocaron en frascos estériles y se mantuvieron en hielo a una temperatura de aproximadamente 4 °C para su transporte al laboratorio. Ahí se mantuvieron refrigeradas y se procesaron antes de 24 h (Gonzalez-Acosta et al., 2006).
Se tomaron 10 g de sedimento para su dilución en 90 mL de solución salina búfer de fosfato (PBS por sus siglas en inglés) estéril [10 mM K2PO4-KH2PO4, 0.14 M NaCl, pH 7.4] (Bashan et al., 1993), y se mantuvieron en agitación a 180 min-1 (rpm) durante dos h para asegurar su mezcla. Posteriormente se realizaron diluciones seriadas del sobrenadante y se sembraron por la técnica de dispersión en placa en medio de cultivo suplementado con carboxilmetilcelulosa (CMC) como fuente de carbono [1 litro de PBS, 1.0 g de polipeptona, 0.5 g de Soytone (Bacto®), 0.5 g Proteosa peptona No. 3 (Difco), 0.5 g de extracto de levadura, 0.05 g de citrato férrico, 5 g de CMC y 15 g de agar; pH a 7.6 (Shieh y Simidu, 1986)], se incubaron a 28 °C ±2 °C por 7 días, se consideraron las placas con 50-500 colonias y se registró el crecimiento en unidades formadoras de colonias por gramo de suelo húmedo (UFC g-1) (Pepper et al., 2015). También se estimó la humedad de cada muestra, para ello se tomó 1 g de sedimento y se secó durante 24 h a 60 °C. La humedad se consideró en los cálculos de UFC g de sedimento seco, siguiendo la ecuación de Pepper et al. (2015):
El medio de cultivo utilizado no se suplementó con agua de mar como proponen Shieh y Simidu, (1986), debido a que puede contener trazas de celulosa y, por lo tanto, podría interferir con la actividad que se mide en este estudio. En cambio se suplementó con solución PBS [NaCl 8.06 g; KCl 0.22 g; Na2HPO4 1.15 g; KH2PO4 0.20 g; 1 L agua destilada] y aunque esta podría afectar en la velocidad de crecimiento (Holm y Sherman, 1921; Sherman et al., 1922; Sherman y Holm, 1922), su efecto se manifestaría uniformemente en los resultados.
Posterior a la incubación, los cultivos se inundaron con una solución de rojo Congo (1 g L-1) por 15 min, posteriormente se retiró el colorante y se inundó con una solución de NaCl (1 mol L-1) por 15 min. Enseguida se retiró la solución y las zonas donde se degradó la CMC se revelaron en el cultivo (Suyama et al., 1993). El porcentaje de actividad se realizó tomando en cuenta el tamaño de la placa y el área de actividad revelada dentro de la caja de Petri, considerando el área de la caja como 100%.
Análisis estadístico
La densidad de bacterias se expresó en unidades formadoras de colonias por gramo de suelo seco (UFC g-1) y se normalizó aplicando logaritmo base 10 (log UFC g-1). Para determinar la existencia de diferencias estadísticas de las densidades de bacterias entre estaciones del año, se realizó un análisis de varianza y prueba de Tukey con una significancia p < 0.05, después de haber cumplido con los supuestos de homogeneidad de varianza (prueba de Shapiro-Wilk) y homocedasticidad (prueba de Bartlett) (McKight y Najab, 2010). Se utilizó un análisis multivariado de escalamiento multidimensional no métrico (nMDS) sobre datos transformados (log x + 1) y estandarizados para determinar si las variables en sedimentos (ortofosfato, amonio, materia orgánica), en agua (nitrito, nitrato, amonio, ortofosfato, temperatura, salinidad, oxígeno disuelto), producción de hojarasca y las densidades bacterianas eran similares durante las cuatro estaciones del ciclo anual. Los análisis se realizaron con el software estadístico PRIMER 6 (Primer-E, Ivybridge, UK).
Se realizó un análisis de componentes principales (ACP) sobre bases de datos de las variables de sedimentos (ortofosfato, amonio, materia orgánica), agua (nitrito, nitrato, amonio, ortofosfato, temperatura, salinidad, oxígeno disuelto), y producción de hojarasca para determinar las variables con mayor influencia en el comportamiento estacional. Los análisis de PCA se realizaron con el software R Studio.
RESULTADOS
Variables del agua
La temperatura del agua tuvo valores más altos en verano (30.9 °C ± 0.1 °C) y más bajos en invierno (17.5 °C ± 0.3 °C). Las estaciones de primavera y verano tuvieron diferencias significativas con otoño e invierno (p < 0.05). La salinidad fue significativamente más alta (p < 0.05) en primavera (37.5 UPS ± 0.1 UPS) y más baja en verano (35.5 UPS ± 0.2 UPS). El oxígeno disuelto fue significativamente más alto (p < 0.05) en otoño con 8.8 mg L-1 ± 0.6 mg L-1 que el resto de las estaciones del año cuyos valores tuvieron escasa variación (6 mg L-1 - 6.6 mg L-1). El pH del agua tuvo valores significativamente (p < 0.05) más altos en invierno (8.3 ± 0.0) y más bajos en otoño (7.9 ± 0.0) (Tabla 1).
Tabla 1 Variables ambientales en agua y sedimentos durante un ciclo anual en la laguna costera El Soldado.
| Invierno | Primavera | Verano | Otoño | ||||||
| Parámetros fisicoquímicos en columna de agua |
Temperatura (°C) | 17.53 ± 0.30 | b | 30.53 ± 0.06 | a | 30.93 ± 0.18 | a | 18.26 ± 0.78 | b |
| Salinidad (UPS) | 37.35 ± 0.01 | a | 37.49 ± 0.06 | a | 35.51 ± 0.16 | c | 35.76 ± 0.04 | b | |
| Oxígeno Disuelto (mg L-1) | 6.65 ± 0.04 | b | 6.29 ± 0.05 | b | 6.03 ± 0.48 | b | 8.77 ± 0.59 | a | |
| pH | 8.33 ± 0.00 | a | 8.26 ± 0.03 | b | 7.86 ± 0.02 | c | 7.91 ± 0.03 | c | |
| Nutrientes
inorgánicos en columna de agua |
NO2 - (µmol) | 0.05 ± 0.01 | b | 0.09 ± 0.03 | b | 0.08 ± 0.05 | b | 0.26 ± 0.02 | a |
| NO3 - (µmol) | 0.64 ± 0.20 | b | 0.00 ± 0.00 | b | 0.16 ± 0.20 | b | 4.58 ± 0.87 | a | |
| NH4 + (µmol) | 0.10 ± 0.08 | b | 1.44 ± 0.88 | a | 1.70 ± 0.02 | a | 0.86 ± 0.15 | ab | |
| 0.79 ± 0.18 | b | 1.53 ± 0.90 | b | 1.95 ± 0.18 | b | 5.71 ± 0.87 | a | ||
| NID | |||||||||
| PO4 3- (µmol) | 0.20 ± 0.12 | b | 1.27 ± 0.30 | a | 0.62 ± 0.11 | b | 1.51 ± 0.06 | a | |
| Nutrientes y
materia orgánica en sedimentos |
PO4 3- (g Kg-1) | 0.70 ± 0.46 | a | 1.50 ± 0.25 | a | 1.00 ± 0.10 | a | 1.40 ± 0.69 | a |
| NH4 + (g Kg-1) | 2.20 ± 0.69 | b | 1.30 ± 0.36 | b | 9.67 ± 1.01 | a | 9.50 ± 1.15 | a | |
| MO (%) | 1.50 ± 0.20 | b | 4.90 ± 1.37 | a | 3.03 ± 0.71 | ab | 2.70 ± 0.52 | b | |
Nota: NID=nitrógeno inorgánico disuelto (NO2- + NO3- + NH4+); MO=Materia orgánica. Los superíndices representan diferencias significativas (P < 0.05).
La concentración promedio de nitritos y nitratos no presentaron variaciones significativas en las estaciones de invierno, primavera y verano, estas fueron de 0.01 µM a 0.02 µM para N-NO2 - y 0 µM a 0.64 µM para N-NO3 -.Ambas especies presentaron un incremento significativo en otoño 0.26 µM ± 0.02 µM N-NO2 - y 4.58 µM ± 0.87 µM N-NO3 -. Las concentraciones de amonio fueron más altas en verano (1.70 µM ± 0.02 µM N-NH4 +) en comparación con las concentraciones observadas en invierno (0.10 µM ± 0.08 µM N-NH4 +) y otoño (0.86 µM ± 0.15 µM N-NH4 +). El fósforo soluble tuvo concentraciones más altas en otoño (1.51 µM ± 0.06 µM) y más bajas en invierno (0.2 µM ± 0.12 µM) (Tabla 1).
Variables en sedimentos
No fueron detectables concentraciones de nitritos y nitratos. Las concentraciones de amonio N- NH4 + fueron más bajas en primavera (1.30 g kg-1 ± 0.36 g kg-1) y más altas en verano (9.67 g kg-1 ± 1.01 g kg-1) (Tabla 1). Las concentraciones de PO4 3- fueron más altas en verano (1 g kg-1 ± 0.25 g kg-1) y más bajas en invierno (0.70 g kg-1 ± 0.46 g kg-1) (Tabla 1). La concentración de materia orgánica fue mayor en primavera (4.9 g kg-1 ± 1.4%) y más baja en otoño (4.0% ± 0.1%) (Fig. 2a). El tamaño de partícula resultó en un alto porcentaje de grava entre 38.8% a 43.8% en las tres réplicas, seguido de arena con un intervalo de 34.3% a 37.9% y, por último, el porcentaje de limo varió entre 12.7% y 16.8%, no se detectaron arcillas (Tabla 2).
Tabla 2 Grupos texturales de sedimentos en tres sitios de mangle negro (Avicennia germinans).
| Sitio | Arena gruesa (%) | Arena (%) | Limo (%) |
| 1 | 38.8 | 34.3 | 16.8 |
| 2 | 43.8 | 35.8 | 13.5 |
| 3 | 43.0 | 37.9 | 12.7 |
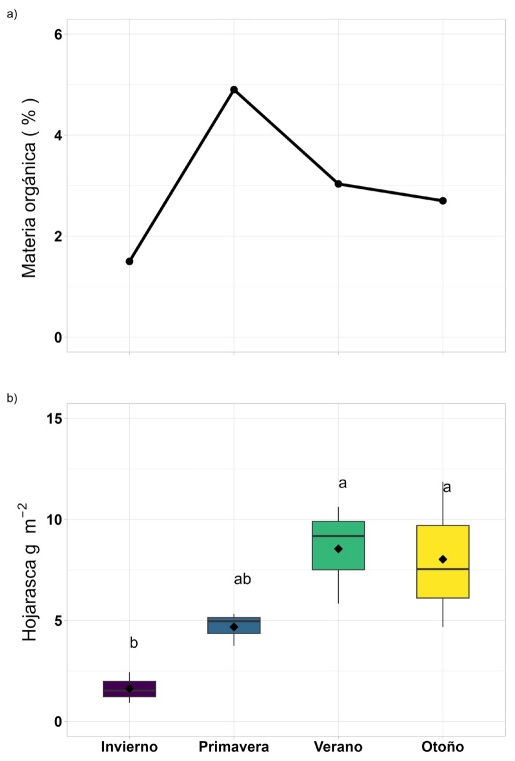
En 2b se muestran la mediana, los cuartiles y los rangos de los datos para cada estación del año. Las letras representan diferencias estadísticas prueba de Tukey (P < 0.05).
Figura 2 Comportamiento estacional del contenido de materia orgánica en sedimentos (a) y producción estacional de hojarasca de Avicennia germinans (b).
Producción de hojarasca
La hojarasca se presenta como el total de hojas, flores y fruto colectadas y pesadas. La aportación de hojarasca fue significativamente (P < 0.05) mayor en verano (8.5 g m-2), y menor en invierno (1.6 g m-2) (Fig. 2b).
Variación estacional de la densidad de bacterias heterótrofas
Las mayores densidades de bacterias heterótrofas se observaron en primavera 9.7 ×104 UFC g-1 (4.99 log UFC g-1 ± 0.09 log UFC g-1) y verano 9.7 × 104 UFC g-1 (4.99 log UFC g-1 ± 0.09 log UFC g-1), sin diferencias significativas entre ambas estaciones. Las menores densidades se observaron en otoño 9.5 × 103 UFC g-1 (3.98 log UFC ± 0.13 log UFC) e invierno 1.02 × 104 UFC g-1 (4.01 log UFC g-1 ± 0.27 log UFC g-1) (Fig. 3a). La actividad celulolítica fue mayor en verano (94% ± 0.5%) y menor en invierno (11% ± 0.1%) (Fig. 3b).
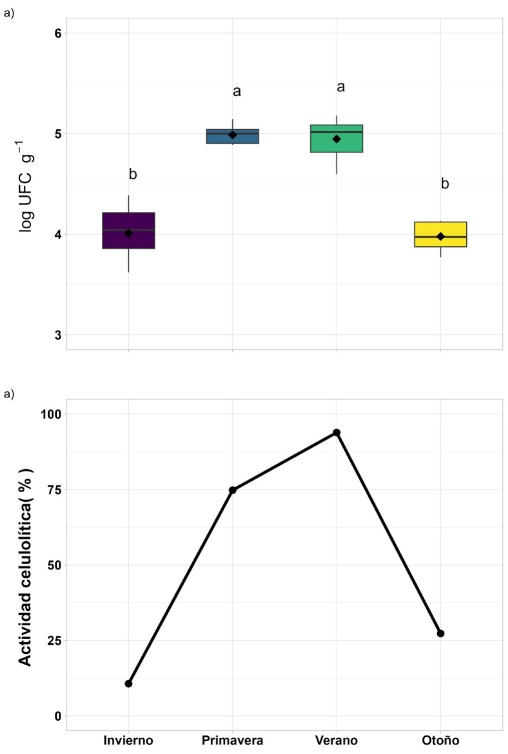
En 3a se muestran la mediana, los cuartiles y los rangos de los datos para cada estación del año; n = 9 réplicas en cada estación. Las letras representan diferencias significativas prueba de Tukey (P <0.05).
Figura 3 Comportamiento estacional de la densidad de bacterias heterótrofas (a) y de la actividad celulolítica en sedimentos de Avicennia germinans (b).
El análisis multivariado (nMDS), integrando agua, sedimento, producción de hojarasca y densidades bacterianas mostró condiciones que caracterizaron cada estación del año (Fig 4). El análisis de componentes principales (ACP) mostró que el componente 1 explicó 46% y el componente 2 explicó 26% de la varianza de los datos. Con la mayor contribución de NH4+ en agua y sedimento, temperatura del agua, materia orgánica en sedimentos y producción de hojarasca (Fig. 5).
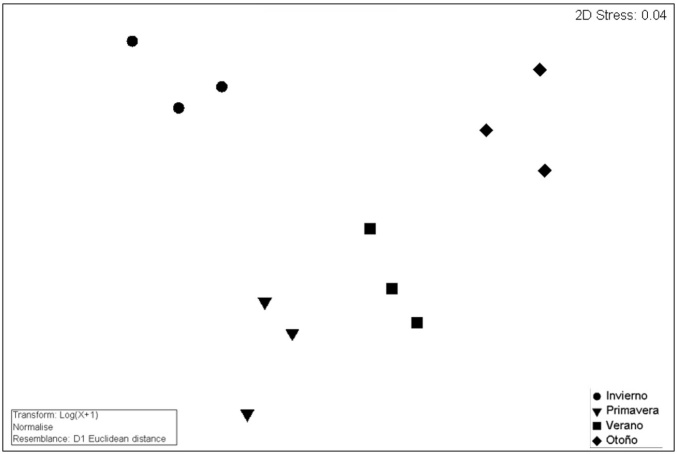
Figura 4 Análisis multivariado de escalamiento multidimensional no métrico (nMDS) del comportamiento estacional del conjunto de variables de sedimentos (ortofosfato, amonio, materia orgánica), agua (nitrito, nitrato, amonio, ortofosfato, temperatura, salinidad, oxígeno disuelto), producción de hojarasca y densidad de bacterias heterótrofas durante un ciclo anual en un ecosistema de Avicennia germinans.
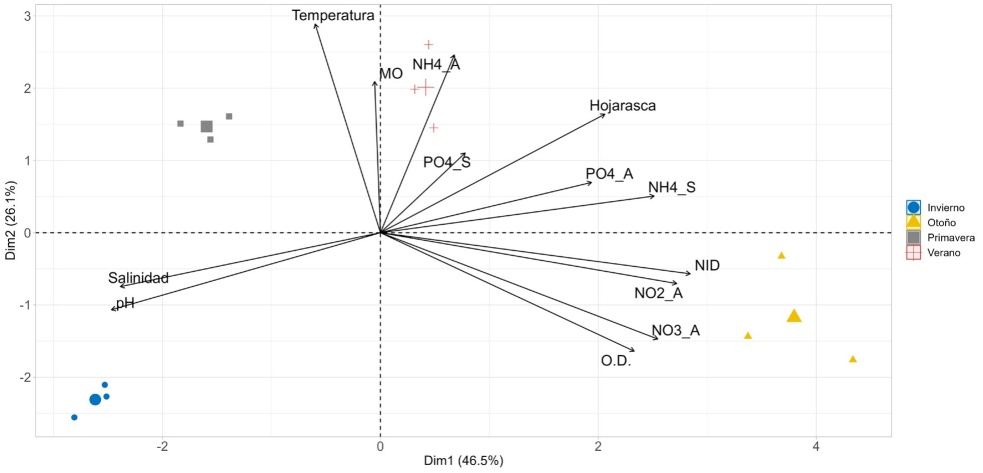
Figura 5 Análisis de componentes principales (ACP) de las variables de sedimentos (ortofosfato, amonio, materia orgánica), agua (nitrito, nitrato, amonio, nitrógeno inorgánico disuelto, ortofosfato, temperatura, salinidad, oxígeno disuelto) y producción de hojarasca durante un ciclo anual en un ecosistema de Avicennia germinans.
DISCUSIÓN
La densidad y actividad celulolítica de bacterias heterótrofas en sedimentos de Avicennia germinans en la laguna costera de región árida y de condiciones prístinas, tuvieron cambios estacionales con valores más altos en primavera y verano, y más bajos en otoño e invierno. La densidad de bacterias heterótrofas observadas 1 × 104 UFC g-1-1 × 105 UFC g-1 (4 log UFC g-1- 5 log UFC g-1) en los sedimentos de mangle negro en la laguna El Soldado, fueron menores a las registradas 1 × 106 UFC g-1- 1 × 108 UFC g-1 (6 log UFC g-1-8 log UFC g-1) por Gonzalez-Acosta et al. (2006) en otro sistema de mangle negro de región semiárida en el suroeste del Golfo de California. Estas diferencias son menores y están asociadas a las características particulares de cada sistema de manglar, principalmente la presencia de arcillas (Alongi, 2005), los resultados obtenidos en esta investigación mostraron ausencia de arcilla, a diferencia de las observaciones de Gonzalez-Acosta et al. (2006), donde esta fue un factor clave para explicar la densidad de bacterias. Otra consideración importante fue el medio utilizado en el presente estudio, debido a que la salinidad se compensó con PBS y se tiene conocimiento de que la variación en las concentración de sales puede afectar la velocidad de crecimiento de las bacterias (Holm y Sherman, 1921; Sherman et al., 1922; Sherman y Holm, 1922). Otros factores importantes corresponden al intervalo anual de la temperatura del agua y al aporte de hojarasca (Alongi, 2005). Por otro lado, en sedimentos de un manglar en estuario influenciado por el monzón del noreste en India, la textura se caracterizó por mayor porcentaje de arena y menor porcentaje de arcilla, la densidad de bacterias obtenidas fue de 4 log UFC g-1 (Saravanakumar et al., 2016) y esto coincide con lo observado en el presente trabajo.
Los resultados de los análisis multivariados mostraron los cambios estacionales de las densidades de bacterias y su relación con las variables del agua y sedimentos. El análisis nMDS mostró que cada estación del año tiene condiciones ambientales particulares en agua y sedimento con densidades de bacterias heterótrofas y su actividad celulolítica asociadas. Estos resultados coinciden con lo observado en un sistema de manglar en Sundarban, India, en donde se observaron cambios estacionales con la mayor densidad de bacterias heterótrofas y degradadoras de celulosa asociados, en este caso, a la influencia del monzón (Das y Mandal, 2022). Asimismo, el ACP mostró que la temperatura del agua, la materia orgánica en sedimentos y la producción de hojarasca, así como la presencia de NH4 + en agua y sedimento, son factores clave que sugieren explicar las densidades bacterianas, considerando que Das y Mandal (2022) observaron una relación positiva entre la densidad de bacterias heterótrofas, la temperatura y la materia orgánica del sedimento.
La temperatura del agua influye en la dinámica y en la composición de las comunidades bacterianas (Hicks et al., 2018) y, en la laguna El Soldado, el intervalo de la temperatura del agua fue de 14 °C entre verano (31 °C) e invierno (17 °C) y sugiere ser un factor clave en la dinámica estacional de bacterias en sedimentos de manglar con mayor densidad en verano y menor en invierno.
La materia orgánica en el sedimento es otro factor que explica el comportamiento estacional de las densidades bacterianas. La mayor cantidad de materia orgánica se observó en primavera, cuando ocurre un incremento de temperatura del agua y de aporte de hojarasca del manglar con respecto al invierno, y con ello ocurre un incremento de la densidad de bacterias y de la actividad celulítica. Gonneea et al. (2004) encontraron en tres sistemas de lagunas tropicales que el manglar aportó 60% de la materia orgánica en el sedimento. En la laguna El Soldado, la cobertura de manglar (~33 ha) sugiere ser la principal fuente de materia orgánica, y se ha estimado que 47% de la hojarasca de A. germinans se degrada en 35 días (Guereca-Hernández, 1994); esto explica el incremento de densidad de bacterias y de la actividad degradadora de celulosa en primavera, y que, en verano, con mayor temperatura del agua y mayor aporte de hojarasca, la densidad de bacterias, junto con actividad celulolítica, tuvieron los valores más altos en el ciclo anual. Las hojas de los mangles están compuestas principalmente de componentes lignocelulósicos que pueden ser degradados únicamente por microorganismos (Alongi et al., 1989). En el caso de la laguna El Soldado, la actividad celulolítica se magnifica en primavera y verano con temperatura del agua ~ 30 °C, aunque en otoño el aporte de hojarasca es mayor que en primavera, la temperatura del agua es < 25 °C y esto parece influir en el descenso de la densidad y actividad celulolítica de las bacterias, hasta mostrar los valores más bajos en invierno.
En los sedimentos, la dinámica estacional de nutrientes mostró que el nitrógeno se observó en forma de amonio y sus concentraciones fueron mayores en verano y otoño en cinco órdenes de magnitud con respecto a invierno y primavera. Esto es explicado por la mayor aportación de hojarasca en verano y otoño, considerando que la concentración de nitrógeno en hojarasca de mangle en proceso de descomposición se incrementa con el tiempo. Ramos e Silva et al. (2007) observaron mayores tasas de transferencia de N y P de hojarasca de mangle al sedimento en los meses con mayor producción de hojarasca. También, nuestros resultados se explican con las observaciones de Van Der Valk y Attiwill (1984), donde la concentración de nitrógeno en hojas de Avicennia marina en proceso de descomposición se incrementó 70% después de 21 días. Si bien la producción de amonio es llevada a cabo por procesos microbianos, también participan hongos mediante mineralización de los complejos taninos-proteína (Kanerva et al., 2006; Maie et al., 2008), de tal forma que, las altas concentraciones de amonio en sedimentos observadas en otoño se pueden atribuir a la participación tanto de hongos como de bacterias. El hecho de no haber detectado nitritos y nitratos en sedimento, se atribuye a observaciones que indican competencia entre las bacterias y las plantas por el nitrógeno disponible en el ecosistema y probablemente el NO3-, es convertido a NH4+ para, posteriormente, ser asimilado por bacterias y plantas, conservando así al nitrógeno dentro del ecosistema (Rivera-Monroy y Twilley, 1996)
En el presente estudio, la mayor densidad de bacterias en los sedimentos de manglar fue observada en verano y, de acuerdo con Medina-Galván et al. (2021), es cuando en esta laguna predomina el proceso de desnitrificación (−0.45 mmol m-2 día-1), propiciado por las condiciones que prevalecen de alta temperatura del agua (~ 30°C) y menor concentración de oxígeno disuelto (~ 4 mg L-1). Sobre esto, se ha aportado evidencia acerca de que la pérdida de nitrógeno por desnitrificación en sedimento de manglar fue de 55% debido a la gran disponibilidad de glucosa encontrada que propicia el crecimiento de microorganismos desnitrificantes (Chiu et al., 2004). En ese sentido, Gilmartin y Revelante (1978) observaron que, durante el verano, en estas lagunas de la costa este del Golfo de California, el reciclaje interno puede ser una fuente importante de nutrientes en el ecosistema de manglar, y esto sugiere que la actividad microbiana debe estar relacionada con procesos de mineralización de la materia orgánica.
La mayor fijación de nitrógeno por bacterias heterótrofas en la zona costera se ha observado en ambientes donde existe acumulación de materia orgánica biodegradable como marismas y manglares (Alongi, 2005). En la laguna El Soldado, la fijación de N2 predominó sobre la desnitrificación en primavera, otoño e invierno y fue dos veces mayor en invierno (1 mmol m-2 día-1) que en primavera y otoño (~ 0,5 mmol m-2 día-1) (Medina-Galván et al., 2021). La fijación de nitrógeno de lagunas costeras se realiza por una variedad de bacterias autótrofas y heterótrofas (Howarth et al., 1988), cianobacterias y organismos planctónicos (Capone y Carpenter, 1982; Zehr, 2011). Los resultados obtenidos sugieren que el aporte de hojarasca de manglar a través del año representa la principal fuente de energía que es utilizada por las bacterias en sedimentos de manglar para fijar nitrógeno.
También debe considerarse que las bacterias celulolíticas son uno de los tipos de bacterias esenciales que suelen encontrarse en el suelo de los manglares y que aportan fuentes de carbono para mejorar la fertilidad del suelo (Dewiyanti et al., 2024). Esto implica que la actividad celulolítica por microorganismos en sedimentos de manglar es relevante (Danovaro, 1996; Haldar y Nazareth, 2018; Loría-Naranjo et al., 2019); sin embargo, existen vacíos en el conocimiento sobre esta actividad en sistemas costeros en el Golfo de California. Los manglares en el Área Natural Protegida Estero El Soldado mantienen condiciones saludables (Torres et al., 2022), y de acuerdo con Dewiyanti et al., (2024), las características de un medio edáfico adecuado en estas áreas favorecen fuertemente la vida y la diversidad de las bacterias celulolíticas.
Estudios futuros de aislamiento de grupos bacterianos, además de abordar procesos biológicos como la fijación de nitrógeno atmosférico, desnitrificación y solubilización de fosfato inorgánico, deben también dirigirse a generar conocimiento acerca de la degradación de celulosa y otros compuestos recalcitrantes de importancia en el ciclo del carbono.
CONCLUSIONES
Los cambios estacionales de bacterias heterótrofas en sedimentos de mangle negro Avicennia germinans en la laguna costera de región árida y de condiciones prístinas exhibieron un patrón estacional con valores más altos de densidades y actividad celulolítica en primavera (4.9 log UFC g-1; 75%) y verano (4.9 log UFC g-1; 94%), y valores más bajos en otoño (3.9 log UFC g-1; 27%) e invierno (3.9 log UFC g-1; 11% ), sugiriendo que la temperatura del agua, la materia orgánica en sedimentos y la producción de hojarasca, así como el NH4 + en agua y sedimento son factores clave.
El aporte de hojarasca del manglar sugiere que es la fuente principal de materia y energía para las bacterias, quienes, al iniciar con la actividad celulolítica, resultan fundamentales en el reciclaje de nutrientes del ecosistema y aportan fuentes de carbono para mejorar la fertilidad del suelo.
Estas observaciones de las densidades y actividad celulolítica de bacterias en sedimentos de mangle negro de región árida, resultan de interés porque aportan evidencia que caracteriza el comportamiento estacional a la actividad bacteriana y su papel en el funcionamiento del ecosistema a través del año, particularmente en el reciclaje de nutrientes en el ecosistema.











 nueva página del texto (beta)
nueva página del texto (beta)



