INTRODUCCIÓN
Las aflatoxinas (AFs) son las micotoxinas de mayor preocupación en la seguridad alimentaria debido a su amplia distribución en los alimentos, en los piensos y por su elevada toxicidad. Son compuestos naturales producidos por los hongos filamentosos presentes en los productos agrícolas y en numerosos alimentos, su ingreso al organismo es directo a través de la ingesta de productos contaminados, alimentos procesados listos para su consumo o indirectamente por alimentos de origen animal (leche, carne o huevos), derivados de organismos con una alimentación contaminada con aflatoxinas (Benkerroum, 2020; Miklós et al., 2020).
Desde su descubrimiento, las AFs se han asociado con diversas enfermedades, los principales vehículos de estas toxinas son los granos y cereales, entre otros alimentos. Los granos almacenados pueden contaminarse con los hongos productores de AFs, que se diseminan como un mecanismo de protección para inhibir el crecimiento de otros hongos (Amde, Temsgen & Dechassa, 2020; Benkerroum, 2020).
Debido al alto riesgo que representan en los alimentos para la población y para los animales por su gran variedad de efectos tóxicos (teratogénicos, mutagénicos y cancerogénicos) además de una extrema resistencia al calor, es importante su vigilancia. Este artículo aborda el tema de las AFs desde su composición química, clasificación, mecanismo de acción, alimentos contaminados y los riesgos a la salud humana y a la animal, con hincapié, como se mencionó en líneas anteriores, de la necesidad de implementar regulaciones homologadas entre los países, así como programas permanentes de monitoreo para su control, que garanticen el cultivo, la importación y la exportación de alimentos y granos libres de estos compuestos.
Clasificación y características de las aflatoxinas
Las aflatoxinas se clasifican dentro del grupo de las micotoxinas. Son metabolitos secundarios tóxicos de bajo peso molecular sintetizados principalmente por los hongos Aspergillus flavus y A. parisiticus abundantes en climas cálidos y húmedos que colonizan a los cultivos en el campo o después de la cosecha; además se ha encontrado que ciertas especies de Penicillium también producen AFs. Existen cuatro tipos de AFs principales que son: AFB1, AFB2, AFG1 y AFG2. Se les ha denominado como B1 (AFB1), B2 (AFB2), G1 (AFG1) y G2 (AFG2), con base en su fluorescencia cuando se iluminan con luz ultravioleta, así como por la movilidad que presentan al analizarlas con cromoplacas de sílica fina (Mollay, Kimanya, Kassim & Stoltzfus, 2022). El hongo Aspergillus parasiticus produce los cuatro tipos de AFs, a diferencia de A. flavus que está limitado a la generación de AFB1 y AFB2. Estos hongos son ubicuos, y saprófitos porque se alimentan de materia orgánica en descomposición en casi todos los sustratos (Amde et al., 2020; Dai et al., 2022).
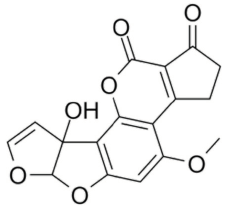
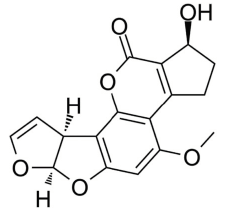
En general existen cerca de 20 diferentes tipos de AFs, las más importantes por su potencial cancerígeno, mutágeno y teratógeno son las AFB1, AFB2, AFB2a, AFM1, AFM2, AFM2a, AFQ1, AFP1 y AFD, siendo esta última, un derivado del tratamiento de AFB1 con amonio. De todas las aflatoxinas, la AFB1 es la más letal y está clasificada como teratogénica, mutagénica y cancerogénica (Amde et al., 2020).
Otro metabolito muy tóxico de la AFB1 es el aflatoxicol (AFL). Mediante la síntesis natural de la AFB1 se generan las AFB2, AFG1 y AFG2. Las AFM1, AFM2, AFQ1, AFG2a, AFP1, AFQ1, AFB2a y AFL son derivados hidroxilados del metabolismo animal o microbiano (Carvajal, 2013). Las aflatoxinas AFM1 y AFM2 pueden ser eliminadas en la leche de los animales que recibieron alimentos contaminados con AFB1 (Dai et al., 2022).
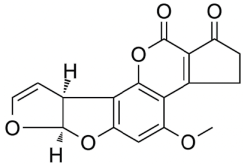
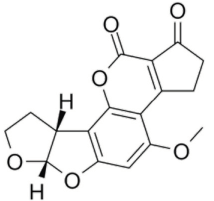
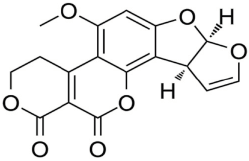
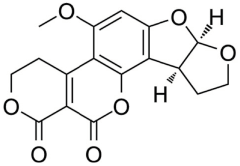
Estructuralmente las AFs están formadas por una cumarina ligada a una unidad bifurano más un anillo de pentanona (AFs B) con cinco átomos de carbono o lactona con seis carbonos (AFs G), además de un anillo dihidrodifurano o tetrahidrodifurano. En el grupo de las difuranocumarinas ciclopentanonas se encuentran las aflatoxinas AFB1, AFB2, AFB2a, AFM1, AFM2, AFM2a, AFQ1, AFP1 y AFL. En el grupo de las lactonas difuranocumarinas se incluye a las AFG1, AFG2 y AFG2a (Toso, Toribio, Diesser, Borrello & Ardoino, 2018). La estructura química de las principales AFs se presenta en la Tabla I.
Tabla I Estructura química de las principales aflatoxinas
| Aflatoxina | Fórmula química | Masa molecular | Estructura química |
|---|---|---|---|
| AFB1 | C17H12O6 | 312.27 |
|
| AFB2 | C17H14O6 | 314.29 |
|
| AFG1 | C17H12O7 | 328.27 |
|
| AFG2 | C17H14O7 | 330.29 |
|
| AFM1 | C17H12O | 328 |
|
| Aflatoxicol | C17H12O6 | 314 |
|
(Modificada de Amde et al., 2020).
Las AFs como sustancias puras se caracterizan por ser cristalinas, de color blanco o amarillo pálido, inodoras, sólidas y solubles en solventes orgánicos como cloroformo, metanol, acetonitrilo y acetona. Son muy estables a temperaturas que superan los 100 °C, con poca o nula descomposición cuando se someten a procesos de pasteurización, tostado y horneado. La existencia del anillo lactona en su estructura química hace que las AFs sean más susceptibles a la hidrólisis por la acción de los álcalis, y otras fracciones de la molécula, que se obtienen después de la acidificación de los productos hidrolizados (Khaneghah, Es, Raeisi & Fakhri, 2018).
El proceso de formación de las AFs no es continuo, se requiere la presencia del hongo productor y de las condiciones ambientales que favorezcan su producción. Sin embargo, no existe una relación directa entre la presencia del hongo y la concentración de la toxina; es decir, el hongo que produce las AFs puede ya no estar presente y el alimento contener una concentración considerable de ellas. Entre los factores que influyen para que ocurra la multiplicación del hongo y la producción de las AFs son: la composición química del sustrato, la cantidad de agua y las condiciones ambientales como la temperatura, la humedad, la concentración de CO2 y el oxígeno, también los daños mecánicos en los granos, el uso de plaguicidas y de fungicidas, el tipo de planta, la presencia de insectos y el número de esporas. Además, la contaminación con AFs dependerá del tiempo de la cosecha, la forma de secar los granos y de su almacenamiento (Khaneghah et al., 2018).
Características del género Aspergillus
El género Aspergillus se divide en seis subgéneros: Circumdati, Nidulantes, Aspergillus, Fumigati, Polypaecili y Cremei, dependiendo del análisis filogenético, las características fenotípicas y fisiológicas. Cada subgénero se divide en varias secciones de especies estrechamente relacionadas. La sección Flavi del subgénero Circumdati agrupa especies productoras de AFs, ácido 3-nitropropiónico, ácido tenuazónico y ácido ciclopiazónico. Entre las principales especies productoras de AFs y ácido ciclopiazónico en los alimentos destaca Aspergillus flavus (Frisvad et al., 2019).
La mayoría de las especies de Aspergillus de la sección Flavi producen esclerocios. Estas estructuras son agregados compactos de hifas pigmentadas que resisten condiciones ambientales desfavorables y tienen la capacidad de permanecer latentes por largos períodos de tiempo. La variación fenotípica de los esclerocios establece los morfotipos “S” y “L”. Las cepas “S” producen esclerocios menores a 400 μm de diámetro y altas concentraciones de AFs, mientras que las cepas “L” generan escasos esclerocios, mayores de 400 μm de diámetro y una menor concentración de AFs (Pérez & Sánchez, 2020).
Las principales cepas fúngicas productoras de la AFB1 pertenecen a la sección de Aspergillus Flavi, filogenéticamente compuesta por 33 especies. Muchas otras especies del género Aspergillus son capaces de producir AFs tipos B y G, como A. cerealis, A. aflatoxiformans, A. arachidicola, A. austwickii, A. luteovirescens, A. minisclerotigenes, A. mottae, A. nomius, A. novoparasiticus, A. parasiticus, A. pseudocaelatus, A. pseudonomius, A. sergii y A. transmontanensis. Otros Aspergillus capaces de producir AFs son las especies del sub-género Nidulantes (A. astellatus, A. olivicola y A. venezuelensis) (Valencia-Quintana et al., 2020). La Tabla II muestra algunos ejemplos de AFs producidas por distintas especies de Aspergillus en diversos alimentos y sustratos.
Tabla II Hongos del género Aspergillus productores de aflatoxinas presentes en algunos alimentos.
| Sección | Especie | Tipo de toxina producida | Granos y alimentos contaminados |
|---|---|---|---|
| Sección Flavi | A. flavus | B1, B2, G1 | Diversos cereales y frutos secos |
| A. novoparasiticus | B1, B2, G1 | Maíz | |
| A. mottae | B1, B2, G1, G2 | Cereales | |
| A. parasiticus | B1, B2, G1, G2 | Cacahuate y maíz | |
| A. nomius | B1, B2, G1, G2 | Trigo y otros sustratos | |
| A. sergii | B1, B2, G1, G2 | Cereales y semillas oleaginosas | |
| A. pseudotamarii | B1, B2 | Cereales | |
| A. pseudocaelatus | B1, B2, G1, G2 | Maíz | |
| A. transmontanensis | B1, B2, G1, G2 | Cereales | |
| A. luteovirescens (formalmente bombycis) | B1, B2, G1, G2 | Cereales | |
| A. parvisclerotigenus) | B1, B2, G1, G2 | Cacahuates | |
| A. minisclerotigenes | B1, B2, G1, G2 | Cacahuates | |
| A. arachidicola | B2, G1, G2 | Maíz | |
| A. austwickii | B1, B2, G1, G2 | Cereales | |
| A. aflatoxiformans | B1, B2, G1, G2 | Cereales | |
| A. pipericola | B1, B2, G1, G2 | Cereales | |
| A. cerealis | B1, B2, G1, G2 | Cereales | |
| A. Togoensis | B1, B2 | Cereales | |
| Sección Nidulante | A. astellatus | B1 | Cereales y otros sustratos |
| A. miraensis | B1 | Cereales | |
| A. olivicola | B1 | Cereales | |
| A. venezuelensis | B1 | Cereales | |
| Sección Ochraceorosei | A. rambellii | B1 | Cereales |
| A. ochraceoroseus | B1 | Cereales |
(Tomado de Jallow et al., 2021).
Entre las características macro y microscópicas del género Aspergillus (Figura 1) utilizadas en la clasificación de las especies, se incluyen el diámetro, la coloración del anverso y el reverso de las colonias, la presencia de esclerocios, las gotas de exudado y el pigmento difusivo, la textura de las colonias, la disposición de las fiálides sobre la vesícula, las medidas de los estipes, las vesículas y las fiálides, el color de los conidios, de las células de Hülle y de las ascosporas (Arrúa et al., 2012). Las colonias de A. parasiticus yA. flavus presentan un micelio abundante, denso y de apariencia algodonosa, sus colonias son planas y aterciopeladas, de color verde con centros lanudos formando una masa de esporas en la superficie de cada colonia (Nikoli´c et al., 2021). A. flavus tienen un aspecto granular y una coloración inicial amarilla que al madurar se oscurece. La coloración de las colonias del género Aspergillus pueden ir de blanco a amarillo, marrón, verde o negro, dependiendo de la especie que se trate (Meneely et al., 2022).

(Tomada de Rangel-Muñoz et al., 2020).
Figura 1: Estructuras morfológicas del género Aspergillus. Conidióforo: Cc = Cabeza conidial, Ee = Estípite, Pe = Célula pie, Mo = Micelio. Cabeza conidial uniseriada: Co = Conidio o espora; Fe = Fiálide, Va = Vesícula. Cabeza conidial biseriada: Co = Conidio, Fe = Fiálide, Va = Vesícula, Me = Métula.
Con relación a su hábitat, los hongosAspergillus están ampliamente distribuidos en todo el mundo, ocupan los primeros lugares como hongos contaminantes del ambiente, son frecuentemente aislados del aire, la tierra, las plantas, la materia orgánica en descomposición y como contaminantes de los alimentos, principalmente de los que contienen carbohidratos y fibra. Presentan facultades adaptativas que facilitan su subsistencia, requieren de una humedad relativa ambiental del 70 al 90 % y un contenido de agua en el sustrato de 15 a 20 %; además, pueden crecer en un amplio rango de temperatura de 0 a 45 °C y a una baja concentración de oxígeno (Carreño, Hurtado & Navas, 2014). Aspergillus flavus tolera rangos de temperatura de 19 a 35 °C, y es de 28 a 30 °C la óptima para su crecimiento y producción de AFs. Puede crecer en sustratos con muy baja actividad de agua, la aw óptima para su desarrollo es de 0.85, en sustratos o tejido del huésped (Meneely et al., 2022). Son una parte importante de los ecosistemas en los que crecen, por su desempeño en el reciclaje del carbono y del nitrógeno y al descomponer la materia orgánica, transformándola en abono para el suelo (Bonifaz, 2012).
La Figura 2 muestra las características morfológicas de A. flavus. Las condiciones climáticas y geográficas son determinantes para su prevalencia y distribución local. La presencia de esta especie es frecuente en países como India, México, Pakistán, Sudán y Arabia Saudita. Estudios realizados en Cuba lo reportan como un hongo abundante y frecuente en ambientes interiores y exteriores. Entre sus cepas existe una gran diversidad morfológica y toxigénica, por lo que la determinación de ambas características es importante para la aplicación correcta de los tratamientos para su control o eliminación (Pérez & Sánchez, 2020).

(Tomada de Rangel-Muñoz et al., 2020).
Figura 2: Estructuras morfológicas de Aspergillus flavus. Cc = cabeza conidial, Ee = estípite, Va = vesícula. Conidióforo. Fe = fiálide, Co = conidio. Cc = conidio, Fe = fiálide. Mo = micelio, So = septo. Esclerocio = Eo. Esclerocio = Eo.
Aspergillus parasiticusse encuentra frecuentemente en áreas tropicales y subtropicales, a diferencia de A. flavusque predomina en los cultivos de climas templados. A Aspergillus parasiticusse le puede encontrar en los suelos, provocando daño a los frutos como el cacahuate y es poco frecuente encontrarlo en la parte aérea de las plantas. A. parasiticus produce conidios rugosos o espinosos, de uniformidad esferoidal y relativamente pesados. Esta especie tiene la capacidad de producir ambas AFs (B y G), pero no produce ácido ciclopiazólico (Vaamonde, Degrossi, Comerio & Fernández, 1995; Pitt, 1993).
Las plantas de maíz o cacahuate estresadas por la sequía, nutrientes o la temperatura, son más susceptibles a ser colonizadas por A. flavus o A. parasiticus. Los cambios repentinos en los patrones de lluvia y de sequía combinados con una alta humedad, temperatura y concentración de CO2, incrementan directamente la expresión de los genes reguladores (aflR) y estructurales (aflD) involucrados en la biosíntesis de las AFs (Valencia-Quintana et al., 2020).
Mecanismos de toxicidad de las aflatoxinas
Las AFs están claramente definidas como agentes genotóxicos cuyo modo de acción inicia a nivel del DNA (Ácido Desoxirribonucleico, por sus siglas en inglés). El órgano diana para el metabolismo de las AFs es el hígado, donde comienza su mecanismo de acción. Después de la ingesta de alimentos contaminados con AFB1, esta es metabolizada por las enzimas del citocromo-P450 y genera metabolitos intermediarios genotóxicos reactivos como el AFB1-8,9-epóxido (AFBO), o metabolitos hidroxilados (AFQ1 y AFM1) y desmetilados (AFP1), todos ellos menos dañinos que la AFB1 (Benkerroum, 2020).
Para ejercer un efecto hepatocancerígeno, el metabolito AFBO que es altamente reactivo se une al DNA de las células hepáticas formando aductos del DNA (8, 9-dihidro-8 (N7guanil) 9-hidroxi-AFB1 (AFB1 N7-Gua). Si estos no se reparan antes de la replicación del DNA, los aductos del DNA interactuarán con la base de la guanina del DNA y causarán los efectos mutacionales en el gen supresor de los tumores p53, generando la hepatocarcinogénesis (Selim, Goitom, Zhang & Zhang, 2013). El metabolito intermediario AFBO es el responsable de la genotoxicidad, es una molécula altamente inestable que reacciona con macromoléculas celulares, incluidos los ácidos nucleicos, las proteínas y los fosfolípidos para inducir a diversas alteraciones genéticas, metabólicas, de señalización y de estructura celular (Garner & Wright, 1975; Rushing & Selim, 2017).
Aproximadamente la mitad de los tipos de cáncer en humanos se deben a la mutación del gen Tp53. Las mutaciones que afectan al gen p53, son diversas por su naturaleza y posición, por ejemplo, mutaciones como la transversión en el codón 249 [guanina (G) a timina (T)], que provoca una sustitución de la arginina (R) a serina (S), es una transversión que se presenta en el 50% de los casos de cáncer hepático (Jackson et al., 2003; Martin & Dufour, 2008).
La Figura 3 resume los diferentes mecanismos de toxicidad de la AFB1 y cómo las especies reactivas de oxígeno (ROS) y el metabolito AFBO causan genotoxicidad, inmunotoxicidad e intoxicación aguda al actuar sobre el DNA genómico, así como la afectación a las macromoléculas funcionales y a las células inmunológicas como las inmunoglobulinas y las citocinas (proteínas que controlan el crecimiento y la actividad de las células del sistema inmunológico y de las células sanguíneas) (Benkerroum, 2020).
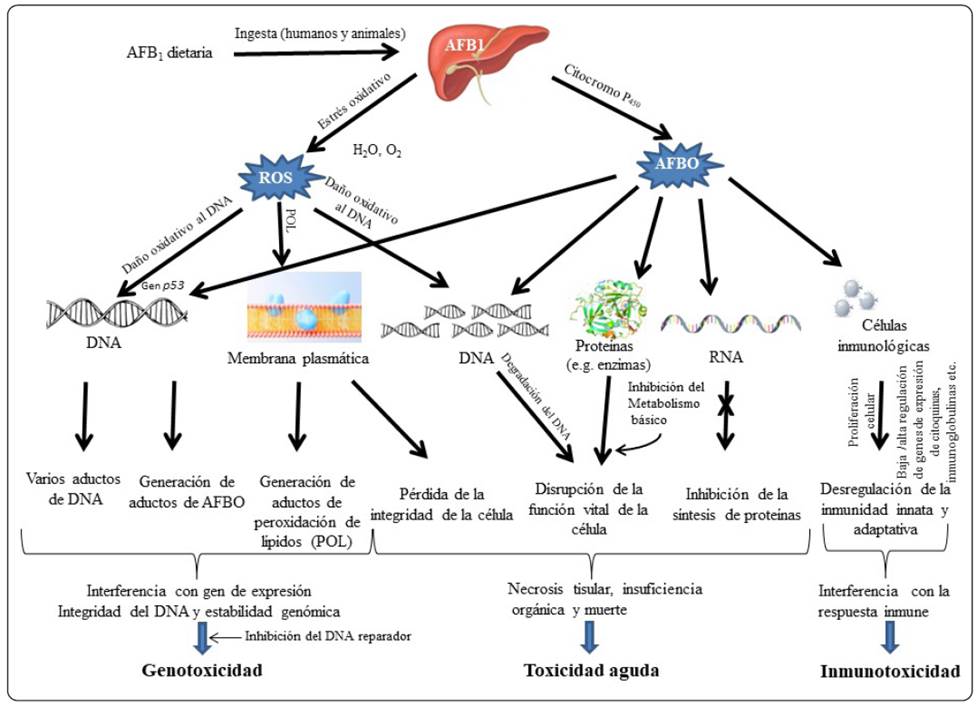
(Tomada de Benkerroum, 2020).
Figura 3 Diferentes mecanismos de toxicidad de la AFB1 y acción de las especies reactivas de oxígeno (ROS) y el metabolito AFBO para causar genotoxicidad, inmunotoxicidad e intoxicación aguda al actuar sobre el DNA, macromoléculas funcionales y células inmunológicas.
Alimentos de origen vegetal contaminados con aflatoxinas
El hongo A. flavus fue reconocido por primera vez en el año 1960, al causar la muerte de miles de pavos por aflatoxicosis. Este acontecimiento generó el monitoreo de las AFs en distintos alimentos y forrajes, incluidos el maíz, cacahuate y el arroz. El segundo hongo importante productor de AFs, es A. parasiticus relacionado con la contaminación del cacahuate, el maíz, los higos y los pistachos (Valencia-Quintana, 2020).
Los hongos productores de AFs colonizan cultivos y alimentos almacenados, por lo que se estima que en el mundo afectan anualmente a más del 25 % de los cultivos. Las condiciones ambientales cálidas y húmedas de las regiones tropicales y el almacenamiento inadecuado de los granos favorecen su crecimiento y la producción de AFs (Carreño et al., 2014; Andrade, Homem, Franc & Caldas, 2013), que son la causa de grandes pérdidas económicas en la agricultura mundial. Se ha estimado que anualmente son afectadas cerca de 16 millones de toneladas de maíz, 12 millones de toneladas de arroz, 1.8 millones de toneladas de nueces y 2.3 millones de toneladas de soya, entre otros cultivos; lo que ha generado la implementación de estrategias de control biológico y para prevenir que se contaminen se utilizan cepas de A. flavus no productoras de AFs, que compiten con las cepas toxigénicas (Carreño et al., 2014).
Los alimentos considerados más susceptibles de ser contaminados por hongos con la consecuente producción de AFs son: las nueces de Brasil, los cacahuates, los pistachos, las avellanas, las semillas de algodón, la pulpa seca de coco (copra), las semillas oleaginosas como las de girasol y la soya, los aceites vegetales sin refinar, los frutos secos como las almendras, los higos, las pasas y las nueces, las especias como el pimentón, el chile, la pimienta, el café y el cacao, los cereales como el sorgo, el maíz, el arroz, el trigo y los derivados de estos productos, raíces y tubérculos y otros alimentos, así como los piensos para el ganado (Martínez, Vargas & Gómez, 2013; EFSA, 2020; Mollay et al., 2022).
Maíz y productos derivados
En México, el maíz es un alimento básico en la dieta y se prepara principalmente como tortilla, con un consumo per cápita de 196.4 kg/año. El 60 % es importado o nacional. La presencia de A. flavus antes de la cosecha es un problema común en las regiones productoras de este cereal y es más severo cuando se presentan altas temperaturas y las plantas sufren estrés por sequía durante el desarrollo del cultivo, lo que favorece la contaminación con AFs, afectando la calidad del maíz y los alimentos derivados. Esto puede representar un factor de riesgo para la salud de la población y de los animales que reciben dietas preparadas con maíz contaminado (Alvarado, Diaz & Ortiz, 2015; SAGARPA, 2017).
Un estudio realizado por Cabrera-Meraz, Maldonado, Bianchini & Espinal, (2021) reportó que las AFs presentes en los granos de maíz fueron transferidas a la masa y a las tortillas. Otros autores también reportaron que las AFs pueden transferirse de los granos a los productos de consumo final (Bullerman & Bianchini, 2007). Además, en una investigación realizada en Veracruz, México, donde se determinaron los niveles de AFs en tortillas, se encontraron niveles de contaminación hasta de 22.17 μg.kg-1, lo que indicó que esta toxina es resistente a los procesos térmicos y puede permanecer en los productos de maíz consumidos por la población (Wall-Martínez et al., 2019).
Diaz, Perilla & Rojas, (2001) evaluaron 109 muestras de maíz y 40 de arroz obtenidas en supermercados, tiendas minoristas y centros de acopio, detectando AFs en el 14 de las muestras de maíz y en 4 de arroz. Doce de las muestras positivas detectadas excedieron el nivel máximo tolerado para AFB1 adoptado en la mayoría de los países (5 ng.kg-1) (Carreño et al., 2014). En México se ha establecido un límite máximo de 12 ng.g-1 de AFs totales en tortillas de maíz (NOM-247-SSA1-2008).
Cereales y Harinas
Los productos alimenticios complementarios como las harinas que están elaboradas básicamente con arroz, maíz, sorgo y trigo son susceptibles a la contaminación por AFs en los países en desarrollo. Para mejorar el valor nutricional de estas harinas se mezclan con otros productos como cacahuates y frutos secos que también son susceptibles a la contaminación por AFs lo que puede provocar un aumento de su concentración en estos productos alimenticios (Mollay et al., 2022). Se ha estimado que cerca del 25 % de los cereales en el mundo están contaminados con micotoxinas, incluidas las AFs, convirtiéndose para los humanos en una de las principales fuentes de exposición a estas toxinas (Bashiry et al., 2021).
Un estudio realizado en Pakistán mostró que las concentraciones de AFs en el arroz, el trigo, el maíz, la cebada, el sorgo, los frijoles rojos, los chícharos y la soya, fueron superiores a los límites establecidos por la Unión Europea, cuyo valor es de 2 µg.kg-1 para AFB1 en alimentos destinados al consumo directo y 5 µg.kg-1 si los alimentos son sometidos a una transformación posterior. Los niveles más altos de contaminación se encontraron en el trigo (15.5 µg.kg-1), el maíz (13.0 µg.kg-1) y la cebada (12.6 µg.kg-1). La justificación para esta situación se basó en un aumento de la temperatura ambiental de 2 a 5 °C en Europa, lo que elevó la aparición de A. flavus. En Argelia, se demostró que este hongo aislado del trigo fue el de mayor prevalencia y un 72 % de esta especie produjo la AFB1 en concentraciones altas (12.1 a 234.6 µg.kg-1). La AFB1 se encontró en el 56 % del trigo y sus derivados en un promedio de entre 0.13 y 37.42 µg.kg-1 (Valencia-Quintana et al., 2020).
Frutos Secos
Alimentos como: diferentes nueces, especias, cacao, frutos secos y pistachos, entre otros, provenientes de América del Sur y del Medio Oriente a menudo contienen AFs y en los pistachos son frecuentes, al presentar concentraciones de hasta 54 µg.kg-1, y si se consideran los límites regulatorios establecidos en esas regiones entre el 40 y 60 % del producto, sería rechazado. Los países importadores, especialmente de la Unión Europea, tienen límites reglamentarios más estrictos que los países exportadores. Esto genera un aumento en el precio de los productos en los países importadores y una mayor exposición a las AFs en los países exportadores (Valencia-Quintana et al., 2020).
Otro de los frutos secos de mayor comercialización en el mundo son los higos secos, que se obtienen por la deshidratación de los frutos de la higuera (Ficus caricaL.). Su elaboración es la tradicional y frecuentemente se contaminan con hongos durante su manejo, cosecha y almacenamiento. La deshidratación de los higos termina con el secado al sol de los frutos senescentes durante tres a cinco días, hasta alcanzar la humedad menor de 26 %. Posteriormente, son almacenados por meses hasta su comercialización. Las características fisicoquímicas de los higos secos favorecen el desarrollo de distintos géneros de hongos como Cladosporium, Acremoniun, Fusarium, Mucor, Penicillium y Aspergillus. La presencia de estos en los higos secos es común y pueden contener distintas micotoxinas, entre las más frecuentes están: AFB1, AFB2, AFG1y AFG2 (Galván et al., 2022).
Como medida regulatoria de las AFs en los higos secos se ha establecido un límite máximo de tolerancia de 6 μg.kg-1 de AFB1y 10 μg.kg-1 para la suma de AFB1, AFB2, AFG1y AFG2. El gran impacto en la salud pública por la contaminación con ellas en higos secos fue respaldado con 138 notificaciones en el Sistema de Alerta Rápida para Alimentos y Piensos (RASFF, 2022), reportándose que la mayoría de los higos contaminados procedían de Turquía (Galván et al., 2022).
Alimentos de origen animal contaminados con aflatoxinas
La exposición a las AFs representa un problema de salud pública, ya que del 20-50 % de todos los tipos de cáncer se han relacionados con los factores dietéticos. También las AFs perjudican a la salud animal y provocan una disminución en su reproducción, al afectar la rentabilidad de las industrias productoras de alimentos, como la porcina y la avícola (Álvarez-Días et al., 2022).
Los huevos, la carne de las aves y los productos derivados de ellas, se consumen como parte de la alimentación diaria de la población. En la industria avícola la presencia de AFs en las dietas para aves compromete los parámetros de producción de la granja, incluida la ingesta del alimento, la conversión alimenticia, el aumento de peso, el rendimiento reproductivo de las aves con una mayor susceptibilidad a las enfermedades, pérdidas económicas para los productores avícolas y una afectación a la salud humana. Las aves de corral que reciben alimento contaminado con AFB1 transfieren esa toxina a los huevos, a la carne y a otras partes comestibles de los animales, con un riesgo para los consumidores de estos productos (Nakavuma et al., 2020; Mohamed et al., 2019).
La susceptibilidad de las aves a padecer aflatoxicosis ha ocurrido en las gallinas reproductoras, los pollos de engorda, las codornices, los patos y los pavos, a los que se les administró alimento contaminado con AFs producidas por A. parasiticus en concentraciones de 3,000, 2,000, 1,500, 1,100 y 500 µg de AFB1.kg-1 respectivamente, por lo que la susceptibilidad de las aves a la AFB1 varió, debido a que tienen una capacidad distinta de convertir la AFB1 en el metabolito intermedio AFB1-8,9-epóxido, mediante la producción de enzimas del citocromo P450. No se ha definido claramente, si el mismo mecanismo que explica la sensibilidad que presentan las distintas especies de aves a la AFB1, se relaciona con los efectos nocivos de la AFB1 producidos por una cepa específica del hongo, incluso en concentraciones bajas, o si otros mecanismos están involucrados (Mohamed et al., 2019).
En las gallinas ponedoras de 2 a 40 semanas de edad y alimentadas con una dieta que contenía 2,500 µg de la AFB1.kg-1 producida por A. parasiticus, se encontraron concentraciones de AFB1 en los huevos de 1.4 µg.kg-1 y diferencias en el color de la yema, así como niveles de AFB1 en la carne de 18.0 µg.kg-1. Además, la adición de 500 µg de AFB1 por kg de alimento, producida por el mismo hongo, administrada a las gallinas de 15 a 67 semanas de edad, dio lugar a una acumulación de 3.5 µg de la AFB1.kg-1en el huevo. En un estudio donde se alimentaron a las codornices con una dieta que contenía 1,500 µg de AFB1.kg-1 producidas también por el mismo hongo hubo una disminución en el grosor de la cáscara del huevo (Mohamed et al., 2019).
En los cerdos, las AFs son frecuentes en las dietas preparadas en las plantas de producción de alimentos, con efectos perjudiciales para su rendimiento, el crecimiento y la salud de los animales. Además de los efectos nocivos en el sistema inmunológico y en la digestibilidad de los aminoácidos, alteran la conversión del alimento y disminuye el aumento de peso en los animales, lo que provoca pérdidas económicas cuantiosas en la industria porcina. Los metaanálisis realizados demuestran la influencia que tienen las AFs contenidas en las dietas porcinas, al mostrar reducciones dosis-dependiente en la ingesta (Jong et al., 2022).
Las temperaturas para la descomposición de las AFs oscilan entre 237 y 306 °C, lo que demuestra que son altamente resistentes a los procesos convencionales de cocción, freído, horneado y asado. En la nutrición animal se han utilizado secuestrantes de AFs como un método de prevención de la aflatoxicosis. En los reportes publicados se menciona que los adsorbentes minerales como la bentonita, zeolita y el aluminosilicato contribuyen a contrarrestar parcial o totalmente los efectos tóxicos de las AFs presentes en las dietas de los animales. Sin embargo, estos adsorbentes minerales tienen la desventaja de unir a las vitaminas, a los minerales y a los aminoácidos, que son esenciales para los animales (Guo, Zhao, Ma & Ji, 2021).
Leche
La leche es un producto de un gran impacto económico a nivel mundial y es uno de los principales alimentos que consume la población de todas las edades, por su valor nutritivo al contener proteínas de alta calidad biológica, además de ser una fuente importante de calcio y de otros elementos nutricionales. Sin embargo, la presencia de la AFM1 afecta su calidad y la salud de los consumidores. La concentración de la AFM1 en la leche varía según la región geográfica y la estación del año, así como los cambios en la temperatura y la humedad ambiental, que impactan significativamente en la contaminación con los hongos productores de AFs en los granos y los forrajes con los que se alimenta al ganado vacuno (Venâncio et al., 2019; Jallow, Xie, Tang, Zhang & Li, 2021).
En México, se ha estimado que la frecuencia natural de la contaminación con AFs ocurre ampliamente en un 99.3 % en las pasturas y en los piensos que se administran a las vacas lecheras, lo que se ha asociado con la presencia de la contaminación de la leche con la AFM1 en un 39.9 %. Por lo que la presencia de las AFs en la alimentación de las vacas lecheras representa un riesgo para la salud humana por un efecto de arrastre (Álvarez-Días et al., 2022). Se ha reportado que los animales de ordeña comienzan a excretar la AFM1 en la leche doce horas después del consumo de los alimentos contaminados con la AFB1 (Jallow et al., 2021; Pokharel et al., 2021).
El proceso para la formación de la AFM1 inicia en el momento en el que el ganado vacuno ingiere los forrajes o granos contaminados con la AFB1, los animales metabolizan las AFs en el hígado y forman el hidroxilado AFM1, que es excretado parcialmente en la leche. La AFM1 es 10 veces menos tóxica que la AFB1; sin embargo, causa citotoxicidad, genotoxicidad y carcinogenicidad en distintas especies. En las ratas, se comprobó que la AFM1 es tan tóxica como la AFB1 y en los patos de un día de nacidos la dosis letal media fue de 0.24 mg.kg-1 con la AFB1 y 0.32 mg.kg-1 con la AFM1. La AFM1 está clasificada por la Agencia Internacional para la Investigación en Cáncer (IARC), como carcinógeno del Grupo 2B. También, la AFM1 puede ser excretada en la leche materna y la orina cuando los seres humanos consumen alimentos contaminados con AFB1 (Pokharel et al., 2021).
Al considerar que la leche es el principal alimento de los infantes, se tiene un mayor interés en los niveles que contenga de AFM1, ya que los niños son más susceptibles a los efectos adversos por su menor peso corporal, una alta tasa metabólica, una baja capacidad de desintoxicación, y dé lugar a un desarrollo incompleto de los órganos y los tejidos vitales. Las AFs pueden ocasionar en los infantes inmunosupresión, reducción en el crecimiento o daño hepático, de ahí la importancia de mantener un control más estricto de estos contaminantes en la leche para ellos (Pokharel et al., 2021; Herrera et al., 2019).
Con el fin de proteger a los grupos de una población más vulnerables, es necesario realizar estudios de vigilancia que permitan determinar el grado de contaminación con las cuatro AFs en los alimentos destinados a la población en general, pero más específicamente en los alimentos destinados a los lactantes y a los niños pequeños (Herrera et al., 2019).
Legislaciones internacionales para las aflatoxinas en los alimentos
Respecto a los límites de tolerancia establecidos para las AFs se sabe que éstos no están homologados en varios países, las regulaciones existentes no se aplican a los mismos alimentos y/o productos alimenticios y algunos de los límites establecidos se aplican solo para la AFB1 y/o para las AFs totales (Valencia-Quintana et al., 2020). Distintos países han establecido límites permitidos de AFs en algunos alimentos basados en el principio de las concentraciones más bajas posibles, derivado de la frecuencia en la distribución de los alimentos y en los resultados de la evaluación del riesgo, además de la capacidad analítica (EFSA, 2020; Dai et al., 2022).
La Unión Europea (UE) estableció niveles de AFs en alimentos para el consumo humano de 2 a 8 μg.kg-1 para la AFB1 y 4 a 15 μg.kg-1 para la suma de las cuatro AFs en alimentos como el cacahuate, los frutos con cáscara, los frutos secos y los subproductos, cereales y subproductos de consumo humano directo o utilizados como materias primas para la fabricación de otros alimentos, al tomar en cuenta que esos procesos puedan reducir la concentración original de AFs (Martínez et al., 2013). También, la UE propuso que el límite de la AFB1 en los alimentos destinados a los animales no sea superior a 10 μg.kg-1 (Valencia-Quintana et al., 2020).
Los niveles permitidos de la AFB1 en los alimentos elaborados a base de cereales destinados a los niños de corta edad son de 0.1 μg.kg-1 (EC, 2006). Para la AFM1 en leche y en las fórmulas para lactantes el valor es de 0.05 ng.kg-1 y en preparados lácteos de 0.025 ng.kg-1 (Amde et al., 2020). Aun cuando se han fijado niveles máximos del contenido de la AFB1 en los alimentos infantiles y para los lactantes, no se han implantado los niveles máximos para la suma de las cuatro principales AFs (B1, B2, G1 y G2). La mayoría de los alimentos para bebés y niños pequeños son multicereales elaborados con diversos granos en sus fórmulas, eso puede incrementar la probabilidad de contener AFs (Herrera et al., 2019).
En Australia, el límite reglamentario es de 15 µg.kg-1 y se aplica para la AFB1 en los cacahuetes y los frutos secos; y en Estados Unidos uno de los primeros países en fijar límites para las AFs en todos los cultivos alimentarios se estableció un valor de 20 µg.kg-1. En Brasil es de 30 µg.kg-1 y en Japón el límite para la AFB1 es de 10 µg.kg-1 (Valencia-Quintana et al., 2020).
En México, la NOM-188-SSA1-2002 reglamenta como límite máximo permitido de AFs en los cereales destinados para el consumo humano y el animal en 20 μg.kg-1 y en la leche de 0.5 μg.L-1 de AFM1. En las tortillas de maíz el nivel permitido de AFs totales es de 12 ng.kg-1 (NOM-247-SSA1-2008). En Colombia el contenido máximo de AFs totales en los alimentos para el consumo humano es de 10 μg.kg-1 (Martínez et al., 2013).
Las AFs no sólo representan una amenaza grave para la salud humana y la animal, también constituyen pérdidas económicas que limitan la comercialización de los productos alimenticios y los piensos. Las pérdidas económicas por la contaminación con AFs en los cultivos son complicadas de estimar con precisión. Sin embargo, los costos por la reducción en el rendimiento animal, el detrimento en el valor del ganado debido a la mortalidad y las enfermedades crónicas, las pérdidas de los alimentos y los piensos contaminados, así como los costos relacionados con la inspección y los análisis empleados para el cumplimiento de normativas reglamentarias, son de miles de millones de dólares anuales (Meneely et al., 2022; Eskola et al., 2020).
Según los datos del Sistema de Alerta Rápida (RASFF) de la Unión Europea, las micotoxinas contribuyen en promedio con el 39 % del total de los casos anuales de productos rechazados en las fronteras donde se instalan los sistemas de revisión de los alimentos y los piensos provenientes de África. Las implicaciones de estos rechazos afectan la reputación del país y la reducción de sus ingresos por la pérdida de los productos exportados, los costos de transporte, de logística y de los seguros. Entre los años 2005 y 2020, 579 envíos de productos agrícolas de origen africano no fueron aceptados por la UE debido principalmente a la contaminación con AFs en niveles que estuvieron por encima de los límites permitidos (4-15 µg.kg-1 de AFs totales). El cacahuate y los productos derivados de éste fueron los más afectados con un 88 %. Países a cuyos productos no se les permitió el ingreso fueron: Egipto que registraron 264, Nigeria 67 y Sudáfrica 54. Los rechazos en la frontera son el resultado del incumplimiento de las normas de la UE y/o de los protocolos analíticos no homologados entre los países africanos y la UE (Adaku, Ejikeme, Chinenye, Oladimeji & Mally, 2022).
Los productos a los que se les impide la entrada en las fronteras de los países del continente africano es también un incidente común. A pesar de la homologación en los límites permitidos para las AFs en los alimentos y los piensos en la Comunidad de África Oriental, se han generado conflictos comerciales entre los países de esa región debido a las concentraciones extremadamente altas de las mismas en los cultivos básicos. La más reciente prohibición fue impuesta por Kenia a las importaciones de maíz procedente de Uganda y Tanzania como consecuencia de la contaminación por arriba de los límites de seguridad de la Comunidad de África Oriental, provocando serias pérdidas económicas (Adaku et al., 2022).
El Codex Alimentarius recomienda que la exposición del consumidor a las AFs debe de ser lo más bajo posible, aplicando buenas prácticas agrícolas (BPA) y de manufactura (BPM), que permitirán reducir considerablemente sus niveles en los alimentos (Codex Alimentarius Comisión, 1995). Las discrepancias en los límites permitidos plantean la necesidad de establecer estrategias analíticas sensibles, accesibles y confiables mediante su validación, a través de los sistemas de revisión instalados en las fronteras geográficas (Amde et al., 2020).
Enfermedades en los humanos asociadas con las aflatoxinas
En los años 60, a la AFB1 se le consideró un potente carcinógeno para algunas especies animales, y fue en 1993 cuando la Agencia Internacional para la Investigación en Cáncer (IARC) ratificó que las AFs tienen la capacidad de provocar toxicidad aguda o crónica en los animales y en los humanos, causando daño hepático agudo, cirrosis hepática, aparición de tumores y efectos teratogénicos, de inmunosupresión e interferencia en la absorción de las proteínas. Los estudios epidemiológicos han demostrado una correlación directa entre la exposición a la AFB1 y el desarrollo del cáncer hepático en los humanos. La Figura 4 esquematiza como ocurre la aflatoxicosis y el carcinoma hepatocelular por el consumo de alimentos contaminados. El riesgo puede incrementarse hasta 30 veces más si existe la presencia del virus de la hepatitis B (VHB) en los pacientes (Umesha et al., 2017; Andrade et al., 2013).
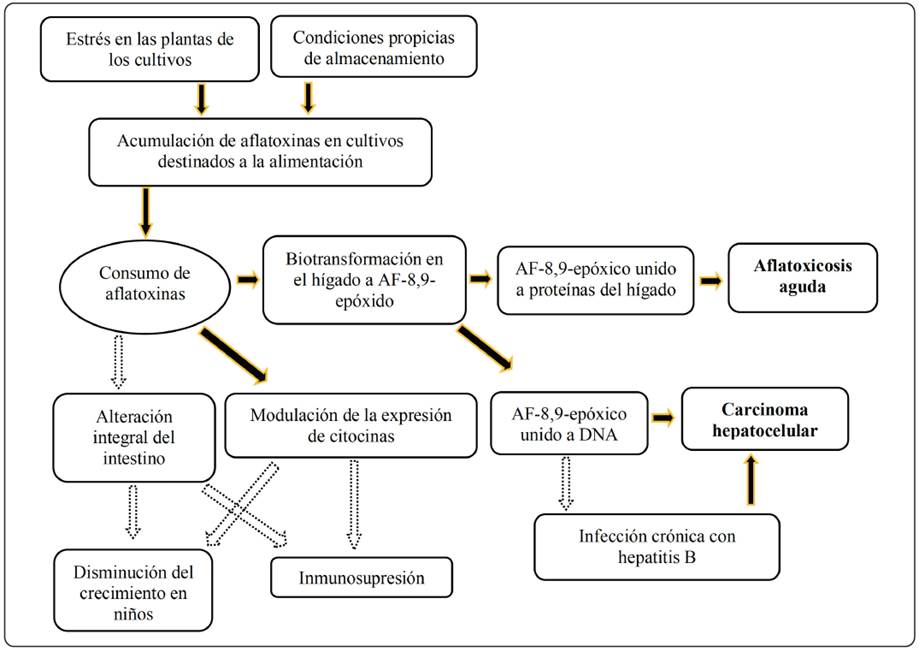
(Tomada de Umesha et al., 2017)
Figura 4 Esquema que muestra el proceso para la formación de metabolitos de aflatoxinas desde que la planta es infectada por el hongo, la biotransformación de la AFB1 al metabolito reactivo y las alteraciones agudas y graves que causan en los organismos.
Las AFs son todavía un tema de investigación en la actualidad porque su consumo en dosis bajas, medias o altas causa efectos tóxicos a corto plazo (efecto agudo), o manifestarse el daño después de meses o años (efecto crónico), y estos últimos son los más comunes. A las AFs se les relaciona con la patogénesis de la malnutrición proteico-energética y la causa del daño hepático en los seres humanos (Martínez et al., 2013).
El consumo de alimentos contaminados con altas concentraciones de AFs, provoca aflatoxicosis aguda, necrosis hepática, hemorragia y edema. Por consiguiente, el efecto crónico por la ingesta de alimentos con bajos niveles de AFs está asociado con los trastornos en la digestión, una mala absorción y deficiencia en el metabolismo de los nutrientes, cirrosis y desarrollo del carcinoma hepatocelular (CHC). También los estudios epidemiológicos establecen una asociación entre la exposición a las AFs y el desarrollo del CHC en las poblaciones con bajos o medianos ingresos, principalmente de África y Asia (Meneely et al., 2022).
El Centro para el Control y la Prevención de Enfermedades (CDC) de los Estados Unidos señaló que más de cuatro millones de personas en el mundo, en específico de los países en desarrollo, pueden estar crónicamente expuestas a las AFs por la reducida diversificación de los alimentos que consumen (Cabrera-Meraz et al., 2021). La AFB1 es vista como el carcinógeno hepático natural más potente, un promotor de la inflamación que actúa como un supresor del crecimiento. Se le ha asociado con el 25 % de los casos de cáncer en el hígado a nivel mundial (172,000 casos/año). Además, hay una preocupación por la relación entre la exposición a la AFB1 y el retraso en el crecimiento infantil, que puede conducir a una variedad de condiciones de salud adversas (Valencia-Quintana et al., 2020).
Investigaciones realizadas en los años 60 y 80 identificaron a los alimentos más comunes contaminados con AFs, el grado de concentración y a la frecuencia del consumo con la aparición del CHC. En 1982 un estudio llevado a cabo en Filipinas demostró que la ingesta de AFs y el consumo de alcohol son un riesgo para el desarrollo del CHC. En los años 90 se realizaron los primeros estudios con biomarcadores en las poblaciones con alta incidencia del CHC, confirmando la asociación entre la manifestación del CHC con una alta exposición a las AFs, además de la sinergia entre éstas y otros factores de riesgo. Aun cuando estas se han relacionado con otros efectos adversos para la salud humana y la animal, como el retraso en el crecimiento y la inmunotoxicidad, el desarrollo del cáncer sigue siendo la base para continuar regulándolas en todo el mundo. Las mezclas de AFs que se encuentran de forma natural están clasificadas por la Agencia Internacional de Investigaciones en Cáncer como un carcinógeno humano del Grupo 1 (Turna, Havelaar, Adesogan & Wu, 2022).
Las AFs también causan otras enfermedades agudas y crónicas, la mayoría son graves, su carcinogenicidad se asocia con el hígado, por ser el órgano donde se metabolizan por primera vez y se liberan como metabolitos intermedios reactivos; causan el mismo problema en otros órganos como el riñón, el páncreas, la vejiga, los huesos y el sistema nervioso central, entre otros. También, se presentan problemas de salud agudos y crónicos tanto en los humanos como en los animales, como la desnutrición, el retraso en la madurez física y mental, así como en la reproducción y en las enfermedades del sistema nervioso, pero sus mecanismos de acción en estos casos no están completamente claros (Benkerroum, 2020).
En Latinoamérica, existen escasos estudios realizados en Cuba, México, Brasil y Colombia dirigidos a la exploración con los biomarcadores, para evaluar la incidencia del CHC y su relación con las AFs en los alimentos. Algunos estudios se han enfocado en identificar la presencia del complejo AFB1-albúmina, y sugieren la validez de utilizar su medición como un marcador que confirme la exposición a AFs (Carreño et al., 2014).
Kimanya et al. (2021) estimaron que, en Tanzania, el riesgo para la población de padecer cáncer de hígado por las AFs puede ser de 2.95 por cada 100,000 habitantes. Diversas investigaciones han puesto de manifiesto que la aflatoxicosis aguda causa la muerte de los organismos. Se han reportado más de 55 mil millones de personas en el mundo expuestas a riesgos en la salud por la contaminación con las AFs en los alimentos (Dai et al., 2022).
También, por los cambios en el clima se requiere monitorear continuamente la presencia de los hongos productores de AFs en los alimentos, en la pastura para el ganado, así como de un control del clima interno en las bodegas donde se almacenan los granos y una mayor vigilancia, incluso, en los alimentos comerciales. Este seguimiento ayudará a la conservación de los productos agrícolas y en la calidad de los alimentos a favor de la salud humana y la animal, además de un mayor éxito comercial y económico de los productos (Valencia-Quintana et al., 2020).
Conclusiones
Las investigaciones realizadas a las AFs demuestran el riesgo en que está la población y los animales destinados al consumo humano por la ingesta de alimentos contaminados con estos compuestos. Por lo que es necesario un esfuerzo por mejorar los sistemas de cultivo, cosecha, almacenamiento y distribución de los granos, ya que las condiciones ambientales propias de ciertas regiones y el inadecuado manejo de los granos cosechados, contribuyen a la contaminación con Aspergillus y con cualquier otro hongo productor de micotoxinas, entre ellas, las aflatoxinas.
Por el efecto negativo a la salud humana y a la animal que ocasionan las AFs es posible que este problema de contaminación sea mayor en las regiones del mundo donde se realizan pocos o nulos estudios por desconocimiento del problema. Asimismo, es importante continuar con la investigación a los mecanismos de producción de las AFs y su impacto como factor de riesgo en los países con alta incidencia de casos de carcinoma hepatocelular y de otros tipos de cáncer.
La eliminación completa de las AFs en los alimentos es difícil, sin embargo, una de las estrategias para reducir el riesgo en la población es la aplicación de una legislación geográfica homóloga que incluya los límites máximos de consumo permitidos.
En México, existen normas que establecen una cantidad determinada de AFs en algunos alimentos, pero se requiere reforzarlas con resoluciones obligatorias que especifiquen los límites de consumo máximos en un mayor grupo de ellos, al considerar la frecuencia de ingesta y el riesgo que representan para la población. Además, de priorizar el análisis a los alimentos destinados a la población infantil por su mayor vulnerabilidad.
Las medidas preventivas que se tomen para evitar el crecimiento de los hongos productores de AFs en los cultivos, así como el desarrollo de métodos analíticos confiables que permitan la determinación de estas toxinas y la implementación de programas para monitorearlas en los alimentos, contribuirán a disminuir el riesgo a su exposición y a mantener un mayor control de estos contaminantes, garantizando alimentos seguros para la salud de los humanos y de los animales.











 nueva página del texto (beta)
nueva página del texto (beta)