Introducción
El mixoma es el tumor intracardiaco izquierdo benigno más frecuente, supone el 65% en la frecuencia de los tumores cardiacos1; su localización es más frecuente en la aurícula izquierda (75%), le sigue la aurícula derecha (23%) y un 2-3% en cavidades ventriculares, y en más raras ocasiones el tumor se presenta en más de una cavidad2. Incluso se ha demostrado un comportamiento familiar al encontrar asociación entre miembros de la misma familia y es transmitido de forma autosómica dominante3. La presentación clínica de estos varía dependiendo del tamaño y la localización del tumor, aunque predominan los síntomas de cavidades izquierdas por la misma frecuencia de presentación de las lesiones4,5. Un porcentaje mayor al 50% de los mixomas presentan embolismo sistémico o tienen el antecedente de accidente vascular cerebral agudo en algún momento de la evolución del padecimiento5, con hallazgo ecocardiográfico de una tumoración en la aurícula izquierda6. Sin embargo, la presentación clínica de embolismo paradójico sistémico con lesión tumoral en aurícula derecha y paso a circulación general por de la coexistencia de una comunicación interauricular es extremadamente rara. El informe de casos de enfermedad metastásica mixomatosa es también muy poco frecuente7,8. Ahora bien, podríamos englobar en una triada la gama de síntomas que pueden presentar estos pacientes: 1). Síntomas y signos ocasionados por la obstrucción de las cavidades cardiacas; 2). Síntomas y signos originados por la migración o embolización del tumor (no metástasis o implantación ectópica) y 3). Síntomas sistémicos asociados9. Predominan, evidentemente, la disnea y la ortopnea, el presíncope o síncope e insuficiencia valvular por efecto de obstrucción tumoral, además de angina, hemoptisis, accidente vascular cerebral, en ocasiones fiebre, malestar general, pérdida de peso y fatiga9. El estándar de oro en el diagnóstico es el ecocardiograma transesofágico que incluso ha hecho pensar a algunos autores que se pueden asociar algunas características morfológicas ecocardiográficas (como el polipoide por ejemplo), con sospecha o probabilidad de embolización10. Histológicamente este tumor deriva de las células mesenquimales multipotenciales del subendocardio11.
Métodos
Revisamos los expedientes clínicos de los pacientes operados con diagnóstico de tumoración intracardiaca en el Servicio de Cirugía Cardiovascular del Hospital Central Sur de Alta Especialidad de Petróleos Mexicanos durante los últimos 7 años, en el periodo comprendido del 1 de agosto de 2006 al 31 de julio de 2013. Todos cumplieron con el protocolo de ingreso al servicio, estudio y presentación en sesión médico-quirúrgica, aceptándolos para cirugía de resección tumoral.
Las cirugías fueron realizadas de acuerdo con el protocolo de circulación extracorpórea, con anestesia general balanceada y monitorización invasiva. Los pacientes fueron tratados con midazolam, fentanil, etomidato, rocuronio, sevofluorano, tiopental y extubación temprana, sin uso prolongado de inotrópicos, vasopresores o vasodilatadores. En la conexión cardiopulmonar se utilizó canulación aortica y bicaval, circulación extracorpórea, bajo pinzamiento aórtico y asistolia con solución cardioplégica anterógrada tipo HTK de Breschneider (Custodiol®), abordaje a través de aurícula izquierda, llegando a la tumoración, resección completa de la misma incluyendo el pedículo, revisión del sitio de implantación del tumor, cierre de aurícula y despinzamiento, sin dificultad para el destete cardiopulmonar, así como su traslado a la unidad de cuidados intensivos coronarios.
Resultados
En 7 años se realizaron 10 cirugías a 9 pacientes (uno de ellos requirió reoperación a los 7 meses de la primera debido a recidiva tumoral).
El sexo más frecuentemente encontrado en nuestra revisión fue el femenino: un 60% de los casos y un 40% varones. Esto concuerda con lo reportado en la literatura nacional e internacional; sabemos que son más frecuentes en mujeres en una relación de 2.5:1.5, y que se originan de las células mesenquimatosas subendocárdicas11.
Por otro lado, hay un predominio de edad entre los 40 y 60 años9. Sin embargo, la verdad es que no existe una edad exclusiva de presentación de estas lesiones tumorales; se sabe que estas proceden de las células mesenquimatosas endocárdicas como ya se ha comentado11. Por ello, tal vez se pensaría en una presentación más temprana incluso inicial de la vida; sin embargo, nuestros hallazgos nos llevaron a edades avanzadas, encontrando una distribución desde los 12 años de edad (un caso que corresponde al 10%), que se operó con resección total. Sin embargo, recidivó 7 meses después, realizando nueva resección cuando tenía 13 años de edad. No hallamos ningún caso del período desde los 13 años hasta la década de los 40 a 50 en que nuevamente encontramos 2 casos (20%), otros 2 casos de los 51 a los 60 años que proporcionan otro 20%, la mayor incidencia fue de los 61 a los 70 años con 3 casos (un 30%), y finalmente a los 76 años de edad un último caso que ocupa el 10% restante. Nos llama la atención la presentación pediátrica, aunque esta es infrecuente como sabemos, dado que su incidencia es del 0.2% en los diagnósticos de enfermedad cardiaca quirúrgica y del 14.2% en menores de 16 años para los tumores cardiacos12; respecto a ello, obtuvimos el 10%, de acuerdo con lo reportado. Todo lo anterior se presenta en la Tabla 1.
Tabla 1 Se muestran las etapas de la vida en las que encontramos pacientes de nuestra casuística. Llama la atención los extremos en pediátricos y en nonagenarios

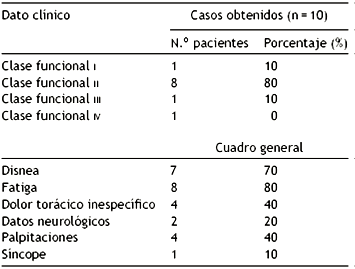
Un punto interesante de lo encontrado se refiere al cuadro que presentan los portadores de mixomas. En la Tabla 2 mostramos el comportamiento clínico y clase funcional de nuestros pacientes estudiados. Es importante mencionar que encontramos al 100% de los pacientes clínicamente positivos, de ellos el 70% con disnea de diverso grado, el 80% con fatiga mayor a la habitual en el momento del ejercicio. El 60% de los pacientes referían dolor torácico inespecífico tipo "malestar", un 20% de ellos presentó un evento cerebral transitorio que no dejó secuelas. Respecto a la clase funcional según la New York Heart Association13, la gran mayoría (un 80%) estaban en la II, un 10% en la I y el restante 10% en la III; no hubo ningún paciente en la IV. Respecto a las palpitaciones, se presentaron en un 40% y solo un paciente sufrió síncope. En un 90% operamos tumores en aurícula izquierda y en un 10% en aurícula derecha. No obtuvimos casos de tumores fuera de estas 2 cavidades mencionadas. Esto es compatible también con lo reportado en la literatura. Si bien se sabe que un 75% de los tumores se encuentran en aurícula izquierda, y un 25% se distribuyen entre el resto de las cavidades e incluso llegan a ser multicavitarios1, en el presente caso no fue así (véase Tabla 3).
Tabla 2 Perfil clínico de los pacientes operados de mixoma en el presente estudio
Fuente: Sistema de Expediente Electrónico del Hospital.
Tabla 3 Resto de variables en nuestra serie de pacientes

Fuente: Sistema de Expediente Electrónico del Hospital.
Encontramos tumores a los que llamamos pequeños, que son menores de 3 cm, en un 20% de los casos con solo 2 pacientes operados; tumores que denominamos medianos, donde se describen las lesiones con dimensiones entre los 4 y los 7 cm de diámetro mayor, ocupando el 50%, con un caso de 4 cm, uno de 5 cm, 2 de 6 cm y 2 de 7 cm todos en su diámetro mayor; y finalmente tumores de gran tamaño donde se englobaron el 30% de los mixomas restantes, de los cuales fue una tumoración de 8 cm, una de 9 cm y una de 10 cm; a este último lo llamamos mixoma gigante. Esta separación por dimensiones la realizamos en forma particular en nuestro hospital para facilitarnos su agrupación, y se detalla más en la Tabla 3. Se lograron extubar en sala el 70% de los pacientes (7) y el 30% (3) dentro de las primeras 6 h después de la cirugía, sin necesidad de nuevo apoyo invasivo ventilatorio en ninguno de ellos, secuelas pulmonares o ambos (Tabla 3).
El 100% de los especímenes se describió como mixoma auricular. Dentro del seguimiento de los pacientes a partir del postoperatorio inmediato, nos percatamos de 2 complicaciones menores a las cuales se les denominó morbilidad, y estas consistieron en dehiscencia mínima de la herida que ameritó curación y resutura en su cama con polipropileno del 3-0 y 2 puntos tipo Sarnoff. Asimismo, llamamos mortalidad temprana la que ocurrió a aquellos pacientes que pudieron haber fallecido en el acto quirúrgico y hasta los primeros 30 días posteriores a este. Sin embargo, el 100% de los pacientes fueron excluidos de este rubro, pues en el seguimiento a 7 años de iniciado el conteo del estudio y hasta el día 31 de julio de 2013, el 100% de los pacientes sobrevive (Tabla 3). En el grupo de pacientes estudiados, tuvimos una femenina de 12 años, con tumor auricular izquierdo, la cual se trató según el protocolo de presentación, preparación, técnica anestésica y quirúrgica ya comentada. Sin embargo, a los 7 meses de operada (ya a los 13 años de edad), fue reingresada y sometida nuevamente a cirugía por recidiva, bajo circulación extracorpórea y paro cardiaco; sin embargo, el abordaje en esta ocasión fue biauricular, con resección completa del tumor, septectomía subtotal y colocación de neoseptum de teflón. A la fecha del cierre del periodo de estudio, está sin recidiva (2 años) y asintomática cardiovascular (Tabla 3).
Discusión
La etiología y el pronóstico de los tumores auriculares varían dependiendo de su estirpe, edad del paciente y comportamiento clinico14,15. Afortunadamente, como conocemos, la gran mayoría de estos casos los conforman las etiologías benignas y de ellos los mixomas1,10. Otros tumores benignos primarios incluyen lipomas, fibromas, hemangiomas, teratomas y rabdomiomas, mientras que los tumores malignos primarios del corazón son predominantemente sarcomas10.
Su sospecha se inicia cuando por comportamiento clínico en adultos hay datos no específicos de cardiopatía isquémica, evolución conocida de alguna valvulopatía, o si se incluye a los menores de 16 años, por datos cardiológicos de reciente aparición tales como disnea, fatiga, palpitaciones, malestar torácico, entre otros16.
El paciente debe someterse de inmediato a protocolo completo de estudio cardiológico, en el que se incluyen estudios de laboratorio preoperatorios: como se muestra en la Figura 1, un ecocardiograma transtorácico, frecuentemente ecocardiograma transesofágico, cateterismo diagnóstico derecho e izquierdo si es necesario, e incluso si hay datos como los que describió el Dr. J. Aidan Carney en 1985 y que sugieran lo que actualmente se conoce como complejo de Carney17-19 (mixomas recurrentes o en varios miembros de la familia con tumores o alteraciones en la pigmentación de la piel e hiperactividad neurotumoral endocrina). Es válida la realización de perfil genético en búsqueda del gen PRKAR1A del cromosoma 17, frecuentemente asociado a este síndrome18,19. Es importante un minucioso escrutinio clínico para definir el procedimiento y abordaje adecuado para cada paciente; incluso por edad podemos encontrar estos casos en recién nacidos, que no se comportan evidentemente como el adulto. El procedimiento de resección es distinto y con probabilidades de requerir incluso plastia valvular. El pronóstico dadas las comorbilidades y estado individualizado varían pero conllevan más de un 95% de éxito20-22. La localización del tumor y sus dimensiones también nos dan otro panorama, el involucrar función valvular con o sin lesión estructural; la localización atípica, intra- o extracardiaca es rara pero debemos tenerla presente23. Estos tumores derivan de células primitivas endoteliales, de células subendocárdicas o de células multipotenciales mesenquimatosas. La estructura del mixoma consiste en capas de células poligonales uniformes en un estroma mixomatoso rico en mucopolisacáridos15. Su etiología no es del todo conocida, pero se origina de células no diferenciadas y totipotenciales. Los mixomas pueden recidivar por un mecanismo aún no conocido, desde de los pocos meses y hasta varios años después de la cirugía15.
Casi siempre las cirugías transcurren sin complicaciones, la curación completa se puede considerar en casi el 100% de los casos, al someter al paciente a paro cardiaco, apertura auricular cómoda, visualización y extracción completa del espécimen incluyendo su sitio de implantación (Figs. 2, 3 y 4), o bien incluyendo fotocoagulación con láser en un área de 1 cm alrededor del pedúnculo; estos procedimientos tienen como objetivo eliminar grupos celulares tumorales residuales capaces de generar una nueva proliferación, pese a todo solo un bajo porcentaje de estas cirugías presentan recidivas en algún momento del seguimiento (menos del 6% de los casos). Se mencionan como posibles causas de recidiva la edad del paciente (por su anabolismo etario), insuficiente resección tumoral en la primera cirugía (permanencia del pedículo activo), siembras metastásicas preoperatorias o intraoperatorias y génesis multifocal24-26.
En pacientes pediátricos, y en base particularmente a la experiencia de los autores, sugerimos la cirugía con abordaje desde el inicio biauricular (el izquierdo para resección tumoral completa y exploración libre de la cavidad), a continuación abrir la aurícula derecha sin cerrar la izquierda, realizar septectomía subtotal con resección central del sitio de implantación del pedículo (esto se constata bajo visión directa transatriotomía izquierda), y entonces implantar un parche de teflón a modo de neoseptum, cierre de ambas aurículas, deaereación, despinzamiento y corroborar reparación mediante una ecocardiografía transesofágica transoperatoria, dado que si bien la recidiva no es tan frecuente, en nuestra serie por la muestra pasa a ser un porcentaje que llama la atención.
Conclusión
Para el paciente, ser portador de una cardiopatía de resolución quirúrgica o de un tumor a pesar de sospecha de etiología benigna siempre serán condiciones que por separado generan inquietud e incertidumbre importantes; saberlas combinadas, para él significan mayor aprehensión y tal vez menores expectativas de vida. La experiencia que se logra recabar con el paso de los años en centros de referencia nacional llega a ser de tal grado que permite ofrecer a los pacientes actualmente una cirugía segura, de extubación temprana, mínima morbilidad, mortalidad del 0% (en la serie reportada) y supervivencia libre de síntomas.
Financiación
No se recibió patrocinio de ningún tipo para llevar a cabo este artículo.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.











 nueva página del texto (beta)
nueva página del texto (beta)






