Introducción
Derivado de la reforma a la Ley General de Salud de Mayo de 20031, en enero de 2004 se creó el esquema de seguridad universal denominado Sistema de Protección Social en Salud en México (SPSS), con el objetivo de proporcionar, entre otros beneficios, la atención médica integral a poblaciones no asalariadas carentes de seguridad social. Para llevar a cabo su cometido, el SPSS estructuró un Seguro Popular de Salud, conocido simplemente como «Seguro Popular». Con este esquema ha sido posible incorporar a poblaciones autóctonas del Estado de Chiapas, tradicionalmente marginadas a los beneficios de diagnósticos y tratamientos completos para un número creciente de padecimientos complejos. Para proporcionar estos servicios se han ido creando instituciones hospitalarias especializadas en el Estado. Así, entre otras, en el año 2007 inició operaciones el Centro Regional de Alta Especialidad de Chiapas de tercer nivel, constituido por el Hospital de Especialidades Pediátricas (HEP) en Tuxtla Gutiérrez para atender a la población infantil, y el Hospital Regional de Alta Especialidad en Ciudad Salud, Tapachula2. A 10 años de su creación, resulta pertinente conocer los resultados de las intervenciones del Seguro Popular en las diversas áreas de la patología local, su comparación con los resultados obtenidos en otras zonas del país bajo el mismo esquema y establecer las determinantes médicas y no médicas de los resultados obtenidos.
Dentro de las patologías complejas que cubre el Seguro Popular en la infancia, las enfermedades neoplásicas, en especial las hematológicas, son las que tienen mayor impacto personal, familiar y social, tanto por su frecuencia y gravedad como por el costo de su diagnóstico y tratamiento. En el HEP, a partir de 2008, cuando se atendieron 63 casos con malignidad hematológica, se ha observado un incremento progresivo del número de casos nuevos atendidos hasta alcanzar la cifra de 80 casos en el año 2011. A partir de ese año se ha observado la estabilización de casos nuevos anuales alrededor de ese número, y la mayor parte de ellos (aproximadamente el 70%) han correspondido a leucemia aguda (Departamento de Estadística, HEP). Por ello, en un primer enfoque, en el presente trabajo se analizaron los resultados del tratamiento de las leucemias agudas valorados como la sobrevida a 5 años de pacientes diagnosticados y tratados en el HEP de 2008 a 2012. Un énfasis particular se hizo en la variante más frecuente, la leucemia linfoblástica aguda, correlacionándola, además, con algunos factores pronósticos clínicos y de laboratorio tradicionales relevantes, como sexo, edad, cifra de leucocitos, índice de DNA (iDNA), alteraciones moleculares, riesgo al ingreso y otros. También se describieron algunos elementos relacionados con su evolución y destino final.
La valoración objetiva de la sobrevida y el destino final de los pacientes con leucemias agudas en el HEP como indicadores del resultado del programa oncohematológico permite tener una visión global de este, la ponderación de la influencia de factores pronósticos tradicionales y no tradicionales (extrahospitalarios) sobre los resultados, su comparación con otras instituciones nacionales similares y, en su caso, poder tomar acciones adecuadas para su mejora basadas en datos objetivos.
Métodos
Se realizó un estudio descriptivo y de sobrevida de los pacientes diagnosticados con leucemia aguda y tratados en el HEP de 2008 a 2012. Las fuentes primarias de información fueron el Sistema de Información para la Gerencia Hospitalaria del HEP y las bases de datos del laboratorio. Se identificaron 244 casos con el diagnóstico confirmado de leucemia aguda (en 240 casos mediante inmunofenotipo y frotis de médula ósea, y en cuatro solamente con frotis de médula ósea con más del 30% de blastos). De esta relación se eliminaron 18 pacientes (7.3%) que una vez hecho el diagnóstico no aceptaron tratamiento, 11 pacientes (4.5%) que no regresaron después de la primera aplicación de quimioterapia y cinco pacientes (2.0%) que fueron transferidos a otra unidad médica una vez establecido el diagnóstico. Los abandonos posteriores se incluyen en el estudio.
La serie de casos motivo del presente análisis consta de 210 pacientes de leucemia aguda. Todos ellos recibieron el tratamiento inicial recomendado por los protocolos nacionales o similares3,4.
Análisis estadístico
Se llevó a cabo un análisis descriptivo de los datos, estableciendo las características generales de los pacientes y la proporción de cada variedad de leucemia. Para efectos de la descripción de la situación actual, en el concepto «defunción» se incluyeron los casos que fallecieron en el hospital, los dados de alta para cuidados paliativos por enfermedad terminal, aquellos en recaída no tributarios de más tratamiento quimioterapéutico por el grado de daño a la médula ósea o la consideración clínica de que, por las condiciones generales del paciente, este no toleraría los efectos secundarios de la medicación que procedía y que fueron dados de alta por máximo beneficio, además de aquellos en recaída que no aceptaron más tratamiento y solicitaron alta voluntaria. En los pacientes terminales que no fallecieron en el hospital y cuyos familiares no reportaron el deceso, se tomó como fecha de defunción la de su último egreso. Bajo el concepto «abandono» se incluyeron los casos que recibían tratamiento y que dejaron de acudir a consulta o tratamiento sin explicación durante más de 4 semanas, y cuya situación personal se ignora a 5 años del diagnóstico.
Se analizó la sobrevida mediante curvas de sobrevida de Kaplan-Meier para toda la población y para cada variedad de la enfermedad, incluyendo el año de diagnóstico, empleando el programa SPSS (IBM SPSS Statistics v.21; IBM Corporation). Los resultados se expresan como sobrevivencia a 5 años del diagnóstico en porcentaje (porcentaje de pacientes vivos a 5 años del diagnóstico) o como mediana de sobrevida en meses (meses en los que se alcanza el 50% de sobrevida). La significación de la diferencia observada entre las diversas curvas de sobrevida se determinó mediante la prueba de rango logarítmico (Log Rank), empleando para ello las opciones del mismo programa (SPSS). Dado que la mayor parte de los casos correspondieron a leucemia de células B, se elaboraron curvas de sobrevida de Kaplan-Meier adicionales solo para esta variedad de leucemia, en función de la agrupación multivariada predefinida implícita en la clasificación inicial de los casos en los denominados «grupos de riesgo». Por separado, se realizaron curvas similares en función de cada una de la mayor parte de las variables independientes que se encuentran integradas en los mismos grupos de riesgo: edad, sexo, presencia de CD10 en superficie, presencia de marcadores aberrantes (cualquiera, CD13, CD7, CD5), cuenta inicial de leucocitos (< 50,000/µl, 50-100,000/µl, > 100,000/µl), translocaciones [cualquiera, t(1;19), t(12;21) y t(9;22)], iDNA (hipodiploide, diploide, hiperdiploide) y cariotipo (normal o anormal). Por último, se describen el tiempo promedio de seguimiento, en su caso el número de recaídas y el tiempo hasta primera recaída, la mortalidad, las causas genéricas de defunción y su relación con el estado de la enfermedad y con la aplicación precedente de quimioterapia.
Resultados
Características generales
De los 210 pacientes diagnosticados con leucemia aguda, la mayoría correspondieron a casos de leucemia B (178; 84.8%), 10 (4.8%) a leucemia T y 22 (10.5%) a leucemias mieloides. La relación de sexos fue de 1.3:1 (masculino: femenino) para las leucemias B, 1:1 para las T y 0.8:1 para las mieloides. Todas las variedades de leucemias afectaron más a los pacientes en edad escolar (5 a < 10 años). Sin embargo, las leucemias B afectaron proporcionalmente a más preescolares que las T y las mieloides, y las mieloides afectaron más a escolares y adolescentes que las linfoides (B y T). Las diferencias de sexo y de distribución en grupos de edad de acuerdo con el tipo de leucemia no fueron significativas.
Situación actual
En la Tabla 1 se muestra la situación de los 210 pacientes con leucemia aguda según tipo de leucemia. Solo el 23% de los pacientes con leucemia B (la de mejor pronóstico) se encontraban vivos a un mínimo de 5 años de tratamiento; de ellos, el 7% cursaba con enfermedad activa. Por otro lado, llama la atención el alto porcentaje de pacientes de todas las variedades que abandonaron el tratamiento. En la mayor parte de estos casos, los expedientes no consignan la causa del abandono, sino simplemente mencionan que el paciente no acudió a su cita, no regresó y no se hizo esfuerzo alguno por localizarlo y determinar las razones.
Tabla 1 Situación de los pacientes con leucemia aguda a 5 años de diagnóstico y tratamiento en el Hospital de Especialidades Pediátricas, 2008‑2012
| Estado | Leucemia B | Leucemia T | Leucemia M | Total | ||||
|---|---|---|---|---|---|---|---|---|
| Defunción | 90 | 51% | 8 | 80% | 15 | 68% | 111 | 53% |
| Abandono | 47 | 26% | 1 | 10% | 6 | 27% | 56 | 27% |
| Vivos | 41 | 23% | 1 | 10% | 1 | 5% | 43 | 20% |
| Libres de enfermedad | 38 | 93% | 1 | 100% | 1 | 100% | 40 | 93% |
| En reinducción | 2 | 5% | 0 | 0% | 0 | 0% | 2 | 5% |
| En recaída | 1 | 2% | 0 | 0% | 0 | 0% | 1 | 2.3% |
| Total | 178 | 85% | 10 | 5% | 22 | 10% | 210 | 100% |
Sobrevida
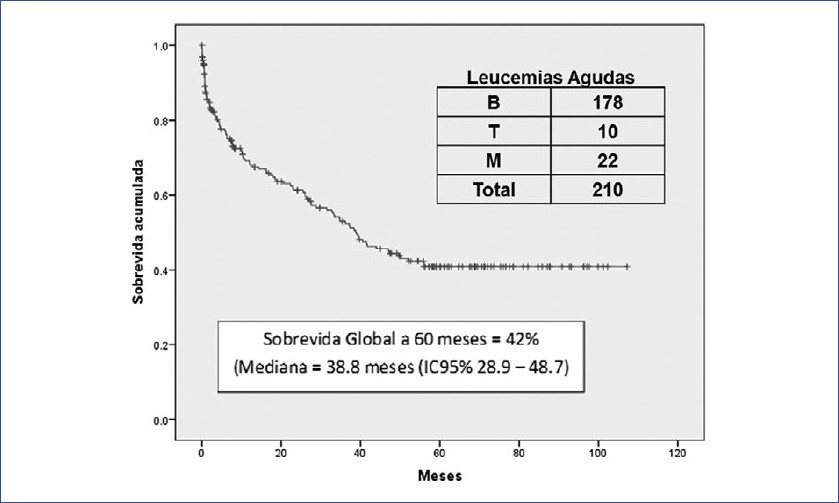
En la Figura 1 se muestra la curva de sobrevida global (Kaplan-Meier) de todos los casos a un mínimo de 5 años de seguimiento. Para todas las leucemias agudas, la sobrevida a 5 años fue del 42% (mediana: 38.8 meses; intervalo de confianza del 95% (IC 95%): 28.9-48.7). La sobrevida varió ampliamente, dependiendo de la variedad de leucemia: desde el 45% (mediana: 47 meses) para las leucemias B y el 20% para las T (mediana: 0.6 meses) al 10% para las mieloides (mediana: 8.2 meses) (Fig. 2). La sobrevida para todos los casos con leucemia aguda mostró una mejoría significativa del año 2008 (mediana: 10.4 meses) a los siguientes años (mediana: 38.4 a 55.9 meses; Log Rank [Mantel-Cox]; p = 0.027).
Asignación inicial de riesgo
Los 178 pacientes con leucemia B fueron asignados inicialmente por el médico tratante a una de cuatro categorías de riesgo: muy alto riesgo (n = 7), alto riesgo (n = 88), riesgo habitual (n = 81) y bajo riesgo (n = 2). Solo el grupo de muy alto riesgo se relacionó significativamente con una menor sobrevida (mediana: 7.7 vs. 47.2 meses; p < 0.05) (Fig. 3). De los dos casos asignados a bajo riesgo, uno presentaba hiperdiploidía (iDNA: 1.3) y actualmente se encuentra libre de enfermedad a 96 meses del diagnóstico; el otro recayó a los 26 meses y abandonó en reinducción a 27 meses de diagnóstico. Ninguno de ellos presentaba la translocación t(12;21).
Sobrevida de las leucemias B relacionada con variables independientes
En la Tabla 2 se presentan los resultados del análisis de la sobrevida en función de cada una de las diversas variables independientes que se han relacionado con el riesgo. Se indican el número de casos en cada variable, la mediana con sus IC 95% para cada una y la significación de las diferencias mediante la prueba Log Rank.
Tabla 2 Comparación de medianas de curvas de sobrevida (Kaplan‑Meier) de leucemia aguda linfoblástica B relacionadas con variables independientes mediante prueba de Log Rank (Mantel‑Cox)
| Variable | Valor 1 | n1 | Med1 | IC 95% | Valor 2 | n2 | Med2 | IC 95% | p |
|---|---|---|---|---|---|---|---|---|---|
| Edad | 1‑10 años | 123 | 41.5 | 30.7‑52.1 | < 1 > 10 | 55 | 55.9 | NR | 0.531 |
| Sexo | Masculino | 101 | 49.7 | 22.8‑76.6 | Femenino | 77 | 36.2 | 27.5‑44.9 | 0.285 |
| CD10 | Positivo | 133 | 51.9 | NR | Negativo | 33 | 28.8 | 20.9‑36.7 | 0.014 |
| Aberrantes | No | 142 | 43.9 | 30.5‑57.4 | Sí | 36 | 49.7 | 9.2‑90 | 0.999 |
| CD13 | No | 153 | 46.9 | 32.6‑61.4 | Sí | 25 | 39.7 | 7.0‑72 | 0.725 |
| CD7 | No | 171 | 47.3 | 29.0‑65.5 | Sí | 7 | 7.7 | 7.5‑7.8 | 0.152 |
| Leucocitos | < 50,000 | 158 | 49.7 | 27.4‑72.0 | 50‑100,000 | 9 | 12.0 | 8.7‑15.4 | 0.014 |
| Leucocitos | < 50,000 | 158 | 49.7 | 27.4‑72.0 | > 100,000 | 11 | 36.2 | 13. 1‑59.4 | 0. 407 |
| Leucocitos | < 50,000 | 158 | 49.7 | 27.4‑72.0 | > 50,000 | 20 | 22.3 | 0‑52.0 | 0.036 |
| iDNA | Diploide | 145 | 47.2 | 33.6‑60.9 | Hiperdiploide | 21 | 73.6* | 56.6‑90.6 | 0.103 |
| Translocaciones | Sin | 109 | 55.9 | 31.4‑80.3 | Con | 21 | 49.7 | NR | 0.993 |
| Translocaciones | Sin t (1;19) | 101 | 55.9 | 31.4‑80.3 | Con t (1;19) | 8 | 43.9 | 6.7‑81 | 0.913 |
| Translocaciones | Sin t (12;21) | 102 | 55.9 | 31.4‑80.3 | Con t (12;21) | 7 | 49.7 | 12.0‑87 | 0.666 |
| Translocaciones | Sin t (9;22) | 105 | 55.8 | 31.4‑80.3 | Con t (9;22) | 4 | 12.0 | 0‑28.7 | 0.517 |
| Riesgo | Habitual | 81 | 47.2 | 29.3‑65.2 | Alto riesgo | 88 | 55.9 | 30.4‑81.3 | 0.996 |
| Riesgo | Habitual | 81 | 47.2 | 29.3‑65.2 | Muy alto | 7 | 7.7 | 0.06‑15.3 | 0.000 |
| Cariotipo | Normal | 111 | 47.2 | 32.2‑62.3 | Anormal | 12 | 67.5 | NR | 0.362 |
* Media.
IC: intervalo de confianza; iDNA: índice de DNA; Med: mediana en meses; NR: no procedente en el análisis.
Edad y sexo
Durante los primeros 36-38 meses de tratamiento se observó una pequeña ventaja de sobrevida de los pacientes entre 1 y 10 años de edad, misma que se revierte en los meses posteriores, cuando se obtiene una ventaja de sobrevida en los menores de 1 año y los mayores de 10 años. Este perfil entrecruzado de sobrevida determina que no exista diferencia entre la sobrevida de los pacientes de ambos grupos (Log Rank; p = 0.531). En la curva de sobrevida en relación con el sexo se observa una ligera ventaja de los pacientes del sexo masculino sobre el femenino (mediana: 49 vs. 36 meses). Sin embargo, la diferencia no resulta estadísticamente significativa (Log Rank; p > 0.05).
Cuenta inicial de leucocitos
Los pacientes con cuentas iniciales < 50,000/µl sobrevivieron significativamente más que los que tenían cifras superiores al ingreso (mediana: 49.7 vs. 22.3 meses; Log Rank; p = 0.036) (Fig. 4). La disminución de la sobrevida en relación con la cifra inicial de leucocitos se debió primordialmente a los pacientes que tenían entre 50 y 100,000/µl, ya que en los pacientes con más de 100,000/µl, si bien tuvieron una mediana de sobrevida menor, la diferencia no alcanzó valores estadísticamente significativos (mediana: 49.7 vs. 36.2 meses; Log Rank; p = 0.407).
CD10 y marcadores aberrantes
La mayor parte de las leucemias B correspondieron al subtipo pre-B II-III o común, CD10 positivo o CD10 negativo. Los pacientes con el marcador CD10 (cALLa) en superficie tuvieron mejor sobrevida que los CD10 negativos (mediana: 51.9 vs. 28.8 meses; p = 0.014 (Fig. 5). En 36 de los 178 casos (20.2%) de leucemia B se detectaron 39 marcadores aberrantes; los más frecuentes fueron los marcadores mieloides CD13 y CD117, seguidos de los marcadores linfoides T (CD7, CD5, CD4 y CD56). La sobrevida en función de la presencia de cualquier marcador aberrante fue la misma que sin marcadores aberrantes (p > 0.05). La comparación de la sobrevida con cada marcador aberrante detectado no mostró diferencias significativas con la presencia de CD13 (p > 0.05) ni de CD7 (p > 0.05). Sin embargo, los siete casos CD7 mostraron una sobrevida claramente inferior a los casos sin este marcador (mediana: 7.7 vs. 47.3 meses), por lo que habrá que determinar si con un número mayor de casos se encuentra diferencia significativa con este marcador de linfocitos T. Los cuatro casos con CD5 se perdieron durante el seguimiento. Los dos casos con CD117 se encontraban libres de enfermedad a los 5 años de seguimiento, y el caso con CD56 falleció en el primer año de tratamiento.
Índice de DNA
Empleando el iDNA para clasificar los genotipos leucémicos en 162 casos estudiados se obtuvieron 141 (87%) casos diploides (iDNA: 0.8-1.16) y 21 (13.0%) hiperdiploides (iDNA > 1.16). No se observaron casos hipodiploides (iDNA < 0.8). La correlación de la sobrevida con el iDNA se muestra en la Figura 6. Aun cuando las diferencias no alcanzan valores significativos, los casos hiperdiploides muestran una clara tendencia a una mejor sobrevida (media: 73.6 vs. 56.4 meses; Log Rank; p > 0.05).
Cariotipo
El cariotipo se analizó en 159 de 178 casos (89.3%). En 36 de los 159 (22.6%) no se obtuvieron divisiones celulares. De los 123 casos analizables, en la mayoría (111; 90.2%) fue normal. Los 12 restantes (9.8%) presentaron anomalías diversas (Tabla 3). La mediana de sobrevida de los casos con alguna alteración fue de 67.5 meses, superior a la de 47.2 meses de los casos con cariotipo normal. Sin embargo, la diferencia no fue significativa (p > 0.05).
Tabla 3 Cariotipos anormales y su correlación con el índice de DNA y el estado en 12 casos con leucemia linfoblástica B
| Alteración cromosómica | iDNA | Estado |
|---|---|---|
| 47 xy,+21 | NR | Defunción |
| 47 xx,+21 | 1.03 | Defunción |
| 47, xy,+16 [4]; 46, xy [20] | 1.16 | Se desconoce |
| 46, xx t (15;17) (q22;q21) | NR | Defunción |
| 46 xx, del (11)(q23); inv (16)(p13;q13) [8]; 46 xx [12] | 1.27 | Libre de enfermedad > 60 meses |
| 46, xx, del (14)(q32) [6]; 46 xx [14] | 1.04 | Se desconoce |
| 46, xy, del (11)(q23) [3]; 46 xy [15] | 0.98 | Libre enfermedad > 60 meses |
| 46, xx, del (11)(q23) [4]; 46 xx [16] | 1.01 | Se desconoce |
| 46, xy t (11:17) (q23:q22) [6]* hiperdiploidía (>50 cromosomas)[5] 46 xy 10] | 1.03 | Se desconoce |
| Hiperdiploidía (32‑44) [7]; 46, xy [15] | 1.01 | Libre enfermedad > 60 meses |
| 46, xx [18] hipodiploide (39‑43)[7] | 1.00 | Se desconoce |
| Hipodiploidía (31‑48) [11] | 1.06 | Defunción |
* La translocación reportada es diferente a la t (11;17)(q23;q21) asociada con la leucemia mieloide (M3).
iDNA: índice de DNA; NR: no reportado.
Translocaciones
Se encontraron 21 casos (16.1%) con translocaciones en 130 pacientes en los que se practicó el estudio de reacción en cadena de la polimerasa con transcriptasa inversa (RT-PCR) a partir del año 2009. Las translocaciones detectadas mediante este método fueron la t(1;19)(q23;p13) en ocho casos (6.2%); la t(12;21) (p13;q22) en siete casos (5.4%); la t(9;22)(q34;q11) en cuatro casos (3.1%); la t(8;21)(q22;q22) en un caso; y la t(16;21)(q11;q22) en un caso. La comparación de la sobrevida con y sin presencia de cualquiera de ellas no mostró diferencias (mediana: 49.7 vs. 55.9 meses; p > 0.05). Analizadas individualmente, la presencia de t(1:19) no modificó la sobrevida (p > 0.05), y tampoco la sola presencia de t(12;21) (p > 0.05). La t(9;22) disminuye claramente la sobrevida de la mediana (55.8 meses) sin la translocación a 12 meses con la misma. Sin embargo, dado el pequeño número de casos (n = 4), la diferencia no es significativa (Log Rank; p > 0.05). El caso con la translocación t(8;21) se encontraba libre de enfermedad a 78 meses del diagnóstico, y el caso con la t(16;21) fue calificado como de alto riesgo, presentó recaída a los 50 meses de seguimiento, se inició reinducción y abandonó. Adicionalmente, se detectó la translocación t(11;17)(q23;q22) en un caso mediante el estudio del cariotipo; el caso presentaba además hiperdiploidía y abandonó el tratamiento, estando en remisión a los 24 meses de seguimiento.
Seguimiento y abandono
El tiempo promedio de seguimiento de los pacientes con leucemia B fue de 36.4 meses (IC 95%: 32-41 meses). Cuarenta y siete pacientes (26.4%) no acudieron a su cita, abandonando el tratamiento. El tiempo promedio de seguimiento al abandono fue de 34.5 meses, muy similar al promedio general.
Recaídas
Cincuenta y seis pacientes (31.4%) experimentaron: una recaída, 45 pacientes; dos recaídas, ocho pacientes; tres recaídas, dos pacientes y cuatro recaídas, un paciente. El tiempo promedio hasta la primera recaída fue de 29.8 meses (rango: 1.2-75 meses).
Mortalidad
Noventa de los 178 pacientes (50.6%) fallecieron durante el tratamiento o el seguimiento. De ellos, 67 (74.4%) fallecieron en el HEP y 23 (25.6%) en su domicilio después de haber solicitado el alta voluntaria (19/23 en cuidados paliativos y 4/23 por no aceptar la continuación de tratamiento). El 12.9% del total de pacientes (23/178; 25.6% de los fallecidos) presentaron muerte temprana (menos de 2 meses de tratamiento). En la Tabla 4 se presentan las causas genéricas de defunción en dos grupos de pacientes: con enfermedad activa o en remisión. En ambos grupos, los pacientes fallecieron por sepsis, sangrado o ambas causas. En el primer grupo se distinguen aquellos casos que fallecieron durante el tratamiento quimioterapéutico de inducción o reinducción y aquellos que fallecieron por la enfermedad misma durante una recaída y no recibían quimioterapia en el episodio que llevó al deceso, porque se consideró que el paciente ya no era tributario de la misma por el grado de daño a la médula ósea, o porque, por sus condiciones generales, el paciente no toleraría los efectos secundarios de la quimioterapia que procedía o el paciente (familiar) no aceptó continuar con ella. El segundo grupo constituye la mortalidad relacionada solo con la terapia (fallecimiento antes de 1 mes tras haber recibido quimioterapia estando en remisión) y representó el 28.9% de los decesos. Tres casos del primer grupo desarrollaron pancreatitis posquimioterapia que contribuyó al deceso. Dos casos que se encontraban libres de enfermedad también presentaron pancreatitis y sobrevivieron. Solo se identificó un paciente (testigo de Jehová) que no recibió transfusiones y se encuentra libre de enfermedad después de 60 meses.
Tabla 4 Estado de la leucemia linfoblástica B en el momento de la defunción
| Estado de la enfermedad | Causa | n | % | % grupo |
|---|---|---|---|---|
| Enfermedad activa | Inducción o reinducción c/QT | 37 | 41.1 | 71.1 |
| Recaída s/QT | 27 | 30.0 | ||
| Remisión | Sepsis pQT | 14 | 15.6 | 28.9 |
| Sangrado pQT | 4 | 4.4 | ||
| Sepsis y sangrado pQT | 8 | 8.9 | ||
| Total | 90 | 100 | 100 | |
c/QT: con quimioterapia; p/QT: posquimioterapia (< 30 días); s/QT: sin quimioterapia.
Discusión
La sobrevida de los pacientes con leucemia aguda a cuando menos 5 años de tratamiento es, sin duda, la forma más directa y contundente de valorar los resultados globales de un programa para la atención de esta enfermedad. En el caso particular del HEP, esta medición es particularmente importante a 10 años del inicio de sus actividades en el Estado de Chiapas, ya que constituye la primera evaluación objetiva del conjunto de acciones coordinadas de salud, tanto estatales como federales, que van implícitas en la atención local de dichas enfermedades bajo el esquema del Seguro Popular. Como resultado final ideal de un programa para el tratamiento de las leucemias linfoblásticas en la infancia, se esperaría que más del 90% de los pacientes lograran una sobrevida prolongada libre de enfermedad (> 5 años), tal como se observa en países desarrollados desde hace varios años5.
En este contexto, los resultados obtenidos en el presente trabajo (< 50% de posibilidad de sobrevida de pacientes con leucemia aguda linfoblástica a 5 años) son particularmente preocupantes, en especial porque se trata de un programa que cuenta desde su inicio con todos los elementos necesarios para lograr mínimamente el doble de sobrevida obtenido. En comparación, Reyes-López et al.6, en el 2012, reportaron en pacientes con leucemia linfoblástica, similares a los atendidos en el HEP, el 82% de sobrevida a 5 años en hospitales de tercer nivel y el 55% en hospitales de segundo nivel, ambos en el valle de México.
Por ello, primero se determinó si la leucemia afectaba a los pacientes del Estado de Chiapas de forma diferente a la afectación nacional. Por un lado, la proporción de los diversos tipos de leucemia aguda observada en los primeros años del HEP, y por nosotros mismos para años posteriores7, corresponde en términos generales a lo reportado previamente en estudios epidemiológicos nacionales8,9, con un predominio de las leucemias B, seguidas de las mieloides y de la leucemia T. Lo mismo puede decirse de la edad promedio para las leucemias linfoide y mieloide, con predominio de preescolares y escolares en las linfoides, y de escolares en las mieloides. La relación de sexos en las leucemias linfoides también se encontró similar a lo reportado; no así para las leucemias mieloides, en las que se observó en el HEP un predominio del sexo femenino que no se ha informado en otras series. Estos datos son, en general, congruentes con una imagen de las leucemias en Chiapas comparable con la situación nacional en cuanto a población afectada y tipos de leucemia observados. Por lo tanto, no es posible sustentar la sobrevida observada en diferencias epidemiológicas relacionadas con la enfermedad misma.
Los resultados podrían también atribuirse a la inexperiencia general del cuerpo médico para el diagnóstico y el tratamiento de los pacientes en un hospital nuevo. Sin embargo, solo en 2008 (el año con el menor número de pacientes) se obtuvieron resultados inferiores a los demás años, por lo que parece poco probable que la inexperiencia del personal médico explique los resultados globales.
Tanto la curva de sobrevida que incluye a todos los pacientes con leucemia aguda como la exclusiva de los pacientes con leucemia B muestran tres regiones: la primera, caracterizada por la caída rápida en la sobrevida, representando la mortalidad temprana (< 2 meses); una segunda región, de caída moderada progresiva hasta los 60 meses; y una última, de estabilización de sobrevida a partir de ese momento. La zona inicial de mortalidad temprana corresponde al 12.9% del total de los pacientes y determina, de inicio, la imposibilidad de obtener remisiones prolongadas en más del 90% de los casos. La mortalidad temprana en pacientes con leucemia aguda linfoblástica B en el HEP de 2013 a 2015 fue objeto de un estudio reciente10, en el que se encontró un porcentaje aún mayor de casos de mortalidad temprana durante esos años (14.6%). En el mismo estudio, la mortalidad se encontró asociada con infección febril, hepatomegalia, plaquetopenia grave con sangrado y datos incipientes de lesión renal en el momento del arribo del paciente al hospital. Los resultados de dicho estudio mostraron que una fracción de pacientes llega al HEP en condiciones muy desfavorables, lo que influye en los resultados globales, para los cuales es factible que se requiera un abordaje especial para mejorar la sobrevida a largo plazo de nuestros pacientes.
La elaboración de curvas individuales de sobrevida a 5 años para cada variedad de leucemia aguda mostró diferencias significativas entre ellas, siendo la de mejor sobrevida la leucemia B, y la más baja, la mieloide. La mediana de sobrevida de las leucemias T (menor de 1 mes) podría sugerir que la T es la variedad de peor pronóstico. Sin embargo, la mediana de sobrevida en esta variedad está determinada por la alta mortalidad en los primeros meses. Pasado este periodo, la mortalidad se estabiliza, determinando que a los 5 años la sobrevida de las T sea superior a las mieloides, cuya mortalidad continúa impactando la sobrevida a los 5 años.
La curva de sobrevida para el conjunto de las leucemias linfoblásticas (B + T) permite comparar con mayor precisión los resultados en el HEP con los obtenidos en otras partes del país, y estudiar el impacto de algunos factores clásicos relacionados con el pronóstico.
Desde principios de los 90 se reconoció que los beneficios obtenidos con el tratamiento quimioterapéutico agresivo de la leucemia linfoblástica -desarrollado progresivamente en los 20 años previos- tenían que balancearse con sus efectos tóxicos. Al mismo tiempo, se identificaron en los pacientes variables clínicas y de laboratorio que permitían su clasificación de inicio basada en el riesgo de recaída y la respuesta al tratamiento11. Con ello, fue posible proporcionar un tratamiento diferenciado basado en el riesgo con el doble propósito de mejorar el índice terapéutico de la quimioterapia y homologar los resultados del tratamiento en todos los pacientes. Esta clasificación inició con dos grupos: riesgo habitual o estándar y riesgo alto, basados en la edad (habitual: >1 año y <10 años; alto <1 año y >10 años) y en la cifra inicial de leucocitos (habitual: <50,000/µl; alto: > 50,000/µl). Con el tiempo, evolucionó a cuatro grupos: riesgo bajo, habitual, alto y muy alto11,12. En general, existen criterios de clasificación comunes compartidos internacionalmente -la edad y la cifra inicial de leucocitos- y criterios que varían por país e institución, y si se incluyen o no los perfiles moleculares de cada caso. Estos criterios han sido incorporados en subclasificaciones recientes13-16. En el HEP, la clasificación de riesgo empleada es la publicada por Rivera-Luna et al.9,17,18, basada en observaciones hechas por diversos grupos oncológicos y ajustada a la realidad nacional.
El análisis de la sobrevida en función de la clasificación inicial de riesgo de nuestros pacientes reveló que solo el grupo de muy alto riesgo presentó una sobrevida menor que los grupos de riesgo habitual y alto riesgo, y que no hubo diferencia entre la sobrevida de estos dos últimos. Este perfil podría interpretarse como que la clasificación inicial fracasó en rescatar a pacientes de muy alto riesgo, pero tuvo el éxito parcial de homologar los resultados de los grupos intermedios, aun cuando los resultados globales fueran insatisfactorios. El grupo de bajo riesgo solo contribuyó con dos casos, por lo que no es posible derivar conclusiones.
Más allá del análisis pronóstico de los grupos de riesgo, la valoración de la sobrevida relacionada con los elementos individuales que estructuran los mismos grupos permite derivar algunas conclusiones adicionales útiles.
En cuanto a la edad y el sexo, en esta serie solo hubo dos pacientes menores de 1 año y los resultados no mostraron diferencias de sobrevida relacionadas con la edad o con el sexo de los pacientes. Esto se debió muy probablemente a los pocos casos involucrados, ya que tanto la edad como el sexo son factores pronóstico conocidos y sólidamente sustentados. Por otro lado, los pacientes con una cuenta de leucocitos > 50,000/µl en sangre periférica en el momento de su diagnóstico tuvieron menor sobrevida que los que no rebasaron esa cifra, confirmando la importancia de esta variable en el pronóstico. Los pacientes con una cuenta de leucocitos > 50,000/µl únicamente representaron el 13% de los casos, por lo que este elemento no explica, por sí mismo, la pobre sobrevida global obtenida.
Actualmente, el inmunofenotipo es el estudio esencial para el diagnóstico de certeza de leucemia. Este análisis permite determinar no solo la línea celular afectada, sino además precisar su grado de diferenciación y la expresión de elementos aberrantes (que se han incorporado a las clasificaciones de riesgo)19. Así, la presencia del marcador CD10 (cALLa) en linfoblastos B caracteriza a una población con un grado de diferenciación intermedio (pre-B II-III) de riesgo habitual, más susceptible a los tratamientos establecidos que las poblaciones de linfoblastos B CD10 negativos, más inmaduros (pro-B) o más maduros (pre-B IV o maduros). Por lo tanto, la presencia del marcador CD10 se traduce en un mejor pronóstico. Este hecho se corroboró en esta serie, en la que los pacientes CD10 positivos (80%) tuvieron casi el doble de sobrevida que los CD10 negativos (52 vs. 29 meses; χ2 = 8.47; p = 0.014).
El estudio del inmunofenotipo de la leucemia B incluye la búsqueda de marcadores mieloides y linfoides T, y su identificación en los linfoblastos B se considera aberrante. Su presencia asociada no se ha correlacionado en forma consistente con variaciones en el pronóstico. En la presente serie no se encontró una relación pronóstica de la presencia de marcadores aberrantes mieloides o de linfocitos T, con la probable excepción del CD7, que podría estar relacionado con mal pronóstico de la leucemia aguda B. Sin embargo, dado que solo se detectó en siete casos, no es posible una conclusión definitiva.
La introducción más reciente de los estudios genómicos para la caracterización de las leucemias ha tenido como consecuencia la formación de nuevos subgrupos clínicos y pronósticos, a la par que ha contribuido al mejor entendimiento de las bases moleculares de su patogenia13-16,20. En estos casos se emplearon tres procedimientos para valorar las características genéticas de los precursores hematológicos malignos: el iDNA, el cariotipo y la detección de translocaciones frecuentemente asociadas a leucemias mediante RT-PCR. El iDNA se incluye en la clasificación de riesgos debido a que un resultado hipodiploide se asocia con mal pronóstico, y uno hiperdiploide, con buen pronóstico21,22. En la serie estudiada no hubo casos hipodiploides, y los pacientes con hiperdiploidía tendieron a vivir más que los diploides, pero sin alcanzar el nivel de significación requerido. El cariotipo se encontró alterado solo en el 10% de los casos en que se estudió, y no fue posible correlacionar las alteraciones con la ploidía determinada por el iDNA ni con el destino final del paciente, exceptuando dos casos de trisomía 21 (síndrome de Down) que fallecieron a los 7 y a los 67 meses de seguimiento.
Las translocaciones específicas detectadas por RT-PCR representaron el 16.0%, porcentaje similar al 16.3% de un reporte propio de una serie de años posteriores7 y al 17.7% reportado por Bekker-Méndez, et al.23 en 282 casos de leucemia linfoblástica aguda B. Las translocaciones más frecuentes también fueron las mismas: t(1;19)(q23;p13) y t(12;21)(p13;q22), seguidas de la t(9;22)(q34;q11) en aproximadamente las mismas proporciones. Debido al bajo número de casos obtenidos con cada variante y a la alta mortalidad global, no fue posible correlacionar significativamente la presencia de cualquiera de ellas con la sobrevida, tal como se ha informado en series extrajeras24. En el país, las translocaciones se han incorporado en la clasificación de riesgos empleada, aun cuando no existe confirmación nacional consistente de su correlación pronóstica. Esto probablemente se deba a la baja frecuencia en cada institución y no a la ausencia de la relación biológica; un estudio nacional multicéntrico podría caracterizar esta correlación en el país de forma definitiva.
La translocación t(11;17)(q23;q22) detectada por cariotipo podría ser un error de interpretación del laboratorio de genética, ya que la t(11;17) solo se ha asociado con la leucemia promielocítica (M3). Sin embargo, las bandas involucradas del cromosoma 17 en la M3 son la 17q11-12 o la 17q21, y en el caso aquí reportado es la 17q22. Por ello, es posible que la translocación reportada sea la correcta e involucre al gen HLF (factor de leucemia hepática, por sus siglas en inglés hepatic leukemia factor) ubicado en el cromosoma 17q22, el cual se ha informado que se asocia con la leucemia linfoblástica aguda25.
Por último, en general, los pacientes fallecieron por sepsis, sangrado o ambas causas en combinación variable. Sin embargo, llama la atención que alrededor del 30% de los casos presentaron estas complicaciones estando en remisión. Es decir, causas asociadas primordialmente con la quimioterapia de mantenimiento recibida. Este porcentaje es aún más alto que lo reportado para Centroamérica en el año 201126. Además, explica la mayor parte de los fallecimientos y contribuye significativamente a la mala sobrevida global obtenida. Queda por definir si estos fallecimientos se debieron a exceso de quimioterapia (derivado de una clasificación inicial de riesgo incorrecta) o a una susceptibilidad particular de la población a ella, ya sea de base genética16, adquirida (impacto a largo plazo sobre el estado nutricional) o derivada del medio ambiente (insalubridad general, educación de los padres). Entre estas últimas, habría que incluir la adquisición de infecciones con patógenos hospitalarios resistentes, ya que un evento frecuente observado en esos años fue que el paciente, a menos de 1 semana después de recibir la quimioterapia, regresó con fiebre y neutropenia, que eventualmente se agravó, no respondió al tratamiento antibiótico y falleció víctima de sepsis con un microorganismo poco común y sangrado masivo, a pesar de recibir transfusiones adecuadas de plaquetas.
Intentando justipreciar los resultados obtenidos en el HEP, se reconoce que los resultados de cualquier programa de atención médica dependen no solo del actuar médico en el hospital y de las propiedades de la enfermedad, sino también de las características de la población beneficiaria, tanto individuales (idiosincrasia, percepción de la enfermedad, pobreza, conocimientos) como de su realidad física circundante (lejanía de los centros de atención médica, condiciones de higiene de su entorno, hacinamiento, posibilidades de transporte).
Uno de los aspectos más relevantes del presente estudio es el haber identificado elementos extrahospitalarios de impacto significativo en los resultados globales en la serie de casos estudiados. Así, es notoria la pérdida de casos por abandono en toda la curva de sobrevida, incluyendo la región de estabilización. Esta pérdida estuvo concentrada en dos momentos: una fracción de pacientes (de aproximadamente el 12%) que no aceptó de inicio el tratamiento o lo abandonó en la primera dosis de quimioterapia, y otra fracción de un poco más de la cuarta parte de los pacientes que abandonó el tratamiento después de más de 1 año de recibirlo, sin que, para ambos fenómenos, haya existido un esfuerzo sistemático para localizar a los pacientes, determinar sus razones e intervenir para la posible aceptación o continuación del tratamiento.
Como determinantes de la primera fracción mencionada se han propuesto las siguientes: las barreras del idioma, que impiden una comprensión real de lo que involucra la enfermedad y el tratamiento; la necesidad de decisiones colectivas por las comunidades indígenas para aceptar el tratamiento de un paciente; la consideración del impacto económico y familiar de la decisión (por la lejanía del lugar de residencia y la necesidad de atención de hermanos sanos); la desconfianza en las decisiones médicas alopáticas; el impacto psicológico del efecto clínico de la quimioterapia; los prejuicios interraciales; y la experiencia histórica comunitaria de malos resultados después de mucho esfuerzo familiar y personal. En cuanto a la segunda fracción, es posible que los factores que la determinan sean el impacto económico y familiar que involucran las citas frecuentes, las distancias, el costo y las dificultades de traslado en el estado, el abandono de familiares, el deterioro progresivo del paciente y la desilusión con los resultados ante las recaídas de la enfermedad.
Dado que la suma de estas fracciones constituye un tercio de los pacientes diagnosticados, afectando significativamente los resultados del programa oncohematológico del estado, resulta imperativo ratificar o rectificar de manera objetiva la contribución proporcional de los elementos listados mediante un estudio prospectivo. La existencia documentada de elementos extrahospitalarios relevantes para los resultados globales del programa oncohematológico del Seguro Popular en el Estado de Chiapas serviría no solo para explicar en buena medida los resultados obtenidos, sino también para sustentar la incorporación de las necesidades de acompañamiento, traslado, alojamiento y otras a determinar, como parte integral de los beneficios del Seguro Popular y un componente esencial para mejorar su impacto en la población atendida.
El conocimiento de la sobrevida de los pacientes con leucemia aguda tratados en el HEP, acompañado del desglose de los elementos asociados con las cifras y las probables determinantes de los resultados, permiten, a manera de auditoría médica, no solo calificar números fríos, sino también el planteamiento de interrogantes relevantes y el diseño de protocolos clínicos y epidemiológicos novedosos con bases objetivas derivadas de la realidad local, con el fin último de mejorar y optimizar el tratamiento y los resultados de la atención médica de pacientes oncohematológicos en el Estado de Chiapas.











 nueva página del texto (beta)
nueva página del texto (beta)