Introducción
La mucopolisacaridosis (MPS) es un grupo heterogéneo de enfermedades que se caracterizan por la acumulación lisosomal de sustancias intermedias del metabolismo de los mucopolisacáridos o glucosaminoglucanos, macromoléculas que proporcionan soporte estructural a la matriz extracelular1. La presentación clínica, la edad del diagnóstico, el tratamiento y sus complicaciones varían dependiendo del tipo de MPS1. El tratamiento es variable, pero el objetivo final es proveer una cantidad adecuada de enzima, evitando o corrigiendo la acumulación de glucosaminoglucanos1,2. El trastorno respiratorio que caracteriza a los pacientes con MPS es la enfermedad pulmonar restrictiva crónica, por lo que la rehabilitación pulmonar, cuyo objetivo es mejorar los síntomas respiratorios por medio de sus tres componentes (educación, fisioterapia y ejercicio), puede ser una opción en la búsqueda de un tratamiento que mejore los síntomas respiratorios restrictivos que se presentan, liberando de secreciones la vía aérea y mejorando la calidad de vida de los pacientes con MPS3,4.
El objetivo de este artículo fue describir las características respiratorias de la MPS y los tratamientos de fisioterapia respiratoria que pueden utilizarse en los niños con MPS. Se realizó una revisión narrativa de artículos en inglés, español y francés en PubMed, Scielo, Latindex, Google académico y EBSCOhost. No hubo limitaciones en cuanto a fecha de publicación ni diseño metodológico, siempre y cuando describieran un aspecto relevante del tema. La revisión de artículos se realizó durante un periodo de 3 meses (1 de marzo a 30 de junio de 2020), considerando aquellos que incluían los siguientes términos de búsqueda (MeSH): mucopolysaccharidosis, physiotherapy techniques, respiratory therapies, pulmonary function test y pulmonary rehabilitation. Además, se examinó la lista de referencias de los artículos identificados en busca de artículos potencialmente relevantes, los cuales se consideraron para su inclusión siempre y cuando describieran algún aspecto importante de los pacientes con mucopolisacáridos y los trastornos respiratorios que les afectan.
Epidemiología
La MPS es una enfermedad infrecuente y variable, dependiendo de los rasgos étnicos y geográficos5-7. En México, las guías del Centro Nacional de Excelencia Tecnológica en Salud refieren una prevalencia de MPS I de 0.69-3.8/100,000 recién nacidos vivos, y de MPS II de 1/132,000 varones recién nacidos vivos8,9. Durante 2019, en el Hospital de Especialidades Pediátricas de Chiapas se encontraban bajo seguimiento 3285 niños, de los cuales 36 se diagnosticaron con MPS, lo que correspondió al 1% del total de niños consultados. La media de edad fue de 9.8 años, la relación masculino/femenino fue de 1:1 (18 casos por sexo) y el grupo con mayor frecuencia de casos fue el de 11 a 15 años de edad (Fig. 1). En cuanto a los límites por edad, se observó una edad mínima de 1 año (un caso) y una máxima de 18 años (un caso). La MPS que más predominó fue la de tipo I (63.8%), el síntoma más común fue el ronquido nocturno (69.4%) y las patologías de mayor asociación fueron la rinosinusitis crónica (44.4%) y el asma (27.7%) (Tabla 1).
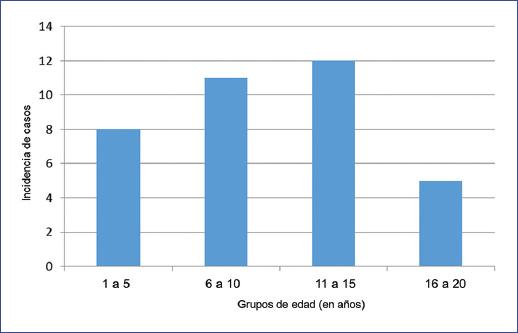
Figura 1 Incidencia de casos de mucopolisacaridosis bajo seguimiento en el Hospital de Especialidades Pediátricas, Tuxtla Gutiérrez, Chiapas, en menores de 20 años.
Tabla 1 Características demográficas y respiratorias de los pacientes con mucopolisacaridosis atendidos en el Hospital de Especialidades Pediátricas de Chiapas (n = 36)
| Características | Media ± DE |
|---|---|
| Edad (años) | 9.8 ± 4.3 |
| Peso (kg) | 17.9 ± 7.5 |
| Talla (cm) | 100.9 ± 17.8 |
| n (%) | |
| Sexo (F) | 18 (50) |
| MPS I | 23 (63.8) |
| MPS II | 5 (13.8) |
| MPS IV | 5 (13.8) |
| MPS VI | 3 (8.3) |
| Rinosinusitis crónica | 16 (44.4) |
| SAHOS | 4 (11.1) |
| Hipercapnia nocturna | 4 (11.1) |
| Hipoxemia | 5 (13.8) |
| Ronquido nocturno | 25 (69.4) |
| Asma | 10 (27.7) |
DE: desviación estándar; F: femenino; MPS: mucopolisacaridosis; SAHOS: apneas o hipopneas obstructivas del sueño.
Clasificación de la mucopolisacaridosis
La clasificación de la MPS es fundamental para iniciar un diagnóstico y un tratamiento oportuno. La MPS se divide en varios tipos1,2:
- MPS I o síndrome de Hurler (Hurler, Hurler-Scheie y Scheie).
- MPS II o síndrome de Hunter (variantes A y B).
- MPS III o síndrome de Sanfilippo (variantes A-D).
- MPS IV o síndrome de Morquio (variantes A y B).
- MPS VI o síndrome de Maroteaux-Lamy.
- MPS VII o síndrome de Sly.
- MPS IX o síndrome de Natowicz.
Se debe considerar que cada fenotipo presenta diferentes alteraciones anatomopatológicas en el sistema respiratorio, lo que resulta de suma importancia dada la necesidad de un tratamiento de reemplazo enzimático, el manejo multidisciplinario y la corrección de los síntomas respiratorios antes de que se presenten complicaciones graves1,10.
Características anatomofisiopatológicas de los pacientes con mucopolisacaridosis
A pesar de la diversidad del espectro clínico, se pueden observar infecciones respiratorias recurrentes y obstrucción de la vía aérea superior por hipertrofia adenoamigdalina y macroglosia, engrosamiento de la mucosa traqueobronquial y tórax restrictivo que puede llevar a presentar padecimientos respiratorios crónicos1,11,12. En la tabla 2 se resumen las características anatomopatológicas respiratorias de las diversas MPS.
Tabla 2 Características anatomopatológicas del aparato respiratorio en los pacientes con mucopolisacaridosis y enzima deficiente
| MPS | Enzima deficiente | Alteraciones del aparato respiratorio características |
|---|---|---|
| I | l-iduronidasa | Obstrucción de la vía aérea superior Micrognatia Enfermedad pulmonar restrictiva |
| II | Iduronato 2 sulfatasa | Macroglosia Hipertrofia gingival Cuello y tórax cortos Alteraciones del macizo facial |
| III | Heparán N sulfatasa Alfa N acetilglucosaminidasa Alfa-glucosamida acetiltransferasa N-acetilglucosamina-6-sulfatasa | Labio inferior grueso y evertido Surco nasolabial prominente Hipoacusia Alteraciones en la deglución |
| IV | Galactosa 6-sulfatasa Beta-galactosidasa | Displasia esquelética Talla baja Tórax restrictivo: Pectus carinatum Tórax en forma de remo Cifosis Escoliosis y cifoescoliosis |
| VI | Arilsulfatasa B | Afectación esquelética torácica Macrocefalia Puente nasal deprimido Restricción pulmonar |
| VII | Beta-glucuronidasa | Macrocefalia Alteraciones del macizo facial Cuello corto |
| IX | Hialuronidasa | Paladar hendido Puente nasal deprimido Aplanamiento facial Pérdida de la audición Disostosis múltiple |
MPS: mucopolisacaridosis.
Las manifestaciones otorrinolaringológicas en los pacientes con MPS generalmente son rinorrea nasal crónica o persistente y secreciones de la vía aérea inferior. Estas son secundarias a alguna obstrucción mecánica, a un proceso inflamatorio persistente y a la calidad de la secreción producida por las glándulas de la mucosa y submucosa, donde la hipersecreción es producto del déficit de dermatán sulfato y de queratán sulfato13. Esta infiltración de glucosaminoglucanos se manifiesta también en otras estructuras de la vía aérea superior, como la laringe, las adenoides y las amígdalas palatinas, produciendo hipotonía y mayor colapso de la vía aérea, y manifestando apneas o hipopneas obstructivas del sueño en los niños con MPS14. En cuanto al parénquima, los niños con MPS cursan con inflamación importante y disminución del lumen de la vía aérea, provocando una irregularidad de sus paredes, lo que produce una hipersecreción bronquial y una disminución del drenaje mucociliar que resulta en broncoconstricción y broncorrea, las cuales pueden complicar los procedimientos de inducción anestésica15. Respecto a las alteraciones del fuelle torácico, estas se manifiestan en aquellas MPS con compromiso esquelético más grave (tipos I, II, IV y VI) y se caracterizan por deformidades y rigidez de las articulaciones costales, horizontalización de las costillas, escoliosis, cifosis, xifoescoliosis y pectus carinatum. También la hepatoesplenomegalia grave se asocia con estas malformaciones, provocando una mayor reducción de la capacidad vital16,17 y manifestando una enfermedad pulmonar restrictiva de diversos grados18.
Valoración respiratoria del paciente con mucopolisacaridosis
La evaluación respiratoria del niño con MPS debe centrarse en realizar un adecuado interrogatorio médico, con la búsqueda intencionada de síntomas sugerentes de hipercapnia restrictiva19, como temblores finos (flapping), hipotensión arterial (por vasodilatación periférica), somnolencia diurna, alteraciones del ritmo vigilia-sueño, cefalea, náusea y vómito. En casos extremos se manifestarán síntomas y signos de coma hipercápnico (desorientación, sudoración, obnubilación y dificultad respiratoria)20. La gasometría arterial y la monitorización de la saturación periférica de oxígeno con oximetría de pulso serán de gran ayuda para descartar hipoventilación alveolar crónica e hipoxemia21,22. Los valores anormalmente altos de bicarbonato y el exceso de base > 4 mEq/L en la gasometría arterial apoyan el diagnóstico de anomalías del intercambio gaseoso durante el sueño o la vigilia en los pacientes con MPS e hipercapnia crónica20,21.
Las pruebas de función respiratoria, como la espirometría, la pletismografía, la difusión de monóxido de carbono, la caminata de 6 minutos y la medición de la fuerza muscular inspiratoria-espiratoria máxima, deben realizarse sistemáticamente23. La mayor limitación para realizar este tipo de pruebas es la necesidad de la máxima disponibilidad posible por parte del paciente23,24. La pletismografía determina la capacidad pulmonar total y sugiere, por medio del índice volumen residual/capacidad pulmonar total, la presencia de una enfermedad restrictiva pulmonar. La espirometría apoya el diagnóstico de una enfermedad obstructiva y sugiere restricción pulmonar con ayuda de una capacidad vital forzada (FVC) < 70% y un volumen espirado forzado durante el primer segundo/capacidad vital forzada (FEV1/FVC) igual o superior al límite inferior de la normalidad. En los pacientes con debilidad muscular respiratoria, los valores de FVC < 1-1.5 L o FEV1 < 40% del predicho sugerirán la presencia de hipercapnia nocturna17,24-27. Las presiones máximas permiten evaluar y cuantificar, en forma global, la fuerza de los músculos respiratorios al realizar una maniobra inspiratoria (Pimax) o espiratoria (Pemax) forzada en contra de una vía aérea ocluida. Son útiles en pacientes con trastornos neuromusculares y patologías restrictivas pulmonares28,29. Un valor de Pimax < 60 cmH2O es un signo de debilidad de los músculos respiratorios y de hipoventilación nocturna; un valor de Pimax < 30 cmH2O es indicativo de insuficiencia respiratoria hipercápnica en vigilia30. La caminata de 6 minutos evalúa la capacidad de ejercicio de los pacientes con patología respiratoria; es adecuada para evaluar los efectos de la rehabilitación y se utiliza con fines pronósticos. Sus ventajas son su alta reproducibilidad (coeficiente de variabilidad del 8%), ser fácil de realizar, ser bien tolerada y reflejar mejor las actividades de la vida diaria que otras pruebas28. La caminata de shuttle y la prueba 1-min sit to stand son también de gran ayuda para valorar la capacidad aeróbica de los pacientes con MPS y patología pulmonar crónica31-33. Los estudios de imagen, como la telerradiografía de tórax y la tomografía computada (TC) con reconstrucción, corroborarán la presencia de alteraciones musculoesqueléticas torácicas. Es recomendable realizar conjuntamente una videobroncoscopia y una TC en fase inspiratoria-espiratoria para evaluar la presencia de colapso dinámico de la vía aérea (traqueobroncomalacia)25,26,34. Otros estudios, como la serie esofagogastroduodenal con mecánica de la deglución, la videofluoroscopia, el salivograma, la gammagrafía con búsqueda de broncoaspiración tardía y el estudio fibroendoscópico de la deglución, se deben considerar para descartar reflujo gastroesofágico y alteraciones de la deglución en los pacientes con MPS y manifestaciones respiratorias crónicas35-41. También son importantes pruebas como la electrocardiografía y los estudios que evalúan el compromiso funcional otorrinolaringológico y auditivo, como la impedanciometría, la audiometría, los potenciales evocados y la nasofibroscopía17. Es muy importante descartar un trastorno del sueño por medio de una polisomnografía con titulación de un sistema de apoyo respiratorio con presión positiva; esto debido a que los pacientes con MPS y deterioro sumamente significativo de la función pulmonar presentan una alta asociación con la presencia de trastornos en la arquitectura del sueño, apneas y alteraciones del intercambio gaseoso arteriovenoso23. El dióxido de carbono exhalado > 45 mmHg es indicativo de hipoventilación alveolar21.
Técnicas de terapia física y ejercicio
El niño con MPS presenta una reducción en la tolerancia al ejercicio y una limitación en los arcos de movilidad de las extremidades8,9. Estos problemas limitan la movilidad y afectan la calidad de vida, por lo que se recomienda la práctica deportiva diaria adaptada a cada individuo, dados los beneficios que se obtienen desde el punto de vista físico, psíquico y de desarrollo personal y social42. Algunas técnicas de terapia física utilizadas en los pacientes con MPS se basan en estiramientos para reducir las contracciones musculares, aumentar la amplitud articular y fortalecer la musculatura con el fin de mejorar la marcha y el equilibrio. También es necesaria la disociación de la cintura escapular y pélvica por medio de ejercicios que ayuden a mejorar la coordinación motora y la propiocepción, baile: saltos y juegos que mejoren el movimiento fino. Se deberá evitar la hiperextensión de la cabeza por causa del compromiso de la articulación atlantoaxial8,9,43.
Técnicas de fisioterapia respiratoria
De acuerdo con la fisiopatología de la enfermedad pulmonar restrictiva que sufren los pacientes con MPS, la rehabilitación pulmonar es la opción más adecuada en niños y adultos con MPS y enfermedades pulmonares crónicas que presentan una disminución de las actividades de la vida diaria3,44,45. Los objetivos de la rehabilitación pulmonar son reducir los síntomas, optimizar el estado funcional y reducir los gastos en salud3. La fisioterapia respiratoria mejorará la ventilación pulmonar y la biomecánica respiratoria deteriorada en los pacientes con MPS, gracias a la ayuda de programas personalizados que evalúan la tolerancia al ejercicio muscular periférico y respiratorio de forma conjunta45.
El objetivo de la fisioterapia respiratoria es mejorar la alteración restrictiva pulmonar en la MPS, la cual es el resultado de la obstrucción provocada en la vía aérea superior, el acortamiento muscular respiratorio, la deformidad del tórax y de la columna dorsal, la hepatomegalia y la broncoaspiración causada por la disfagia41. Estos mecanismos llevarán a una reducción en la expansión y la movilidad torácica, y a la producción de tos ineficaz que se traducirá en hipersecreción, infecciones recurrentes y apneas del sueño16-18,43. Las guías de práctica clínica para el cuidado respiratorio de los pacientes con MPS o enfermedad de Pompe recomiendan iniciar los cuidados respiratorios tempranamente y realizarlos de una a cuatro veces al día46. El objetivo de las maniobras indicadas es mejorar la higiene bronquial. Entre estas maniobras se encuentran las vibraciones, la percusión (clapping), el drenaje postural (evitar la posición de Trendelemburg), la tos asistida mediante la maniobra de aceleración del flujo espiratorio y la asistencia de la tos con una bolsa de reanimación manual. Siempre deberán indicarse junto con maniobras dinámicas de estiramiento, fortalecimiento, masajes y posicionamiento adecuado46. También pueden utilizarse nebulizaciones y limpieza de la vía aérea superior con solución fisiológica43. Existen otras técnicas muy efectivas para liberar las secreciones de la vía aérea superior y que pueden aplicarse en niños cooperadores con obstrucción nasal importante, como son la desobstrucción retrofaríngea retrógrada, la tos nasal y las duchas nasales asociadas a tos provocada47.
La tos es uno de los mecanismos de defensa del árbol traqueobronquial, cuyo objetivo es expulsar secreciones de manera espontánea, provocada o dirigida. En los niños con MPS, la tos puede estar disminuida, por lo que las técnicas que ayudan a mejorar su efectividad, sobre todo cuando existe un pico flujo de tos (PFT) < 270 L/min, son las siguientes: tos provocada, técnica que se da en un acto reflejo desencadenado tras una estimulación manual en los centros tusígenos de la tráquea47,48; y asistencia manual de la tos, que se basa en el aumento de la capacidad inspiratoria seguida de un incremento del esfuerzo espiratorio a través de una maniobra expulsiva (compresión abdominal) con las manos del terapeuta49. Otras técnicas buscan obtener un volumen espiratorio mayor, con el objetivo de mejorar la desinsuflación pulmonar al evitar la aparición de una zona de estrechamiento bronquial (espiración lenta prolongada)50,51. También pueden aplicarse técnicas como la espiración lenta total con glotis abierta, técnica pasiva o activa-asistida que se realiza a partir de la capacidad residual funcional y que continúa hasta el volumen residual. Siempre debe situarse la región a permeabilizar en infralateral; de esta forma, se asiste la desinsuflación y se favorece la eliminación de secreciones del árbol bronquial medio y distal51. Las técnicas respiratorias instrumentadas están indicadas en pacientes con volúmenes pulmonares altamente reducidos y tos ineficaz (PFT < 160 L/min) secundaria a malformaciones como cifoescoliosis, debilidad muscular respiratoria y restricción pulmonar48. Las más utilizadas son la máquina de tos asistida52-54, la ventilación percusiva intrapulmonar55-57, el percutor acústico (Vibralung®)58,59 y el chaleco oscilador (Vest®)47,53,60-62. Existen otros instrumentos que aumentan la fuerza muscular respiratoria, como Threshold IMT y PEEP63, TheraPEP®47 y EZPAP®64,65. En la tabla 3 se resumen las técnicas instrumentadas mencionadas.
Tabla 3 Resumen de las técnicas de fisioterapia pulmonar instrumentadas que pueden utilizarse en los pacientes con mucopolisacaridosis
| Tipo de fisioterapia instrumentada | Técnica y objetivo |
|---|---|
| Máquina de tos asistida (insuflador-exuflador mecánico) | Técnica: comienza con una inspiración máxima (presión
positiva que oscila entre +30 y +50 cmH2O) combinada con
presión negativa (presión de exuflación que oscila entre −20 y −40
cmH2O). El flujo pico de tos puede aumentar del
14-100%. Indicaciones: casos de obstrucción bronquial proximal, debilidad muscular, tapones de moco en atelectasias, neumonía, bronquiolitis. |
| Presión espiratoria positiva (TheraPEP®, Threshold Peep, EZPAP®) | Técnica: el objetivo es modular el flujo espiratorio
para evitar el colapso precoz de la vía aérea y favorecer el drenaje
de secreciones. Objetivo: mejorar el drenaje de las secreciones al incrementar la presión del gas detrás del moco mediante ventilación colateral o previniendo el colapso de la vía aérea durante la espiración. |
| Ventilación percusiva intrapulmonar | Técnica: el mecanismo de acción consiste en liberar
corrientes de gas con flujos altos en la vía aérea a una frecuencia
de 100-300 impulsos por minuto controlados mediante un interruptor
llamado Phasitron y a baja presión. Objetivos: producir broncodilatación por aumento de la presión y humidificación de la vía aérea. Desobstruye el árbol bronquial periférico. |
| Oscilación a alta frecuencia en la pared torácica (chaleco oscilador) | Técnica: se realiza con un chaleco neumático que aplica
pulsos de aire a presión positiva y vibración externa en la pared
torácica por medio de cambios oscilantes bruscos en la presión del
chaleco. Objetivo: el mecanismo de acción es inflar y desinflar gentil y rápidamente, para comprimir y liberar la pared del tórax a una frecuencia de entre 5 y 20 ciclos por segundo, con el propósito de crear un flujo de aire en el interior de la vía aérea. Permite despegar el moco para ser movilizado hacia la vía aérea central, de modo que pueda ser expulsado por la tos o la succión. |
La ventilación mecánica no invasiva es otro tratamiento efectivo en las enfermedades restrictivas asociadas a apneas del sueño graves e hipoventilación. Entre sus beneficios se encuentran la mejora de la permeabilidad de la vía aérea superior, el restablecimiento de la sensibilidad de los quimiorreceptores centrales, la mejora de la calidad del sueño y de la distensibilidad pulmonar, y el enlentecimiento de la deformidad de la caja torácica66,67.
El papel del especialista pediátrico
Las manifestaciones pulmonares son diversas y se manifiestan más precozmente en las MPS de los tipos I, II y VI. La MPS de tipo IV presentará con mayor frecuencia deformidades torácicas graves y se complicarán con compresiones extrínsecas de la vía aérea1,2. La MPS de tipo III se asociará a hipersecreción bronquial, defectos del drenaje mucociliar, trastornos de la deglución y aspiración pulmonar crónica1,2,17,41, lo que hace necesario el seguimiento por neumología infantil para cuantificar la función pulmonar y vigilar los síntomas de obstrucción nocturna y restricción pulmonar. En los pacientes con MPS que cooperen es necesaria la evaluación de la función pulmonar dos veces al año, sobre todo en aquellos que inician alguna terapia de reemplazo enzimático o trasplante de médula ósea8,9,17. Las pruebas obligatorias de función respiratoria son la caminata de 6 minutos, la pletismografía y la espirometría, para clasificar tanto la obstrucción como la restricción pulmonar y la calidad de vida17. También es importante la valoración por el neumólogo-rehabilitador pulmonar para la evaluación de un programa individualizado de fisioterapia respiratoria y de ejercicios. Todo esto con el objetivo de evaluar la función pulmonar como un marcador de respuesta al uso de cualquiera de las terapias indicadas en la MPS8,9,18.











 nueva página del texto (beta)
nueva página del texto (beta)


