Introducción
La toxoplasmosis es una infección parasitaria causada por Toxoplasma gondii. Es asintomática en las personas inmunocompetentes, incluyendo las mujeres gestantes. Sin embargo, puede haber una trasmisión materno-fetal que genera toxoplasmosis congénita (TC). La TC es un serio problema de salud pública, especialmente en los países en vías de desarrollo de África, Europa y América Latina, incluyendo Colombia, donde se reportan altas tasas de infección por T. gondii1. El daño fetal se determina por el momento en que ocurre la infección, y es mayor durante el primer trimestre del embarazo.
Existen métodos de diagnóstico temprano (serología) y medidas preventivas. Aunado a esto, también se cuenta con intervenciones que permiten detectar a las gestantes de alto riesgo, y con intervenciones no farmacológicas (prevención de la infección) y farmacológicas (tratamiento) que podrían disminuir la transmisión fetal.
En muchos países, la vigilancia durante el embarazo no es una conducta establecida de forma universal y de carácter obligatorio como parte integral del control del embarazo, a pesar del impacto fetal ya conocido2. Colombia es un país con alta prevalencia de TC por sus condiciones socioecológicas. Por ello, existen recomendaciones sobre el seguimiento de la TC durante la gestación, basadas en trabajos de detección precoz e intervención, que buscan disminuir la transmisión al feto3. Sin embargo, al parecer, las guías se ignoran o no se aplican de manera apropiada.
En este trabajo se presentan dos casos de TC en los que claramente no se aplicaron las guías, pero además se identificaron retos de diagnóstico temprano e implicaciones clínicas y éticas.
Casos clínicos
Caso 1
Producto de madre de 21 años, G1P1V1, con embarazo controlado y antecedentes de infección de vías urinarias y vaginosis. Parto vaginal a término y sin complicaciones. El producto egresa asintomático y permanece así durante la primera semana. Durante la segunda semana se advierten problemas en la alimentación, succión insistida y dificultad en la movilidad del brazo derecho. Acuden a consulta y se descarta fractura de clavícula, pero se presenta hipotonía global, sin llanto y cianosis, por lo que se sospecha cardiopatía. A su ingreso, se encuentra cianótico y con bradicardia, por lo cual se inicia soporte ventilatorio. Se observa un fenotipo llamativo con frente prominente, fontanela anterior amplia, diástasis de suturas, disminución del tamaño de los globos oculares, anisocoria leve, hipotonía grave y ausencia de reflejos primitivos (Moro). En la fundoscopia se evidencia hemorragia en el lado derecho. Ante el compromiso de encefalopatía de etiología no clara, se realizaron análisis de laboratorio con los siguientes resultados: plaquetas 105,000/mm3, aspartato aminotransferasa 61 U/l, alanina aminotransferasa 33 U/l, troponina 34 pg/ml (valores normales [VN]: 0-34.2), lactato deshidrogenasa 410 U/l (VN: 124-220), glucemia 267 mg/dl, creatinina 0.5 mg/dl, nitrógeno ureico en sangre 20 mg/dl, sodio 143 mmol/l, potasio 3.6 mmol/l, amonio 36 mmol/l, creatina fosfocinasa total 108 U/l, y VDRL negativo. El ecocardiograma y el electrocardiograma resultaron normales. Ante este cuadro de etiología no clara, se realizó una angiorresonancia cerebral en la que se observó hidrocefalia (Fig. 1).

Figura 1 Hallazgos de angiorresonancia cerebral. En las secuencias potenciadas en T1 se observa una imagen hiperintensa del plexo coroideo izquierdo, que sugiere un pequeño foco de sangrado intraventricular. Adicionalmente, se identifican imágenes puntiformes de alta señal en T1 (con baja señal en secuencias de susceptibilidad magnética), de localización córtico-subcortical y en ambas convexidades, al igual que en la región ganglio basal de manera bilateral. Estas señales corresponden a pequeños focos de sangrado intraparenquimatoso, y también se observan a nivel de las matrices germinales. El sistema ventricular presenta importante dilatación de los ventrículos laterales, en especial nivel de los cuernos occipitales, por signos de hidrocefalia no comunicante con alteración en la intensidad de señal de la sustancia blanca periventricular y áreas de alta señal en T2 que sugieren paso transependimario por hidrocefalia activa.
El paciente fue valorado por neurocirugía, donde realizaron punción ventricular para el análisis de líquido cefalorraquídeo (LCR). Los resultados del estudio de LCR fueron los siguientes: xantocrómico, hematíes 2/mm3 (normales, 100%), leucocitos 1/mm3, glucosa 36 mg/dl, proteína 459 mg/dl y coloración de Gram sin gérmenes. En la valoración por oftalmología pediátrica se encontró iris con sinequias posteriores y fundoscopia anormal (Fig. 2).
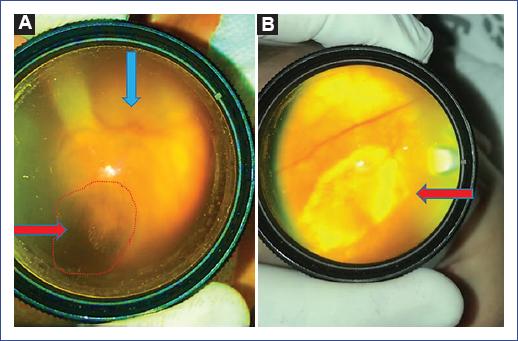
Figura 2 A: ojo derecho con disco óptico hipoplásico (flecha azul) y mácula con cicatriz coriorretinal hiperpigmentada, con el centro de color blanco, no activa, de aproximadamente 6 × 4 diámetros de disco (flecha roja y área delineada en color rojo). B: en el ojo izquierdo se observa en la mácula una gran cicatriz coriorretinal, de aproximadamente 15 × 10 diámetros de disco, activa, hipopigmentada, con hiperpigmentación en el centro. Hallazgos sugestivos de toxoplasmosis congénita.
Con base en estos datos se sospechó TC, por lo cual se realizaron pruebas para T. gondii con los siguientes resultados: IgG 164 U/ml, IgM 0.8 U/ml (positivo > 1.1), IgA 2.8 U/ml (positivo > 11) y test de avidez IgG 0.156 (bajo). Otros datos del TORCH, como la carga viral para citomegalovirus, rubeola y virus de la inmunodeficiencia humana, fueron negativos. No se realizaron serologías para T. gondii durante la gestación. A pesar de las serologías negativas, se pudo observar un cuadro clínico sugestivo de TC en la tomografía computarizada de cráneo, que mostró calcificaciones difusas (Fig. 3). Ante esta evidencia, se tomó una nueva muestra de LCR para estudio por reacción en cadena de la polimerasa (PCR) y serología. Los resultados de ambos estudios fueron positivos, por lo que se confirmó la infección congénita: IgM en LCR para T. gondii de 1.1 (ensayo inmunoenzimático positivo).

Figura 3 Ectasia ventricular supratentorial con posible zona de estrechez del acueducto de Silvio. Se aprecian extensas áreas de hipodensidad de la sustancia blanca en los lóbulos frontales y parietales, las regiones periventriculares, la unión troncoencefálica y los lóbulos temporales. También se observan áreas de posible malacia de la sustancia blanca periventricular y adyacente a las regiones ganglio basales bilaterales, especialmente del lado izquierdo, aunado a extensas áreas de encefalomalacia temporal bilateral, relativamente simétricas. Asimismo, se observan múltiples macrocalcificaciones y calcificaciones lineales que comprometen los territorios fronto-parieto-temporo-occipital bilaterales y la unión troncoencefálica, los núcleos grises, los plexos coroideos y los lóbulos temporales. Borramiento parcial de los surcos cerebrales de manera generalizada.
Aunque se inició el manejo del paciente, su evolución fue estacionaria y con gran daño neurológico. Después de 3 semanas de manejo, se redireccionó la terapia. El paciente falleció en el día 34 de estancia hospitalaria y no fue posible realizar la necropsia.
Caso 2
Producto de madre de 22 años, G1P1, con embarazo controlado. Se realizó serología por micro-ELISA para T. gondii cuando inició el embarazo: IgG 2.4 U/ml e IgM 0.4 U/ml (semana 4). Con estos resultados, se realizó el seguimiento con los siguientes hallazgos de IgM por cada mes: 3.2, 4.3, 5.08, 4.73, 4.01 y 4.42 U/ml hasta el séptimo mes de gestación. La madre presentó vaginosis terminando la gestación. El producto se obtuvo por parto vaginal a las 38 semanas de gestación, sin complicaciones. Por el riesgo de sepsis temprana del producto, se realizó un hemograma que mostró leucocitopenia y trombocitopenia (65,000 × 103). Por tal motivo, se inició un tratamiento con antibióticos de primera línea. Se tomaron muestras para hemocultivos, que resultaron negativos. Por la persistencia de la trombocitopenia, el recién nacido fue referido para más estudios. A su ingreso se encontraba en buenas condiciones, pero se confirmó la trombocitopenia. Con base en los valores de IgM prenatal, además de la falta de estudios durante los últimos 2 meses, se realizaron estudios y se obtuvieron los siguientes resultados: IgG 200 U/ml, IgM 39.5 U/ml e IgA 5.7 U/ml. En el estudio de LCR se encontraron los siguientes valores: hematíes 167/mm3 (normales 96%, crenados 4%), leucocitos 14 (100%), glucosa 42 mg/dl y proteínas 126 mg/dl. Los estudios de oftalmología pediátrica reportaron lesión coriorretiniana de 1.5 × 1.5 diámetros de disco, no activa, y hemorragias intrarretinianas en los cuatro cuadrantes. La tomografía computarizada de cráneo mostró hipodensidades subcorticales frontoparietales y signos de leucoencefalopatía. Con estos hallazgos se confirmó el diagnóstico de TC y se inició el manejo con pirimetamina-sulfadoxina y ácido folínico. Los controles de hemograma resultaron normales. En controles posteriores de oftalmología se evidenció que la lesión coriorretiniana continuó sin actividad y que las hemorragias intrarretinianas desaparecieron. Durante el seguimiento, se observó una ganancia adecuada de peso.
Discusión
En este reporte se ilustra la importancia de la adherencia a las guías para determinar el riesgo de TC, además de la implementación de políticas educativas serias de prevención en las gestantes seronegativas. El riesgo de TC aumenta con la progresión del embarazo. Clásicamente se consideraba un menor riesgo de daño fetal, pero el riesgo de compromiso existe, como se reportó en estos casos (visual y leucopatía periventricular, entre otros). Además, puede haber serias dificultades diagnósticas en neonatos con poca expresión clínica4, y más en áreas rurales.
De acuerdo con estas observaciones, la valoración madre-feto debe comenzar con el estado inmunitario de la gestante, aunque en general es asintomática, para determinar los riesgos de primoinfección; de ahí la importancia de la serología. Sin embargo, en ciertas circunstancias puede existir una reactivación (inmunosupresión) o reinfección (nuevas cepas más agresivas)5. El seguimiento es fundamental para determinar las intervenciones que se deben realizar (una vez demostrada la seroconversión) y disminuir el riesgo de trasmisión fetal (o su gravedad si se presenta). Si bien existen controversias con respecto a la profilaxis, las últimas revisiones demuestran que la terapia con espiramicina más sulfonamida es superior en la reducción de la transmisibilidad en comparación con el placebo o la espiramicina sola. Sin embargo, existe un periodo de ventana para la intervención de 3 semanas después de la seroconversión6, y de ahí la importancia de los tiempos en el seguimiento.
En Colombia, el protocolo de control prenatal determina el tamizaje serológico (IgG e IgM) en gestantes de forma preconcepcional y temprano durante el primer trimestre del embarazo3. En las gestantes seronegativas, la implementación de medidas preventivas ha demostrado ser costo-efectiva. Clásicamente, la ingesta de comida, leche y agua pobremente tratadas podría tener un papel relevante en estas regiones, lo cual se refuerza por la disminución de la prevalencia de toxoplasmosis en algunos países debido a la urbanización7. Aunado a esto, el conocimiento sobre la patología no es global, por lo cual es más grave que no se conozcan las medidas de prevención8.
Por otra parte, la interpretación de los resultados de las inmunoglobulinas es un pilar. Se deben analizar de forma temprana como método diagnóstico y de seguimiento, para permitir los cuidados pertinentes durante la gestación y tras el nacimiento. Aunque el número anual de casos de TC en todo el mundo es de aproximadamente 190,100 (intervalo de confianza del 95%: 179,300-206,300), la decisión del tamizaje probablemente se determinará por la incidencia regional. Sudamérica presenta la mayor incidencia acumulada: 18-34/10,000 nacimientos5. Esta incidencia debe ser evaluada en cada país para determinar su impacto en la salud pública nacional, así como las secuelas a mediano y largo plazo9. En Colombia, la incidencia reportada se encuentra alrededor de 1/1000 nacidos vivos, pero con variaciones regionales importantes influenciadas por cambios climáticos1, lo que reafirma la necesidad de una adecuada adherencia al protocolo de TC.
Aunque se conoce la expresión clínica en los casos graves, otros pueden ser asintomáticos o presentar síntomas atípicos, e incluso fatales, como en el primer caso aquí reportado. El otro aspecto a destacar es el riesgo de transmisión por trimestre de embarazo y el compromiso fetal9. El seguimiento siempre debe realizarse hasta el final de la gestación.
Una manifestación clínica importante es el compromiso ocular, pues hasta más del 90% de los pacientes pueden presentar coriorretinitis. Esta es progresiva y puede ser activa en el 85% de los casos, pero también puede pasar desapercibida por ser subclínica10. Otros hallazgos asociados a esta patología son microftalmos, cataratas, panuveítis, vitritis, atrofia óptica, nistagmo y estrabismo; con menos frecuencia se pueden encontrar desprendimiento de retina, papiledema, edema macular, iritis y membrana neovascular coroidea, entre otras. Por ello, se recomienda la valoración oftalmológica, la cual puede orientar y ayudar con criterios diagnósticos fuertes a favor de TC5.
Del 70% al 90% de los neonatos son asintomáticos al nacer, pero existe el riesgo de compromiso ocular y del neurodesarrollo4. Por ello, la historia serológica materna es fundamental para realizar una evaluación neonatal, sobre todo en la población asintomática. En los casos sintomáticos, debe determinarse la gravedad de la enfermedad para plantear el tratamiento, que no garantiza la cura. De hecho, es posible que algunos pacientes con gran compromiso no sean siquiera candidatos a la intervención, como el primer caso del presente reporte y otros reportes previos11.
La TC no se debe diagnosticar basándose únicamente en las serologías, las cuales son negativas en muchos casos; de ahí que las alternativas como la PCR sean una opción. También se debe considerar la complejidad que presentan algunas situaciones clínicas, en las que se requiere la combinación de métodos para un diagnóstico certero12.
Para terminar, es muy importante determinar la gravedad del compromiso fetal, lo cual puede disminuir las intervenciones innecesarias13. Algunos casos podrían considerarse con pobre pronóstico vital, por lo que es importante plantearse hasta dónde podrían ir las intervenciones con estos neonatos, según la gravedad evaluada por la clínica y las imágenes. Muchos casos pueden terminar en muerte neonatal o una sobrevida con grave compromiso del neurodesarrollo a los 24 meses, obligando a replantearse las limitaciones terapéuticas en algunos de ellos11,13. Una situación similar ocurre con otras infecciones, como la producida por citomegalovirus, en la que los pacientes con hidrocefalia grave y sordera profunda no son candidatos al manejo terapéutico14.
Se debe considerar que la atención primaria, incluyendo un adecuado control prenatal, la educación de las gestantes y las intervenciones tempranas, es la mejor medida para disminuir la prevalencia de esta enfermedad.











 nueva página del texto (beta)
nueva página del texto (beta)


