Artículos
Efecto de 6-bencilaminopurina y nitrato de potasio sobre la micropropagación in vitro de Laelia anceps subsp. anceps (Orchidaceae)
Effect of 6-benzylaminopurine and potassium nitrate on the in vitro micropropagation of Laelia anceps subsp. anceps (Orchidaceae)
Resumen
Laelia anceps subsp. anceps es una especie de la familia Orchidaceae que presenta altas tasas de extracción y comercio ilegal en diversos estados de la República Mexicana, además requiere de condiciones nutricionales específicas debido a sus características de desarrollo y distribución. Por lo cual, el objetivo de la presente investigación fue establecer un protocolo de micropropagación in vitro comparando el efecto de la citocinina 6-bencilaminopurina (BAP) y el nitrato de potasio (KNO3). Para ello, se cultivaron semillas estériles en medio MS sin reguladores de crecimiento vegetal. Posterior a la germinación, se indujo en las vitroplantas la formación de brotes y raíces en medio MS, suplementado con 0, 2.5, 5.0 y 10 mg L-1 de BAP o 0, 2.5, 5.0 y 10 mg L-1 de KNO3. Los resultados mostraron que la adición de BAP mejoró el proceso de propagación en todos los tratamientos analizados, en tanto que, la adición de 10 mg L-1 de KNO3 indujo los mejores resultados al producir 11.4 ± 0.6 raíces las cuales desarrollaron velamen, una estructura radicular que favorece la absorción de agua. Estos resultados sugieren que a mayor concentración de KNO3 podrían mejorar los resultados de propagación en esta orquídea.
Palabras-clave::
conservación, orquídeas, biotecnología vegetal
Introducción
L. anceps subsp. anceps es una orquídea epífita que se distribuye en las vertientes del Golfo de México, al sur del Pacífico mexicano y alcanza los países de Guatemala y Honduras en Centroamérica. Esta especie crece a una altitud entre los 900 y 1500 m, principalmente en el ecosistema de bosque mesófilo de montaña, por lo cual está sujeta a las heladas en los meses invernales (Halbinger y Soto, 1997). Debido a sus características de desarrollo y distribución, los requerimientos nutricionales de elementos como fósforo, magnesio, calcio y potasio en esta orquídea son más exigentes.
-
Halbinger y Soto, 1997Laelias of MexicoOrquidea (Mex), 1997
En algunas especies de orquídeas, elementos como las sales de potasio incrementan la resistencia contra las enfermedades y las sequías, además contribuyen en la síntesis de proteínas, el uso eficiente del agua y la generación y desarrollo de brotes y raíces (Velasco-Velasco, 1999; Rademacher, 2015).
-
Velasco-Velasco, 1999Papel de la nutrición mineral en la tolerancia a las enfermedades de las plantasTerra Latinoamericana, 1999
-
Rademacher, 2015Plant growth regulators: Backgrounds and uses in plant productionJournal of plant growth regulation, 2015
L. anceps subsp. anceps alcanza los 50 cm de altura, presenta pseudobulbos alargados y cada pseudobulbo desarrolla una hoja apical con estructura coriácea. La inflorescencia es terminal y usualmente produce de dos a tres flores, resupinadas, grandes y muy vistosas donde los pétalos y sépalos poseen colores que van desde el rosa hasta el morado, el labelo suele ser de un color púrpura con el disco amarillo pálido líneas magenta, moradas o rojas (Halbinger y Soto, 1997).
-
Halbinger y Soto, 1997Laelias of MexicoOrquidea (Mex), 1997
Debido a la belleza ornamental de sus flores, esta orquídea posee una fuerte demanda entre los coleccionistas nacionales e internacionales, además de estar sometida a una fuerte presión de extracción por ser una especie utilizada en ceremonias y rituales religiosos (Tejeda-Sartorius et al., 2017). Aunado a lo anterior, también se le han conferido algunas propiedades medicinales, entre las que destacan: su uso como tratamiento para la hipertensión, la disentería, los dolores postparto, agente vasorelajante y relajante espasmolítico (Vergara-Galicia et al., 2010).
-
Tejeda-Sartorius et al., 2017Características ornamentales de orquídeas silvestres y su propagación con fines comerciales. Alternativa de aprovechamiento sustentable ex situAgroproductividad, 2017
-
Vergara-Galicia et al., 2010Vasorelaxant and antihypertensive effects of methanolic extract from root of Laelia anceps are mediated by calcium-channel antagonismFitoterapia, 2010
De acuerdo con la clasificación de la NOM-059-SE-MARNAT-2010, esta especie no se encuentra considerada dentro de alguna categoría de riesgo, sin embargo, ante el saqueo y tráfico desmesurado de esta orquídea en diversas regiones del país, es importante como medida preventiva implementar un protocolo de propagación masiva que disminuya la presión que actualmente sufren sus poblaciones silvestres. En este contexto, la micropropagación in vitro a través del Cultivo de Tejidos Vegetales (CTV) es considerada como una alternativa biotecnológica efectiva.
-
NOM-059-SE-MARNAT-2010Norma Oficial Mexicana “Protección ambiental-Especies nativas de México de flora y fauna silvestres-Categorías de riesgo y especificaciones para su inclusión, exclusión o cambio-Lista de especies en riesgo”, 2010
La micropropagación in vitro se ha utilizado para propagar con éxito diferentes especies de orquídeas terrestres, epífitas y rupícolas en diferentes partes del mundo. Los protocolos de propagación incluyen germinación simbiótica y asimbiótica de semillas (Diengdoh et al., 2017), y métodos asexuales que emplean como explantes secciones de raíces (Nunes-Picolotto et al., 2017), protocormos (Pérez-Martínez y Castañeda-Garzón, 2016) y hojas (Santos-Díaz y Carranza-Álvarez, 2009; Goswami, 2016).
-
Diengdoh et al., 2017Asymbiotic germination and seed storage of Paphiopedilum insigne, an endangered lady’s slipper orchidSouth African Journal of Botany, 2017
-
Nunes-Picolotto et al., 2017Micropropagation of Cyrtopodium paludicolum (Orchidaceae) from root tip explantsCrop Breeding and Applied Biotechnology, 2017
-
Pérez-Martínez y Castañeda-Garzón, 2016Propagación in vitro de orquídeas nativas como una contribución para la conservación ex situBiotecnología Vegetal, 2016
-
Santos-Díaz y Carranza-Álvarez, 2009Plant regeneration through direct shoot formation from leaf cultures and from protocorm-like bodies derived from callus of Encyclia mariae (Orchidaceae), a threatened Mexican orchidIn Vitro Cellular & Developmental Biology-Plant, 2009
-
Goswami, 2016In vitro regeneration of Dendrobium sp. of orchid using leaf tip as explantJournal of Environmental Science and Natural Resources, 2016
Otro paso clave dentro del proceso de micropropagación in vitro, es la adición de las cantidades correctas de macro y micronutrientes, además de diversas hormonas sintéticas de crecimiento vegetal para inducir la morfogénesis in vitro (de Wit et al., 2016). Sin embargo, el costo de los materiales utilizados para la elaboración de los medios de cultivo y el uso de fitohormonas sintéticas es alto en comparación con nutrientes como el potasio. Por lo anterior, el objetivo de la presente investigación fue evaluar y comparar el efecto de diferentes concentraciones de la citocinina 6-bencilamino-purina (BAP) y nitrato de potasio (KNO3) sobre el rendimiento para la producción de brotes y raíces en L. anceps subsp. anceps bajo condiciones in vitro.
-
de Wit et al., 2016Light-mediated hormonal regulation of plant growth and developmentAnnual Review of Plant Biology, 2016
Materiales y métodos
Material vegetal
Plantas jóvenes de L. anceps subsp. anceps fueron recolectadas en el municipio de Tamasopo, S.L.P., México (coordenadas: 21º49’25.01’’ latitud Norte y 99º27’58.36’’ longitud Oeste) a una altitud de 1129 m. Las plantas fueron colocadas sobre corteza de árbol de la especie Tabebuia rosea (Bignoniaceae) y mantenidas durante 40 días en condiciones de invernadero (25 °C y 70 % de humedad) para su adaptación y aclimatación. La polinización de estas plantas se realizó de forma manual siguiendo la metodología establecida por Menchaca-García (2011), y las semillas de las cápsulas formadas fueron utilizadas como donadoras de explantes. Se utilizó el medio basal con vitaminas MS (Murashige y Skoog, 1962; Phyto Technology Laboratories) suplementado con 30 g L−1 de sacarosa, 3.0 g L-1 de carbón activado (Karal S.A. de C.V, León, México) y 8 g L−1 de agar (Phyto Technology, Shawnee Mission, KS; Plant Tissue Culture grade). El pH de los medios de cultivo se ajustó a 5.7 y fueron esterilizados a 120 °C por 20 min (1.37×105 Pa). Los cultivos se mantuvieron a 25 °C con un fotoperiodo de 16 horas de luz a 45 μmol m−2 s−1 y 8 horas de oscuridad, la luz fue suministrada con lámparas fluorescentes blanco frío (Phillips, Saltillo, México).
-
Menchaca-García (2011)Manual para la propagación de orquídeas, 2011
Desinfección de la cápsula y protocolo de germinación
Las cápsulas de L. anceps subsp. anceps antes de la dehiscencia fueron esterilizadas de forma superficial con jabón antibacterial al 30 % por 20 minutos, AgNO3 al 10 % por 10 minutos, etanol al 70 % por 2 minutos, y finalmente con hipoclorito de sodio al 10 % por 10 minutos. Las semillas fueron cultivadas para germinar en medio MS basal adicionado con 1 % (p/v) de carbón activado (Karal S.A. de C.V, León, México) y sin la adición de reguladores de crecimiento vegetal. Las unidades experimentales se mantuvieron en el cuarto de cultivo del Laboratorio de Investigación en Ciencias Ambientales de la U.A.S.L.P., a una temperatura de 25 °C con un fotoperiodo de 16 horas de luz y 8 horas de oscuridad, la luz fue suministrada con lámparas fluorescentes blanco frío (Phillips, Saltillo, México).
Inducción de brotes y raíces
Para inducir el desarrollo de brotes y raíces, se utilizaron vitroplantas de L. anceps subsp. anceps de 12 semanas de edad contadas a partir de la germinación. Las vitroplantas se cultivaron en medio MS suplementado con 0, 2.5, 5.0 y 10 mg L-1 de 6-bencilaminopurina (BAP; marca Phyto Technology Laboratories) o con 0, 2.5, 5.0 y 10 mg L-1 de nitrato de potasio (KNO3; marca Fermont). Después de la adición de ambos reactivos, se ajustó el pH de los medios a 5.7 con NaOH 1N y/o HCl 1N. Las vitroplantas se sembraron en estos medios de cultivo durante 90 días, y se mantuvieron a 25 °C con un fotoperiodo de 16 horas de luz a 45 μmol m−2 s−1 y 8 horas de oscuridad, la luz fue suministrada con lámparas fluorescentes blanco frío (Phillips, Saltillo, México).
Diseño experimental y análisis estadístico
Se establecieron ocho tratamientos que tuvieron diez frascos como repetición, en cada frasco se sembraron diez vitroplantas, para un total de 80 unidades experimentales con 100 vitroplantas por tratamiento. El desarrollo de las vitroplantas en cada tratamiento fue evaluado mensualmente. Se registraron cuatro variables: número de brotes, longitud foliar, número de raíces y longitud de raíces por un periodo de 90 días. Los datos fueron recopilados como media ± error estándar de la media (SEM). Posteriormente, para cada variable se realizó un análisis de varianza (ANOVA) de una vía tipo modelo lineal general (MLG), verificando previamente los supuestos de normalidad (prueba de Kolmogorov-Smirnov) y homogeneidad de varianzas (prueba de Levene). Adicionalmente, se utilizó la prueba de Tukey (p < 0.05) para comparar las medias entre los diferentes tratamientos. Los análisis estadísticos fueron realizados usando el programa Statistic para Windows, versión 8.0.
Resultados y discusión
Germinación de las semillas
Las semillas de las orquídeas son de tamaño microscópico, contienen un embrión que se encuentra indiferenciado y carecen de un endospermo por lo cual necesitan de la simbiosis con hongos denominados micorrízicos para poder germinar (Hágsater et al., 2015). Con el uso del cultivo in vitro es posible sustituir dicha relación simbiótica, ya que durante este proceso biotecnológico se proporcionan los reguladores de crecimiento necesarios para que las semillas puedan germinar (Yang et al., 2017). En la actualidad, existen diversos protocolos reportados para la germinación asimbiótica de semillas de orquídeas, tanto epífitas como terrestres, que han sido exitosos (Zhang et al., 2015; Khamchatra et al., 2016).
-
Hágsater et al., 2015Las orquídeas de México, 2015
-
Yang et al., 2017Impacts of host trees and sowing conditions on germination success and a simple ex situ approach to generate symbiotic seedlings of a rare epiphytic orchid endemic to Hainan Island, ChinaThe Botanical Review, 2017
-
Zhang et al., 2015Embryo development in association with asymbiotic seed germination in vitro of Paphiopedilum armeniacum SC Chen et FY LiuScientific reports, 2015
-
Khamchatra et al., 2016Symbiotic seed germination of an endangered epiphytic slipper orchid, Paphiopedilum villosum (Lindl.) Stein. from ThailandSouth African Journal of Botany, 2016
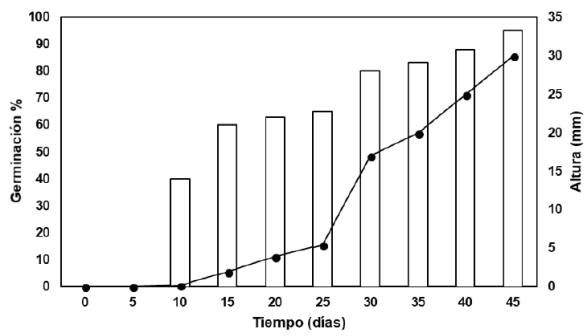
En la presente investigación, se seleccionaron las semillas como explantes, dado que el establecimiento de cultivos in vitro no fue exitoso con hojas, pseudobulbos ni con raíces (resultados no mostrados), debido a la falta de respuesta de los tejidos en los medios adicionados con auxinas o citocininas. Posterior a los 45 días de cultivo, la germinación de las semillas de L. anceps subsp. anceps alcanzó el 95 % y se observó la formación de cuerpos similares a protocormos (PLB´s: Protocorm Like Bodies), de igual manera, la longitud de las plántulas germinadas también aumentó alcanzando aproximadamente los 30 mm en promedio (Figura 1). En cuanto al aspecto morfológico, las semillas comenzaron a hincharse y los embriones comenzaron a desarrollar un color verde-amarillento que terminó en color verde (Figura 2A), además se presentó la aparición de las primeras hojas a los 23 días de cultivo (Figura 2B). La mayor tasa de crecimiento se observó a los 45 días (0.66 mm/día). Sin embargo, la conservación de las plántulas en este medio durante más de 65 días indujo oxidación y necrosis tisular.
Thumbnail
Figura 1
Germinación de semillas de L. anceps subsp. anceps y crecimiento de vitroplantas. Las semillas germinaron en medio MS basal adicionado con 1 % (p/v) de carbón activado. Figure 1. Germination of L. anceps subsp. anceps seeds and growth of vitroplants. Seed germinated in MS basal medium added with 1 % (w/v) of activated charcoal.
Germinación de semillas de L. anceps subsp. anceps y crecimiento de vitroplantas. Las semillas germinaron en medio MS basal adicionado con 1 % (p/v) de carbón activado. Figure 1. Germination of L. anceps subsp. anceps seeds and growth of vitroplants. Seed germinated in MS basal medium added with 1 % (w/v) of activated charcoal.
Thumbnail
Figura 2
Desarrollo de Laelia anceps subsp. anceps. (A), Semilla con embrión no germinado; (B), el embrión aumenta de tamaño y rompe la testa (germinación); (C), aparición de protocormo y rizoides; (D), aparición de la hoja primordial; (E), desarrollo de más hojas y raíces; (F), plántula con raíz y hojas completamente desarrolladas. c: cubierta seminal, e: embrión, ri: rizoides, p: protocormo, h: hoja, ra: raíz. Figure 2. Development of Laelia anceps subsp. anceps. (A), Seed with non-germinated embryo; (B), the embryo increases in size and breaks the seed coat (germination); (C), emergence of protocormo and rhizoids; (D), appearance of the primordial leaf; (E), development of more leaves and roots; (F), seedling with root and fully developed leaves. c: seminal cover, e: embryo, ri: rhizoids, p: protocormo, h: leaf, ra: root.
Desarrollo de Laelia anceps subsp. anceps. (A), Semilla con embrión no germinado; (B), el embrión aumenta de tamaño y rompe la testa (germinación); (C), aparición de protocormo y rizoides; (D), aparición de la hoja primordial; (E), desarrollo de más hojas y raíces; (F), plántula con raíz y hojas completamente desarrolladas. c: cubierta seminal, e: embrión, ri: rizoides, p: protocormo, h: hoja, ra: raíz. Figure 2. Development of Laelia anceps subsp. anceps. (A), Seed with non-germinated embryo; (B), the embryo increases in size and breaks the seed coat (germination); (C), emergence of protocormo and rhizoids; (D), appearance of the primordial leaf; (E), development of more leaves and roots; (F), seedling with root and fully developed leaves. c: seminal cover, e: embryo, ri: rhizoids, p: protocormo, h: leaf, ra: root.
Efecto de las concentraciones de BAP y KNO3 sobre la formación de nuevos brotes y la longitud foliar
Para la inducción de nuevos brotes, se transfirieron hojas individuales de al menos 1 cm de longitud a medio MS suplementado con las diferentes concentraciones de BAP y KNO3. La aparición de los nuevos brotes se manifestó mediante protuberancias pequeñas de color verde con la aparición de rizoides y las primeras hojas (Figura 2C, D) después de dos semanas de cultivo. La formación de los nuevos brotes aumentó de forma gradual en los tratamientos adicionados con BAP (Figura 2E).
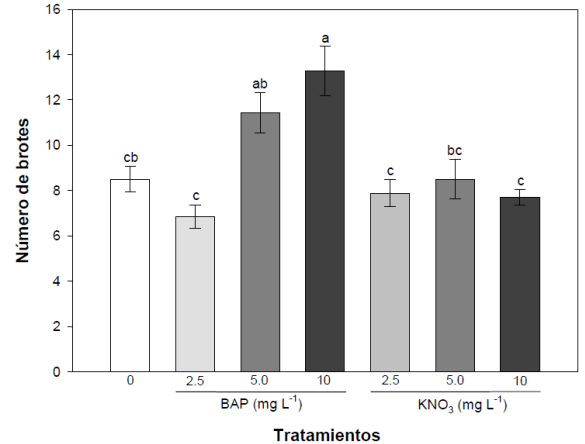
La mayor producción de brotes se encontró en el tratamiento adicionado con 10 mg L-1 de BAP el cual produjo 13.2 ± 1.1 brotes el cual fue estadísticamente significativo con respecto al control. La producción de brotes en los tratamientos adicionados con KNO3 fueron similares cuando se compararon con el tratamiento control y la adición de 2.5 mg L-1 de la citocinina BAP (Figura 3).
Thumbnail
Figura 3
Producción media (n = 10) del número de brotes obtenidos en los tratamientos adicionados con BAP y KNO3. Las barras de error representan el error estándar de las concentraciones. Las medias con diferentes letras muestran diferencias significativas (p<0.05). Figure 3. Average production (n = 10) of the number of shoots obtained in the BAP and KNO3 added treatments. The error bars represent the standard error of the concentrations. Means with different letters show significant differences (p<0.05).
Producción media (n = 10) del número de brotes obtenidos en los tratamientos adicionados con BAP y KNO3. Las barras de error representan el error estándar de las concentraciones. Las medias con diferentes letras muestran diferencias significativas (p<0.05). Figure 3. Average production (n = 10) of the number of shoots obtained in the BAP and KNO3 added treatments. The error bars represent the standard error of the concentrations. Means with different letters show significant differences (p<0.05).
Estos resultados concuerdan con lo reportado por distintas investigaciones donde la adición de BAP al medio de cultivo induce el desarrollo de los brotes en diferentes especies de orquídeas epífitas (Cazarez-Favela et al., 2016; Robinson et al., 2017), por este motivo es una de las citocininas más utilizadas para inducir la división celular y estimular la proliferación de brotes. Por su parte, Lozano-Rodríguez et al. (2015) describieron que la concentración de BAP utilizada es directamente proporcional a la formación de brotes in vitro en especies epífitas de la familia Orchidaceae.
-
Cazarez-Favela et al., 2016Propagación in vitro de la orquídea Prosthechea citrina (La Llave & Lex.) WE Higgins nativa del estado de Durango, MéxicoInvestigación y Ciencia, 2016
-
Robinson et al., 2017In vitro seed germination of Cymbidium aloifolium (L.) Sw., a potential medicinal orchid from Eastern Ghats of Tamil Nadu, IndiaJournal of Plant Biotechnology, 2017
-
Lozano-Rodríguez et al. (2015)Cultivo in vitro de yemas axilares de Vanilla planifolia Andrews con diferentes citocininasRevista Científica Biológico Agropecuaria Tuxpan, 2015
La acción del KNO3 en la inducción de brotes vegetales no ha sido reportada hasta la actualidad, sin embargo, existen algunas investigaciones que mencionan la adición de KNO3 al medio de cultivo durante el proceso de micropro-pagación in vitro de orquídeas epífitas en las cuales el KNO3 solo es utilizado para enriquecer el medio de cultivo, no para analizar su efecto inductor de brotes o raíces (Sultana et al., 2015; Nahar et al., 2015, 2017).
-
Sultana et al., 2015Effect of Hyaluronic Acid (HA) on organogenesis in Protocorm-Like Bodies (PLBs) of Phalaenopsis ‘Fmk02010’ cultured in vitroAmerican-Eurasian Journal of Agricultural & Environmental Sciences, 2015
-
Nahar et al., 2015Organogenesis of Cymbidium finlaysonianum under different sources of lightsmerican-Eurasian Journal of Agriculture & Environmental Science, 2015
-
2017Effect of light quality and plant growth regulator on organogenesis of orkid Cymbidium dayanumBangladesh Journal of Agricultural Research, 2017
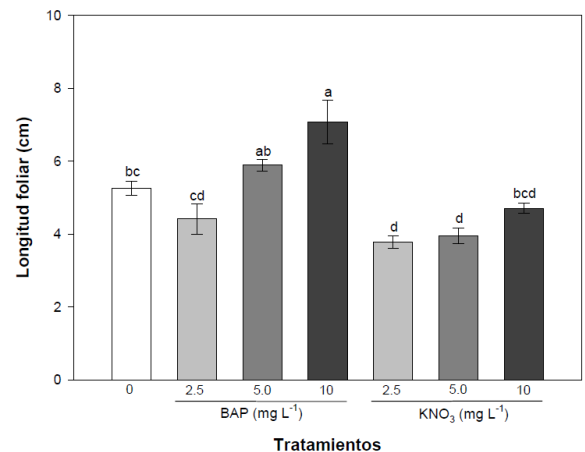
La longitud foliar desarrollada en los nuevos brotes aumentó de forma gradual en los medios de cultivo adicionados tanto con BAP, como con KNO3. Las plantas que desarrollaron la mejor longitud foliar después de 90 días fueron las cultivadas en el medio adicionado con 10 mg L-1 de BAP, alcanzando una longitud de 7.0 ± 0.6 cm (Figura 4). Los tratamientos adicionados con 10 mg L-1 de KNO3 mostraron resultados similares a los tratamientos control y los adicionados con 2.5 y 5.0 mg L-1 de BAP (Figura 4).
Thumbnail
Figura 4
Longitud foliar media (n = 10) desarrollada en los tratamientos adicionados con BAP y KNO3. Las barras de error representan el error estándar de las concentraciones. Las medias con diferentes letras muestran diferencias significativas (p<0.05). Figure 4. Average leaf length (n = 10) developed in the BAP and KNO3 added treatments. The error bars represent the standard error of the concentrations. Means with different letters show significant differences (p<0.05).
Longitud foliar media (n = 10) desarrollada en los tratamientos adicionados con BAP y KNO3. Las barras de error representan el error estándar de las concentraciones. Las medias con diferentes letras muestran diferencias significativas (p<0.05). Figure 4. Average leaf length (n = 10) developed in the BAP and KNO3 added treatments. The error bars represent the standard error of the concentrations. Means with different letters show significant differences (p<0.05).
No existen hasta el momento reportes científicos donde se haya analizado el efecto del KNO3 sobre la longitud foliar en orquídeas, sin embargo, en brotes de Musa sp. Cv. Cavendish se encontró que la adición de KNO3 no produce efectos significativos en la altura de los brotes provenientes de plantas propagadas in vitro (Montenegro-Juárez et al., 2014).
-
Montenegro-Juárez et al., 2014Efecto del sulpomag y complejos orgánicos como sustitutos parciales del medio de cultivo de micropropagación de Musa sp. Cv. CavendishAgronomía Costarricense, 2014
La inclusión de mayores concentraciones de KNO3 podría inducir una mayor cantidad de brotes nuevos con adecuada longitud foliar, debido a que aumentaría la cantidad de potasio biodisponible en el medio. El potasio es considerado como uno de los cationes principales en el desarrollo de las plantas y entre sus funciones bioquímicas más importantes destacan, el balance eléctrico de la mayoría de los aniones minerales y orgánicos como los carboxilatos, la regulación osmótica, el incremento de electrólitos en la célula (debido a que mantiene una pared celular gruesa), la regulación del agua en la planta y la disminución de ataque por microorganismos patógenos, debido a que elimina la acumulación de cadenas de carbohidratos y de nitrógeno no proteico, los cuales pueden producir la proliferación de bacterias, hongos, nemátodos y virus (Becerra-Sanabria et al., 2007).
-
Becerra-Sanabria et al., 2007Efecto de niveles de fósforo y potasio sobre el rendimiento del cultivar ‘Criolla Guaneña’ en el departamento de NariñoRevista Latinoamericana de la papa, 2007
Efecto de las concentraciones de BAP y KNO3 sobre el sistema radicular
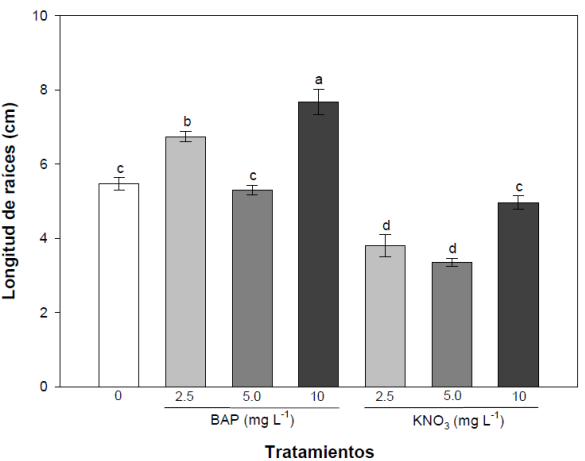
Para el proceso de rizogénesis en los diferentes tratamientos adicionados con BAP y KNO3 se evaluaron dos variables: 1) la producción del número de raíces y 2) la longitud que alcanzaron las raíces desarrolladas. Para el número de raíces se detectó que la mayor producción se obtuvo al agregar 10 mg L-1 de BAP, donde se produjeron un promedio de 14.4 ± 0.9 raíces. Los tratamientos con las concentraciones de 2.5 y 5.0 mg L-1 de KNO3 mostraron los valores más bajos para la producción de raíces (7.6 ± 0.5 y 8.3 ± 0.6 raíces respectivamente) y el tratamiento adicionado con 10 mg L-1 de KNO3 fue similar a los tratamientos adicionados con BAP y al tratamiento control, formando 11.4 ± 0.6 raíces (Figura 5). Además, las raíces que se produjeron bajo este tratamiento desarrollaron una estructura radicular conocida como velamen (Figura 6), tejido esponjoso constituido por células muertas sin citoplasma, el cual capta el agua del ambiente dejándola disponible para su absorción al interior de la raíz (Chomicki et al., 2015). En la Figura 2 F se puede observar una vitroplanta con hojas y raíces completamente desarrolladas, en la cual la formación de velamen radicular podría favorecer el subsecuente proceso de aclimatación.
-
Chomicki et al., 2015The velamen protects photosynthetic orchid roots against UV‐B damage, and a large dated phylogeny implies multiple gains and losses of this function during the CenozoicNew Phytologist, 2015
Thumbnail
Figura 5
Producción media (n = 10) del número de raíces desarrolladas en los tratamientos adicionados con BAP y KNO3. Las barras de error representan el error estándar de las concentraciones. Las medias con diferentes letras muestran diferencias significativas (p<0.05). Figure 5. Average production (n = 10) of the number of roots developed in the treatments added with BAP and KNO3. The error bars represent the standard error of the concentrations. Means with different letters show significant differences (p<0.05).
Producción media (n = 10) del número de raíces desarrolladas en los tratamientos adicionados con BAP y KNO3. Las barras de error representan el error estándar de las concentraciones. Las medias con diferentes letras muestran diferencias significativas (p<0.05). Figure 5. Average production (n = 10) of the number of roots developed in the treatments added with BAP and KNO3. The error bars represent the standard error of the concentrations. Means with different letters show significant differences (p<0.05).
Thumbnail
Figura 6
Velamen en las raíces de vitroplantas de L. anceps subsp. anceps observadas con un estereoscopio. Figure 6. Velamen in the roots of vitroplants of L. anceps subsp. anceps observed with a stereoscope.
Velamen en las raíces de vitroplantas de L. anceps subsp. anceps observadas con un estereoscopio. Figure 6. Velamen in the roots of vitroplants of L. anceps subsp. anceps observed with a stereoscope.
La longitud que las raíces alcanzaron bajo el efecto de los tratamientos fue mayor en los adicionados con BAP (Figura 7). El tratamiento adicionado con 10 mg L-1 de BAP indujo la mayor longitud en las raíces de las plántulas (7.6 ± 0.3 cm) y mostró diferencias significativas contra todos los demás tratamientos. Sin embargo, la menor y mayor concentración de BAP no mostraron la tendencia que se observó en la variable para el número de raíces, donde el incremento del número de raíces fue directamente proporcional al incremento de las concentraciones de BAP. Esto podría deberse a que cada planta responde de forma diferente en procesos de estímulos mecánicos o estrés ambiental, disminuyendo o aumentando su crecimiento radicular (Jaffe, 1980), lo cual pudo ocasionar que las plantas evaluadas para esta variable hayan tardado más en adaptarse a la adición de BAP pero que con el paso del tiempo la hayan metabolizado adecuadamente.
-
Jaffe, 1980Morphogenetic Responses of Plants to Mechanical Stimuli or StressBioScience, 1980
Las raíces de las plántulas sembradas en los tratamientos adicionados con 2.5 y 5.0 mg L-1 de KNO3 alcanzaron una longitud de 3.8 ± 0.2 y 3.3 ± 0.1 cm, respectivamente, siendo estos los tratamientos con los resultados más bajos. Las plántulas bajo el tratamiento adicionado con 10 mg L-1 de KNO3 desarrollaron una longitud radicular de 4.9 ± 0.1 cm, este efecto fue similar al observado en el tratamiento control (5.4 ± 0.1 cm) y al tratamiento adicionado con 5.0 mg L-1 de BAP (5.3 ± 0.1) sin diferencias estadísticas entre estos tratamientos (Figura 7).
Thumbnail
Figura 7
Longitud radicular media (n = 10) desarrollada en los tratamientos adicionados con BAP y KNO3. Las barras de error representan el error estándar de las concentraciones. Las medias con diferentes letras muestran diferencias significativas (p < 0.05). Figure 7. Mean root length (n = 10) developed in the treatments added with BAP and KNO3. The error bars represent the standard error of the concentrations. Means with different letters show significant differences (p<0.05).
Longitud radicular media (n = 10) desarrollada en los tratamientos adicionados con BAP y KNO3. Las barras de error representan el error estándar de las concentraciones. Las medias con diferentes letras muestran diferencias significativas (p < 0.05). Figure 7. Mean root length (n = 10) developed in the treatments added with BAP and KNO3. The error bars represent the standard error of the concentrations. Means with different letters show significant differences (p<0.05).
Las investigaciones sobre el uso de KNO3 como inductor de raíces en especies vegetales se encuentran muy limitadas, por lo cual este trabajo podría servir como referente para futuros estudios. De acuerdo con la Potassium Nitrate Association, la manera más recomendable de agregar KNO3 a las plantas es mediante la aplicación foliar, lo cual plantea la hipótesis, de que probablemente, los rendimientos obtenidos fueron bajos por que el compuesto se agregó directamente al medio de cultivo dificultando la biodisponibilidad de los iones NO-3 y del K+ para las plantas in vitro.
Finalmente, la Figura 8 muestra una comparación general entre las vitroplantas del tratamiento control, las desarrolladas en medios enriquecidos con BAP y en medios con KNO3. Las vitroplantas en el tratamiento control manifestaron un buen desarrollo foliar con buena producción de raíces (Figura 8A), en tanto que, se observó una clara diferencia entre el sistema radicular desarrollado en las plantas con BAP donde no se produjo velamen (Figura 8B), en comparación con las plantas adicionadas con KNO3, donde el velamen radicular fue evidente, además de que la coloración de las raíces se observó de un color verde más intenso (Figura 8C) comprobando con esto el efecto benéfico de este tratamiento en el desarrollo de las vitroplantas.
Thumbnail
Figura 8
Aspecto final de las vitroplantas de Laelia anceps subsp. anceps. (A) tratamiento control; (B) tratamiento adicionadas con BAP; (C) tratamiento adicionadas con KNO3. Figure 8. Final appearance of vitroplants of Laelia anceps subsp. anceps. (A) control treatment; (B) treatment added with BAP; (C) treatment added with KNO3.
Aspecto final de las vitroplantas de Laelia anceps subsp. anceps. (A) tratamiento control; (B) tratamiento adicionadas con BAP; (C) tratamiento adicionadas con KNO3. Figure 8. Final appearance of vitroplants of Laelia anceps subsp. anceps. (A) control treatment; (B) treatment added with BAP; (C) treatment added with KNO3.
Conclusiones
Las concentraciones de 2.5 y 5.0 mg L-1 de KNO3 utilizadas en este estudio no mostraron resultados estadísticamente significativos en la morfogénesis o diferenciación celular (formación de raíces y hojas). La adición de 10 mg L-1 de KNO3 produjo efectos similares al tratamiento control y a la adición de 2.5 mg L-1 de BAP, observándose el desarrollo de velamen en las raíces de las vitroplantas. Este resultado sugiere que podría incrementarse y mejorarse la morfogénesis en cuanto a la formación de nuevos brotes y del sistema radicular de las plántulas al aumentar la concentración de KNO3. La adición de BAP favoreció la inducción y el desarrollo de los brotes, así como el proceso de rizogénesis en las plantas de todos los tratamientos. Los resultados obtenidos en la presente investigación podrán ser utilizados para propagar de manera masiva plantas de L. anceps subsp. anceps, las cuales podrían ser comercializadas de manera legal a través de una Unidad de Manejo para la Conservación de la Vida Silvestre (UMA), o bien implementar protocolos de transferencia de la tecnología para la reinserción de la especie a su hábitat natural.
Agradecimientos
Parte de este trabajo fue realizado con recursos del Consejo Nacional de Ciencia y Tecnología (CONACYT, México), con número de proyecto 269491/2016 proporcionados a CCA. LJCP es estudiante de la maestría en Ciencias Ambientales y cuenta con el apoyo de una beca CONACYT.
Referencias
- Becerra-Sanabria, L. A., Navia-de Mosquera, S. L., Ñústez-López, C. E. 2007. Efecto de niveles de fósforo y potasio sobre el rendimiento del cultivar ‘Criolla Guaneña’ en el departamento de Nariño. Revista Latinoamericana de la papa. 14: 51-60. Links
- Cazarez-Favela, T. L., Graciano-Luna, J. J., Solís-González, S., Díaz-Ramírez, B., Najera-Luna, J. A., Montoya-Ayón, J. B. 2016. Propagación in vitro de la orquídea Prosthechea citrina (La Llave & Lex.) WE Higgins nativa del estado de Durango, México. Investigación y Ciencia. 24: 19-25. Links
- Chomicki, G., Bidel, L. P., Ming, F., Coiro, M., Zhang, X., Wang, Y., Baissac, Y., Jay-Allemand, C., Renner, S. S. 2015. The velamen protects photosynthetic orchid roots against UV‐B damage, and a large dated phylogeny implies multiple gains and losses of this function during the Cenozoic. New Phytologist. 205: 1330-1341. Links
- De Wit, M., Galvão, V. C., Fankhauser, C. 2016. Light-mediated hormonal regulation of plant growth and development. Annual Review of Plant Biology. 67: 513-537. Links
- Diengdoh, R. V., Kumaria, S., Tandon, P., Das, M. C. 2017. Asymbiotic germination and seed storage of Paphiopedilum insigne, an endangered lady’s slipper orchid. South African Journal of Botany. 11: 215-224. Links
- Goswami, K., Yasmin, S., Nasiruddin, K. M., Khatun, F., Akte, J. 2016. In vitro regeneration of Dendrobium sp. of orchid using leaf tip as explant. Journal of Environmental Science and Natural Resources. 8: 75-78. Links
- Halbinger, F. y Soto, M. 1997. Laelias of Mexico. Orquidea (Mex). 15: 37-61. Links
- Hágsater, E., Soto, A. M., Salazar, C. G., Jiménez, M. R., López, R. M., Dressler, L. M. 2015. Las orquídeas de México. 2nd ed. Instituto Chinoín México, D.F. Links
- Jaffe, M. J. Morphogenetic Responses of Plants to Mechanical Stimuli or Stress. 1980. BioScience. 30: 239-243. Links
- Khamchatra, N., Dixon, K. W., Tantiwiwat, S., Piapukiew, J. 2016. Symbiotic seed germination of an endangered epiphytic slipper orchid, Paphiopedilum villosum (Lindl.) Stein. from Thailand. South African Journal of Botany. 104: 76-81. Links
- Lozano-Rodríguez, M. A., Menchaca-García, R. A., Alanís-Méndez, J. L., Pech-Caché, J. M. 2015. Cultivo in vitro de yemas axilares de Vanilla planifolia Andrews con diferentes citocininas. Revista Científica Biológico Agropecuaria Tuxpan. 4: 1153-1165. Links
- Menchaca-García, R.A. 2011. Manual para la propagación de orquídeas. 1st ed. Comisión Nacional Forestal. Mexico. Links
- Montenegro-Juárez, F. E., Rojas-Idrogo, C., Quevedo-Calle, D., Delgado-Paredes, G. E. 2014. Efecto del sulpomag y complejos orgánicos como sustitutos parciales del medio de cultivo de micropropagación de Musa sp. Cv. Cavendish. Agronomía Costarricense. 38: 147-159. Links
- Nahar, S. J., Haque, S. M., Shimasaki, K. 2015. Organogenesis of Cymbidium finlaysonianum under different sources of lights. American-Eurasian Journal of Agriculture & Environmental Science. 15: 2095-2101. Links
- Nahar, S. J., Haque, S. M., Shimasaki, K. 2017. Effect of light quality and plant growth regulator on organogenesis of orkid Cymbidium dayanum. Bangladesh Journal of Agricultural Research. 42: 185-190. Links
- Norma Oficial Mexicana “Protección ambiental-Especies nativas de México de flora y fauna silvestres-Categorías de riesgo y especificaciones para su inclusión, exclusión o cambio-Lista de especies en riesgo”. [Consultado 10 Noviembre 2016] 2010. Disponible en: Disponible en: http://dof.gob.mx/nota_detalle_popup.php?codigo=5173091 . Links
- Nunes-Picolotto, D. R., de Paiva-Neto, V. B., de Barros, F., Castro-Padilha, D. R., Ferreira-da-Cruz, A. C., Campos-Otoni, W. 2017. Micropropagation of Cyrtopodium paludicolum (Orchidaceae) from root tip explants. Crop Breeding and Applied Biotechnology. 17: 191-197. Links
- Pérez-Martínez, B. A. y Castañeda-Garzón, S. L. 2016. Propagación in vitro de orquídeas nativas como una contribución para la conservación ex situ. Biotecnología Vegetal. 16: 143-151. Links
- Pottasium Nitrate Association. Usos del nitrato de potasio. [Consultado 2 Noviembre 2016]. Disponible en: Disponible en: http://www.kno3.org/es/about-potassium-nitrate/uses-of-potassium-nitrate . Links
- Rademacher, W. 2015. Plant growth regulators: Backgrounds and uses in plant production. Journal of plant growth regulation. 34: 845-872. Links
- Robinson, P., Kakati, J. P., Sebastinraj, J., Suriya, K. 2017. In vitro seed germination of Cymbidium aloifolium (L.) Sw., a potential medicinal orchid from Eastern Ghats of Tamil Nadu, India. Journal of Plant Biotechnology. 44: 343-348. Links
- Santos-Díaz, M. D. S. y Carranza-Álvarez, C. 2009. Plant regeneration through direct shoot formation from leaf cultures and from protocorm-like bodies derived from callus of Encyclia mariae (Orchidaceae), a threatened Mexican orchid. In Vitro Cellular & Developmental Biology-Plant. 45: 162-170. Links
- Sultana, K. S., Hasan, K. M., Hasan, K. M., Sultana, S., Mehraj, H., Shimasaki, K., Habiba, S. U. 2015. Effect of Hyaluronic Acid (HA) on organogenesis in Protocorm-Like Bodies (PLBs) of Phalaenopsis ‘Fmk02010’ cultured in vitro. American-Eurasian Journal of Agricultural & Environmental Sciences. 15: 1721-1724. Links
- Tejeda-Sartorius, O., Téllez-Velasco, M. A. A., Trejo-Téllez, L. I. 2017. Características ornamentales de orquídeas silvestres y su propagación con fines comerciales. Alternativa de aprovechamiento sustentable ex situ. Agroproductividad. 10: 37-45. Links
- Velasco-Velasco, V. A. 1999. Papel de la nutrición mineral en la tolerancia a las enfermedades de las plantas. Terra Latinoamericana. 17: 193-200. Links
- Vergara-Galicia, J., Ortiz-Andrade, R., Rivera-Leyva, J., Castillo-España, P., Villalobos-Molina, R., Ibarra-Barajas, M., Gallardo-Ortiz, I., Estrada-Soto, S. 2010. Vasorelaxant and antihypertensive effects of methanolic extract from root of Laelia anceps are mediated by calcium-channel antagonism. Fitoterapia. 81: 350-357. Links
- Yang, F. S., Sun, A. H., Zhu, J., Downing, J., Song, X. Q., Liu, H. 2017. Impacts of host trees and sowing conditions on germination success and a simple ex situ approach to generate symbiotic seedlings of a rare epiphytic orchid endemic to Hainan Island, China. The Botanical Review. 83: 74-86. Links
- Zhang, Y. Y., Wu, K. L., Zhang, J. X., Deng, R. F., Duan, J., Teixeira-Da Silva, J., Huang, W. C., Zeng, S. J. 2015. Embryo development in association with asymbiotic seed germination in vitro of Paphiopedilum armeniacum SC Chen et FY Liu. Scientific reports. 5: 16356. Links