Introducción
La α1-AT es una glicoproteína de 418 aa codificada por el gen SERPINA1 en el humano, en el locus 14q32.13 (Thun et al., 2013; Stockley, 2015), la cual ejerce efectos pleiotrópicos en el organismo (Tumpara et al., 2020), aun cuando su función efectora principal consiste en inhibir a las proteasas de serina y tripsina sérica y proteger al tejido pulmonar contra la actividad de la elastasa de los neutrófilos ya que α1-AT se une a ella formando complejos (Kunder et al., 2018). Se han descrito variantes genéticas de importancia clínica, principalmente porque su efecto biológico contribuye en la reducción de la concentración de los niveles séricos solubles de α1-AT, relacionados con la predisposición de patologías severas, incluyendo enfisema pulmonar y enfermedad hepática (Bashir et al., 2016; Motawi et al., 2016). Algunos polimorfismos en el gen SERPINA1 están asociados con el desequilibrio en la concentración de α1-AT (Ortega et al., 2020) con un posible papel en el cáncer (Enewold et al., 2012). En este sentido, múltiples estudios a la fecha han descrito que la participación de α1-AT en el microambiente del tumor a través de diversos mecanismos fisiopatológicos, que incluyen la inhibición de la apoptosis (Lim et al., 2020) mediante la inactivación de caspasas efectoras que promueven la muerte celular programada, y otros tipos de proteasas (Janciauskiene et al., 2011). Mutaciones en genes supresores de tumor, como p53, pueden influir en la expresión de α1-AT favoreciendo la progresión de la carcinogénesis; sin embargo, los mecanismos moleculares involucrados no están claros (Shakya et al., 2017). Posiblemente, la α1-AT promueva la fosforilación de la subunidad p85 de PI3K conduciendo a la activación de la proteína Akt, cuya estimulación anormal favorece la expresión de genes que codifican citocinas proinflamatorias asociadas a una elevada respuesta proliferativa y antiapoptótica (Zhao et al., 2018). También, los altos niveles séricos de α1-AT correlacionan con metástasis y mal pronóstico en pacientes con cáncer de pulmón y vejiga (Chang et al., 2012), disminución de la supervivencia y aumento de la resistencia a tratamientos citotóxicos. Esto permite que la α1-AT, sea considerada un biomarcador para cáncer colorrectal (Jaberie et al., 2020).
Desarrollo
Alfa-1 antitripsina (α1-AT)
La α1-AT pertenece a la superfamilia de las SERPINAs (Serine proteinase inhibitors); es codificada por el gen SERPINA1 (GenBank NG_008290) ubicado en el cromosoma 14q32.13; posee una longitud de 11.856 kb y está conformado por 5 exones (numerados de 1 al 5) y 4 intrones (De Serres y Blanco, 2014; Foil, 2021). De acuerdo con la base de datos UniProtKB, el transcrito canónico de α1-AT codifica para una cadena polipeptídica de 418 aminoácidos, con un peso molecular de 46.73 kDa. Existen, adicionalmente, dos isoformas de menor tamaño generadas por corte y empalme alternativo con pesos moleculares de 40.26 kDa y 34.75 kDa (https://www.uniprot.org/). La secuencia completa de la α1-AT consta de un péptido señal de 24 aa (aminoácidos: 1-24) en su extremo amino terminal que es necesario para su localización celular, seguido de una cadena polipeptídica madura de 394 aa (aminoácidos: 25-418) que conforman la estructura terciaria con 3 láminas-β (A, B y C), 9 hélices-α y un centro reactivo en la región del C-terminal (dominio RCL) de 24 aa (aminoácidos: 344-368). El mecanismo inhibitorio de la α1-AT se genera a través de la interacción entre su dominio RCL con el centro activo de la proteasa blanco, lo que permite que la proteasa corte este dominio para formar un complejo proteasa- α1-AT estable, inhibiendo irreversiblemente su actividad (Marijanovic et al., 2019).
Las modificaciones postraduccionales pueden originar características especiales y funcionales en las proteínas sintetizadas; por ejemplo, pueden modificar la solubilidad, estabilidad, tiempo de vida media e inducir interacciones con otras proteínas. La glicosilación es una modificación postraduccional que puede estabilizar a las proteínas, protegiéndolas de su degradación, elevando su vida media en el entorno celular. En la proteína α1-AT, las glicosilaciones pueden evitar la formación de agregados, una vez que es secretada (Lechowicz et al., 2020). El 14 % del peso de la α1-AT corresponde a carbohidratos que han sido agregados de forma postraduccional, lo que sugiere que estas modificaciones son esenciales para su función. La proteína α1-AT presenta tres sitios de N-glicosilación, en la Asn 70, Asn 107 y Asn 271, pero se han descrito otros sitios de N-glicosilación, dos sitios ubicados en la Asn 46 y Asn 83, codificadas dentro del exón II y otro sitio en la Asn 247 ubicado en el exón III (Blanchard et al., 2011) (https://www.uniprot.org/). Sin embargo, las diversas formas glicosiladas de la α1-AT y su función han sido poco estudiadas. Adicionalmente, la α1-AT presenta dos sitios de fosfoserina (Ser 38 y Ser 383) y un residuo modificado de S-cisteinilcisteina (Cys 256) (https://www.uniprot.org/)
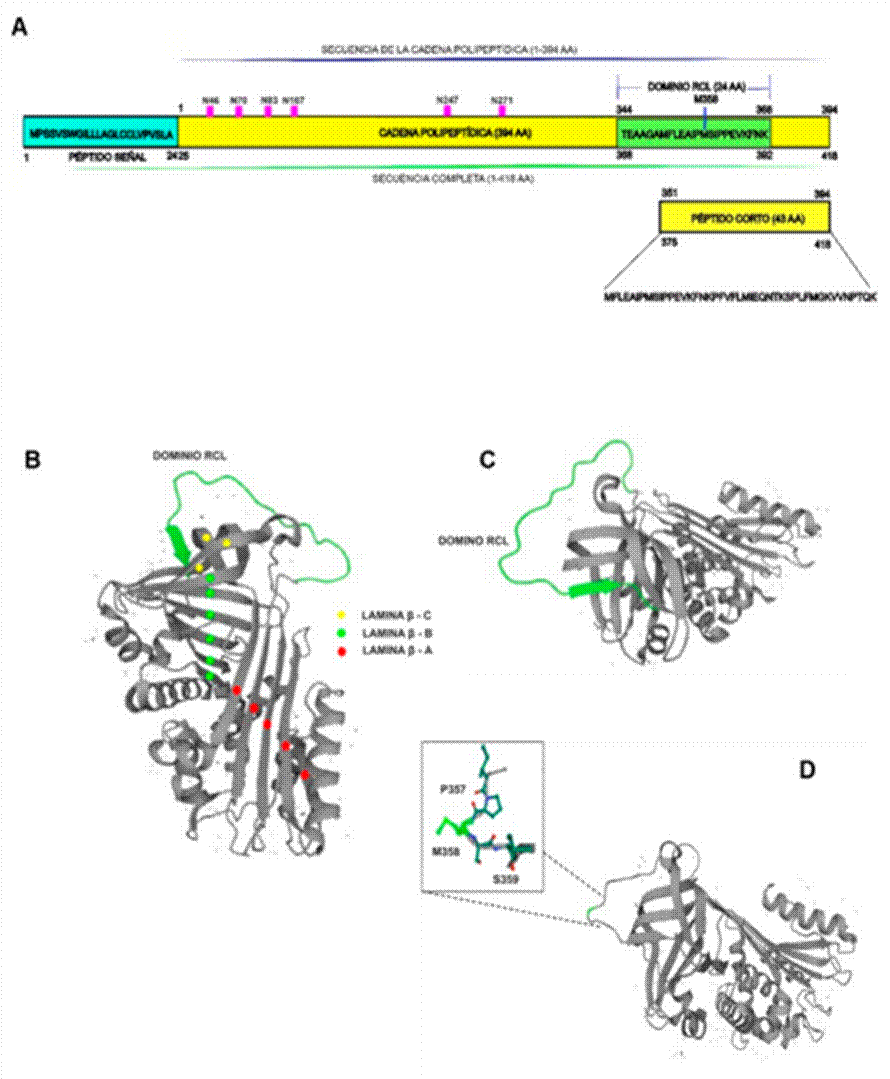
Características estructurales de la proteína α1-AT. A) La α1-AT contiene en su secuencia completa 418 aa, al eliminarse el péptido señal (24 aa) en el retículo endoplásmico rugoso, la cadena polipeptídica resultante es de 394 aa. En la estructura puede observarse un dominio RCL (Reactive Center Loop) de 24 aa. Además, la proteína muestra varios sitios de N-glicosilación en residuos de asparagina (N) en las posiciones: 46, 70, 83, 107, 247 y 271. Un péptido corto de 43 aa que contiene el dominio RCL puede ser generado a partir de la α1-AT, a través de la actividad de proteasas. Este fragmento puede inhibir quimotripsina, elastasa de neutrófilos, pero carece de efecto inhibitorio en la tripsina. B) Estructura terciaria de la α1-AT (vista de 90°); se pueden observar el dominio RCL y las láminas β: A, B y C, que son características de su estructura. C) Estructura del dominio RCL (vista de 180°); el cual se pliega hacía el exterior de la estructura. La interacción del dominio RCL con la proteasa blanco, es clave en el mecanismo de inhibición de la α1-AT. D) En el dominio RCL se muestra un residuo de metionina (M) en la posición 358, el cual se extiende hacia el exterior de la proteína y dirige la unión con la proteasa blanco. Al lado de la metionina se muestran los residuos de prolina y serina en la posición 357 y 359, respectivamente. Las imágenes B, C y D fueron tomadas y modificadas de UniProtKB (https://www.uniprot.org/); P01009 · A1AT_HUMAN. PDB ID:1HP7, X-ray 2.10 A° (25-418). Último acceso el 2 de marzo del 2024. Las imágenes fueros creadas y/o editadas con Inkscape software license, versión 3.0.
Figure 1 Structural characteristics of the α1-AT protein.
Variantes del gen SERPINA1
Existe un alto grado de polimorfismo en el gen SERPINA1, con más de 200 variantes. En la base de datos UniProtKB se enlistan 502 variantes, algunas son patogénicas o de importancia clínica y en otras sin un papel definido (Foil, 2021) (https://www.uniprot.org/). El gen humano silvestre de SERPINA1 codifica la proteína α1-AT normal designada con la letra M, pero existen diversas subvariantes benignas que difícilmente se diferencian con las tecnologías de rutina (Foil, 2021). Se han descrito diversas variantes de relevancia clínica, incluyendo variantes Z (p.Glu366Lys), S (p.Glu288Val), I (p.Arg63Cys) y F (p.Arg247Cys), generadas por mutaciones puntuales que se manifiestan con una disminución de los niveles séricos de α1-AT y una predisposición al desarrollo de enfisema pulmonar (Barzon et al., 2022). Particularmente, la forma Z se relaciona con el desarrollo de enfisema pulmonar y enfermedad hepática (Tan et al., 1976; Foil, 2021). Otras variantes denominadas “raras” (MHeerlen, MMalton, MProcida, MWürzburg, PBrescia, y PLowell) se asocian con el desarrollo de enfermedad pulmonar (EPOC) y/o enfermedad hepática, como resultado de cambios en la concentración sérica de α1-AT, inducción de formas poliméricas de la proteína y/o reducción de la habilidad para inhibir la elastasa de neutrófilos (Foil, 2021). Algunas variantes inducen un plegamiento incorrecto que promueven la formación de polímeros que se acumulan dentro del retículo endoplásmico de los hepatocitos, asociados con hepatitis neonatal, cirrosis y carcinoma hepatocelular (Barzon et al., 2022). Adicionalmente, diversas formas alélicas nulas de α1-AT (Q0Amrsfoort, Q0Mattawa, Q0Bellingham), donde la proteína no se expresa se han relacionado al desarrollo de enfisema pulmonar. También, ciertos polimorfismos están asociados con el desbalance en los niveles solubles de esta proteína en diferentes padecimientos, incluido el cáncer (Lechowicz et al., 2020). En este sentido, la expresión fenotípica se agrupa en cuatro escenarios de variantes: normales, disminuidas, disfuncionales o nulas, con base en los niveles circulantes de la proteína. Además, el gen SERPINA se hereda con un patrón autosómico codominante, lo que quiere decir que cada alelo desempeña un papel en la determinación de los niveles circundantes finales de la proteína (Manne y Kowdley, 2020).
Papel fisiológico de α1-AT
La proteína α1-AT tiene una amplia gama de funciones biológicas, incluyendo la modulación del sistema inmune, reparación de tejido, antioxidante, antimicrobiano, regulación de coagulación, reparadora de tejidos, citoprotectora, regulación de la adhesión celular, migración, proliferación, angiogénesis, control del ciclo celular, entre otras (de Serres y Blanco, 2014; Lorincz y Curiel, 2020; Janciauskiene et al., 2021). Sin embargo, también juegan un papel en procesos patológicos (Lechowicz et al., 2020). La α1-AT forma parte de la respuesta de fase aguda, como un inhibidor de las proteasas de serina y tripsina sérica, proporciona protección al tejido pulmonar contra el daño causado por la elastasa de los neutrófilos. Además, mantiene la homeostasis proteasaantiproteasa protegiendo el tejido pulmonar de la degradación proteolítica. Es uno de los principales componentes proteicos del plasma sanguíneo, después de la albúmina y las inmunoglobulinas (Kim et al., 1999; López-Árias et al., 2012; de Serres y Blanco, 2014; Stockley, 2015; Shakya et al., 2017; Remih et al., 2021).
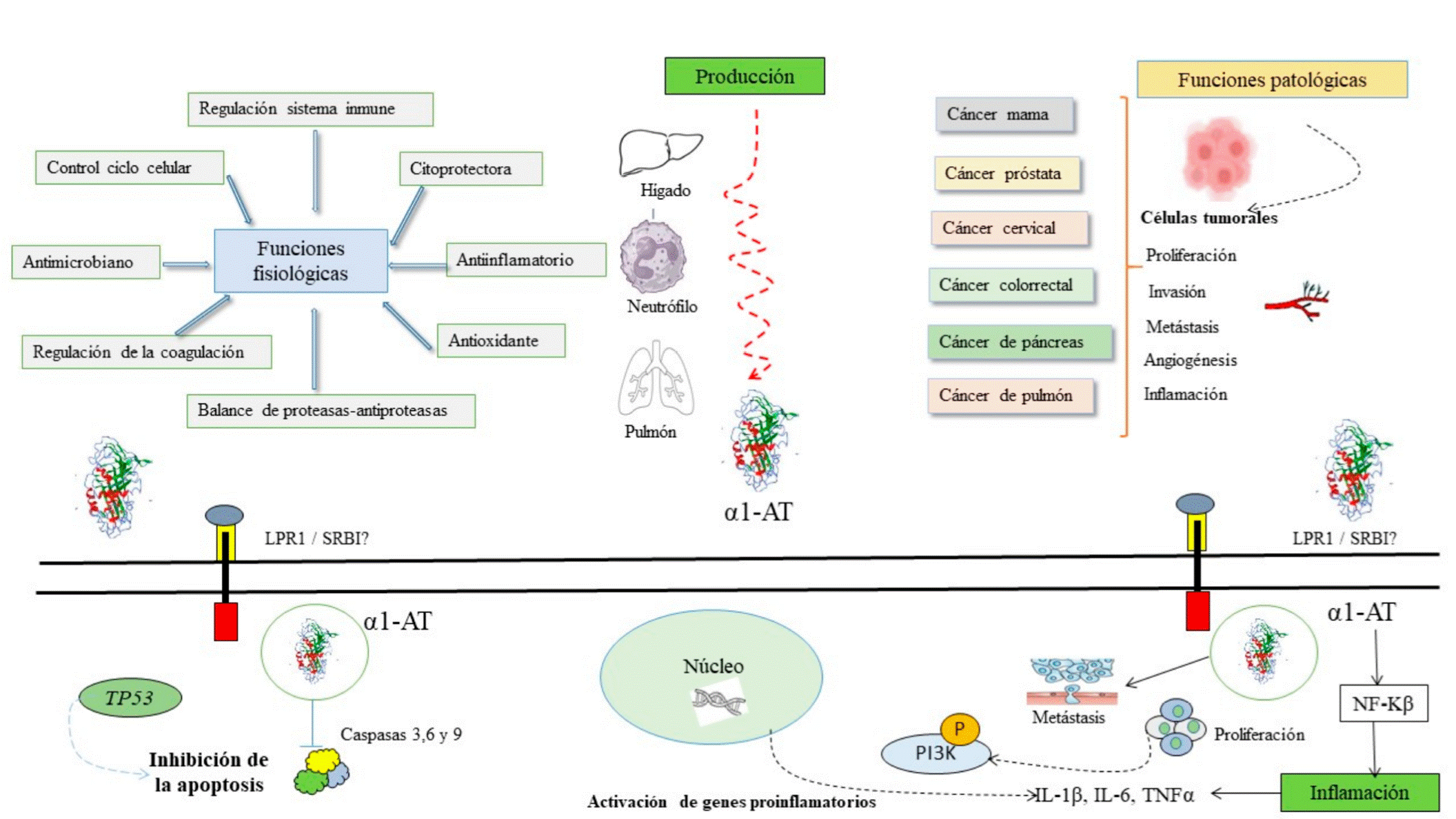
Propiedades fisiológicas y patológicas de la proteína α1-AT. Es Producida principalmente por el hígado para proteger el pulmón de las elastasas producidas por los neutrófilos y regular el balance. En cáncer, participa en la proliferación, invasión, metástasis, inflamación y formación de vasos sanguíneos. Se ha propuesto como posibles receptores a LPR1/SRBI, que favorece su ingreso a la célula a través de endosomas. Una vez dentro, puede activar la vía de señalización NFkB, que favorece la producción de citocinas proinflamatorias por la activación de genes proinflamatorios con retroalimentación positiva. La proliferación mediante la vía PI3K. La α1-AT también puede interaccionar con p53 y bloquear a las caspasas 3, 6 y 9, inhibiendo la apoptosis.
Figure 2 Physiological and pathological properties of the α1-AT protein.
La α1-AT es sintetizada, dentro del retículo endoplasmático, principalmente en los hepatocitos, así como en células alveolares, intestinales, epiteliales, renales, fagocitos pulmonares y por células tumorales (Janciauskiene et al., 2019; Strnad et al., 2020; Vianello et al., 2021). En el hígado hay una producción de 34 mg de α1-AT por kg de peso corporal por día, lo que lleva a un nivel plasmático de 0,9 a 1,75 mg/ mL, con una vida media de 3 a 5 días. Los niveles de α1-AT pueden aumentar debido a una amplia variedad de procesos inflamatorios, infecciones, cáncer, enfermedad hepática o embarazo. Durante la respuesta de fase aguda, los niveles de α1-AT aumentan hasta cuatro veces (Sun y Yang, 2004; de Serres y Blanco, 2014; Janciauskiene et al., 2019; Strnad et al., 2020). El 80 % de la proteína se difunde en tejido intersticial, mientras que entre el 0.5 - 10.0% se difunde a fluidos biológicos como el fluido alveolar, saliva, lágrimas, leche, semen, bilis, orina y líquido cefalorraquídeo, con una vida media de 4-5 días (De Serres y Blanco, 2014). La concentración plasmática de α1-AT puede aumentar entre 2 y 4 veces debido a citocinas proinflamatorias como IL-6, IL- β, IL-8, IL-17 y TGF-β (Marando et al., 2022).
En su función antiproteasa la α1-AT participa en la degradación de proteínas intracelulares en lisosomas y productos de degradación en focos inflamatorios; así como en la degradación de membranas bacterianas, elastina y colágeno-IV, para en la remodelación de la matriz extracelular (Belmonte et al., 2016). La α1-AT también participa en la activación de citocinas proinflamatorias, proteólisis de proteínas estructurales, para promover remodelación tisular y generación de fragmentos peptídicos con actividad antibacteriana en el huésped (Crisford et al., 2018). También juega un papel en la activación de plasmina, degradación de fibrina, quimiotaxis de monocitos, inflamación del endotelio por la activación de fosfolipasa A2, remodelación tisular mediante la eliminación de tejido necrótico y aumento de la actividad fagocítica de células dendríticas (Draxler et al., 2016; Baker y Strickland, 2020).
Además, de actuar como un inhibidor de proteasas de serina, la α1-AT tiene efectos antiinflamatorios, (a través de los neutrófilos), inhibe la síntesis de superóxido, previniendo la muerte celular de hepatocitos (Ehlers, 2014). Además, disminuye la quimiotaxis de los neutrófilos por limitar la activación de IL-8 mediante la formación del complejo α1-AT / IL-8, lo cual impide la interacción de la IL-8 con su receptor CXCR1. Por otro lado, inhibe la liberación de la proteína de membrana FcγRIIIb ligada a glicosilfosfatidilinositol (GPI) en la quimiotaxis de los neutrófilos, mediante el bloqueo de la actividad enzimática de la metaloproteinasa ADAM-17 (Bergin et al., 2014), reducción de la liberación de TNFα mediante la unión con TNFR1 y 2 impidiendo la degranulación de neutrófilos (Bergin et al., 2014), y activación de la proteína fosfatasa 2A, limitando la liberación de proteínas granulares secundarias y terciarias (Geraghty et al., 2014).
Papel de la α1-AT en el cáncer
El cáncer se caracteriza por el crecimiento sin control de células que pueden originarse de cualquier órgano y tienen la capacidad de sobrevivir, proliferar, infiltrarse y diseminarse a otras partes sanas del cuerpo, esto debido a que las células transformadas comparten un conjunto de características distintivas (Hanahan y Weinberg, 2011).
Entre las características distintivas de las células cancerosas que nos permiten comprender el comportamiento complejo que presentan, en el 2011 se establecieron ocho sellos funcionales: 1) en los que mantener la señalización proliferativa; 2) evadir los supresores de crecimiento, 3) resistir la muerte celular; 4) capacidad de replicación ilimitada; 5) inducir angiogénesis; 6) activar la invasión y metástasis, 7) reprogramación del metabolismo celular y, 8) evasión de la destrucción inmunitaria (Hanahan y Weinberg, 2011). Posteriormente, se describieron con más detalle los mecanismos moleculares y celulares precisos que permiten que las células preneoplásicas en evolución se desarrollen y adquieran estas capacidades fenotípicas aberrantes; e incluyeron las denominadas características habilitadoras: i) inestabilidad del genoma, ii) inflamación promotora de tumores, iii) desbloqueo de la plasticidad fenotípica, iv) reprogramación epigenética no mutacional, v) microbiomas polimórficos y vi) células senescentes (Hanahan, 2022).
En este sentido, el papel del sistema inmunológico desempeña un papel clave para resolver y eliminar de manera eficiente la transformación maligna, a través de un proceso llamado inmunoedición del cáncer, que consta de tres fases: eliminación, equilibrio y escape (Wang et al., 2017). En la etapa de eliminación, el sistema inmune reconoce y elimina las células cancerosas emergentes. Las células pueden ser erradicadas por completo o desarrollar variantes resistentes mediante mecanismos de inmunogenicidad y/o secreción de factores que inhiben la respuesta inmunológica, llegando a la etapa de equilibrio. El cáncer puede seguir avanzando debido a que el sistema inmune es incapaz de eliminar las células cancerosas emergentes y estas células progresan hasta diseminarse a otras partes del cuerpo, lo cual se ha denominado fase final o de escape (Bates et al., 2018).
Las células cancerosas evaden o pueden alterar la respuesta inmune del hospedero, mediante diversas formas que aseguran su desarrollo y supervivencia. De tal manera que, modificación del metabolismo de las células inmunitarias y la señalización de células T, así como la inhibición de citocinas en el microambiente tumoral pueden conducir a la supresión inmune y la progresión del tumor en los pacientes (de Aquino et al., 2016).
Existe evidencia de diversas proteínas que están sobreexpresadas y participan en el cáncer favoreciendo su desarrollo, así como el proceso inflamatorio al activar vías de señalización para la proliferación, sobrevida, inflamación y metástasis (Zhao et al., 2018). Diversas citocinas del perfil Th17 e IL-1β, IL-6 y TNFα, están sobreexpresadas, en mujeres con cáncer de mama en diferentes subtipos moleculares y estadios clínicos (Avalos et al., 2019). Entre estas, la proteína α1-AT ha tomado importancia por su asociación pronóstica, y su uso como un potencial marcador tumoral en diferentes tipos de cáncer, incluidos el cáncer colorrectal, cáncer de pulmón, cáncer de mama, cáncer cervical, entre otros (Miyake et al., 2013; Timms et al., 2014; Capoun et al., 2015; Zhao et al., 2018; Janciauskiene et al., 2019; Keeratichamroen et al., 2020; Wu et al., 2020; Hirasawa et al., 2021; Verathamjamras et al., 2023).
La α1-AT tiene propiedades anti-apoptóticas en células malignas, y su expresión esta relacionada con la invasión y metástasis en diversos cánceres humanos debido interrupción de la apoptosis en el microambiente tumoral (Ljujic et al., 2016).
La α1-AT inhibe directamente a la caspasa 3, así como otras caspasas ejecutoras, incluyendo las caspasas 6 y 7, y metaloproteinasas de matriz, lo cual evita la apoptosis (Janciauskiene et al., 2021). Shakya et al., en el 2017, demostraron que mutaciones presentes en p53 conducen a una vía oncogénica, a través de la modulación de expresión de diversos genes, destacando el gen de α1-AT, cuya relación es indispensable para el desarrollo de la invasión celular, tanto en modelos in vivo e in vitro. Aunado a lo anterior, se ha documentado que las células tumorales presentan el oncogén P53; cuya función es regular la expresión de genes involucrados en varios procesos celulares que incluyen la reparación del ADN, detención del ciclo celular, apoptosis y participa directamente sobre la expresión de α1-AT y, esta su vez actúa sobre p53, es decir, se genera una retroalimentación positiva, que promueve la invasión y proliferación en células tumorales (Ljujic et al., 2016; Shakya et al., 2017; Yuan et al., 2018).
Al parecer, altos niveles plasmáticos de α1-AT en pacientes con cáncer de páncreas, próstata, cuello uterino, ovario, mama, laringe, colorrectal, linfoma de Hodgkin, entre otros (Tabla 1), están asociados con el factor pronóstico y de progresión de la enfermedad (López-Árias et al., 2012; Zhao et al., 2018; Janciauskiene et al., 2021).
Table 1 Association studies of the α1-AT protein in cancer.
| Tipo de cáncer | Hallazgo | Referencia |
|---|---|---|
| Cáncer de vejiga | Concentraciones incrementadas de la proteína α1-AT en la orina de pacientes con cáncer de vejiga vs. sujetos control (606.4 ng/mL vs 120.0 ng/ mL, p < 0.0001). | Miyake et al., 2013 |
| Cáncer gástrico | Se encontró baja expresión de la proteína α1-AT en tejido de cáncer gástrico y un incremento en tejido normal adyacente. Se sugirió como posible biomarcador para este tipo de cáncer. | Wu Jeng-Yih et al., 2014 |
| Cáncer de ovario | Se elaboraron perfiles proteómicos de proteínas séricas en muestras de cáncer de ovario y sujetos control. La proteína α1-AT, se encontró incrementada en los estadios III-IV (aprox. 1000 µg/ml) en comparación con muestras benignas. | Timms et al., 2014 |
| Cáncer colorrectal | Se observó que el nivel sérico promedio de α1-AT en pacientes con cáncer colorrectal fue significativamente mayor (208.0 ± 60.0 mg/dL) en comparación con un grupo control (144.0 ± 20.5 mg/dL) (p = 0.0001), mediante nefelometría. | Pérez et al., 2014 |
| Cáncer de próstata | Generación de un modelo predictivo con la evaluación de biomarcadores séricos para el cáncer de próstata, incluida la α1-AT, los niveles de las proteínas se correlacionaron con los resultados de las biopsias para detectar cáncer. | Capoun et al., 2015 |
| Cáncer de mama | Elevada expresión de α1-AT en tejido tumoral de pacientes con cáncer de mama triple negativo. El silenciamiento de α1-AT disminuye la activación de las vías PI3K/Akt/mTOR, la migración celular y metástasis. | Zhao et al., 2018 |
| Cáncer de pulmón de células no pequeñas | Se analizaron muestras de suero y tejido pulmonar tumoral. Se observó que un nivel de α1-AT mayor a 2,66 mg/mL en pacientes en etapa III se correlaciona con una disminución en la supervivencia (p = 0,002). | Ercetin et al., 2019 |
| Cáncer colorrectal | Niveles incrementados de la proteína α1-AT en pacientes con cáncer colorrectal vs sujetos control (1.05-4.24 g/L (mediana 2.3 g/L) y, 1.01-2.13 g/L (mediana 1.43 g/L) (p = 0.0001). | Jaberie et al., 2020 |
| Cáncer cervical | α1-AT sérica se encuentra incrementada en mujeres con cáncer cervical en los estadios III y IV comparado con el grupo control (P < 0.01). | Keeratichamroen et al., 2020 |
| Cáncer de vejiga | Determinaron que los niveles urinarios de un panel de biomarcadores, incluida la α1-AT permitió discriminar de forma más precisa entre pacientes con cáncer de vejiga y sujetos control a través de inmunoensayos. | Hirasawa et al., 2021 |
| Cáncer colorrectal | Se reportaron niveles incrementados en plasma de la proteína α1-AT en pacientes con cáncer colorrectal, así como su expresión vs sujetos control. | Verathamjamras et al., 2023 |
Se han propuesto diversos mecanismos de acción de la proteína α1-AT en cáncer; sin embargo, no se han dilucidado completamente todos ellos. Por un lado, la proteína α1-AT puede interactuar con el receptor de proteínas de baja densidad relacionada con la proteína 1 (LRP-1) y el receptor scavenger clase b tipo I (SRBI), promoviendo su endocitosis y posterior liberación al citoplasma que induce la fosforilación y activación de AKT, a través del complejo mTORC2 (Janciauskiene et al., 2021). También α1-AT induce la fosforilación de la proteína PI3K (Zhao et al., 2018), que promueve la proliferación y supervivencia celular (Zhao et al., 2018).
La activación de la vía PI3K/AKT/mTOR, involucra la activación de receptores de tirosina quinasa (RTKs) presentes en la membrana plasmática como respuesta a la señalización mediada por los factores de crecimiento en la membrana celular con las señales extracelulares como factores de crecimiento (factor de crecimiento epidérmico, factor de crecimiento derivado de plaquetas, factor de crecimiento similar a la insulina); además de citocinas, hormonas (Aldecoa et al., 2021), α1-AT (Zhao et al., 2018), entre otros.
Diversos estudios demuestran que el incremento significativo de la α1-AT a nivel sistémico en distintos tumores, incluyendo cáncer colorrectal (Pérez-Holanda et al., 2014; Wu et al., 2020), de vejiga (Urquidi et al., 2012) y cáncer de pulmón de células no pequeñas (Ercetin et al., 2019), juegan un rol muy importante en la progresión de cáncer, supervivencia, metástasis y resistencia a la quimioterapia (Pérez-Holanda et al., 2014; Janciauskiene et al., 2021).
Conclusión
La α1-AT es una proteína producida principalmente por el hígado con múltiples funciones biológicas en el organismo. Su disminución en su concentración sérica está asociada a diversas condiciones clínicas como enfisema pulmonar, paniculitis y enfermedad hepática. En contraste, en algunos tipos de cáncer se han reportado niveles séricos incrementados de α1-AT. En estadios avanzados del cáncer la concentración de la proteína se incrementa de forma significativa. Por otro lado, es posible que α1-AT participe en la adquisición de la tolerancia inmunológica o depleción del sistema inmunológico, ya que pacientes con enfermedades autoinmunes (artritis reumatoide y lupus eritematoso sistémico) muestran efectos benéficos al ser tratados con α1-AT. Sin embargo, la deficiencia severa de α1-AT puede incrementar el riesgo de padecer cáncer hepático u otro tipo de neoplasia, lo que comprueba que la biología del tumor es compleja y surge la necesidad de llevar a cabo más estudios que permitan comprender mejor la relación que existe entre la concentración de α1-AT con los mecanismos fisiopatológicos del cáncer, a pesar de que α1-AT ha sido propuesta como un biomarcador de progresión y supervivencia en pacientes.











 nueva página del texto (beta)
nueva página del texto (beta)



