Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de ciencias farmacéuticas
versión impresa ISSN 1870-0195
Rev. mex. cienc. farm vol.42 no.2 Ciudad de México abr./jun. 2011
Trabajos científicos
Potencial nutracéutico de componentes bioactivos presentes en huitlacoche de la zona centro de México
Nutraceutic potential of bioactive components present in huitlacoche from the central zone of Mexico
Rosalba Beas F.1, Guadalupe Loarca P.2, Salvador Horacio Guzmán M.3, Martín Gerardo Rodriguez1, Nora Lilia Vasco M.1, Fidel Guevara L.1
1 Centro de Ciencias Básicas, Universidad Autónoma de Aguascalientes.
2 Programa de Posgrado en Alimentos del Centro de la República (PROPAC), Facultad de Química, Universidad Autónoma de Querétaro.
3 Unidad de Biotecnología, Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias (INIFAP).
Correspondencia
Dr. Fidel Guevara Lara
Departamento de Química, Centro de Ciencias Básicas,
Universidad Autónoma de Aguascalientes
Av. Universidad 940, Cd. Universitaria, Aguascalientes, Ags.,
C.P. 20131, México.
Tel. (449) 910 8414 Fax. (449) 910 8401
e–mail: fguevara@correo.uaa.mx, fguevaralara@yahoo.com.mx
Fecha de recepción: 26 de enero de 2011.
Fecha de recepción de modificaciones: 22 de marzo de 2011.
Fecha de aceptación: 12 de abril de 2011.
Resumen
El huitlacoche es un hongo que se consume tradicionalmente en México y actualmente es considerado una alternativa alimenticia. Análisis proximal, diversos carbohidratos y compuestos fenólicos, así como actividad antioxidante fueron analizados en muestras de huitlacoche. Se encontraron cantidades considerables de proteína [11.5–14.2% base seca (bs)] y de 54 a 65% bs de fibra dietaria total (método oficial enzimático–gravimétrico). El análisis por cromatografía líquida de alta resolución (HPLC) detectó altos niveles de los oligosacáridos, rafinosa, estaquiosa y verbascosa (1505, 541 y 2611 mg/100 g bs, respectivamente). Los principales ácidos fenólicos detectados por HPLC fueron los ácidos ferúlico, 4–hidroxibenzóico, siríngico y protocatecúico. Elevada actividad antioxidante mostraron extractos metanólicos (actividad antirradical 57–74%, método 2,2 difenil–1–picrilhidrazilo). Niveles considerables de fibra dietaria, oligosacáridos, ácidos fenólicos y elevada actividad antioxidante sustentan al huitlacoche como alimento funcional con potencial nutracéutico.
Palabras clave: huitlacoche, compuestos fenólicos, actividad antioxidante, alimento funcional, potencial nutracéutico.
Abstract
Huitlacoche is a mushroom consumed traditionally in Mexico and is currently considered a food alternative. Proximate analysis, carbohydrates and phenolic compounds, as well as antioxidant activity were analyzed in huitlacoche samples. Considerable levels of protein [11.5–14.2 % dry basis (db)] and 54 to 65 % db of total dietary fiber (official enzymatic–gravimetric method) were found. High performance liquid chromatography (HPLC) analyses detected high levels of the oligosaccharides raffinose, stachyose and verbascose (1505, 541 and 2611 mg/100 g db, respectively). HPLC also detected ferulic, 4–hydroxibenzoic, syringic and protocatechuic acids, mainly. Methanol extracts of huitlacoche showed high antioxidant activity (57–74 % anti–radical activity, 2,2 diphenyl–1–picrylhydrazyl method). Considerable quantities of dietary fiber, oligosaccharides, phenolic acids and high antioxidant activity give huitlacoche a value as a functional food with nutraceutic potential.
Keywords: huitlacoche, phenolic compounds, antioxidant activity, functional food, nutraceutic potential.
Introducción
Se conoce como huitlacoche a las agallas jóvenes que el hongo basidiomiceto Ustilago maydis (DC) Corda induce en las mazorcas inmaduras de maíz (Zea mays L.). En México, y otros países de Latinoamérica el huitlacoche se consume tradicionalmente como un hongo comestible1; en la actualidad es considerado una alternativa alimenticia, ya que en diferentes países es apreciado como una delicadeza culinaria2,3. En estudios previos se ha encontrado que el huitlacoche posee bajos niveles de grasa, pero un alto contenido de proteína, aminoácidos esenciales, ácidos grasos esenciales, así como fibra cruda y carbohidratos4–6. A la fecha, los estudios dirigidos a la caracterización de carbohidratos y compuestos fenólicos presentes huitlacoche son escasos y/o incompletos; por tal motivo es importante profundizar en el conocimiento de la composición detallada de este hongo, generando información que lo avale como un alimento funcional, además de considerar el desarrollo de productos nutracéuticos derivados del mismo.
Los carbohidratos se encuentran comúnmente en plantas y hongos comestibles, los cuales son fáciles de digerir y absorber por el humano, además de que son considerados una fuente importante de energía7. Los oligosacáridos que contienen galactosa, como la rafinosa, estaquiosa y verbascosa, son componentes principales de las semillas de diferentes leguminosas; estos azúcares son considerados fermentables, ya que el sistema digestivo del humano carece de la enzima α–galactosidasa y por tal motivo no pueden ser fragmentados, sin embargo se lleva a cabo la fermentación anaerobia de los mismos por parte de las bacterias presentes en el intestino grueso generando flatulencias8–10. Por otro lado, los polisacáridos de la fibra dietaria son componentes estructurales de la pared celular de plantas y hongos, y están formados de un gran número de unidades enlazadas de monosacáridos, que pueden ser iguales o diferentes11. Recientemente, ha surgido un gran interés en la caracterización de dichos polisacáridos ya que tienen la capacidad de inhibir el crecimiento de tumores12. La fibra dietaria es la lignina y aquellos polisacáridos resistentes a la hidrólisis de las enzimas digestivas del humano13, y puede ser parcialmente fermentada por la microflora colónica dando lugar a hidrógeno, metano, bióxido de carbono, y a los ácidos carboxílicos de cadena corta (ACCC) acético, propiónico y butírico. Dichos ACCC generados por la fermentación de la fibra pueden tener diferentes efectos como son el aporte de energía, aumento del flujo sanguíneo del colon, estimulación del crecimiento de bacterias benéficas del mismo y disminución en la incidencia de tumores en el colon14. Por lo anterior, el proceso de fermentación de la fibra en el colon es fundamental, pues gracias a este es posible el establecimiento y desarrollo tanto de la flora bacteriana presente, como de las células epiteliales del colon11.
Los hongos comestibles no sólo son fuente de carbohidratos sino que también sintetizan un conjunto de moléculas orgánicas denominadas metabolitos secundarios, los cuales están ampliamente distribuidos y tienen un papel importante en la estructura y sobrevivencia del hongo. Los ácidos caféico, clorogénico, ferúlico, sinápico, y ρ–cumárico son un grupo de metabolitos secundarios conocidos en forma genérica como ácidos fenólicos, los cuales presentan mayor actividad antioxidante15,16. Dichos compuestos presentan actividades farmacológicas interesantes como son la actividad antibacterial, antiviral, anti–inflamatoria, anti–alérgica, antitrombótica, y vasodilatadora17. Evidencias experimentales18–21 indican que los hongos comestibles presentan un gran número de compuestos biológicamente activos, entre ellos los compuestos fenólicos, que ofrecen un beneficio a la salud y protección contra enfermedades crónico degenerativas; es por ello que son tradicionalmente considerados como una parte fundamental de las dietas saludables y adicionalmente se han procesado generando nutracéuticos13.
El presente trabajo se enfoca en la caracterización química y funcional de compuestos bioactivos presentes en el huitlacoche, poniendo énfasis en su posible actividad antioxidante lo cual sustentaría su papel nutracéutico, abordando la comparación entre muestras colectadas en diferentes localidades del centro de México y muestras generadas en diferentes variedades de maíz.
Material y método
Muestras de huitlacoche
Se colectaron muestras de huitlacoche en mercados municipales de cinco localidades diferentes de la zona centro de México (Aguascalientes, Ags.; Encarnación de Díaz, Jal.; Irapuato y Salamanca, Gto.; y Puebla, Pue.) durante los meses de Julio y Agosto. Adicionalmente se produjeron muestras de huitlacoche por inoculación en tres variedades criollas de maíz llamadas Amarillo, Negro y Pipitillo; estas variedades fueron inoculadas en el mes de Julio y se cosechó en el mes de Septiembre. Cabe mencionar que el inóculo aplicado en dichas variedades se obtuvo a partir de cepas extraídas de agallas secas de muestras colectadas en Aguascalientes e Irapuato. Las agallas fueron congeladas y liofilizadas (liofilizadora Labconco 4.5) a –50 °C; después se molieron (molino 3383–L10) y se pasaron por un tamiz de malla 100 (tamaño aproximado de partícula 150 μm) y se almacenaron a –4 °C para su posterior análisis.
Caracterización química Análisis proximal
Se llevó a cabo con los métodos oficiales de la AOAC22 para la determinación de proteína cruda, grasa cruda, ceniza y humedad (métodos gravimétricos).
Análisis de carbohidratos solubles
La cuantificación de azúcares solubles se realizó de acuerdo al método descrito por Dubois y col23 con ciertas modificaciones.
La muestra liofilizada (liofilizadora Labconco 4.5) se extrajo con etanol (JT Baker) al 80%, se agitó y centrifugó a 5000 rpm (centrífuga MultiReax). Posteriormente se tomó el extracto (1 mL), se agregaron 25 μL de fenol (JT Baker) al 80% y 2.5 mL de ácido sulfúrico concentrado (JT Baker) directamente sobre la muestra; se dejó reposar por 25 min a temperatura ambiente (25 °C aproximadamente). Se tomó lectura en espectrofotómetro (Jenway 6405) a 490 nm contra un blanco. Para la cuantificación, se hizo una curva estándar de glucosa (Sigma) de 15–90 mg/mL. Los resultados se reportan como gramos de azúcares solubles equivalentes de glucosa por 100 g de muestra en base seca (g ASEG/100 g bs).
El método utilizado para la determinación de carbohidratos por HPLC fue el descrito por Muzquiz y col.24. Una muestra de 0.5 g de huitlacoche liofilizado fue mezclado con 5 mL de etanol al 80% y agitado vigorosamente. Posteriormente, se centrifugó a 3000 rpm recuperando el sobrenadante. El procedimiento anterior se repitió dos veces más. Los sobrenadantes recuperados se juntaron y secaron por evaporación a 50° C durante 24 h. Los extractos fueron disueltos en agua desionizada y filtrados en membranas de 0.45 μm de diámetro de poro; alícuotas de 1 mL fueron colocadas en viales e incorporadas al HPLC (Agilent 1100).
Para la separación, identificación y cuantificación de monosacáridos y oligosacáridos se usó una precolumna Zorbax NH2 (tamaño de partícula de 5 μm, 12.5 mm de longitud x 4.6 mm d.i.) y una columna Zorbax (tamaño de partícula de 5 μm, 250 mm de longitud x 4.6 mm d.i). La fase móvil consistió en acetonitrilo–agua grado HPLC (65:35, v/v) (Karal) con un flujo de 1 mL/min; el equipo fue programado con un volumen de inyección de 20 μL. Se usaron estándares de monosacáridos (glucosa, fructosa y sacarosa) y oligosacáridos (rafinosa, estaquiosa y verbascosa) (Sigma) para la identificación, la cual se realizó por comparación con los tiempos de retención de los picos detectados. Los resultados se reportan en miligramos de carbohidrato por 100 g de muestra en base seca (mg/100 g bs).
Análisis de fibra dietaria
Se utilizó el kit de fibra dietaria total de Sigma (Sigma) basado en la metodología enzimática–gravimétrica descrita por la AOAC25, con algunas modificaciones. Las muestras liofilizadas y desgrasadas fueron digeridas enzimáticamente con α–amilasa, proteasa y amiloglucosidasa. Se agregaron 150 de cada enzima, las muestras fueron puestas en baño maría (termo baño, Felisa) a 95 °C para la enzima α–amilasa, y 60 °C para la proteasa y amiloglucosidasa. Se mantuvieron en agitación constante y se dejó enfriar a temperatura ambiente antes de agregar cada una de las enzimas. Después de las digestiones se centrifugó a 5000 rpm separando el sobrenadante (fibra soluble) del precipitado (fibra insoluble). Una vez separados se les agregó etanol absoluto y se dejó precipitar la fibra durante 24 h; después de este periodo la mezcla fue separada por centrifugación (5000 rpm), para luego realizar tres lavados con etanol y dos con acetona. Finalmente las muestras se liofilizaron y se determinó proteína y ceniza. La fibra dietaria se obtuvo restando al peso inicial de la muestra, la cantidad de proteína y ceniza encontrada.
Análisis de compuestos fenólicos solubles
Los compuestos fenólicos solubles en metanol fueron cuantificados usando el método de Folin–Ciocalteu descrito por Singleton y col26. A 0.1 g de huitlacoche liofilizado se le agregaron 10 mL de metanol al 30% y se agitó en vortex. Se tomaron 125 μL del extracto metanólico, se le agregó 0.5 mL de agua desionizada y 125 μL del reactivo de Folin–Ciocalteu (Sigma); se agitó vigorosamente y se dejó reaccionar por 6 min; posteriormente se adicionó 1.25 mL de Na2CO3 (JT Baker) al 7% y se ajustó con agua desionizada a un volumen final de 3 mL. La mezcla se dejó reaccionar por 90 min en oscuridad y se leyó la absorbancia a 760 nm en espectrofotómetro (Jenway 6405). La concentración de fenoles solubles en huitlacoche se determinó por comparación con una curva de calibración de ácido gálico (Sigma) de 20–100 mg/mL. Los fenoles solubles se expresaron como gramos de equivalentes de ácido gálico por 100 g de muestra en base seca (g EAG/100 g bs).
El análisis de ácidos fenólicos por HPLC se llevó a cabo bajo las condiciones empleadas por Ramamurthy y col27. Se extrajo 1 g de huitlacoche liofilizado con 10 mL de metanol al 30% agitando con vortex. Posteriormente la mezcla fue filtrada con papel filtro No. 541 (Whatman), se tomó el extracto y se pasó por una membrana de 0.2 μm de diámetro del poro. Alícuotas de 1 mL fueron colocadas en viales y se introdujeron al HPLC (Agilent 1100). El análisis de los compuestos fenólicos se efectuó usando una columna Zorbax octadecilsilano (C18), con un flujo de 1.5 mL/min de la fase móvil, la cual consistió en solvente A: ácido acético/agua (2:98 v/v) y solvente B: ácido acético/acetonitrilo/agua (2:30:68 v/v/v). El equipo fue programado con un volumen de inyección de 20 μL. Se utilizaron 15 estándares de ácidos fenólicos para su identificación (ácido gálico, protocatecúico, benzoico, 4–hidroxibenzoico, 4–hidroxi–3–metoxibenzoico, vanílico, cumárico, ferúlico, salicílico, clorogénico, caféico y siríngico, así como catequina, epicatequina y vainillina) (Sigma) la identificación se realizó por medio de tiempos de retención de los picos detectados. Los resultados se reportan en miligramos de compuesto fenólico por 100 g de muestra en base seca (mg/100 g bs).
Determinación de antocianinas
La cuantificación de antocianinas se realizó conforme al método desarrollado por Abdel–Aal y Hucl28. A 0.1 g de muestra liofilizada se le agregaron 24 mL de etanol acidificado (etanol/ HCl 1 N, 85:15 v/v) con agitación en vortex. Posteriormente se ajustó el pH a 1.0 usando HCl (JT Baker) 4 N; la suspensión fue centrifugada a 3000 rpm; se recuperó el sobrenadante y se transfirió a un matraz volumétrico aforando a 50 mL con etanol acidificado. Finalmente, se midió la absorbancia a 535 nm. La concentración de antocianinas totales en la muestra se calculó como equivalentes de cianidina 3–glucósido, de acuerdo a la siguiente ecuación:
C=(A/ε) (vol/1000) (PM) (1/peso de la muestra) (106)
Donde:
C= concentración de antocianinas totales (mg/kg)
A= absorbancia máxima
ε= absortividad molar de la cianidina 3–glucósido (25965 cm–1M–1)
vol= volumen total del extracto de antocianinas
PM= peso molecular de cianidina 3–glucósido (449 Da)
Los resultados se reportan como miligramos de equivalentes de cianidina 3–glucósido por kilogramo de muestra en base seca (mg eq cianidina 3–glucósido/kg bs).
Taninos condensados
La determinación de taninos condensados se realizó de acuerdo al ensayo de la vainillina de Desphande29. A 500 mg de muestra liofilizada se le agregaron 10 mL de metanol absoluto (JT Baker) durante 24 h. Al término de este periodo la mezcla se agitó y centrifugó 10 min a 3000 rpm. Se tomó una alícuota de 1 mL del sobrenadante y se le adicionaron 5 mL de reactivo de vainillina (Sigma) recién preparado (vainillina al 1% en metanol y HCl al 8% en metanol en proporción 1:1, v/v). Se preparó un blanco con 1 mL del extracto de la muestra más 5 mL de HCl al 4% en metanol. La reacción se llevó a cabo a una temperatura de 30 °C durante 20 min y se leyó la absorbancia de cada muestra a 500 nm en un espectrofotómetro (Jenway 6405). La concentración de taninos condensados se calculó en base a una curva de calibración de (+)-catequina (0.02-0.20 mg/mL) disuelta en metanol. Los taninos condensados del huitlacoche fueron expresados como gramos de equivalentes de (+)-catequina por 100 g de muestra en base seca (g ECat/100 g bs).
Evaluación de actividad antioxidante
La actividad antioxidante se determinó por el método del 2,2 difenil–1–picrilhidrazilo (DPPH) (Sigma) con el uso de microplacas descrito por Fukumoto y Mazza30. A 8 g de huitlacoche liofilizado se le agregaron 100 mL de metanol absoluto y se dejó agitar por 24 h; posteriormente se centrifugó (5000 rpm) y el sobrenadante fue rotaevaporado (rotaevaporador Buchi). Se diluyeron 50 mg de la muestra rotaevaporada en 1 mL de metanol absoluto (50 mg/mL). Para la determinación de actividad antioxidante se agregaron 20 μL del extracto metanólico de huitlacoche (concentración de 0.869–1.387 μM de fenoles solubles), así como butilhidroxitolueno (BHT) (concentración 100–1000 μM) (Sigma) en una placa de microtitulación; posteriormente se añadió una alícuota de 200 μL del DPPH. La placa se cubrió con aluminio para proporcionarle condiciones de oscuridad y se dejó a temperatura ambiente (20 °C aproximadamente). Dicha placa se colocó en el espectrofotómetro (Spectramax Plus 384) y se tomaron lecturas cada 10 min hasta completar 90 min a una longitud de onda de 540 nm. Se calculó la actividad antirradical (ARA) con la siguiente ecuación:
% ARA= (100) (1 – absorbancia de la muestra/absorbancia control)
Análisis estadístico
Los resultados obtenidos con las muestras de huitlacoche de diferentes localidades fueron sometidos a análisis de varianza y a la comparación de los diferentes grupos por el método de rangos múltiples de Student–Newman–Keuls (Olivares31, Steel y Torrie32).
Resultados y discusión
Análisis proximal
El contenido de proteína en el huitlacoche varió tanto en muestras colectadas en diferentes localidades como en el obtenido en variedades criollas de maíz, presentando un promedio de 12.4% de proteína en muestras colectadas (el contenido de proteína más bajo fue de Jalisco con 9.6% y el más alto Aguascalientes con 14.2%). Por otro lado, las muestras generadas por inoculación presentaron 12.1% de proteína en promedio (en las variedades Negro y Amarillo presentaron 11.8% y 12.6% en Pipitillo). Nuestros resultados son similares a los encontrados por Paredes y col.33 quienes llevaron a cabo la producción masiva de huitlacoche en diferentes localidades y diferentes variedades de maíz encontrando un porcentaje de 10 a 14.5% de proteína. Estos autores atribuyeron la variación en el contenido de proteína a las condiciones medioambientales en las cuales se desarrolló el hongo; así mismo señalaron que el contenido de proteína varía de 8.9 a 38.7% en el hongo comestible Pleurotus, lo cual depende del sustrato que se utilice para su producción. Se ha reportado en general que los hongos comestibles presentan una variación en el contenido de proteína de 19 a 35%19, sin embargo este porcentaje puede ser menor en Shiitake (Lentinula edodes) 13.4–17.5%, en setas (Pleurotus ostreatus) 10.5–30.4%, y en dos especies del hongo blanco (Tricholoma portentosum y Tricholoma terreum) donde se encontró 16% de proteína34; también se encuentran dentro de este rango Volvariela volvacea 25.9% y el champiñon (Agaricus bisporus) 23.8–34.8%13. El huitlacoche mostró contenidos mayores en comparación con el maíz, el cual contiene alrededor de 10%, y similar al frijol (16 a 33%)35.
Se encontró un promedio de 2.9% de grasa cruda en muestras de huitlacoche colectado en diferentes localidades (los valores más bajo y más alto fueron 2.4 y 3.6% de las localidades de Aguascalientes y Jalisco, respectivamente), así como un promedio de 2.6% (2.3 y 2.8% en muestras generadas por inoculación en las variedades Pipitillo y Negro, respectivamente. El contenido de grasa se aproxima a lo reportado por Paredes y col. (2.7–6.5%)33. Comparando nuestros resultados con otros hongos comestibles, el huitlacoche tiene menor cantidad de grasa que el hongo Lentinula edodes (4.9–8.0%); sin embargo está por encima de Pleurotus ostreatus (1.6–2.2%) y Volvariela volvacea (2.4%) y se encuentra dentro del rango encontrado en Agaricus bisporus (1.7–8.0%)13. Paredes y col.33 reportaron 3.4–6.2% de ceniza en huitlacoche generado en diferentes variedades de maíz, lo cual es similar a lo que se encontró en el presente trabajo donde se obtuvo un promedio de 4.7% de ceniza en muestras colectadas en diferentes localidades (con un rango de 3.8% a 5.3%), mientras que para las muestras generadas por inoculación se obtuvo un promedio de 4.0% (rango de 2.9 a 5.2%). Comparando estos resultados con otros hongos comestibles, el huitlacoche presenta menor cantidad de ceniza que Agaricus bisporus (7.7–12%) Volvariela volvacea (8.8%) y Pleurotus ostreatus (6.1–9.8%), pero se encuentra dentro del rango de Lentinula edodes (3.7–7.0%)13. El huitlacoche presentó un rango de humedad de 80 a 86%, el cual se encuentra dentro del rango de otros hongos comestibles como Pleurotus ostreatus (73.790.8%), Agaricus bisporus (78.3–90.5%) y es cercano a Volvariela volvacea (89%) y Lentinula edodes (90–92%)13.
Análisis de carbohidratos solubles
Se encontraron altos niveles de azúcares solubles determinados con el método colorimétrico; para el huitlacoche colectado se obtuvo un rango de 6.4–10.0 g ASEG/100 g bs y para las muestras generadas 5.0–8.0 g ASEG/100 g bs. El análisis de carbohidratos por HPLC reveló la presencia de alto contenido de glucosa (741–1066 mg/100 g bs) y fructosa (394–553 mg/100 g bs) en relación a sacarosa (241–267 mg/100 g bs) (Tabla 1). La tendencia de nuestros resultados son similares a los reportados por Lizárraga6, quien encontró mayor cantidad de glucosa que de fructosa en las muestras liofilizadas de huitlacoche, lo cual explica el característico sabor dulce que presenta el huitlacoche con respecto a otros hongos comestibles como Agaricus bisporus y setas (Pleurotus ostreatus); esto se debe a la acumulación de diferentes carbohidratos en el área de infección en el maíz. Los oligosacáridos encontrados y cuantificados por HPLC en muestras de huitlacoche se presentan en la Tabla 1. Los niveles de rafinosa fueron altos comparándolos con los encontrados en frijol, el cual contiene 190–220 mg/100 g bs; en el huitlacoche se encontraron 520–1505 mg/100 g bs; sin embargo, el frijol contiene mayor cantidad de estaquiosa pues presenta de 1840 a 2450 mg/100 g bs35, mientras que en huitlacoche se encontró un rango de 124 a 541 mg/100 g bs. Comparando el contenido de oligosacáridos de la familia de la rafinosa presente en el huitlacoche, con otras semillas de leguminosas, encontramos que el garbanzo presenta 670 mg/100 g bs, en lenteja 600 mg/100 g bs y en chícharo 1470 mg/100 g bs de rafinosa, por lo que el huitlacoche presentó mayores niveles que las leguminosas. Sin embargo, la estaquiosa se presenta en mayor concentración en las leguminosas antes mencionadas con respecto al huitlacoche ya que presentan 2160, 4500 y 1700 mg/100 g bs en garbanzo, lenteja y chícharo, respectivamente8. Otro oligosacárido como es la verbascosa solamente se detectó en dos de las muestras colectadas; esto puede sugerir que la presencia y la cantidad de los diferentes oligosacáridos depende de la variedad de maíz. El alto contenido de oligosacáridos en las muestras de huitlacoche nos da una visión del valor nutracéutico y del efecto farmacológico que podría presentar este hongo, ya que dichos compuestos están directamente involucrados en disminuir colesterol, presión sanguínea y presentar efectos anticancerígenos36.

Análisis de fibra dietaria
Con respecto a la determinación de fibra dietaria total (FDT) se encontró alto contenido en el huitlacoche (54–65%) con respecto a otros hongos comestibles como Agaricus bisporus y Lentinula edodes, ya que éstos contienen 18% y 37%, respectivamente20, así como Volvariella volvacea con 28% y Pleurotus sajor–caju con 35% 21. En dos especies de Tricholoma se encontró un rango de 45 a 50%34. El contenido de FDT presente en el huitlacoche es elevado comparándolo con otros alimentos como el garbanzo (15.4%)37, frijol (25%), maíz (23–25%)35, y avena (10 a 11%)38. Por otra parte, el contenido de fibra dietaria insoluble (FDI) se encontró en mayor cantidad (47–49%) con respecto a la fibra dietaria soluble (FDS, 8.6–12.5%); los niveles en alimentos como la avena son menores ya que ésta presenta 6.0–7.1% de FDI y 4.1–4.9 FDS36, el frijol 22.6% de FDI y 2.6% de FDS, garbanzo 15.4% de FDI, y FDS no fue detectada.
Las diferencias encontradas en las muestras de huitlacoche colectadas en localidades diferentes de la zona centro de México y generadas en las variedades criollas de maíz, pueden atribuirse a las variedades de maíz utilizadas y a la localidad en la que se llevó a cabo su desarrollo. Por otra parte, también cabe resaltar que los niveles de FDT, FDS y FDI en huitlacoche son elevados y que estos componentes aportan un beneficio importante a la salud ya que disminuyen el riesgo de contraer cáncer de colon.
Análisis de compuestos fenólicos solubles, antocianinas y taninos condensados
En la Tabla 2 se muestran los contenidos de fenoles solubles, antocianinas y taninos condensados. Para fenoles solubles encontramos en el huitlacoche un rango que varió de 390 a 640 mg/100 g bs, y que es elevado con respecto al hongo comestible Lentinula edodes, el cual presentó 479 mg/100 g y tiene menor cantidad de fenoles con respecto a Volvariela volvacea (1500 mg/100 g)39. Comparándolo con otros alimentos, el huitlacoche presentó mayor cantidad de fenoles solubles que algunas variedades de frijol (141–198 mg/100 g bs)40 y algunas frutas como la manzana y la pera (186 y 191 mg/100 g bs, respectivamente)41. El rango encontrado de antocianinas en las muestras de huitlacoche fue de 71–226 mg/kg bs, el cual se puede comparar con el presente en ciruelas (20–250 mg/kg bs). Sin embargo, lo encontrado en el huitlacoche es bajo en comparación con las uvas rojas pues tienen un rango de 300–7500 mg/kg bs42. Cabe mencionar que el contenido de antocianinas encontrado en el huitlacoche es aceptable ya que el consumo de este compuesto químico es de 185–215 mg/día/persona43. El contenido de taninos condensados fue bajo en huitlacoche en comparación a lo encontrado en semillas de frijol (2030–2140 mg Eq (+)Cat/100 g bs40.

Los principales compuestos fenólicos solubles que fueron identificados y cuantificados por el HPLC fueron los ácidos protocatecúico, siríngico, 4–hidroxibenzoico, y ferúlico con 93, 158, 174 y 239 mg/100 g bs, respectivamente. Los ácidos fenólicos solubles encontrados en el huitlacoche están ampliamente distribuidos en la naturaleza, son abundantes en vegetales, frutas y cereales, y han demostrado propiedades antioxidantes, antiinflamatorias, anticarcinogénicas y estimulantes del sistema inmunológico. El consumo de alimentos ricos en compuestos fenólicos está asociado con disminuir el riesgo de contraer enfermedades degenerativas tales como el cáncer, enfermedades cardiovasculares, disfunción cerebral y del sistema inmunológico15,40 además de presentar propiedades farmacológicas44.
Evaluación de actividad antioxidante
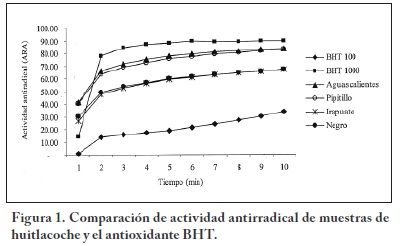
La Figura 1 muestra la actividad antirradical (ARA) de los extractos metanólicos de huitlacoche, los cuales fueron comparados con el BHT, un antioxidante comercial ampliamente utilizado para prevenir la rancidez de alimentos enlatados. La actividad antioxidante determinada en las muestras colectadas de Irapuato y Aguascalientes, así como las generadas en las variedades Negro y Pipitillo presentaron un porcentaje de ARA elevado pues Irapuato y Aguascalientes resultaron con 56.5 y 74.2% mientras que el porcentaje de Negro y Pipitillo fue de 57.2 y 72.5%, respectivamente. Como se muestra en la Tabla 2, Aguascalientes y Pipitillo tienen mayor concentración de ácidos fenólicos, y como se muestra en la Figura 1 su porcentaje de ARA fue elevado con respecto a Irapuato y Negro, los cuales presentaron menor concentración de ácidos fenólicos y por consecuencia menor ARA. De acuerdo a investigaciones realizadas en los hongos comestibles Volvariella volvacea y Lentinus edodes, éstos presentaron ARA de 57.8% y 29.8%, respectivamente30, por lo que encontramos que el huitlacoche presenta mayor ARA (57–74%). Con respecto a otros alimentos como el frijol (32.6 %45 y 22%46) y el maíz (7.3 %47), la ARA encontrada en el huitlacoche es elevada.
Conclusiones
De acuerdo a los resultados obtenidos, se concluye que la variación encontrada en los principales componentes del huitlacoche colectado en diferentes localidades y generado por inoculación se debe a la variedad de maíz utilizada y a las condiciones medioambientales en las cuales se desarrollaron. Los altos niveles de oligosacáridos de la familia de la rafinosa y fibra dietaria sugieren que el huitlacoche puede aportar un beneficio importante a la salud, ya que dichos componentes han demostrado estar directamente involucrados en disminuir el riesgo de contraer cáncer de colon. Las concentraciones elevadas de compuestos fenólicos que se encontraron tanto en las muestras colectadas como generadas están directamente relacionadas con la actividad antioxidante que presentó el hongo; esto indica que el huitlacoche puede considerarse dentro del grupo de los nutracéuticos, además de que puede aportar un efecto farmacéutico pues dichos componentes bioactivos están relacionados con la disminución de la incidencia de enfermedades crónico degenerativas.
Agradecimientos
Se agradece el financiamiento por parte de CONACyT (proyecto S52900–Z y beca de doctorado a Rosalba Beas F.) Esta investigación también fue apoyada por los proyectos PIBT–05–3N, PIBT–09–8N y MP0013 de la Universidad Autónoma de Aguascalientes, y los financiamientos PIFI 3.3 P/CA–35 200601–08 y PTC076/103.5/08/1265 de PROMEP, Secretaría de Educación Pública. También agradecemos el apoyo financiero del INIFAP, Campo Experimental Bajío y de la Universidad Autónoma de Querétaro.
Referencias
1. Serafin MAH, Kubachka K, Wrobel K, Gutierrez CF, Yathavakilla SKV, Caruso JA, Wrobel K. Metallomics approach to trace element analysis in Ustilago maydis using cellular fractionation, atomic absorption spectrometry and size exclusion chromatography with ICP–MS detection. J Agric Food Chem. 2005; 53:5138–5143. [ Links ]
2. Pataky JK. Improved methods for producing huitlacoche. Sexto Congreso Mexicano sobre Producción de Hongos Comestibles. Puerto Vallarta, México. 2002. [ Links ]
3. Castro EL, Ruiz HI. Huitlacoche: Una delicadeza alimenticia que se puede producir en el Valle del Yaqui. Universidad y Sociedad: Interacción para el Desarrollo. 2005; 27–28. [ Links ]
4. Paredes LO, Guevara LF, Bello PLA. Los Alimentos Mágicos de las Culturas Indígenas Mesoamericanas. 1a Ed. México DF: Fondo de Cultura Económica; 2006. [ Links ]
5. Lizárraga R, López M. Content of free amino acids in huitlacoche (Ustilago maydis). J Agric Food Chem. 1996; 44:2556–2559. [ Links ]
6. Lizarraga R, López M. Monosaccharide and alditol contents of huitlacoche (Ustilago maydis). J Food Compos Anal. 1998; 11:333–339. [ Links ]
7. Fox B, Cameron A. Carbohidratos. En: Ciencia de los Alimentos, Nutrición y Salud. México DF: Noriega Editores–Limusa; 2002. p. 112–134. [ Links ]
8. Ötles S, Cagindi Ö. Cereal based functional foods and nutraceuticals. Acta Sci Pol, Technol Aliment. 2006; 5(1):107–112. [ Links ]
9. Biruete GA, Juarez HE, Sieiro OE, Romero VR, Silencio BJL. Los nutracéuticos. Lo que es conveniente saber. Rev Mex Pediatr. 2009; 76(3):136–145. [ Links ]
10. Granito M, Champ M, Bonnet C, Guerra M. Identification of gas–producing components in different varieties of Phaseolus vulgaris by in vitro fermentation. J Sci Food Agric. 2001; 81:543–540. [ Links ]
11. Gordon DT. Intestinal health through dietary fiber, prebiotics, and probiotics. Food Technol. 2002; 56:23. [ Links ]
12. Cencic A, Chingwaru W. The role of functional foods, nutraceuticals, and food supplements in intestinal health. Nutrients. 2010; 2:611–625. [ Links ]
13. Chang S, Miles, P. Mushrooms: Cultivation, Nutritional Value, Medicinal Effect and Environmental Impact. 2a Ed. Boca Raton: CRC Press; 2004, p. 451. [ Links ]
14. Garcia P, Breton I, De la Cuerda C, Camblor M. Metabolismo colónico de la fibra. Nutr Hosp. 2002; 17(2):11–16. [ Links ]
15. Robbins JR. Phenolic acids in foods: An overview of analytical methodology. J Agric Food Chem. 2003; 51:2866–2887. [ Links ]
16. Shahidi F, Ho C–T. Antioxidant measurement and applications. ACS Symposium Series 956. Washington: American Chemical Society; 2007. [ Links ]
17. McCann SE, Ambrosone CB, Moysich KB, Brasure J, Marshall JR, Freudenheim JL, Wilkinson GS, Graham S. Intakes of selected nutrients, foods, and phytochemicals and prostate cancer risk in western New York. Nutr & Cancer. 2005; 53(1):33–41. [ Links ]
18. Lakshmi B, Tilak JC, Adhikari S, Devasagayam TPA, Janardhanan KK. Evaluation of antioxidant activity of selected Indian mushrooms. Pharm Biol. 2004; 42(3):179–185. [ Links ]
19. Mattila P, Suonpaa K, Piironen V. Functional properties of edible mushrooms. Nutr. 2000; 16:694–696. [ Links ]
20. Mattila P, Salo VP, Konko K, Aro H, Jalava T. Basic composition and amino acid contents of mushrooms cultivated in Finland. J Agric Food Chem. 2002; 50:6419–6422. [ Links ]
21. Cheung PCK. Dietary fiber content and composition of some cultivated edible mushroom fruiting bodies and mycelia. J Agric Food Chem. 1996; 44:468–471. [ Links ]
22. AOAC. Official Methods of Analysis. 15a Ed. Arlington: Association of Official Analytical Chemists; 1990. [ Links ]
23. Dubois M, Gilles KA, Hamilton JK, Rebes PA, Smith F. Colorimetric method for determination of sugars and related substances. Anal Chem. 1956; 28:350–356. [ Links ]
24. Múzquiz M, Burbano C, Ayet G, Pedrosa M, Cuadrado C. The investigation of antinutritional factors in Phaseolus vulgaris. Environmental and varietal differences. Biotechnol Agron Soc Environ. 1999; 3(4):210–216. [ Links ]
25. AOAC. Official Methods of Analysis of AOAC International. 16a Ed. Arlington: Association of Official Analytical Chemists International; 1997. [ Links ]
26. Singleton VL, Orthofer R, Lamuela RM. Analysis of total phenols and other oxidation substrates and antioxidants by means of the Folin–Ciocalteu reagent. Meth Enzymol. 1999; 299:152–178. [ Links ]
27. Ramamurthy M, Maiti B, Thomas P, Nair M. High performance liquid chromatography determination of phenolic acids in potato tuber (Solanum tuberosum) during wound healing. J Agric Food Chem. 1992; 40:569–572. [ Links ]
28. Abdel–Aal ESM, Hucl P. A rapid method for quantifying total anthocyanins in blue aleurone and purple pericarp wheats. Cereal Chem. 1999; 76(3):350–354. [ Links ]
29. Desphande, SS. Tannin analysis of food products. Crit Rev Food Sci Nutr. 1985; 24:401–449. [ Links ]
30. Fukumoto LR, Mazza G. Assessing antioxidant and prooxidant activities of phenolic compounds. J Agric Food Chem. 2000; 48:3597–3604. [ Links ]
31. Olivares SE. Paquete de diseños experimentales. Versión 2.5. Marín, México: Facultad de Agronomía, Universidad Autónoma de Nuevo León; 1994. [ Links ]
32. Steel RGD, Torrie JH. Principles and Procedures of Statistics–A Biometrical Approach. 2a Ed. Tokyo: McGraw–Hill; 1981. p. 215. [ Links ]
33. Paredes LO, Valverde ME, Guevara LF, Vanegas EP. Tecnologías para la producción masiva de huitlacoche. Cuaderno de Trabajo, Área de Alimentos. México DF: Sistema de Investigación Miguel Hidalgo–CONACyT; 2000. [ Links ]
34. Diez VA, Alvarez A. Compositional and nutritional studies on two wild edible mushrooms from northwest Spain. Food Chem. 2001; 75:417–422. [ Links ]
35. Guzmán MS., Paredes LO. Functional products of plants indigenous to Latin America: Amaranth, quinoa, common beans, and botanicals. En: Mazza G, editor. Functional foods: Biochemical and processing aspects. Lancaster: Technomic; 1998. p. 239–328. [ Links ]
36. Paredes LO, Valverde ME. Los recursos nutracéuticos y medicinales que Mesoamérica le ha dado al mundo. Cinvestav. 2006; 65–73. [ Links ]
37. De Almeida CGE, Da Silva QMK, Pissini MRSM, Costa DOA. Chemical composition, dietary fibre and resistant starch contents of raw and cooked pea, common bean, chickpea and lentil legumes. Food Chem. 2006; 94:327–330. [ Links ]
38. Manthey FA, Hareland GA, Huseby DJ. Soluble and insoluble dietary fiber content and composition in oat. Cereal Chem. 1999; 76(3):417–420. [ Links ]
39. Cheung LM, Cheung PCK, Ooi VEC. Antioxidant activity and total phenolics of edible mushroom extract. Food Chem. 2003; 81:249–255. [ Links ]
40. Guevara LF, Espinosa ALG, Valverde ME, Lygin A, Widholm J, Paredes LO. Phenolics, flavonoids and other nutraceuticals in Mexican wild common beans (Phaseolus vulgaris). En: Tunick MH, González ME, editors. Chemistry and flavor of Hispanic foods. ACS Symposium series 946. Washington: American Chemical Society/Oxford University Press; 2007. p. 77–88. [ Links ]
41. Vinson JA. Phenol antioxidant quantity and quality in foods: Fruits. J Agric Food Chem. 2001; 49:5315–5321. [ Links ]
42. Clifford MN. Anthocyanins–Nature, occurrence and dietary burden. J Sci Food Agric. 2000; 80:1063–1072. [ Links ]
43. Wu X, Beecher GR, Holden J, Haytowits D, Gebhardt S, Prior R. Concentrations of anthocyanins in common foods in the United States and estimation of normal consumption. J Agric Food Chem. 2006; 54:4069–4075. [ Links ]
44. Drago SME, López LM, Saínz ETR. Componentes bioactivos de alimentos funcionales de origen vegetal. Rev Mex Cienc Farm. 2006; 37(4):58–66. [ Links ]
45. Cardador MA, Loarca PG, Ooman D. Antioxidant activity in common beans (Phaseolus vulgaris). J Agric Food Chem. 2002; 50:6975–6980. [ Links ]
46. Oomah BD, Cardador MA, Loarca PG. Phenolics and antioxidative activities in common beans (Phaseolus vulgaris L). J Sci Food Agric. 2005; 85:935–942. [ Links ]
47. Ruiz TN, Rincón SF, Hernández LV, Figueroa CJ, Loarca PG. Determinación de compuestos fenólicos y su actividad antioxidante en granos de maíz. Rev Fitotecn Mex. 2008; 31(3):29–34. [ Links ]














