Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de ciencias farmacéuticas
versión impresa ISSN 1870-0195
Rev. mex. cienc. farm vol.43 no.3 Ciudad de México jul./sep. 2012
Trabajo científico
Disolución comparativa de indometacina en cápsulas utilizando los Aparatos 1 y 4 USP
Comparative dissolution of indomethacin capsules using the USP Apparatus 1 and 4
José Raúl Medina López, Marcela Hurtado y de la Peña, Alma Rosa Cortés Arroyo, Adriana Miriam Domínguez Ramírez
Departamento Sistemas Biológicos, Universidad Autónoma Metropolitana-Xochimilco.
Correspondencia:
M. en C. José Raúl Medina López
Departamento Sistemas Biológicos
Universidad Autónoma Metropolitana-Xochimilco
Calzada del Hueso 1100 Colonia Villa Quietud
Delegación Coyoacán CP 04960 México DF, México
Teléfono y fax: (55) 5483 7000 ext. 3445, (55) 5483 7237
e-mail: rmlopez@correo.xoc.uam.mx
Fecha de recepción: 30 de marzo de 2012.
Fecha de recepción de modificaciones: 30 de julio de 2012.
Fecha de aceptación: 24 de agosto de 2012.
Resumen
Se compararon los perfiles de disolución de cuatro medicamentos genéricos de indometacina (cápsulas) y el medicamento de referencia, con el método oficial en el Aparato 1 (canastillas) y el Aparato 4 (celda de flujo continuo) de la USP. En el Aparato 1 todos los medicamentos cumplieron con el criterio farmacopeico (Q=80% en 20 min) pero los perfiles de disolución mostraron diferencia con el perfil del medicamento de referencia (f2<50), así como el tiempo medio y la eficiencia de disolución (p<0.05). En el Aparato 4 sólo en un medicamento genérico y el de referencia alcanzaron el criterio farmacopeico y sus perfiles fueron similares (f2>50). El Aparato 4 USP resultó más discriminativo al permitir diferenciar tanto la cantidad como la velocidad del proceso de disolución de indometacina en cápsulas.
Palabras clave: indometacina, cápsulas, celda de flujo continuo, Aparato 4 USP.
Abstract
Dissolution profiles of four indomethacin generic products (capsules) and the reference product were compared under pharmacopeial specifications with the USP Apparatus 1 (baskets) and the USP Apparatus 4 (flow-through cell system). All products met the dissolution criteria (Q=80 % in 20 min) with the USP Apparatus 1, but dissolution profiles of generic products differed significantly from the reference product (f2<50), as well as mean dissolution time and dissolution efficiency (p<0.05). Only one of the generic products and the reference reached dissolution criteria and their dissolution profiles were similar (f2>50) in the USP Apparatus 4. USP Apparatus 4 had more discriminative capacity to evaluate differences in both, rate and extent of indomethacin dissolution process from capsules.
Key words: indomethacin, capsules, flow-through cell, USP Apparatus 4.
Introducción
La prueba de disolución farmacopeica de las formas de dosificación sólidas y algunas semisólidas se realiza en su mayoría con los Aparatos 1 ó 2 USP (canastillas y paletas, respectivamente). Los procedimientos empleados en estos equipos han sido estandarizados mundialmente y el entorno hidrodinámico que generan sobre las formas farmacéuticas continúa siendo materia de estudio por diversos autores.1-3 A pesar de su amplio uso, ninguno de estos equipos reproduce fielmente el proceso de disolución que se lleva a cabo in vivo debido a la compleja naturaleza del tracto gastrointestinal y a los factores que lo afectan. Por otra parte y desde su introducción, el sistema de celda de flujo continuo Aparato 4 USP, se presentó como un equipo de disolución alternativo a los Aparatos 1 y 2 USP por las ventajas que sobre éstos equipos manifiesta.4-6 El Aparato 4 USP permite una extracción continua del fármaco, simulando la absorción a la circulación sistémica, al generar un flujo intermitente del medio de disolución hacia la celda en donde se encuentra la forma farmacéutica a evaluar.7 Es posible utilizar el Aparato 4 USP como un sistema abierto que trabaja bajo condiciones "sink" o de "no saturación" lo que facilita la disolución de fármacos poco solubles. Adicionalmente, el Aparato 4 USP permite el recambio continuo del medio de disolución a lo largo de la prueba en un intervalo de valores de pH de relevancia fisiológica.8
Es conocido que la absorción de fármacos poco solubles está limitada por la velocidad de disolución y tanto la formulación como el proceso de manufactura desempeñan un papel importante en la liberación completa y oportuna del principio activo a partir de la forma farmacéutica que lo contiene. De acuerdo al Sistema de Clasificación Biofarmacéutica los fármacos de baja solubilidad y alta permeabilidad pertenecen a las Clase II. Los compuestos con esta clasificación son candidatos a presentar una correlación in vitro-in vivo significativa, de ahí que la elección de las condiciones necesarias para llevar a cabo los estudios de disolución sea una acción fundamental para contar con un método capaz de discriminar entre productos con problemas potenciales de biodisponibilidad. Reportes previos demuestran que datos in vitro obtenidos en el sistema de celda de flujo continuo reflejan mejor el comportamiento in vivo de fármacos poco solubles.9-11
La indometacina es un fármaco de Clase II12 utilizado en el tratamiento de la artritis reumatoide y otras enfermedades de las articulaciones. La indometacina, al igual que la mayoría de los analgésicos anti-inflamatorios no esteroides, posee una reacción adversa irritante en el tracto gastrointestinal, debido posiblemente a su baja solubilidad y prolongado contacto con la mucosa gástrica, relacionada con la dosis y el tiempo de tratamiento.13
La prueba de disolución farmacopeica para cápsulas de indometacina indica el uso del Aparato 1 USP a 100 rpm y 750 mL de una mezcla de solución amortiguadora de fosfatos pH 7.2:agua en proporción (1:5) a 37 ± 0.5°C como medio de disolución. En estas condiciones, se debe disolver el 80% de fármaco en 20 min (Q= 80%).14 Sin embargo, la velocidad de agitación alta parece tener inconvenientes ya que se ha encontrado poca capacidad discriminativa de éste método para diferenciar entre medicamentos de indometacina.15 Diversos investigadores han evaluado la relación entre la velocidad de agitación y la biodisponibilidad y han encontrado correlación significativa para el método de canastillas sólo a una baja velocidad de agitación (55 rpm).16 Además, se ha reportado correlación in vitro-in vivo significativa con productos de indometacina de liberación inmediata17 y modificada18 únicamente con el Aparato 2 USP y con un modelo de disolución de flujo continuo.19
El Aparato 4 USP ha mostrado ser útil en el desarrollo de un método de disolución más discriminativo que el método oficial con el Aparato 2 USP para tabletas del compuesto poco soluble albendazol20 y para establecer la relación in vitro-in vivo de supositorios de paracetamol, fármaco de Clase IV.21 A pesar de las ventajas del Aparato 4 USP sobre los sistemas convencionales de vasos, la información sobre su aplicación en la evaluación de medicamentos genéricos de venta en el mercado nacional es limitada.
El objetivo del presente trabajo fue comparar las características de disolución de indometacina en cápsulas utilizando el método farmacopeico y un método alternativo en el sistema de celda de flujo continuo para valorar la aplicabilidad del Aparato 4 USP en la evaluación del proceso de disolución de medicamentos mexicanos y proponer las condiciones in vitro que permitan discriminar entre productos candidatos a presentar problemas de biodisponibilidad.
Material y método
Productos
Se utilizaron cápsulas de indometacina con dosis de 25 mg de cinco medicamentos comerciales nacionales. Los medicamentos de prueba (designados con las letras: A, B, C y D) se compararon con el producto Indocid® (designado con la letra R) indicado por la COFEPRIS como medicamento de referencia.22 Se utilizó indometacina estándar nacional de referencia (Secretaria de Salud-México). Las sales de fosfato se adquirieron de Merck-México.
Uniformidad de dosis y valoración
Las pruebas de uniformidad de dosis y valoración se realizaron a todos los productos de acuerdo a las condiciones especificadas en la FEUM 10a Edición.14
Validación del método de disolución
Previo al estudio de disolución, se llevó a cabo la validación del método analítico para cuantificar indometacina en el medio de disolución. El método analítico se validó con el fármaco y con el medicamento siguiendo los lineamientos del proyecto norma oficial mexicana NOM-177-SSA1-2008.23
Para demostrar la linealidad con el fármaco, se prepararon tres curvas de calibración con indometacina disuelta en una mezcla de solución amortiguadora de fosfatos pH 7.2:agua (1:5) a las concentraciones de: 1.56, 3.12, 6.25, 12.5, 25 y 50 μg/mL y se determinó la absorbancia de cada solución a 318 nm en celdas de cuarzo de 1 cm. Los datos se ajustaron por mínimos cuadrados a una función lineal y se calcularon los coeficientes de la regresión, el análisis de varianza (ANADEVA) de la regresión y el intervalo de confianza al 95% (IC95%) para el valor del intercepto. La precisión con el fármaco se demostró con el cálculo del coeficiente de variación (CV) del factor respuesta. Para evaluar la influencia del filtro se prepararon dos series de soluciones de indometacina en el medio de disolución en concentraciones de 3 y 30 μg/mL. Una serie se filtró en seis ocasiones a través de filtros de nylon Sun Sri® de 0.45 μm y la otra serie se filtró seis veces utilizando filtros de nitrocelulosa Millipore® de 0.45 μm. Las muestras se analizaron a 318 nm en celdas de cuarzo de 1 cm antes y después de filtrar.
La linealidad con el medicamento se determinó preparando curvas de calibración preparadas con el polvo de las cápsulas a las concentraciones de: 1.6, 6.6, 13.3, 33.3 y 40 μg/mL (equivalentes al 5, 20, 40, 100 y 120% de la dosis). Este procedimiento se realizó por duplicado con todos los medicamentos en estudio. Los datos se ajustaron por mínimos cuadrados y se calcularon los coeficientes de la regresión. Se realizó el ANADEVA de la regresión y se calcularon los IC95% para los valores de la pendiente y el intercepto. La exactitud con el medicamento se evaluó calculando el promedio del porcentaje cuantificado de los datos anteriores. La precisión con el medicamento se determinó con el cálculo del CV del porcentaje cuantificado (repetibilidad) y el análisis por duplicado de una muestra homogénea de las cápsulas con el equivalente al 100% de la dosis por dos analistas diferentes (reproducibilidad). Con estos resultados se calculó el CV global del porcentaje de fármaco cuantificado.
Perfiles de disolución en el Aparato 1 USP
Los estudios de perfiles de disolución de indometacina se determinaron de acuerdo al método de disolución para cápsulas descrito en la FEUM 10a Ed.14 Aparato 1 USP a 100 rpm con 12 unidades de cada producto utilizando un disolutor Marca Hanson Research modelo 72RL (Northridge, EUA). En cada uno de los vasos se transfirieron 750 mL de medio de disolución [una mezcla de solución amortiguadora de fosfatos pH 7.2:agua (1:5)] a 37 ± 0.5°C previamente desgasificado con vacío.
Se tomaron alícuotas filtradas de 5 mL a través de membranas de nitrocelulosa de 0.45 μm cada cinco min durante los primeros 30 min y a los 45 y 60 min, sin reposición de medio de disolución. La cantidad disuelta de indometacina se determinó en un espectrofotómetro UV/Vis Perkin Elmer, modelo Lambda 2S (Überlingen, Alemania) a 318 nm en celdas de cuarzo de 1 cm con referencia a una curva de calibración de indometacina estándar disuelta en el medio de disolución preparada el mismo día del análisis.
Perfiles de disolución en el Aparato 4 USP
Con el fin de seleccionar las condiciones apropiadas para determinar los perfiles de disolución de indometacina en el Aparato 4 USP, se llevó a cabo el estudio de disolución con el medicamento de referencia en un disolutor automatizado de celda de flujo continuo automatizado Marca Sotax, modelo CE6 (Basilea, Suiza) acoplado a un espectrofotómetro Perkin Elmer modelo Lambda 10 (Überlingen, Alemania). En el estudio se emplearon celdas de 22.6 mm (d.i.) y se evaluaron dos proporciones de la mezcla solución amortiguadora de fosfatos pH 7.2:agua (1.2 y 1:5) a 37 ± 0.5°C y cuatro diferentes velocidades de flujo laminar (12, 16, 18 y 20 mL/min) como se indica en la Tabla 1.
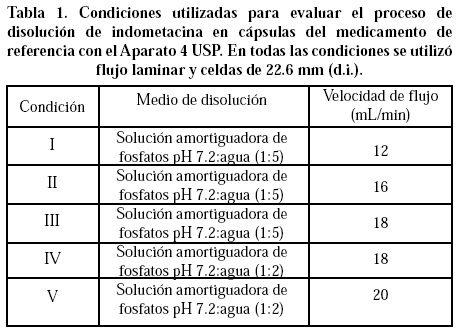
El equipo se programó para tomar alícuotas filtradas a través de membranas de nitrocelulosa de 0.45 μm cada cinco min durante 60 min. La cantidad disuelta de indometacina se determinó a partir de la absorbancia de las muestras a 318 nm y una curva de calibración de indometacina estándar disuelta en el medio de disolución preparada el mismo día del análisis.
Las condiciones de disolución del medicamento de referencia se seleccionaron con base en el criterio de alcanzar un porcentaje disuelto de indometacina igual a 80% a los 20 min (especificación farmacopeica) y un CV< 20% en el primer tiempo de muestreo y < 10% en los tiempos de muestreo restantes (FDA).23,24
Finalmente se estudiaron los perfiles de disolución de todos los medicamentos de prueba bajo la condición seleccionada y previamente descrita.
Análisis de datos
Los perfiles de disolución de indometacina a partir de todos los medicamentos de prueba (en ambos aparatos) se compararon con el perfil de disolución del medicamento de referencia utilizando el factor de similitud f2 calculado de acuerdo a la siguiente ecuación:25

Donde n es el número de puntos de tiempo utilizado para evaluar la cantidad de indometacina disuelta; Rj es el porcentaje promedio de indometacina disuelta en un momento específicoj a partir del medicamento de referencia y Pj es el porcentaje promedio de indometacina disuelta en un momento específico j a partir del medicamento de prueba.
Adicionalmente, se calcularon los parámetros modelo independiente: tiempo medio de disolución (TMD)26 y eficiencia de la disolución (ED).27
Los valores obtenidos para los medicamentos de prueba, se compararon con los valores del medicamento de referencia mediante un ANADEVA de una vía seguido de una prueba de comparaciones múltiples de Dunnett o Dunnett T3 según fuera apropiado. Las diferencias se consideraron significativas si p< 0.05.
Finalmente con el objetivo de evaluar la cinética de liberación de indometacina, bajo los ambientes hidrodinámicos generados por los Aparatos 1 y 4 USP, los datos de disolución se ajustaron por regresión no lineal a los siguientes modelos cinéticos: Primer orden, Hixson-Crowell, Higuchi, Weibull, Logístico y Makoid-Banakar.
El modelo de mejor ajuste se eligió utilizando criterios estándar como el valor más alto de coeficiente de determinación ajustado (R2ajustado) y el valor más bajo de criterio de información de Akaike (AIC, por sus siglas en inglés). Se estimaron valores de TMD con el modelo cinético seleccionado y se compararon con un ANADEVA de una vía seguido de una prueba de comparaciones múltiples de Dunnett o Dunnett T3 según fuera apropiado.
El ajuste de los datos se realizó con el programa DDSolver28 y las comparaciones estadísticas con el programa SPSS (versión 17.0). Las diferencias se consideraron significativas si p< 0.05.
Resultados y discusión
Uniformidad de dosis y valoración
Todos los medicamentos cumplieron las pruebas de uniformidad de dosis y valoración especificadas en la FEUM (Tabla 2). Los resultados quedaron incluidos dentro del criterio farmacopeico el cual consiste en un intervalo de 85-115% para la prueba de uniformidad de dosis y de 85-110% para la valoración.

Validación del método de disolución
Los resultados de la validación con el fármaco mostraron que el sistema analítico para cuantificar indometacina en el medio de disolución fue lineal en el intervalo de 1.56 a 50 μg/mL con un coeficiente de determinación > 0.999 y un error relativo debido a la regresión menor de 2%. La ecuación de regresión calculada con los datos promedio fue y = 0.020x + 0.0002 (p< 0.05). El IC95% calculado para el valor del intercepto fue -0.0025 a 0.0029 y para la pendiente 0.0198 a 0.0201.
La precisión con el fármaco presentó un CV del factor respuesta de 0.78%. La evaluación de la influencia del filtro permitió identificar a los filtros de nitrocelulosa como los más adecuados para el estudio de disolución ya que la diferencia absoluta en el promedio del porcentaje de fármaco adherido al filtro fue 1.6%, mientras que con los filtros de nylon fue de 4.3%.
Los resultados de la validación con los medicamentos mostraron una linealidad apropiada con coeficientes de correlación > 0.99 (p< 0.05) y errores relativos debido a la regresión menores de 2%. Los valores de cero y uno quedaron incluidos dentro de los IC95% para las ordenadas al origen y las pendientes, respectivamente.
Con los datos de linealidad del método, el calculo de los porcentajes promedio cuantificados se encontraron entre el 97-103% lo que demostró una exactitud adecuada. La precisión con los medicamento se demostró al calcular los CV del porcentaje cuantificado que en todos lo casos fue menor a 3%. El método se consideró selectivo ya que cumplió con los criterios de linealidad, exactitud y precisión.
Selección de las condiciones de prueba en el Aparato 4 USP
Únicamente con la Condición III [solución amortiguadora de fosfatos pH 7.2:agua (1:5) y velocidad de flujo de 18 mL/min] se alcanzó un nivel de fármaco disuelto mayor al 80% a los 20 min y los CV cumplieron con los criterios establecidos previamente (Tabla 3). Con el resto de las condiciones evaluadas el CV alcanzó un valor de hasta 35% para el primer tiempo de muestreo y hasta 27% para los tiempos restantes por lo cuál se eligió la Condición III para comparar los perfiles de disolución de los medicamentos genéricos en el Aparato 4 USP.

Los perfiles de disolución obtenidos en ambos equipos, se presentan en la Figura 1 (A y B). En ella se observa que todos los medicamentos estudiados con el Aparato 1 USP cumplen con la especificación farmacopeica de Q requerida (80% de indometacina disuelta a los 20 min); mientras que con el Aparato 4 USP únicamente el medicamento de referencia y el medicamento de prueba C cumplieron con la especificación (Q= 91 y 80%, respectivamente).
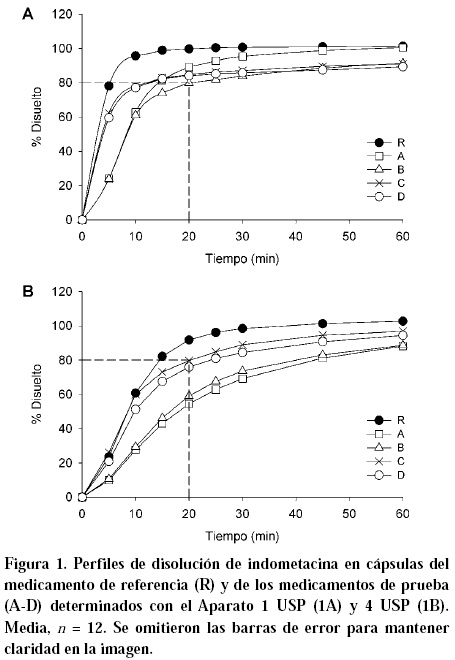
En la Figura 1 se aprecia la diferencia en el proceso de disolución de los medicamentos de prueba en relación con el medicamento de referencia en ambos aparatos. Al utilizar el Aparato 1 USP el medicamento de referencia mostró un perfil correspondiente a una completa y muy rápida disolución disolviéndose el 100% de fármaco en 15 min, mientras que únicamente del medicamento de prueba A se disolvió el 100% de indometacina hasta los 60 min. El resto de los medicamentos de prueba alcanzaron a liberar hasta el 90% de fármaco al término de la prueba. Al utilizar el Aparato 4 USP todos los medicamentos mostraron una velocidad de disolución más lenta que la encontrada con el uso del Aparato 1 USP. Con el sistema de celda de flujo continuo el medicamento de referencia mostró nuevamente un perfil de disolución correspondiente a una rápida disolución al disolverse el 100% de fármaco a los 30 min, mientras que la velocidad de disolución fue menor para el resto de los medicamentos ya que únicamente del medicamento de prueba C se disolvió el 80% de indometacina a los 20 min y la cantidad disuelta a los 60 min fue de 96%. Por otro lado, bajo las mismas condieiones los medicamentos de prueba A, B y D no cumplieron con la especificación farmacopeica de Q y la cantidad total de indometacina liberada al término de la prueba fue menor de 96%.
Los perfiles de disolución de todos los medicamentos de prueba obtenidos bajo las condiciones del método oficial (Aparato 1 USP) no se consideraron similares con el perfil del medicamento de referencia al calcular el factor de similitud (f2 < 50), Figura 2.

Estos resultados concuerdan con un reporte previo en donde cápsulas de indometacina evaluadas bajo las condieiones indicadas en la farmacopea alcanzaron el criterio de disolución y los perfiles de disolución de dos medicamentos de prueba no resultaron similares al perfil de disolución del medicamento de referencia.15
En el sistema de celda de flujo continuo, sólo el perfil de disolución de indometacina del medicamento de prueba C se consideró similar al perfil de disolución del medicamento de referencia (f2 = 54).
Desde el punto de vista de calidad el método de disolución oficial de canastillas no mostró suficiente capacidad discriminativa porque aunque los perfiles de disolución de todos los medicamentos de prueba no fueron similares al perfil del medicamento de referencia todos los medicamentos utilizados alcanzaron el criterio farmacopeico de Q. Por el contrario, con el método propuesto en el Aparato 4 USP únicamente el perfil de disolución del medicamento de prueba C fue similar al perfil del medicamento de referencia (f2> 50) y ambos medicamentos alcanzaron la especificación farmacopeica de Q.
Las diferencias encontradas en ambos aparatos se pueden explicar por las condiciones hidrodinámicas que caracterizan al sistema de celda de flujo continuo el cual no utiliza mecanismos de agitación, por lo que la forma de dosificación y las partículas de fármaco están expuestas continuamente a un flujo laminar homogéneo, similar al ambiente natural del tracto gastrointestinal, lo que provoca un patrón de disolución diferente al sistema convencional de vasos.29
La prueba de disolución es una prueba de control de calidad que provee información sobre el grado de disolución de un fármaco a un tiempo específico. Esta prueba es útil como medida de control de calidad entre lotes o después de un cambio en el proceso de manufactura. Sin embargo, y especialmente para fármacos de Clase II, es necesario determinar los perfiles de disolución para establecer una posible correlación con el desempeño de la formulación in vivo. Adicionalmente, se debe mencionar que el método usado en la prueba de disolución, aún cuando se utilice para determinar la disolución en un solo punto, debe ser capaz de discernir las características de disolución del fármaco a partir de diferentes formulaciones o de diferentes lotes de un mismo producto.
En el presente estudio al utilizar el método propuesto en el Aparato 4 USP fue posible diferenciar adecuadamente las características de disolución de los medicamentos genéricos en comparación con el medicamento de referencia tanto en la cantidad como en la velocidad de disolución, por lo que se puede considerar como un método más discriminativo.
Además del cálculo del factor f2, se determinaron los parámetros modelo independiente TMD y ED con el fin de comparar las características de liberación de los medicamentos de prueba respecto al medicamento de referencia. Ambos parámetros son esenciales para el establecimiento de algún nivel de correlación in vitro-in vivo?30 El nivel B de correlación se basa en la comparación de parámetros calculados con la teoría de "momentos estadísticos"; en el aspecto de disolución, con el valor del TMD. El nivel C requiere el cálculo de algún parámetro in vitro que exprese de manera global la disolución del fármaco, como es el caso de la ED. Este parámetro relaciona el área bajo la curva del perfil de disolución del producto en estudio respecto al área total del rectángulo formado por la disolución teórica del 100% de la dosis y el intervalo de tiempo de la prueba.
Los valores promedio ± error estándar (EE) de los parámetros TMD y ED calculados a partir de los datos de disolución de todos los medicamentos en estudio se presentan en la Tabla 4. El ANADEVA seguido de la prueba de comparaciones múltiples de Dunnett reveló diferencia significativa en prácticamente todos los valores de los parámetros, en ambos aparatos (p< 0.05).

Finalmente, al ajustar los datos obtenidos en ambos aparatos a los diferentes modelos cinéticos de disolución, se encontró que los mayores valores R2ajustado así como los menores valores de AIC se obtuvieron al utilizar la función de Weibull (Tabla 5) cuya expresión es la siguiente:28


Donde F es el porcentaje de fármaco disuelto en función de tiempo t, Fmáx es el porcentaje máximo de fármaco disuelto a tiempo infinito; α es el factor de escala del proceso, β es el factor de forma del proceso y Ti es un parámetro de localización del tiempo en que el fármaco comienza a disolverse.
Los datos de las cápsulas evaluadas en los Aparatos 1 y 4 USP ajustaron apropiadamente al modelo de Weibull, excepto los datos del medicamento de prueba B en el Aparato 4 USP que ajustaron mejor al modelo Logístico dado por la ecuación:28

donde los parámetros tienen el mismo significado que en el modelo de Weibull.
Los valores de TMD calculados con el modelo cinético se utilizaron para comparar los perfiles de disolución de los medicamentos de prueba con el perfil del medicamento de referencia. Los valores obtenidos para los parámetros del modelo cinético y del TMD derivados del mismo se presentan en la Tabla 6. Se encontró diferencia significativa en los valores del TMD de los medicamentos de prueba A y B con respecto al valor del medicamento de referencia en ambos equipos así como con los valores del TMD del medicamento de prueba D en el Aparato 4 USP (p< 0.05). Con los resultados en el sistema de celda de flujo continuo únicamente el medicamento de prueba C (de todos los medicamentos evaluados en el este equipo) confirma su similitud con el proceso de disolución del medicamento de referencia.

Algunos autores reportan ajustes de perfiles de disolución de productos de indometacina a diferentes modelos cinéticos: orden-cero para tabletas de liberación sostenida,31 orden-uno para gránulos de la sal sódica de indometacina cubiertos por diferentes materiales32 y Higuchi para microesferas lipofílicas de liberación sostenida.33 Estas diferencias son explicables ya que los sistemas mencionados se diseñan con el fin de modificar el proceso de liberación del fármaco, el cuál será determinado por los materiales utilizados en la formulación. Por el contrario, tratándose de formas de dosificación de liberación inmediata (como es el caso de los medicamentos utilizados en este trabajo) la cinética de liberación generalmente se puede representar mediante la función de Weibull. Este es el primer estudio que compara los perfiles de disolución de cápsulas de indometacina en los Aparatos 1y4 USP, utilizando métodos modelo dependiente e independiente, con productos de venta en el mercado nacional.
Considerando los resultados obtenidos con el sistema de celda de flujo continuo Aparato 4 USP, es posible mencionar que las diferencias observadas en el proceso de disolución in vitro pueden presentar implicaciones concernientes a la equivalencia de los medicamentos genéricos de indometacina disponibles en México.
Conclusiones
El presente estudio revela diferencias significativas en la velocidad y el grado de disolución de la indometacina a partir de los medicamentos genéricos estudiados. El Aparato 4 USP, bajo las condiciones descritas, es una opción adecuada para evaluar los perfiles de disolución de la indometacina en cápsulas ya que resultó ser una herramienta sensible y discriminatoria para caracterizar el proceso de disolución de los medicamentos utilizados. Sería conveniente realizar estudios in vivo para establecer la capacidad predictiva de la metodología de disolución propuesta.
Agradecimientos
Los autores agradecemos a los QFB Heberto Gutiérrez y Julio César Rodríguez su apoyo técnico.
Referencias
1. Bai G, Wang Y, Armenante PM. Velocity profiles and shear strain rate variability in the USP Dissolution Testing Apparatus 2 at different impeller agitation speeds. Int J Pharm. 2011; 403:1-14. [ Links ]
2. Gray V, Kelly G, Xia M, Butler C, Thomas S, Mayock S. The science of USP 1 and 2 dissolution: present challenges and future relevance. Pharm Res. 2009; 26:1289-1302. [ Links ]
3. Mona AM, Abdel-Mottaleb MM, Lamprecht A. Standardized in vitro drug release for colloidal drug carriers using modified USP dissolution apparatus 1. Drug Dev Ind Pharm. 2011; 37:178-184. [ Links ]
4. Chevalier E, Viana M, Artaud A, Chomette L, Haddouchi S, Devidts G, Chulia D. Comparison of three dissolution apparatuses for testing calcium phosphate pellets used as ibuprofen delivery systems. AAPS PharmSciTech. 2009; 10:597-605. [ Links ]
5. Greco K, Bergman TL, Bogner R. Design and characterization of a laminar flow-through dissolution apparatus: comparison of hydrodynamic conditions to those of common dissolution techniques. Pharm Dev Technol. 2011; 16:75-87. [ Links ]
6. Shiko G, Gladden LF, Sederman AJ, Connolly PC, Butler JM. MRI studies of the hydrodynamics in a USP 4 dissolution testing cell. J Pharm Sci. 2011; 100:976-991. [ Links ]
7. Qureshi SA, Caillé G, Brien R, Piccirilli G, Yu V, Mc Gilveray IJ. Application of flow-through dissolution method for evaluation of oral formulations of nifedipine. Drug Dev Ind Pharm. 1994; 20:1869-1882. [ Links ]
8. Zhang GH, Vadino WA, Yang TT, Cho WP, Chaudry IA. Evaluation of the flow-through cell dissolution apparatus: effects of flow rate, glass beads and tablet position on drug release from different type of tablets. Drug Dev Ind Pharm. 1994; 20:2063-2078. [ Links ]
9. Emara LH, El-Menshawi BS, Estefan MY. In vitro-in vivo correlation and comparative bioavailability of vincamine in prolonged-release preparations. Drug Dev Ind Pharm. 2000; 26:243-251. [ Links ]
10. Jinno J, Kamada N, Miyake M, Yamada K, Mukai T, Odomi M, Toguchi H, Liversidge GG, Higaki K, Kimura T. In vitro-in vivo correlation for wet-milled tablet of poorly water-soluble cilostazol. J Control Release 2008; 130:29-37. [ Links ]
11. Okumu A, DiMaso M, Löbenberg R. Dynamic dissolution testing to establish in vitro/in vivo correlations for montelukast sodium, a poorly soluble drug. Pharm Res. 2008; 25:2778-2785. [ Links ]
12. Clarysse S, Psachoulias D, Brouwers J, Tack J, Annaert P, Duchateau G, Reppas C, Augustijns P. Postprandial changes in solubilizing capacity of human intestinal fluids for BCS class II drugs. Pharm Res. 2009; 26:1456-1466. [ Links ]
13. Hardman JG, Limbird LE, Gilman A. Editores. Goodman & Gilman Las Bases Farmacológicas de la Terapéutica, 10a Ed. Vol. I. México McGraw-Hill Interamericana Editores SA de CV; 2003, p. 697-717. [ Links ]
14. Farmacopea de los Estados Unidos Mexicanos. 10a Ed. Secretaría de Salud México 2011. p. 1844-1846. [ Links ]
15. Medina JR, Rodríguez JC. Liberación de indometacina a partir de medicamentos de prueba (cápsulas) en el sistema de disolución convencional de vasos. inFÁRMAte. 2006; Año 2, No. 7. [ Links ]
16. Shah VP, Gurbarg M, Noory A, Dighe S, Skelly JP. Influence of higher rates of agitation on release patterns of immediate-release drug products. J Pharm Sci. 1992; 81:500-503. [ Links ]
17. Aoyagi N, Ogata H, Kaniwa N, Ejima A. Bioavailability of indomethacin capsules in humans (II): correlation with dissolution rate. Int J Clin Pharmacol Ther Toxicol. 1985; 23:529-534. [ Links ]
18. Tandt GL, Stubbs C, Kanfer I. Use of dissolution rate data to account for differences in the absorption profiles of two controlled/modified-release capsule dosage forms of indomethacin in humans volunteers. Int J Pharm. 1994; 104:11-17. [ Links ]
19. Herzfeldt CD, Lambov N. In vitro/in vivo-correlation of indomethacin absorption kinetics based on a flow-through dissolution model. Acta Pharm Technol. 1986; 32:43-48. [ Links ]
20. Hurtado M, Vargas Y, Domínguez-Ramírez AM, Cortés AR. Comparison of dissolution profiles for albendazole tablets using USP apparatus 2 and 4. Drug Dev Ind Pharm. 2003; 29:777-783. [ Links ]
21. Therapeutic System Research Laboratories TSRL inc. Biopharmaceutics Classification System (BCS) Results. http://69.20.123.154/services/bcs/results.cfm Acceso 13 Jul 2012. [ Links ]
22. Relación de Medicamentos de Referencia. Comisión Federal para la Protección contra Riesgos Sanitarios. México. Enero 2012. http://www.cofepris.gob.mx/AS/Documents/RegistroSanitarioMedicamentos/Referencia.pdf Acceso 20 Feb 2012. [ Links ]
23. Proyecto Norma Oficial Mexicana NOM-177-SSA1-2008. Diario Oficial de la Federación, México D.F., May 7 2008; 44-67. [ Links ]
24. Food and Drug Administration & Center for Drug Evaluation and Research Guidance for Industry-Dissolution Testing of Immediate Release Solid Dosage Forms 1997. [ Links ]
25. Moore JW, Flanner HH. Mathematical comparison of dissolution profiles. Pharm Technol. 1996; 20:64-68. [ Links ]
26. Podczeck F. Comparison of in vitro dissolution profiles by calculating mean dissolution time (MDT) or mean residence time (MRT). Int J Pharm. 1993; 97:93-100. [ Links ]
27. Khan KA. The concept of dissolution efficiency. J Pharm Pharmacol. 1975; 27:48-49. [ Links ]
28. Zhang Y, Huo M, Zhou J, Zou A, Li W, Yao C, Xie S. DDSolver: an add-in program for modeling and comparison of drug dissolution profiles. AAPS J. 2010; 12:263-271. [ Links ]
29. Langenbucher F, Benz D, Kurth W, Moller H, Otz M. Standardized flow-cell method as an alternative to existing pharmacopoeial dissolution testing. Pharm Ind. 1989; 51:1276-1281. [ Links ]
30. Cardot JM, Beyssac E, Alric M. In vitro-in vivo correlation: importance of dissolution in IVIVC. Dissolution Technol. 2007; 14:15-19. [ Links ]
31. Efentakis M, Buckton G. Modeling drug release from hydrophobic matrices by use of thermodynamic activation parameters. Int J Pharm. 1990; 60:229-234. [ Links ]
32. Eerikainen S, Yliruusi J, Laakso R. Behavior of the sodium salt of indomethacin in the cores of film coated granules containing various fillers. Int J Pharm. 1991; 71:201-211. [ Links ]
33. Karasulu E, Karasulu HY, Ertan G, Kirilmaz L, Guneri T. Extended release lipophilic indometachin microspheres: formulation factors and mathematical equations fitted drug release rates. Eur J Pharm Sci. 2003; 19:99-104. [ Links ]














