Introducción
Los estuarios, manglares, praderas de pastos marinos y lagunas costeras se consideran importantes sitios de refugio para diversos organismos marinos durante su fase juvenil (Tanaka et al., 2011), ya que les brindan abundante fuente de alimento y protección contra los depredadores durante sus primeras etapas de vida (Nagelkerken et al., 2002). Muchos peces arrecifales aprovechan la conectividad de estos ecosistemas a lo largo de su desarrollo ontogenético, y van desplazándose de manera secuencial en ellos conforme sus necesidades alimenticias cambian, lo cual constituye una migración ontogenética (Cocheret de la Morinière et al., 2003; Nagelkerken y van der Velde, 2004).
El Sistema Arrecifal Mesoamericano (SAM) es de gran importancia ecológica y económica debido a su diversidad biológica (Carrillo et al., 2015). Además, tiene conectividad biológica con distintos hábitats, por ejemplo con la bahía de Chetumal/Corozal. Uno de los peces que habitan en esta área es Sphyraena barracuda, un depredador que, cuando juvenil, utiliza las zonas con vegetación, generalmente manglares y praderas de pastos marinos, como sitio de crianza; pasa los primeros años de su vida en estos sitios, antes de desplazarse al arrecife o al mar abierto (D’Alessandro et al., 2011; de Sylva, 1963).
La barracuda es, junto con tiburones y meros, un depredador tope de estuarios y arrecifes (Hooker et al., 2007). En el sur de Quintana Roo y Belice es un recurso comercial y turístico, parte de la pesca deportiva y artesanal, generalmente capturado con redes de atajo en verano y otoño (Medina-Quej et al., 2009).
Los isótopos estables se han utilizado en ecología trófica en las últimas décadas debido a sus ventajas sobre los análisis que exclusivamente usan identificación de contenido estomacal (Boecklen et al., 2011), ya que para estos últimos se requiere un tamaño de muestra mayor y muchas veces se encuentran demasiados estómagos vacíos (Cortés, 1997). Además, los análisis de isótopos estables solo requieren un poco del tejido del animal u organismo de interés; sin embargo, no identifican de qué presas específicas se está alimentando el organismo, por lo que es recomendable integrar ambos análisis en un estudio de ecología trófica (Post, 2002; Schiffman et al., 2012).
La firma isotópica de δ13C ayuda a identificar el lugar donde el animal se alimentó en las semanas o meses previos (Harrigan et al., 1989). Por su parte, la señal de δ15N varía entre niveles tróficos por la acumulación de nitrógeno en proteínas, de modo que es un buen sucedáneo de la posición trófica de un organismo (Fry et al., 1982; Post, 2002).
El objetivo del presente estudio es evaluar si hay factores tróficos (presas preferenciales, señal isotópica) relacionados con el movimiento entre hábitats de la barracuda (S. barracuda) en el sur del Caribe mexicano y la bahía de Chetumal. Se examinará también si estos cambios de alimentación y de hábitat corresponden con cambios en la talla del pez.
Materiales y métodos
El estudio se llevó a cabo en la bahía de Chetumal/Corozal y la costa sur del Caribe mexicano de Mahahual a Xcalak, en 14 localidades. Éstas se clasificaron en 3 zonas: bahía o zona dentro (D), canal de Zaragoza o zona intermedia (I) y laguna arrecifal o zona fuera (F) (Fig. 1).
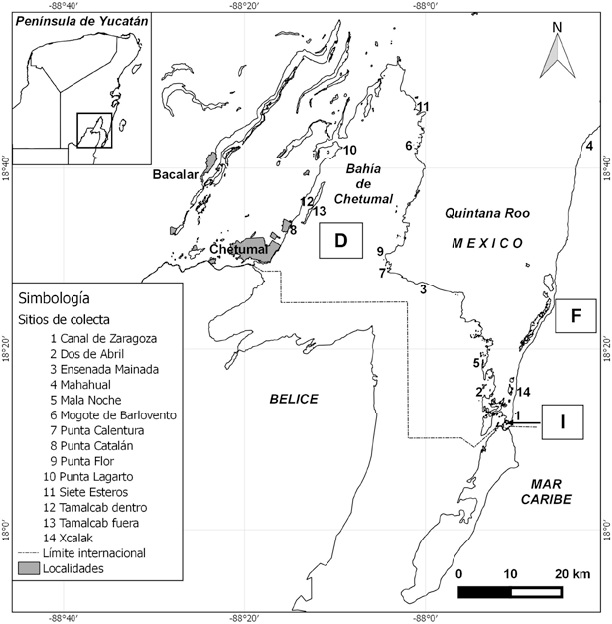
Figura 1 Ubicación del área de estudio y puntos de muestreo de los organismos juveniles y adultos de Sphyraena barracuda.
La bahía de Chetumal/Corozal (zona D) se ubica en la porción sur del Caribe mexicano, norte de Belice. Debido a su alta diversidad de especies animales y vegetales, se considera un área marina prioritaria (Arriaga-Cabrera et al., 1998) y el estado de Quintana Roo la ha protegido como “santuario del manatí”. Se pueden encontrar en ella 3 especies de mangle, 3 de mamíferos acuáticos, 32 de reptiles y varias de anfibios. Es un cuerpo de agua muy extenso, somero y oligotrófico, con agua salobre en su mayor parte y dulce en la desembocadura del río Hondo y otros sistemas menores; el intercambio de agua con el mar es limitado, pero el sistema es internamente dinámico por el movimiento que producen los vientos alisios, predominantes. La bahía está rodeada por humedales, selvas bajas y medianas, y manglares (Espinoza-Ávalos et al., 2009).
En la costa adyacente del Caribe (zona F), entre la localidad de Mahahual y el Parque Nacional Arrecifes de Xcalak, se encuentran diversos tipos de ecosistemas interdependientes, tales como arrecifes de coral, humedales, lagunas costeras, playas y selvas, las cuales se encuentran en un estado de conservación relativamente bueno (Conanp, 2004). También esta región ha sido considerada un área marina prioritaria (Arriaga-Cabrera et al., 1998).
Finalmente, el canal de Zaragoza (zona I) comunica entre sí a las 2 anteriores (Fig. 1). Su flujo es generalmente de la bahía hacia el Caribe, aunque la marea lo puede revertir; la salinidad tiende a ser cercana a la marina. Sus márgenes tienen alguna vegetación de manglar, pero en gran parte son de roca y arena expuestas, debido al carácter artificial de esta vía (Espinoza-Ávalos et al., 2009).
Se realizaron 2 salidas prospectivas y posteriormente 5 expediciones para recolecta de ejemplares y muestras. En las 2 primeras, marzo y noviembre de 2015, se obtuvo material sólo de la zona D (Punta Catalán y Punta Calentura); en abril de 2016 se visitaron todas las zonas (Fig. 1); en febrero y mayo de 2016 se realizó esfuerzo adicional en la zona F. La pesca se realizó en 4 horarios: madrugada (5:00-7:00 am), mañana (8:00 am a 12:00 pm), mediodía (12:00 pm a 4:00 pm) y tarde (4:00 a 7:00 pm). En cada ocasión, se capturaron juveniles y adultos de S. barracuda con chinchorros playeros (25 m de largo, 2 m de caída, 1 cm de luz de malla, con bolsa, hilo alquitranado), trampas de atajo (generalmente con una barrera de 20-30 m desde la orilla y un encierro de unos 10-15 m de diámetro, cercado con malla de gallinero, 1 a 1.5 m de caída y 2 cm de luz), atarrayas (3 m de diámetro y 1.3 cm de luz de malla, hilo monofilamento) y trasmallos (dejados operando toda la noche, típicamente 100 m de largo, 3 m de caída, luz de malla de 10 cm). También se obtuvieron peces de diversas especies y distintos niveles tróficos, moluscos y crustáceos, así como muestras de hojas de Rhizophora mangle y Thalassia testudinum de las 3 zonas (D, F, I) para obtener una representación de las señales isotópicas del área de estudio. Los peces quedaron depositados en la colección ictiológica de ECOSUR, unidad Chetumal.
Los ejemplares de barracuda se midieron mediante un ictiómetro hasta décimas de centímetro (excepto los de talla grande, con cinta métrica, hasta centímetros) y se clasificaron según su longitud patrón en 3 categorías: chicos (CH), hasta 21 cm; medianos (M), entre 21.1 y 49 cm; y grandes (G), de 50 cm o más. Luego se extrajeron los estómagos, los cuales fueron rotulados y colocados en bolsas con etanol al 96%. A los organismos de tamaño mayor a 2 cm de longitud (peces, moluscos, crustáceos) se les extrajo un trozo de tejido muscular, mientras que los crustáceos, moluscos más pequeños y las muestras de vegetales, se conservaron enteras en bolsas de plástico; este material (tejidos y organismos enteros) se trasladó al laboratorio en hielo y allí se secó en un horno a 60 °C por 48 h. Posteriormente, se pulverizó en un mortero de porcelana, se colocó en viales rotulados, y se envió a un laboratorio certificado de isótopos estables (Environmental Isotope Laboratory, Universidad de Arizona) para obtener las proporciones isotópicas δ13C y δ15N.
Con las proporciones de cada elemento se realizaron sendos Anova de una vía (zona, F, D o I) para la mayoría de los taxones y de 2 vías (sitio y clase de talla) para la barracuda, previa comprobación de homoscedasticidad y normalidad (programa Statgraphics vers. 5.0.1.0: StatPoint Technologies, 2010). La expectativa era reconocer una firma isotópica de δ13C correspondiente a la bahía, a partir de las hojas de R. mangle allí recolectadas, y otra correspondiente al mar Caribe adyacente, con la obtenida de T. testudinum. Con la señal δ15N se caracterizó el nivel trófico de los organismos, como un dato adicional para distinguir el uso de recursos tróficos por parte de las barracudas según la talla y hábitat. Los resultados se representaron mediante gráficas δ13C vs. δ15N.
El contenido estomacal se identificó cuando el grado de digestión lo permitió. Se calculó también el índice de vacuidad, es decir, el porcentaje de estómagos vacíos. Estos datos se compararon contra la hipótesis nula de porcentajes invariantes mediante pruebas de c2, con p < 0.05 como criterio de significancia, mediante el programa mencionado.
Resultados
Se capturaron 116 especímenes de barracuda, de los cuales 18 se clasificaron como chicos, 37 medianos, y 61 grandes. Los organismos grandes sólo se registraron en la zona F, y en la zona I sólo hubo ejemplares medianos; las tallas chicas y medianas predominaron en la zona D, aunque también se encontraron en la F (Tabla 1). Además, se obtuvieron 45 muestras de peces (sin contar S. barracuda), crustáceos y moluscos, así como 2 muestras vegetales, R. mangle en el interior de la bahía de Chetumal y T. testudinum en Mahahual (Tabla 2).
Tabla 1 Longitud patrón (LP) mínima y máxima (mediana, entre paréntesis; en cm), por horario (ver texto), clase de talla y zona de captura de Sphyraena barracuda en la bahía de Chetumal/Corozal y el mar Caribe adyacente. Zonas: D, dentro de la bahía; I, intermedia (canal de Zaragoza); F, fuera de la bahía (costa del Caribe). Clases de talla: (CH)ica, (M)ediana, (G)rande.
| LP | Horario | Talla | Número de muestras | Sitios de captura | Zona |
| 29.0-49.0 (41.2) | Mediodía | M | 22 | Punta Flor | D |
| 13.1-19.2 (17.0) | Mediodía | CH | 9 | Mala Noche, Tamalcab, Punta Lagarto | D |
| 13.0-20.5 (19.3) | Tarde | CH | 7 | Siete Esteros, Mogote Barlovento, Punta Catalán | D |
| 23.5-31.5 (29.4) | Mediodía | M | 4 | Tamalcab, Punta Catalán, Ensenada Mainada, Punta Flor |
D |
| 21.2-30.2 (23.5) | Tarde | M | 6 | Siete Esteros, Mogote Barlovento, Punta Catalán, Dos de Abril |
D |
| 20.7 | Mediodía | CH | 1 | Xcalak | F |
| 90.0-190.0 (111.0) | Madrugada | G | 61 | Mahahual | F |
| 97 | Madrugada | M | 1 | Mahahual | F |
| 29.0-34.0 (32.0) | Mediodía | M | 4 | Canal de Zaragoza | I |
Tabla 2 Firmas isotópicas (‰) de los organismos de especie diferente a Sphyraena barracuda: valores mínimo y máximo (mediana entre paréntesis). Se indica la zona de captura: D, dentro de la bahía; I, intermedia (canal de Zaragoza); F, fuera de la bahía (costa del Caribe).
| Taxón | Zona | Tamaño de muestra | δ15N | δ13C |
| Peces | ||||
| Achirus lineatus | D | 3 | 13.2-13.4 (13.2) | -21.7 - -21.5 (-21.7) |
| Caranx hippos | F | 3 | 9.4-11.9 (11.4) | -12.5 - -10.4 (-11.3) |
| Chriodorus atherinoides | D | 1 | 12.1 | -15.6 |
| Floridichthys polyommus | F | 2 | 8.6-11.6 (10.1) | -16.3 - -14.3 (-15.3) |
| Haemulon sciurus | F | 3 | 7.6-8.3 (7.8) | -12.4 - -10.8 (-11.5) |
| Harengula humeralis | F | 3 | 7.1-9.0 (7.3) | -16.3 - -15.7 (-15.9) |
| Lutjanus apodus | F | 3 | 7.1-9.4 (8.6) | -13.7 - -10.3 (-12.5) |
| L. synagris | F | 1 | 10.1 | -8.7 |
| Sphoeroides testudineus | F | 1 | 7.5 | -11.8 |
| S. testudineus | D | 1 | 11.6 | -17.4 |
| Crustáceos | ||||
| Callinectes sp. | I | 1 | 7.9 | -18.5 |
| Callinectes sp. | F | 1 | 7.4 | -12.6 |
| Callinectes sp. | D | 2 | 7.2-10.2 (8.7) | -10.8 - -9.7 (-10.3) |
| Pleoticus robustus | I | 1 | 9.3 | -19.4 |
| Periclimenes sp. | D | 1 | 5.4 | -12.4 |
| Moluscos | ||||
| Almejas | D | 2 | 11.4-12.9 (12.2) | -21.1 - -21.0 (-21.1) |
| Gasterópodos | D | 1 | 6.6 | -26.8 |
| Vegetales | ||||
| Thalassia testudinum | F | 1 | 6.6 | -11.6 |
| Rhizophora mangle | D | 1 | 7.2 | -27.7 |
En la muestra total de barracuda hubo un porcentaje significativamente mayor de estómagos vacíos por la tarde, 73%, contra 35% en la madrugada, 20% en la mañana y 8% al mediodía (c2 = 70.4, df = 3, p < 0.0001). También se halló un mayor índice de vacuidad en la talla mediana: 58%, contra 21% en la talla chica y 33% en la grande (c2 = 18.5, df = 2, p < 0.0001).
Muy pocos contenidos estomacales fueron identificables. Se logró determinar sólo 2 especies de peces: Atherinomorus stipes (Atherinidae) y Eucinostomus jonesii (Gerreidae); el resto sólo se pudo identificar como las familias Cyprinodontidae y Gerreidae. Los crustáceos y moluscos se encontraron solamente en las barracudas de talla pequeña; el resto de las tallas de presentó en su contenido estomacal exclusivamente peces y materia orgánica no determinable.
Las firmas isotópicas de las barracudas variaron según la talla y el sitio de captura (Tabla 3). La señal isotópica también varió según la zona de captura en el resto de los organismos (Tabla 2). La señal de δ13C fue significativamente diferente entre los organismos capturados dentro de la bahía y los recolectados en la costa (F = 5.75, p < 0.00001), con un mayor valor de δ13C en las muestras marinas en general; el botete Sphoeroides testudineus, un pez que fue capturado tanto en la zona D como en la F, mostró también esa misma diferencia entre hábitats. Sin embargo, el bolín Floridichthys polyommus, la sardina Harengula humeralis y la jaiba Callinectes sp. capturados en la costa (zona F) presentaron una señal isotópica más parecida a la de los organismos recolectados en el interior de la bahía (zona D). Por su parte, la firma isotópica de δ15N (F = 7.02, p < 0.00001) colocó a las barracudas de todas las tallas en los niveles tróficos más altos, junto con otros depredadores, como Caranx hippos (Fig. 2).
Tabla 3 Firmas isotópicas (‰) de Sphyraena barracuda por tallas y zonas de captura: valores mínimo y máximo (mediana entre paréntesis). Zonas: D, dentro de la bahía; I, intermedia (canal de Zaragoza); F, fuera de la bahía (costa del Caribe). Clases de talla: (CH)ica, (M)ediana, (G)rande.
| Talla | Zona | Número de muestras | δ15N | δ13C |
| CH | D | 14 | 10.1-15.9 (13.6) | -23.7 - -9.2 (-16.7) |
| CH | F | 1 | 12.3 | -11.8 |
| M | I | 5 | 12.5-15.9 (13.5) | -18.5 - -12.0 (-15.2) |
| M | D | 10 | 9.7-15.4 (12.8) | -20.4 - -6.8 (-16.8) |
| G | F | 15 | 8.0-13.6 (11.7) | -19.9 - -9.0 (-13.9) |

Figura 2 Señales isotópicas de carbono y nitrógeno de organismos capturados en la bahía de Chetumal (D), canal de Zaragoza (I) y la costa del Caribe (F). De las barracudas se indica la clase de talla: G, grande; M, mediana; CH, chica.
La firma isotópica de δ13C reflejó también diferencias entre las distintas tallas de barracuda y los sitios en que fueron capturadas, formando así 3 subpoblaciones (Fig. 3). Las de talla grande de la costa del Caribe (zona F) y canal de Zaragoza (zona I) estuvieron menos enriquecidas en δ13C en comparación con las chicas y medianas de adentro de la bahía (zona D). En la bahía (zona D), las barracudas chicas reflejaron un δ15N muy similar a las de la talla mediana (Fig. 3) y cercano al de Achirus lineatus (Fig. 2). En la zona F, la señal de δ15N fue más alta en los organismos de menor talla que en los grandes; sin embargo no se observó traslape en la señal de δ13C, lo que sugiere que cada grupo se alimenta en sitios distintos (Fig. 3).

Figura 3 Subpoblaciones de S. barracuda capturadas en la bahía de Chetumal (D), canal de Zaragoza (I) y la costa del Caribe (F). De las barracudas se indica la clase de talla: G, grande; M, mediana; CH, chica. Mismos datos de la Figura 2.
Discusión
La firma isotópica δ13C fue significativamente distinta según la zona de captura, especialmente entre las zonas D y F; los organismos chicos de la zona F tienen señales isotópicas de δ13C más enriquecidas que los chicos y medianos de la zona D. Las barracudas grandes de la zona F tienen valores intermedios entre los anteriores. Cocheret de la Morinière et al. (2003) encontraron resultados similares en Curazao; los organismos recolectados en bahías y estuarios mostraban valores más bajos de δ13C, en comparación con los organismos recolectados en las zonas arrecifales.
Únicamente se pudieron encontrar organismos juveniles (chicos y medianos) en el interior de la bahía de Chetumal y el canal de Zaragoza (zonas D, I). Lo mismo detectó Paz-Pérez (2006) en la propia bahía de Chetumal, lo cual confirma el uso de estuarios y manglares como sitios de refugio por la barracuda en sus etapas juveniles (Marguillier et al., 1997; Schmidt, 1989).
Aunque hay variación en la señal isotópica de δ15N, la barracuda siempre ocupó una posición de depredador tope, junto con otras especies, como el lenguado Achirus lineatus y C. hippos, cuyos hábitos piscívoros ya han sido señalados en la literatura (Saloman y Naughton, 1984; Vasconcelos-Filho et al., 2003). En el caso de la barracuda, esto ocurre en toda etapa de su desarrollo y en las 3 zonas donde se realizó el presente estudio; resultados similares fueron encontrados por Marguillier et al. (1997). El decremento en nitrógeno en tallas mayores es atribuible a la disminución de crustáceos y la mayor inclusión de peces (probablemente herbívoros y omnívoros) en la dieta de la barracuda; sin embargo, Schmidt (1989) determinó en Florida que también los juveniles de barracuda eran enteramente piscívoros.
La barracuda suele considerarse un carnívoro generalista y oportunista (de Sylva, 1963), características que permiten ahorrar energía. En el presente estudio, al igual que en el de Hooker et al. (2007), se identificaron como presas peces de las familias Gerreidae y Cyprinodontidae; éstos, así como el aterínido A. stipes (equivalente ecológico de Allanetta harringtonensis, muy común en la dieta de la barracuda en las Antillas Menores: Randall, 1967) son de los peces más frecuentes y abundantes en la bahía de Chetumal (Schmitter-Soto et al., 2009).
La variación de la vacuidad estomacal a lo largo del día sugiere que S. barracuda se alimenta preferentemente en horarios crepusculares. Esto contrasta con estudios previos (de Sylva, 1963; Randall, 1967) de la barracuda como depredador predominantemente diurno.
La separación espacial entre categorías de talla se debe probablemente a los diferentes requerimientos alimenticios y de refugio a lo largo del ciclo de vida de la barracuda. Lo anterior concuerda con lo encontrado por Nagelkerken y van der Velde (2004) y Cocheret de la Morinière et al. (2003), quienes también registraron tales diferencias en distintos ecosistemas de los “hábitats continuos” - manglares, pastos y arrecife (Aguilar-Perera y Appeldoorn, 2007).
Entre los juveniles recolectados en la bahía (zona D) y el ejemplar de Xcalak (zona F) no se registró traslape en la señal de δ13C, lo cual sugiere que el único juvenil capturado en la zona costera probablemente no usó como sitio de crianza la bahía de Chetumal ni el arrecife, pero tal vez sí la zona de mangle cercana a Xcalak, posiblemente la pequeña laguna costera del mismo nombre. Este ejemplar también reflejó una señal de δ13C más cercana a la de los juveniles capturados en el canal de Zaragoza. Considerando que éstos últimos son de talla mediana, pero no adultos, es probable que hayan nacido en la costa del Caribe (zona F) y más tarde hayan buscado refugio en el canal de Zaragoza (zona I).
En conclusión, la barracuda es en esta área un carnívoro oportunista con hábitos crepusculares, mientras que la firma isotópica δ13C por tallas apunta a que S. barracuda se mueve entre hábitats (al menos de la zona F a la I) al crecer. Se encontraron 3 subpoblaciones espacialmente separadas de S. barracuda en el continuo de hábitats bahía de Chetumal (D) - canal de Zaragoza (I) - costa del Caribe (F), donde la firma isotópica δ15N señala a S. barracuda como depredador tope dentro de la bahía de Chetumal y la zona costera adyacente, posición trófica que no varía a lo largo de su desarrollo, aunque sí hay un menor valor de nitrógeno en las tallas mayores. Se concluye también que sí existe para la barracuda una migración entre estos sistemas a medida que el pez crece, la cual está ligada con sus requerimientos alimenticios.











 nueva página del texto (beta)
nueva página del texto (beta)


