Introducción
La cuenca del río Balsas es una provincia biogeográfica del centro de México limitada por las elevaciones de la Faja Volcánica Transmexicana y la sierra Madre del Sur. Incluye las zonas con altitud menor a 2,000 m snm de los estados de Guerrero, Jalisco, México, Michoacán, Morelos, Oaxaca y Puebla (Morrone, 2014). Su orografía presenta drásticos cambios altitudinales que van desde tierras bajas en la desembocadura del río en el océano Pacífico, hasta 2,000 m snm en las serranías.
La avifauna de esta provincia biogeográfica posee una considerable riqueza específica, aproximadamente el 33% (379 especies) del total para México (Castro-Torreblanca et al., 2014), debido a su complejidad ecológica: aunque las tierras bajas de la cuenca están dominadas por bosques tropicales caducifolios, en las tierras altas alberga bosques de encino, con afinidad Neártica (Almazán-Núñez y Navarro, 2006; Vázquez-Reyes et al., 2017). Además, las variaciones microclimáticas locales promueven composiciones bióticas particulares y altas tasas de recambio entre áreas específicas del bosque tropical seco (Trejo y Dirzo, 2002). Esto define un elevado nivel de recambio taxonómico a través del gradiente altitudinal (Espinosa-Organista et al., 2008; Koleff et al., 2008). Los bosques tropicales subcaducifolios, palmares, vegetación riparia y ambientes acuáticos complementan la compleja matriz ecológica regional (Fernández-Nava et al., 1998; Ramírez-Albores, 2007; Ramírez-Albores y Ramírez-Cedillo, 2002).
Por otro lado, la riqueza de especies endémicas para México representa aproximadamente el 26% de su riqueza específica total (Navarro-Sigüenza et al., 2014). Por esta razón, se le considera un área de endemismo de aves de importancia global (EBA-008; Stattersfield et al., 1999). Este patrón se origina por el aislamiento orográfico de la cuenca (Morrone, 2014), los cambios paleoecológicos que moldearon la cobertura de bosques tropicales y templados, provocando efectos de aislamiento y diversificación de especies restringuidas entre final del Mioceno (Mason et al., 2018; Navarro-Sigüenza et al., 2017) y el Pleistoceno (Linares-Palomino et al., 2011; Lovette, 2005; Pennington et al., 2000). Por esta conjugación de factores ecológicos e históricos, la avifauna de la cuenca del Balsas posee un gran valor para la biodiversidad mexicana (Espinosa-Organista et al., 2008; Morrone, 2014; Ríos-Muñoz, 2013).
Actualmente, tenemos una valiosa visión general de la biodiversidad de aves en la cuenca del Balsas gracias a diversos inventarios (Almazán-Núñez y Navarro, 2006; Nova-Muñoz et al., 2011; Ramírez-Albores, 2007; Ramírez-Albores y Ramírez-Cedillo, 2002; Rojas-Soto et al., 2009) y estudios biogeográficos a partir de bases de datos (Castro-Torreblanca et al., 2014). Sin embargo, existen importantes vacíos de información; particularmente en el Alto Balsas de Guerrero, subprovincia definida por las cuencas de los ríos Amacuzac, Nexapa, Atoyac, Mixteco y Tlapaneco, al oriente de la sierra de Taxco (Meza y López-García, 1997). Hasta el año 2012, se ignoraba la presencia de la guacamaya verde, Ara militaris, en el Alto Balsas (Jiménez-Arcos et al., 2012), aún cuando se trata de una especie prioritaria en México y vulnerable a nivel global (Conabio, 2017). Además, hasta ahora no se han publicado estudios de campo enfocados en la riqueza, composición y recambio taxonómico de las aves del Alto Balsas de Guerrero.
Desafortunadamente, la pérdida de hábitat pone en grave riesgo la conservación de las aves del trópico seco mexicano, incluyendo la cuenca del Balsas (NABCI, 2016). La agricultura, la ganadería y el desarrollo de asentamientos humanos impulsan tasas de deforestación cercanas al 4% anual (Maass et al., 2010; Sánchez-Azofeifa y Portillo-Quintero, 2011). Como consecuencia, el bosque tropical caducifolio conservado representa sólo el 12.8% de su extensión original, mientras los encinares conservados cubren el 35% (Conafor, 2014). Aunado a ésto, no existen áreas naturales protegidas relevantes en la región (existen 2 reservas estatales, ninguna mayor a 450 ha (Conanp, 2018; Semaren, 2018). Esta situación limita las posibilidades para frenar la pérdida de hábitat, principal amenaza para las aves de México (Peterson y Navarro-Sigüenza, 2016).
Como respuesta a dicha problemática, este trabajo tiene como objetivo describir la biodiversidad de aves del Alto Balsas de Guerrero para aportar información útil en la toma de decisiones encaminadas a su conservación. Para ello, se presenta: el inventario taxonómico regional, la riqueza específica en los tipos de hábitat dominantes, el análisis de recambio taxonómico entre tipos de hábitat; así como el análisis de estacionalidad, endemismo, estatus de conservación, vulnerabilidad y atributos ecológicos generales de la avifauna.
Materiales y métodos
El área de estudio se localiza al noreste del estado de Guerrero (municipios de Atenango del Río, Copalillo y Olinalá), incluyendo el extremo suroeste del estado de Puebla (municipio de Santa María Cohetzala), debido a que representan un continuo de hábitat (Fig. 1). Las coordenadas extremas son: 18º16’ N, 99º14’ O (noroeste); 18º16’ N, 98º47’ O (noreste); 17º53’ N, 99º14’ O (suroeste) y 17º53’ N, 98º47’ O (sureste), con una superficie de aproximadamente 2,000 km2 dentro del Alto Balsas. El clima es cálido semiseco con lluvias en verano (Aw), con precipitación aproximada de 780 mm anuales (Martínez-Gordillo et al., 1997; Meza y López-García, 1997). La zona incluye un gradiente altitudinal que va de 650 m snm, en las riberas de los ríos Balsas y Amacuzac, hasta 1,950 m snm en las zonas más elevadas (Fig. 1).

Figura 1 Zona de estudio en el Alto Balsas de Guerrero. El cuadro superior derecho indica la localización de la zona en el centro-occidente de México. El cuadro inferior izquierdo muestra las localidades de colecta histórica de aves (Navarro-Sigüenza et al., 2002; puntos azules); así como los registros observacionales (eBird, 2017; puntos anaranjados) más cercanos a la zona de estudio. Los polígonos verdes indican las áreas de muestreo en la región.
Por su latitud, altitud, temperatura y precipitación, la región corresponde a la zona de vida de bosque tropical seco (Holdridge, 1967), e incluye diferentes tipos de vegetación. Entre 650 y 1,200 m snm, la vegetación es bosque tropical caducifolio. Distribuido en laderas y valles, su estrato arbóreo se caracteriza por árboles de Bursera spp., Lysiloma spp., Cyrtocarpa procera y Ceiba aesculifolia. En barrancas y cañadas la vegetación es bosque tropical subcaducifolio, cuyo estrato arbóreo está representado por Enterolobium cyclocarpum, Ficus spp. y Lonchocarpus spp. En la ribera de los ríos, entre 650 y 750 m snm, existen elementos de bosque de galería representados por Taxodium mucronatum, Caesalpinia coriaria y E. cyclocarpum. Entre 1,500 y 1,950 m snm, el bosque de encino (Quercus spp.) es la vegetación dominante. Entre 1,200 y 1,500 m snm existen ecotonos de bosque de encino con bosque tropical caducifolio que incorporan árboles como Celtis caudata, Heliocarpus spp. y Lysiloma acapulcense. En las laderas norte existen palmares de Brahea dulcis con elementos arbóreos de bosques tropicales y de encino (Fernández-Nava et al., 1998; Martínez-Gordillo et al., 1997; Rzedowski, 2006). El hábitat acuático disponible incluye los cauces de los ríos, corrientes temporales en las barrancas, pozas naturales y artificiales. La disponibilidad de agua es variable en función de la temporada de lluvias, aunque el río y los jagüeyes mantienen agua todo el año. En la región existen asentamientos humanos que han provocado una pérdida aproximada del 18% de la cobertura forestal debido al desarrollo de agricultura de subsistencia, ganadería extensiva, extracción de madera para leña y construcción (Naturam Sequi, 2016). En el hábitat conservado, las actividades humanas se limitan al tránsito eventual de personas y ganado a través de veredas.
Este trabajo recopila los datos de incidencia de aves obtenidos entre junio de 2006 y noviembre de 2017, a través de diferentes proyectos enfocados al estudio de la biodiversidad del Alto Balsas (Jiménez-Arcos et al., 2012; Naturam Sequi, 2015, 2016; Vázquez-Reyes et al., 2017). Se consideraron los siguientes tipos de hábitat: bosque tropical caducifolio, bosque tropical subcaducifolio, bosque de encino, ecotonos forestales entre el bosque tropical caducifolio y de encino, palmares, vegetación riparia y hábitat acuático. El esfuerzo de muestreo fue de 293 días, distribuidos en 44 salidas de trabajo de campo. El muestreo de aves se realizó en diversas horas del día, dando prioridad al registro durante las primeras 4 horas después del amanecer, para aprovechar el pico de actividad de las aves diurnas. También se realizaron recorridos vespertinos y nocturnos para obtener datos de las especies crepusculares y nocturnas (Bibby et al., 2000). Siempre que fue posible, se obtuvo registro fotográfico digital. Para ello, se usaron cámaras SLR Canon EOS 30D y 7D, con objetivos EF 100-400mm f/4.5-5.6L IS USM y EF 100MM F/2.8 MACRO USM. Se usaron guías de campo de aves de México (Howell y Webb, 1995; Peterson y Chalif, 1989) y Norteamérica (Dunn y Alderfer, 2006; Robbins et al., 1966) para la identificación de las especies. También se consultaron ejemplares de referencia en la colección del Museo de Zoología de la Facultad de Ciencias de la Universidad Nacional Autónoma de México (MZFC).
En total, se consideraron datos provenientes de 5 métodos de muestreo: 1) recorridos para observación libre, entre junio de 2006 y noviembre de 2017 (190 días), incluyendo los 7 tipos de hábitat; 2) puntos de conteo, entre febrero de 2014 y mayo de 2016 (65 días). En total se realizaron 412 puntos, 204 en bosque tropical caducifolio y 208 en bosque de encino. Se tomaron en cuenta ambientes conservados, vegetación secundaria y poblados en ambos tipos de vegetación. Durante un periodo de 10 minutos se registraron las aves observadas y escuchadas dentro de un radio de 30 m. Los puntos fueron separados al menos 200 metros entre sí para mantener independencia entre los datos obtenidos (Ralph et al., 1996); 3) colecta científica, con redes de niebla (aproximadamente 3,500 horas/metro/red) y rifles de diábolos en el bosque tropical caducifolio, subcaducifolio y de encino; durante 49 días entre febrero de 2014 y marzo de 2016. Los ejemplares se taxidermizaron, colectando los tejidos de músculo, corazón e hígado para estudios moleculares; 4) grabación de cantos y vocalizaciones en todos los tipos de hábitat durante 26 días, entre febrero de 2014 y abril de 2016. Se obtuvieron archivos *.wav, con tasa de grabación de 44.1 KHz e intervalo dinámico de 16 bits con una grabadora Tascam DR-100 y micrófonos Sennheiser ME67 y Telinga TwinScience 5 con parábola, y 5) monitoreo fotográfico comunitario. Se capacitó a pobladores de las localidades de Papalutla, Xixila y Zicapa para obtener registro fotográfico digital georreferenciado de las aves observadas en recorridos libres. Este método sumó 100 días de muestreo entre septiembre de 2016 y febrero de 2017. Los ejemplares colectados (pieles y tejidos), así como grabaciones de cantos y fotografías (obtenidas por LDV-R), fueron depositados en la Colección de Aves del MZFC.
El inventario de las aves registradas (Apéndice) se ordenó a nivel supraespecífico con los criterios de la AOS (2017). A nivel específico, se usaron los criterios de la propuesta taxonómica alternativa para las aves de México (Navarro-Sigüenza y Peterson, 2004). Al considerar como especies los linajes monofiléticos evolutivamente independientes, permite una mejor identificación de las áreas prioritarias para conservación por su papel en la diversificación de taxones únicos para México (Bertelli et al., 2017; Navarro-Sigüenza y Peterson, 2004; Navarro-Sigüenza et al., 2014).
Para evaluar la biodiversidad regional, consideramos la riqueza específica registrada por tipo de hábitat como diversidad α; mientras que la riqueza específica regional fue considerada como diversidad γ (Whittaker, 1972). Para calcular la riqueza esperada y modelar la eficiencia del muestreo por tipo de hábitat, se usó el estimador no paramétrico ICE (Incidence Coverage Estimator), basado en datos de incidencia de las aves. Este estimador considera a las especies raras y especies únicas para calcular la probabilidad de encontrar nuevas especies y generar una estimación de la riqueza total a partir de datos de incidencia (Moreno, 2001). El indicador fue elegido dado que tiene un desempeño estable aún con datos provenientes de diferentes tamaños muestrales (Chazdon et al., 1998). El análisis fue ejecutado en el programa EstimateS v. 9.1 (Colwell, 2013). Dado que los modelos de predicción de riqueza específica requieren unidades muestrales comparables, usamos como unidad de muestreo los días de registro de datos en campo, en lugar del número de individuos o eventos de muestro. De esta forma buscamos aprovechar las diferentes fuentes de información en el estudio, intentando reducir posibles sesgos derivados de las diferentes probabilidades de detección para las aves (Hortal y Lobo, 2002; Jiménez-Valverde y Hortal, 2003).
Se consideró al recambio taxonómico entre tipos de hábitat como diversidad β (Whittaker, 1972). Para evaluarlo, se usó el índice βsim, que mide las diferencias asociadas con las especies no compartidas, independientemente de la riqueza específica (Koleff et al., 2003). Esto permite reducir los sesgos que pueden generar tamaños de biotas diferentes en el análisis (Baselga, 2010). Para analizar las relaciones taxonómicas entre tipos de hábitat, se hizo un análisis de clasificación a la matriz de disimilitud con el método de ligamiento completo. Estos análisis se ejecutaron con la paquetería “betapart” (Baselga y Orme, 2012) del software R v. 3.2 (R Development Core Team, 2008).
Se consideraron 6 categorías de residencia a partir de la propuesta de NatureServe (Ridgely et al., 2005), disponible en la Red de Conocimientos sobre las Aves de México (Berlanga et al., 2008): residentes permanentes, migratorias locales, migratorias invernales, migratorias de verano, transitorias, y accidentales.
Se usaron 3 categorías de endemismo: endémicas, con distribución solo en México, cuasiendémicas, cuya distribución fuera de México es < 35,000 km2 y semiendémicas: migratorias cuya distribución invernal se encuentra solo en México (González-García y Gómez-de Silva, 2003).
Se usaron las categorías de riesgo de extinción de acuerdo con la NOM-059-SEMARNAT-2010 (Semarnat, 2010) y la lista roja de la UICN (Birdlife International, 2018). Para evaluar la vulnerabilidad ecológica, se usaron los resultados de la evaluación del estado de conservación de las aves de Norteamérica (NABCI, 2016). Éste se basa en datos de tendencias poblacionales y amenazas de cada especie para generar un índice con valores de 4 a 20. Generamos 3 categorías de vulnerabilidad para comparar entre tipos de hábitat: baja, valores de 4 a 8; media, valores de 9 a 13; y alta, valores de 14 a 18.
Se consideró la dieta general como un atributo relacionado con los requerimientos ecológicos de las aves. Se usaron 9 categorías: nectarívora, frugívora, granívora, carnívora, insectívora, malacófaga, piscívora, carroñera y omnívora (del Hoyo et al., 2017). Por otro lado, la vinculación con servicios ecosistémicos se consideró como atributo del efecto ecológico de las aves sobre el ambiente (Salgado-Negret y Paz, 2015). Se consideraron 9 categorías: polinización, dispersión de semillas, control poblacional de semillas, de vertebrados, de invertebrados, ingeniería ecosistémica (generación de recursos para múltiples taxa), reciclaje de cadáveres, transporte de nutrientes entre hábitat acuático y terrestre, e interacciones ecológicas múltiples (Sodhi et al., 2011). La última categoría fue asignada para aves omnívoras que pueden vincularse con varios de los servicios ecosistémicos que referimos arriba (del Hoyo et al., 2017).
Resultados
En total se registraron 209 especies de aves en el Alto Balsas de Guerrero, distribuidas en 21 órdenes, 50 familias y 135 géneros. El estimador ICE, indicó que la eficiencia de muestreo de la avifauna regional difiere entre tipos de hábitat. Los tipos de hábitat mejor muestreados fueron el bosque de encino (90.7%) y el bosque tropical caducifolio (83.8%). La eficiencia de muestreo en los tipos de hábitat restantes varía entre 70.7% y 34.5% (Tabla 1). El bosque tropical caducifolio (150 especies) y el bosque de encino (133 especies) fueron los tipos de hábitat con mayor representación de la biodiversidad regional (71.7% y 63.6% respectivamente), mientras el resto tuvieron una riqueza específica ≤ 50% del total registrado (Tabla 1). El inventario taxonómico obtenido se muestra en el Apéndice.
Tabla 1 Resumen taxonómico de la avifauna por tipo de hábitat en el Alto Balsas de Guerrero. Se indica la riqueza de los taxonómicos de orden, familia, género y especie por tipo de hábitat, el valor de riqueza específica estimada (ICE) y la eficiencia del muestreo para detectar la avifauna.
| Taxón | Alto Balsas |
Hábitat acuático |
Vegetación riparia |
Tropical caducifolio |
Tropical subcaducifolio |
Ecotono forestal |
Palmar | Bosque de encino |
| Orden | 21 | 9 | 12 | 14 | 15 | 13 | 9 | 14 |
| Familia | 50 | 13 | 26 | 34 | 30 | 30 | 18 | 35 |
| Género | 135 | 20 | 40 | 96 | 47 | 69 | 23 | 82 |
| Especie | 209 | 23 | 60 | 150 | 76 | 103 | 28 | 133 |
| ICE | 44.57 | 95.36 | 178.86 | 112.06 | 145.69 | 81.17 | 146.64 | |
| ICE (%) | 51.60 | 62.92 | 83.86 | 67.82 | 70.70 | 34.50 | 90.70 |
El valor promedio del recambio taxonómico regional (bsim) fue de 0.41 (± 0.28). La Tabla 2 presenta la matriz de disimilitud (βsim) a nivel regional y la riqueza de especies únicas por tipo de hábitat. Los bosques tropical caducifolio (22 especies) y de encino (18 especies) aportaron más especies únicas que ningún otro tipo de hábitat (Tabla 2). En total, aproximadamente el 25% de la biodiversidad regional (53 especies) representan recambio neto. El análisis de clasificación generó 2 agrupaciones principales (Fig. 2). La primera incluyó al hábitat acuático y la vegetación riparia, sumando 70 especies totales y 9 únicas. La segunda agrupación se formó por los diferentes tipos de hábitat forestal (192 especies) y tuvo 2 subgrupos. El primero se formó por el palmar, el bosque de encino y los ecotonos forestales e incluyó 152 especies, 21 de ellas únicas. El segundo subgrupo se formó por los bosques tropicales caducifolio y subcaducifolio, e incluyó 153 especies totales y 22 únicas.
Tabla 2 Valores de recambio taxonómico (bsim) de las avifaunas presentes en los tipos de hábitat en el Alto Balsas de Guerrero.
| βsim (sp. únicas) | Hábitat acuático |
Vegetación riparia |
Tropical caducifolio |
Tropical subcaducifolio |
Ecotono forestal |
Palmar | Bosque de encino |
| acuático (6) | 0.43 | 0.65 | 0.87 | 0.74 | 1.00 | 0.74 | |
| riparia (3) | 0.25 | 0.53 | 0.50 | 0.71 | 0.43 | ||
| caducifolio (21) | 0.04 | 0.18 | 0.07 | 0.26 | |||
| subcaducifolio (1) | 0.29 | 0.32 | 0.26 | ||||
| ecotono (4) | 0.18 | 0.17 | |||||
| palmar (0) | 0.07 | ||||||
| encino (17) | |||||||
| βsim promedio | 0.74 | 0.48 | 0.24 | 0.39 | 0.34 | 0.39 | 0.32 |
| (± 0.19) | (± 0.15) | (± 0.22) | (± 0.28) | (± 0.23) | (± 0.38) | (± 0.24) | |
| βsim Alto Balsas | 0.41 | ||||||
| (± 0.28) |
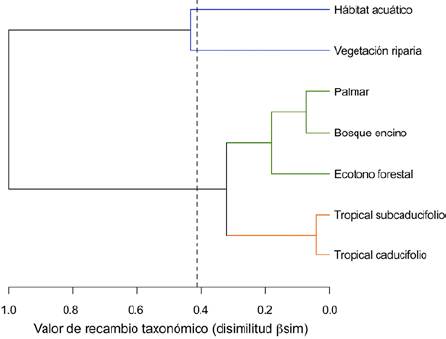
Figura 2 Análisis de clasificación basado en disimilitud por recambio taxonómico general de la avifauna del Alto Balsas de Guerrero. Se usó el índice βsim y el método de ligamiento completo. La línea vertical punteada indica el valor promedio de la matriz de disimilitud (0.41 ± 0.28).
Del total regional, 112 especies fueron residentes permanentes (53.6%), 18 migratorias locales (8.6%), 64 migratorias invernales (30.6%), 6 migratorias de verano (2.8%) y 8 transitorias (3.8%). El bosque tropical caducifolio fue el hábitat con mayor riqueza de especies migratorias de larga distancia, con 49, seguido por el bosque de encino con 44, y los ecotonos entre bosques tropicales y de encino, con 34. La vegetación riparia tuvo 26 migratorias de larga distancia, el hábitat acuático 13, el bosque subcaducifolio 15, y el palmar 4 (Fig. 3).
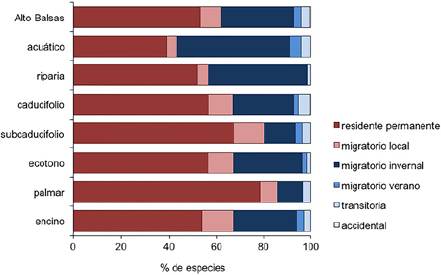
Figura 3 Distribución de frecuencias de la avifauna del Alto Balsas por su categoría de estacionalidad. Se muestran los valores porcentuales de por cada categoría contemplada.
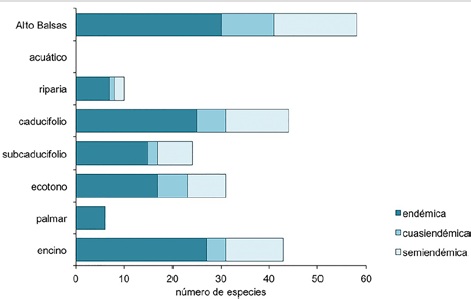
La riqueza específica del componente endémico fue de 30 especies (14.3%), 11 cuasiendémicas (5.2%), y 17 semiendémicas (8.1%), sumando 58 especies (27.7%) a nivel regional. Los tipos de hábitat con mayor riqueza de endemismo fueron el bosque caducifolio, con 44 especies, el bosque de encino, con 43 especies, seguido de los ecotonos con 31, el bosque tropical subcaducifolio con 24, la vegetación riparia con 12 y el palmar con 6. No se registró ninguna especie endémica en el hábitat acuático (Fig. 4).
El 12% (25 especies) de la biodiversidad registrada se considera en riesgo de acuerdo con la legislación mexicana y la lista roja de la UICN. Las especies en mayor riesgo son: Ara militaris (guacamaya verde), en peligro de extinción en México y vulnerable a nivel global; Megascops seductus (tecolote del Balsas), amenazado en México y cerca de amenaza a nivel global; Xenotriccus mexicanus (mosquero del Balsas) y Passerina ciris (colorín sietecolores), ambas especies sujetas a protección especial en México y cerca de amenaza global. El estatus de conservación de todas las especies se presenta en el Apéndice.
El 29.2% (61) de las especies tuvieron valores de vulnerabilidad baja, 56.5% (118) media y 14.3% (30) alta. (Fig. 5a). La vegetación riparia y los ambientes acuáticos tuvieron una menor representación de especies con vulnerabilidad alta. Por otro lado, las aves endémicas tuvieron una mayor proporción de especies con alta vulnerabilidad respecto con las especies de amplia distribución (31% y 7.9% respectivamente; Fig. 5b).
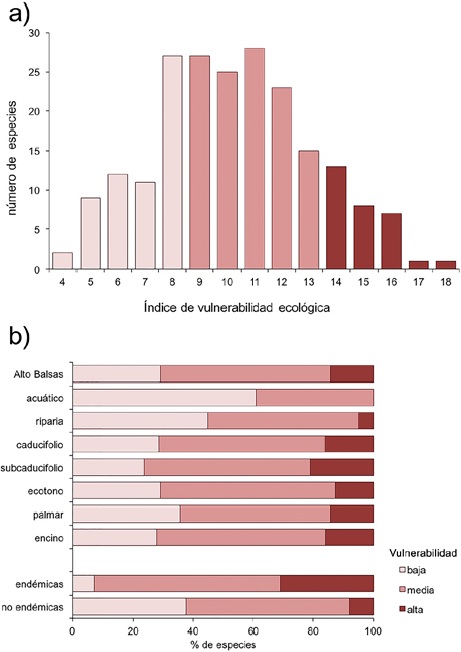
Figura 5 Vulnerabilidad ecológica de la avifauna del Alto Balsas, de acuerdo con la evaluación del estado de conservación de las aves de Norteamérica (NABCI, 2016). a) Distribución de frecuencias de la avifauna regional; b) comparación por tipo de hábitat y endemismo.
A nivel regional (Fig. 6), el atributo de requerimientos ecológicos mejor representado fue la dieta insectívora con 51.2% (105 especies) del total de especies. Le siguen la dieta granívora con 16.1% (33 especies), la carnívora con 10.2% (21 especies), la nectarívora con 6.8% (14 especies), la frugívora y la piscívora, cada una con 5.4% (11 especies), la omnívora con 2.9% (6 especies), carroñera, con 1.5% (3 especies) y la malacófaga con 0.5% (1 especie). Respecto al efecto ecológico, el atributo mejor representado fue el control poblacional de invertebrados, con 43.9% (90 especies), seguido del control poblacional de semillas con 19.0% (39 especies), transporte de nutrientes del ambiente acuático al terrestre con 8.8% (18 especies), control de poblaciones de vertebrados con 8.3% (17 especies), polinización de plantas con 6.8% (14 especies), dispersión de semillas con 6.3% (13 especies), interacciones múltiples con 2.9% (6 especies), ingeniería ecosistémica con 2.4% (5 especies) y reciclaje de cadáveres con 1.5% (3 especies) (Fig. 7). En el Apéndice 1 se indican los atributos de dieta y vinculación con servicios ecosistémicos considerados para cada especie registrada.

Figura 6 Distribución de frecuencias de los atributos de requerimientos ecológicos (dieta general) por tipo de hábitat para la avifauna del Alto Balsas de Guerrero. Los valores de frecuencia se expresan como porcentaje de especies dentro de cada categoría por tipo de hábitat.
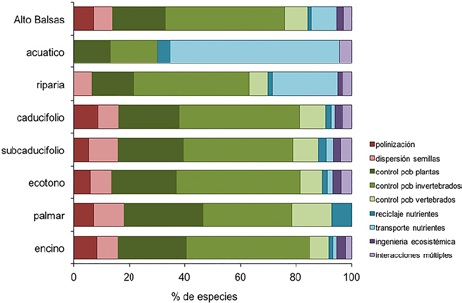
Figura 7 Distribución de frecuencias de los atributos de efecto ecológico (vinculación con servicios ecosistémicos) por tipo de hábitat para la avifauna del Alto Balsas de Guerrero. Los valores de frecuencia se expresan como porcentaje de especies dentro de cada categoría por tipo de hábitat.
Los ambientes forestales (caducifolio, subcaducifolio, encinar y ecotonos) tuvieron patrones similares en la representación de atributos de requerimientos y efectos ecológicos (Fig. 7). En contraste, en el palmar hubo una mayor representación de aves carnívoras y carroñeras y menor representación de frugívoras e insectívoras respecto a los ambientes forestales. Además, no se registraron aves omnívoras ni piscívoras (Fig. 7). La dieta malacófaga sólo se registró en el bosque caducifolio y la vegetación riparia.
Respecto a la vinculación con servicios ecosistémicos, el palmar tuvo una mayor representación de los atributos de control poblacional de vertebrados y reciclaje de cadáveres; mientras que los atributos de ingeniería ecosistémica, transporte de nutrientes e interacciones múltiples no fueron registrados (Fig. 7). La vegetación riparia y el hábitat acuático fueron diferentes a los demás tipos de hábitat por la baja representación de las dietas frugívora y nectarívora. Los atributos de polinización, dispersión de semillas e ingeniería ecosistémica no estuvieron representados en el hábitat acuático; mientras que la dieta piscívora y del transporte de nutrientes tuvieron una mayor representación respecto a los ambientes forestales (Fig. 7).
Discusión
La biodiversidad de aves del Alto Balsas de Guerrero representa aproximadamente el 18% del total nacional, distribuida en el 0.1% del territorio mexicano. Con esto, supera a otras zonas del Alto Balsas (Puebla, 128 especies, Ramírez-Albores, 2007; Morelos, 177 especies, Ramírez-Albores y Ramírez-Cedillo, 2002) y del Balsas Medio (Guerrero, 164 especies, Almazán-Núñez y Navarro, 2006; 124 especies, Rojas-Soto et al., 2009, y 105 especies, Nova-Muñoz et al., 2011). De hecho, la riqueza específica de las aves terrestres del Alto Balsas de Guerrero es similar a la cuenca baja del Balsas (Villaseñor-Gómez et al., 2000) y la región de Chamela (Arizmendi et al., 1990), en la costa occidente de México; región donde los bosques tropicales secos alcanzan su mayor diversidad de aves (Feria-Arroyo y Peterson, 2002; Vega-Rivera et al., 2010).
Esta alta diversidad avifaunística regional se explica, desde el punto de vista ecológico, tanto por la elevada diversidad beta entre el hábitat con influencia Neotropical y Neártica (Espinosa-Organista et al., 2008; Koleff et al., 2008), como por variaciones microclimáticas locales que elevan el recambio entre áreas específicas del bosque tropical seco (Trejo y Dirzo, 2002). La avifauna de los bosques caducifolio y subcaducifolio fue definida por especies tropicales como Megascops seductus, Glaucidium griscomi y Cassiculus melanicterus (Vega-Rivera et al., 2010). En contraste, los bosques de encino, ecotonos y el palmar incorporaron especies típicas de bosques templados con influencia biogeográfica Neártica, como Cyrtonyx montezumae, Glaucidium gnoma, Trogon mexicanus, Baeolophus wollweberi, Melanerpes formicivorus (Ramírez-Bastida et al., 2015). Se trata de un patrón tanto en vertebrados terrestres (Ochoa-Ochoa et al., 2014) como con la flora de los bosques montanos del centro del país (Becerra, 2005; Espinosa-Organista et al., 2008; Rzedowski et al., 2005; Valencia, 2004). Por otro lado, las aves dependientes de los ambientes acuáticos (17 especies) representaron el 32% del recambio taxonómico regional. Esto contrasta con el bajo porcentaje de la riqueza específica regional que representan (7.3%). Sin embargo, considerando la baja eficiencia del muestreo en el hábitat acuático, es esperable que su diverisidad alfa aumente a casi 40 especies (Ramírez-Bastida et al., 2008), aumentando también la diversidad beta y gamma regionales.
En contraste, el bosque subcaducifolio, los ecotonos forestales y el palmar tuvieron pocas especies únicas, dado al uso del hábitat forestal como un continuo (Ramírez-Bastida et al., 2015; Vega-Rivera et al., 2010). Ortalis poliocephala, Ciccaba virgata, Xiphorhynchus flavigaster y Calocitta formosa son ejemplos de aves tropicales (Stotz et al., 1996) que usaron los ecotonos entre bosques tropical y de encino en tierras altas (Tabla 2). Esto influyó en que el bosque subcaducifolio, los ecotonos forestales y el palmar tuvieran pocas especies únicas.
De las 78 migratorias de larga distancia registradas, 65 son aves terrestres. Esta riqueza ha sido explicada por similitudes ecológicas entre el gradiente altitudinal del centro occidente de México y el hábitat reproductivo de las aves. Con ello, el Alto Balsas de Guerrero es una de las zonas con mayor riqueza de migratorias en el Neotrópico (Hutto, 1992, 2010).
El componente migratorio influyó en el recambio taxonómico debido al uso diferencial del gradiente de altitud de algunas especies (Hutto, 1986). Setophaga petechia se registró en bosques tropicales; mientras que Setophaga townsendi se registró en bosques de encino y ecotonos. Las aves Charadiiformes (chorlos y playeros) y Pelecaniformes (garzas) migratorias fueron muy importantes para el hábitat acuático y la vegetación riparia, un patrón común en los ambientes ribereños de México (Navarro-Sigüenza et al., 2014).
Los movimientos locales asociados con la disponibilidad de recursos influyen en la composición y recambio de la avifauna (Vega-Rivera et al., 2010). Ara militaris se desplaza de los bosques tropicales a los ecotonos y bosques de encino para alimentarse entre noviembre y febrero (Naturam Sequi, 2016). Chloroceryle americana, Sayornis nigricans y Parkesia motacilla se internan en las barrancas del bosque subcaducifolio para alimentarse de peces e invertebrados acuáticos durante la temporada de lluvias, cuando la escorrentía forma cauces temporales. Finalmente, Amazilia viridifrons e Hylocharis leucotis, características de bosques tropicales y encinares respectivamente (Ornelas y Arizmendi, 1995; Vega-Rivera et al., 2010; Ramírez-Bastida et al., 2015) fueron registrados en extremos opuestos de su distribución altitudinal (ver Apéndice), posiblemente buscando recursos alimenticios (Arizmendi y Ornelas, 1990; Lara, 2006; Vega-Rivera et al., 2010). La información acerca de movimientos locales es clave para entender la ecología de los bosques que frecuentemente es omitido en estudios descriptivos (Boyle, 2017).
En cuanto a endemismos e identidad biológica mexicana, la riqueza de especies endémicas registrada hace del Alto Balsas un área prioritaria para la conservación a escala global (Arizmendi, 2002; Bertelli et al., 2017; Navarro-Sigüenza y Peterson, 2004; Peterson y Navarro-Sigüenza, 2000). En términos históricos, la evolución de endemismos en los bosques tropicales secos del occidente de México se explica por varios factores: el efecto de aislamiento que la Faja Volcánica Transmexicana y la sierra Madre del Sur producen sobre la cuenca del Balsas (Becerra, 2005; Morrone, 2014); el levantamiento del istmo de Tehuantepec durante el Mioceno (Mason et al., 2018; Navarro-Sigüenza et al., 2017) y los cambios paleoclimáticos derivados del avance y retroceso de glaciares del Pleistoceno (Arbeláez-Cortés, Milá et al., 2014; Arbeláez-Cortés, Roldán-Piña et al., 2014; Montaño-Rendón et al., 2015; Navarro-Sigüenza et al., 2017). En conjunto, estos procesos moldearon la distribución de los bosques templados y tropicales, generando efectos de aislamiento y contacto periódicos que elevaron las tasas de diversificación de las aves (Lovette, 2005). Como consecuencia, los actuales bosques tropicales caducifolios y de encino del centro-occidente de México están entre los ambientes con mayor riqueza de endemismos. De esta forma, procesos históricos y ecológicos definieron la identidad de una de las avifaunas evolutivamente más mexicanas que existen (Navarro-Sigüenza et al., 2014).
La incidencia simpátrica de especies diagnósticas para diferentes provincias biogeográficas y áreas de endemismo señala al Alto Balsas de Guerrero como un área de conectividad en el centro de México, aumentando su relevancia en la planeación de estrategias de conservación (Peterson y Navarro-Sigüenza, 2000). A escala del Neotrópico, Megascops seductus, Campylorhynchus jocosus, Cynanthus sordidus y Peucaea humeralis identifican a la provincia cuenca del Balsas (Morrone, 2014). Por otro lado, endémicas y cuasiendémicas que habitan tierras altas, como Cyrtonyx sallaei, Glaucidium gnoma, Lepidocolaptes leucogaster, Ptiliogonys cinereus y Piranga hepatica son evidencia de contacto con los bosques templados de la Zona de Transición Mexicana (Morrone, 2014; Ramírez-Bastida et al., 2015). Amazilia viridifrons (Vega-Rivera et al., 2010) y Cardinalis cardinalis (Ramírez-Albores, 2010) indican conectividad con la Sierra Madre del Sur y la costa del Pacífico. Además, aves tropicales (Nyctibius jamaicensis, Chondrohierax uncinatus, Buteogallus urubitinga y Ara militaris) y costeras (Dendrocygna autumnalis, Mycteria americana y Megaceryle torquata) indican la conectividad entre las Tierras Bajas del Pacífico y el centro del país (Jiménez-Arcos et al., 2012; Ochoa-Arteaga et al., 2016; Vega-Rivera et al., 2010; Urbina-Torres, 2016).
En lo referente a la identidad funcional, aunque el empleo de indicadores simples tiene limitaciones en la interpretación de la funcionalidad ecológica asociada a las aves (Luck et al., 2012), los resultados obtenidos muestran que las aves hacen un importante aporte a los procesos de regulación, soporte ecológico y resiliencia de los sistemas naturales en el Alto Balsas (Fischer et al., 2007; Sodhi et al., 2011; Wenny et al., 2011).
En primer lugar, participan en la dinámica forestal, pues funcionan como conectores genéticos que influyen en el éxito reproductivo de las especies vegetales al influir en la polinización, mediada principalmente por la familia Trochilidae (Arizmendi y Rodríguez-Flores, 2012). También se vinculan con el reclutamiento poblacional de especies vegetales al dispersar semillas. Los mosqueros Myiarchus son los principales dispersores para Bursera, un género clave del hábitat forestal regional (Almazán-Núñez et al., 2016; Ramos-Ordoñez y Arizmendi, 2011). Numerosas especies funcionan como conectores en procesos de regulación ecosistémica, a través del atributo de control poblacional (Sodhi et al., 2011). La depredación de semillas puede moldear el reclutamiento de las plantas que las aves consumen, por ejemplo, Ara militaris sobre árboles del dosel y cactáceas columnares (Contreras-González y Arizmendi, 2014); además, las aves depredadoras de animales son un componente importante de las cascadas tróficas que regulan el flujo de materia y energía (Şekercioğlu et al., 2004; Sodhi et al., 2011). Particularmente, la mayor representación del atributo de control de poblaciones de vertebrados registrada en el palmar podría implicar una presión de depredación diferencial mediada por aves, respecto a los bosques tropicales o de encino. Esto podría explicarse con la menor cobertura vegetal del palmar, que aumenta la visibilidad de las presas y el éxito de captura (Dickman et al., 1991; Pietrek et al., 2009). Por otro lado, los pájaros carpinteros (familia Picidae) son importantes como ingenieros ecositémicos, al generar cavidades en el hábitat forestal (Cockle et al., 2011). Cathartes aura, Coragyps atratus y Caracara cheriway aportan el servicio de regulación ecológica de reciclaje de cadáveres, reduciendo la posibilidad de brotes patógenos y reintegrando materia orgánica al flujo de energía del ecosistema (Şekercioğlu et al., 2004). Finalmente, las aves acuáticas representan un vínculo importante entre el hábitat acuático y el terrestre, transportando nutrientes hacia el hábitat forestal (Şekercioğlu, 2004). Al involucrarse estrechamente en la provisión de servicios ecosistémicos, la biodiversidad de aves es importante para el bienestar de las poblaciones humanas (Cardinale et al., 2012; Díaz et al., 2004).
La principal amenaza para las aves en el Alto Balsas es la pérdida de hábitat (Vega-Rivera et al., 2010; Maass et al., 2010). Aunque la región mantiene extensiones forestales conservadas, al menos el 18% de la cobertura vegetal ha cambiado por suelos agropecuarios y asentamientos humanos (Naturam Sequi, 2016). Esto amenaza particularmente a las especies de distribución retringuida (McKinney y Lockwood, 1999; NABCI, 2016).
Megascops seductus y Glaucidium griscomi son endémicas que dependen de cavidades distribuidas en áreas específicas del bosque subcaducifolio (Monterrubio-Rico y Escalante-Pliego, 2006; Vázquez-Reyes y Renton, 2015). El Mosquero del Balsas, Xenotriccus mexicanus es un ave muy poco conocida y amenazada por la deforestación (Vega-Rivera et al., 2010). Migratorias como Contopus cooperi, Vireo bellii y Passerina ciris también enfrentan esta amenaza (Berlanga et al., 2010). Accipitriformes, Falconiformes y Strigiformes suman el 48% de las especies protegidas por la legislación nacional debido a la pérdida de hábitat y contaminación con residuos químicos (Enríquez y Vázquez-Pérez, 2015; Thiollay, 2017). Además, la presión humana directa también afecta a las poblaciones de aves (Naranjo y Cuarón, 2010). La captura ilegal y la pérdida de hábitat (Rivera-Ortíz et al., 2013) han colocado a Ara militaris en peligro de extinción, y amenazan a otras especies.
Las especies invasoras como Columba livia, Streptopelia decaocto (una invasión reciente en la región, Blancas-Calva et al., 2014) y Passer domesticus deben su presencia a las actividades humanas que aumentan artificialmente la conectividad biogeográfica (Hulme, 2009). Estas aves son un factor de riesgo al provocar exclusión competitiva y funcionar como vectores de enfermedades (Simberloff et al., 2013). Thraupis episcopus, se consideró un visitante accidental que podría haber sido traslocado por huracanes desde su área de distribución en el golfo de México (Faaborg y Gauthreax, 2014). Sin embargo, hay registros de T. episcopus usando ambientes perturbados en la costa de Guerrero (Blancas-Calva et al., 2017), por lo que podría tratarse de un proceso incipiente de dispersión facilitado por la transformación del hábitat (Rodríguez-Ruíz et al. 2011).
Estudios previos han mostrado que la perturbación antropogénica en el Alto Balsas ha impulsado tanto la pérdida local de especies nativas, como la incidencia de invasiones biológicas, erosionando las diferencias taxonómicas entre las avifaunas de los bosques tropicales caducifolios y de encino (Vázquez-Reyes et al., 2017). Este fenómeno, conocido como homogeneización biótica, es un componente clave de la crisis global de biodiversidad que afecta a la región (McGill et al., 2015).
Históricamente, la cuenca del Balsas es una de las áreas con menor inversión para conservación en el país (Bezaury, 2010). Aunque el registro de Ara militaris (Jiménez-Arcos et al., 2012) despertó el interés por la región (Naturam Sequi, 2015, 2016) y fue designada IBA (MX264, Birdlife International, 2017), este nombramiento es insuficiente para frenar la pérdida de biodiversidad. La conservación de la biodiversidad del Alto Balsas depende de la inversión de recursos para investigación, conservación y restauración de la cobertura forestal, mantenimiento de la funcionalidad ecosistémica y desarrollo de manejo agropecuario sustentable (Chazdon et al., 2009; List et al., 2017; Peterson y Navarro-Sigüenza, 2016; Prieto-Torres et al., 2016). Será indispensable involucrar la complejidad sociocultural de la región, altamente marginada, y hasta ahora dependiente de la agricultura y la ganadería (Good-Eshelman y Barrientos-López, 2004). Una opción para reducir la presión sobre los sistemas naturales es el eventual desarrollo de ecoturismo comunitario basado en la observación de aves (Peterson y Navarro-Sigüenza, 2000). Sin embargo, antes será necesario lograr que la población conozca y apropie a la biodiversidad como un recurso que debe ser conservado, así como garantizar que las actividades económicas beneficien específicamente a las comunidades locales (Sánchez-González y Ortega-Álvarez, 2015).
Finalmente, aunque es necesario desarrollar estudios de otros grupos taxonómicos, nuestros resultados indican que el Alto Balsas de Guerrero cumple criterios para la designación de reserva de la biosfera (LGEEPA, 2017; UNESCO, 2017). Posee una complejidad funcional relevante a través de un gradiente ecológico y altitudinal; conectividad entre provincias biogeográficas, una notable representación de taxa endémicos y amenazados, así como una elevada diversidad beta, todo dentro de un área mayor a 200,000 ha. Obtener dicho nombramiento favorecería la creación de un marco normativo que conjugue a comunidades locales, academia, ONGs y al sector gubernamental en el manejo sustentable y conservación de su patrimonio biológico.











 nueva página del texto (beta)
nueva página del texto (beta)