Introducción
Los equinoideos del orden Clypeasteroida son conocidos popularmente como galletas de mar, presentan testa aplanada, generalmente en forma de disco, de contorno oval a circular, con los bordes redondeados y recubiertos por numerosas espinas cortas que utilizan para enterrarse en los fondos arenosos. Comprenden 150 especies recientes distribuidas en 26 géneros y 9 familias (Ghiold, 1988).
La familia Mellitidae es una de las más representativas del orden Clypeasteroida e incluye 5 géneros, de los cuales 3 se han registrado en el Caribe colombiano con las especies: Leodia sexiesperforata (Leske, 1778), Mellita quinquiesperforata (Leske, 1778), Encope emarginata (Leske, 1778) y Encope michelini L. Agassiz, 1841 (Borrero-Pérez et al., 2012). Las especies que integran esta familia se caracterizan por tener una selección de sustrato restringida (esencialmente fondos blandos), ya que morfológicamente están adaptados para el enterramiento, por lo que aprovechan la materia orgánica intersticial para alimentarse (Galván-Villa et al., 2018). Estos invertebrados poseen espinas y pies ambulacrales que sirven como órganos de locomoción. Por un lado, las espinas les sirven empujar y levantar la superficie oral, en tanto que los pies ambulacrales sirven para excavar y desplazarse, igual que algunas estrellas de mar (Brusca y Brusca, 2003). La actividad de excavación de este grupo de organismos permite la mezcla de los sedimentos y partículas orgánicas de la capa superficial del fondo marino, lo que favorece la recirculación de materia orgánica (Hilber y Lawrence, 2009), así como la presencia y distribución de otros organismos, como crustáceos carídeos, moluscos, anélidos, entre otros (Morin et al., 1985).
E. michelini es una especie de equinoideo irregular característico del Caribe, se distribuye desde Cabo Hatteras, Carolina del Norte, la punta sur de la Florida a través del golfo de México hasta Venezuela y Cuba, con una distribución batimétrica que va desde los 3 hasta los 90 m de profundidad (Alvarado y Solís-Marín, 2013; Hendler at al., 1995). Para el caso del Caribe colombiano, se ha documentado en las ecorregiones del Tayrona, Magdalena y Morrosquillo, en esta última, específicamente en la bahía de Cispatá (Borrero-Pérez et al., 2012; Quirós-Rodríguez, 2015). Habita esencialmente en sustratos arenosos enterrados justo debajo de la superficie, vive en arenas gruesas y finas con residuos de pastos marinos o algas filamentosas (Hendler et al., 1995).
Por otra parte, E. michelini presenta asociaciones con algunos invertebrados incluyendo al crustáceo Dissodactylus crinitichelis Moreira, 1901 el cual reside sobre una densa capa de espinas en el lado oral de los equinoideos irregulares (Campos y Solís-Marín, 1998; George y Boone, 2003). La presencia de este tipo de asociaciones entre organismos que habitan en fondos blandos como entre los equinodermos - crustáceos, es un aspecto muy notable en las comunidades marinas y la adopción de este hábito de vida posee consecuencias en las especies implicadas, tales como la modificación en las estructuras y tallas del huésped y adaptaciones relacionadas al tamaño, morfología, y otras características del hospedero, las cuales se verán reflejadas directamente en un cambio para la vida social de estos organismos (Arcos, 2013).
La biología y la ecología de erizos irregulares han sido poco estudiadas en Colombia, por lo general los estudios de estructura, y ecología poblacional en macroinvertebrados marinos, se dirigen hacia especies de importancia comercial. Sin embargo, es necesario centrarse en las especies de equinoideos irregulares y detallar aspectos como la densidad poblacional, la estructura de tallas, aspectos morfométricos y relaciones ecológicas que puedan presentar con otras especies en estos ambientes marinos, más aún cuando existe un incremento en la destrucción y pérdida de sus hábitats en los últimos años (ya sea por causas antrópicas o naturales). Este estudio se realizó con el fin de ampliar el conocimiento sobre la ecología del equinoideo irregular E. michelini, incluida la asociación con el pinoterido D. crinitichelis en fondos someros del sector la Ahumadera, bahía de Cispatá, Caribe colombiano. Esta información constituye un marco de referencia para proponer medidas de conservación de esta especie y proporciona datos relevantes sobre el estado de la población de este equinoideo en esta área del Caribe colombiano.
Materiales y métodos
La presente investigación se realizó en la bahía de Cispatá, la cual se encuentra localizada en el Caribe colombiano, al extremo sur del golfo de Morrosquillo. El área de estudio se caracteriza por presentar 2 épocas climáticas: una seca que comprende desde mediados de diciembre a mediados de abril y una de lluvias que incluye los meses de agosto a noviembre, presentándose las mayores precipitaciones hacia el mes de octubre, los periodos comprendidos desde la segunda mitad de abril hasta julio se consideran como transiciones o inicio esporádico de lluvias (Ávila, 2009).
De acuerdo con MADS-INVEMAR (2013), esta zona se desarrolla bajo las siguientes condiciones físicas: 1) déficits en los aportes fluviales de agua y sedimentos, 2) condiciones bajas - intermedias de energía del oleaje, 3) presencia de mareas meteorológicas de gran intensidad, 4) rango micromareal, y 5) permanente intervención antrópica sobre el sistema físico-litoral.
Dentro de la bahía de Cispatá, se escogió el sector La Ahumadera, el cual tiene una extensión de 1.08 km2 y se encuentra entre los 9°24’51.7” N, 75°48’82.1” O. La temperatura superficial del agua varía entre los 22 y 28 °C con una alta productividad. Además, se caracteriza por ser de agua muy someras y poseer un sustrato fango-arenoso colonizado principalmente por esponjas y praderas de Thalassia testudinum Banks ex König, 1805 (Quirós-Rodríguez, 2015).
Se realizaron 7 salidas de campo de marzo a septiembre de 2017, utilizando la técnica de transecto de banda (CARICOMP, 2001), en donde se colocaron 5 transectos de 10 m de longitud × 2 m de ancho, perpendiculares a la línea de costa y separados entre sí por al menos 5 m, abarcando un área muestreada de 100 m2; los transectos se ubicaron sobre el sustrato a una profundidad entre los 0 y 2 m; se procedió a contabilizar los individuos de E. michelini que se encontraban dentro del área delimitada. Posteriormente fueron medidos in situ utilizando una cinta métrica, evitando al máximo cualquier tensión fisiológica en los organismos. Para la obtención de las medidas se siguió la metodología utilizada por Arévalo (1978), para ello se tomó del erizo la talla, correspondiente al diámetro mayor de los individuos (D), además se midió el diámetro menor (d), altura del ápice (h), longitud de la lúnula posterior (LLp), longitud de las lúnulas ambulacrales anteriores (LLAa) y longitud del pétalo anterior (LPA).
Cabe resaltar que en salidas anteriores a campo, se había registrado la asociación de E. michelini con el cangrejo pinotérido Dissodactylus crinitichelis, por lo que para entender esta relación ecológica, se procedió a revisar a cada uno de los individuos de E. michelini para verificar si se encontraban D. crinitichelis, de ser así se hicieron algunas anotaciones ecológicas y se procedió a recolectar a los ectosimbiontes, se rotularon y conservaron en alcohol al 70%, posteriormente fueron trasladados al Laboratorio de Microscopía del Centro de Investigación Piscícola de la Universidad de Córdoba (CINPIC). Los individuos de E. michelini fueron devueltos al medio.
En las instalaciones de la Universidad de Córdoba, para constatar la identificación taxonómica de D. crinitichelis, se realizaron observaciones estereoscópicas y se hicieron comparaciones con las descripciones de Griffith (1987). Posteriormente, cada individuo de D. crinitichelis fue ubicado en una caja de Petri con alcohol y fotografiado en un estereoscopio Carl Zeiss Stemi 2000 (Canon 16x Zoom), las imágenes fueron procesadas y las mediciones se hallaron utilizando el software Carl Zeiss Axiovisión 4.8. Las medidas a los especímenes de D. crinitichelis se realizaron con base a la metodología de Scelzo (1985). Se tuvo en cuenta la longitud total del cefalotórax desde el frente hasta el borde del mismo, el ancho del cefalotórax en su parte más ensanchada, la longitud del abdomen y el ancho del segundo somito abdominal en machos y hembras (este último fue utilizado como indicativo de la talla). El sexo se determinó teniendo en cuenta la forma del abdomen (estrecho en machos y ensanchado en hembras).
Con los datos obtenidos en campo y laboratorio, se procedió a realizar matrices de datos en la hoja de cálculo Microsoft Excel ® 2016. La densidad poblacional de E. michelini fue estimada mensualmente empleando la fórmula: D = N i / A i ; donde N i es el número total de individuos contabilizados y A i es el área total (m2). Para el caso de la estructura de tallas, se elaboraron histogramas de frecuencias del diámetro mayor de los organismos encontrados en el área de interés. También se aplicaron las pruebas de Shapiro-Wilks y Bartlett para determinar si los datos de abundancia y talla cumplían con los supuestos de normalidad y homocedasticidad (Zar, 1999). Debido a que dichas variables no presentaron una distribución normal, se realizó una prueba de Kruskal-Wallis con el fin de determinar si existían diferencias estadísticamente significativas a nivel mensual, por último, se aplicó una prueba de comparaciones múltiples (LSD). Para el caso de las medidas morfométricas anexas, los valores se reportan como la media ± error estándar (x ± SE) para cada uno de los meses de estudio. Esta información se obtuvo mediante el paquete estadístico STATGRAPHIC Centurión XVI y el programa XLSTAT 7.5 (Addindoft, 2007).
Con el fin de determinar la proporción de E. michelini que presentaron D. crinitichelis en el sector la Ahumadera, se estimó la incidencia de este último mediante los índices de intensidad y prevalencia (Margolis et al., 1982); el primero indica la cantidad de simbiontes que se encuentran por hospedero, y se calcula dividiendo el número de simbiontes encontrados, entre el número de erizos hospederos. La prevalencia muestra la proporción de la población que sufre simbiosis y se obtiene al dividir el número de individuos que sufren simbiosis entre el total de organismos revisados. También se procedió a establecer si existía independencia entre la talla de E. michelini y la abundancia de D. crinitichelis o si estaban relacionadas usando una prueba de Chi- cuadrado con simulación de Monte Carlo mediante el programa R versión 3.5.3. Complementariamente, se comprobó si existía alguna afinidad de los cangrejos con algunas estructuras morfológicas de los erizos y los meses de muestreo, y para ello, se realizó un análisis de componentes principales (ACP), donde se tuvieron en cuenta: las medidas morfométricas de E. michelini, la abundancia mensual de D. crinitichelis y los meses de estudio, ésto se realizó utilizando el software XLTSAT 7.5.2.
Resultados
A lo largo del estudio fueron contabilizados 405 individuos de E. michelini, presentándose una densidad media de x = 0.58 ± DE = 0.14 ind m-2 en el sector La Ahumadera. Los mayores valores de densidad se presentaron en los meses de abril y mayo con 0.69 ± 0.07 ind m-2 y 0.69 ± 0.04 ind m-2 respectivamente, el mes de marzo presentó el menor valor (0.37 ± 0.02 ind m-2) (Fig. 1). La prueba de Kruskal-Wallis registró diferencias estadísticamente significativas en los valores de densidad de E. michelini registrados durante los meses de muestreo (p < 0.05). Al aplicar una prueba LSD a posteriori, se observó una tendencia a agrupamientos; el mes de marzo, con la media más baja forma el grupo A, seguido de los meses: agosto, junio, septiembre y julio, que forman el grupo C, mayo y abril con medias más altas forman el grupo B (Tabla 1).

Figura 1. Densidad media de E. michelini en La Ahumadera durante el periodo de estudio. Las barras representan el error estándar.
Tabla 1. Comparación múltiple de medias de la densidad y talla de E. michelini, mediante el método LSD.
| Densidad ind m-2 | Talla (cm) | |||
| Meses | Media estimada | Grupos homogéneos | Media estimada | Grupos homogéneos |
| marzo | 7.4 | A | 9.6 | A |
| abril | 13.8 | B | 9.59 | A |
| mayo | 13.8 | B | 9.74 | A |
| junio | 10.8 | C | 10.1 | B |
| julio | 13.4 | C | 10.18 | B |
| agosto | 8.4 | C | 10.09 | B |
| septiembre | 13.4 | C | 10.03 | B |
Para el caso de la estructura de tallas E. michelini, la especie presentó una distribución de tallas multimodal, registrándose una talla promedio de 9.91 ± 0.25 cm, siendo 6.2 cm el valor mínimo y el 11.9 cm el valor máximo registrado. La mayor frecuencia para tallas grandes se presentó en mayo y septiembre; las tallas pequeñas obtuvieron una mayor frecuencia en marzo y julio. Los organismos de tallas intermedias fueron los más representativos durante los meses de estudio (Fig. 2). La prueba de Kruskal-Wallis no arrojó diferencias estadísticamente significativas entre la distribución de las tallas por mes de E. michelini en el sector La Ahumadera (p > 0.05); no obstante, la prueba de múltiples rangos mostró una tendencia a la formación de 2 grupos: marzo, abril y mayo formaron el grupo A con las medias más bajas, septiembre, agosto, junio y julio reunieron el grupo B con las medias más altas (Tabla 1).

Figura 2. Histograma de frecuencia de tallas (diámetro) por mes registradas de E. michelini en el sector La Ahumadera, Caribe colombiano.
Además del diámetro mayor, se tomaron medidas morfométricas complementarias de E. michelini, para el caso del diámetro menor y la altura, los mayores valores se presentaron en el mes de julio con 10.3 ± 0.5 cm y 4.87 ± 0.34 cm respectivamente, esta misma tendencia la presentó la variable longitud de las lúnulas ambulacrales posteriores con el valor más alto en julio (1.13 ± 0.04 cm). Por otra parte, los valores de la longitud del pétalo anterior y longitud de pétalos ambulacrales fueron más grandes en septiembre con valores de 2.92 ± 0.32 y 3.09 ± 0.02 cm, respectivamente (Tabla 2).
Tabla 2. Medidas morfométricas de E. michelini. d, diámetro menor; h, altura; LLP, longitud de lúnula posterior; LLAa, longitud de lúnulas ambulacrales anteriores; LLAp, longitud de lúnulas ambulacrales posteriores; LPA, longitud del pétalo anterior; LPAa, longitud de pétalos ambulacrales anteriores; LPAp, longitud de pétalos ambulacrales posteriores.
| Mes | d (cm) | h (cm) | LLP (cm) | LLAa (cm) | LLAp (cm) | LPA (cm) | LPAa (cm) | LPAp (cm) |
| mar | 9.90 ± 0.8 | 4.60 ± 0.83 | 1.94 ± 0.41 | 0.69 ± 0.01 | 0.96 ± 0.01 | 2.66 ± 0.30 | 2.42 ± 0.07 | 3.01 ± 0.05 |
| abr | 9.88 ± 0.4 | 4.64 ± 0.32 | 2.01 ± 0.28 | 0.69 ± 0.01 | 0.94 ± 0.01 | 2.71 ± 0.25 | 2.44 ± 0.02 | 3.05 ± 0.01 |
| may | 10.2 ± 0.5 | 4.55 ± 0.53 | 2.02 ± 0.27 | 0.73 ± 0.02 | 1.06 ± 0.01 | 2.62 ± 0.42 | 2.96 ± 0.01 | 2.36 ± 0.03 |
| jun | 10.3 ± 0.5 | 4.82 ± 0.27 | 2.07 ± 0.27 | 0.70 ± 0.05 | 1.01 ± 0.05 | 2.83 ± 0.25 | 3.00 ± 0.01 | 2.46 ± 0.02 |
| jul | 10.4 ± 0.5 | 4.87 ± 0.34 | 1.99 ± 0.32 | 0.67 ± 0.03 | 1.13 ± 0.04 | 2.84 ± 0.22 | 2.98 ± 0.01 | 2.43 ± 0.02 |
| ago | 10.3 ± 0.5 | 4.72 ± 0.63 | 2.03 ± 0.51 | 0.72 ± 0.01 | 1.00 ± 0.01 | 2.81 ± 0.24 | 3.02 ± 0.03 | 2.41 ± 0.06 |
| sep | 10.2 ± 0.9 | 4.78 ± 0.83 | 1.99 ± 0.31 | 0.67 ± 0.03 | 1.01 ± 0.01 | 2.92 ± 0.32 | 3.09 ± 0.02 | 2.67 ± 0.29 |
Por otra parte, de los 405 individuos de E. michelini registrados, el 14.5% presentó asociación con D. crinitichelis (Fig. 3), encontrándose un total de 64 individuos de D. crinitichelis en 59 de E. michelini. De los 64 individuos de D. crinitichelis, 45 eran machos (70%) y 19 hembras (30%), determinándose así una proporción de sexos para este crustáceo de 2.3:1, sesgada a los machos. El mayor número de machos recolectados fue de 11 en el mes de junio y de hembras recolectadas fue de 6 en el mes de abril. El menor número de individuos recolectados fue de 2 machos y 1 hembra en el mes de agosto. De acuerdo con la prueba de Chi-cuadrado no se presentaron diferencias estadísticamente significativas entre el número de machos y hembras (p > 0.05). Al realizar un análisis por intervalos de talla se encontró una mayor abundancia .de cangrejos simbiontes en individuos de E. michelini con tallas intermedias (10-10.5 cm) y una menor preferencia por individuos de tallas pequeñas (Fig. 4). Sin embargo, la prueba de independencia (Chi-cuadrado con simulación de Monte Carlo) mostró que no existe relación entre la talla del erizo irregular y la abundancia de D. crinitichelis (p > 0.05).

Figura 3. Dissodactylus crinitichelis habitando en la parte oral de su hospedero E. michelini. Escalas: crustáceo = 1 cm; equinoideo = 9 cm.

Figura 4. Distribución de la abundancia de D. crinitichelis de acuerdo con los intervalos de talla de E. michelini en el área de estudio.
En cuanto al índice de intensidad y prevalencia, se obtuvo una intensidad promedio de 1.1 ± 0.1 huéspedes por hospedero. El mayor valor se presentó en marzo (1.3) encontrándose 4 individuos de D. crinitichelis en 3 individuos de E. michelini. La intensidad menor (1.0) se presentó en junio y agosto, encontrándose 13 individuos de D. crinitichelis en 13 individuos de E. michelini, y 3 individuos de D. crinitichelis en 3 individuos de E. michelini, respectivamente (Fig. 5). La prevalencia, dada por el número de hospederos infestados del total muestreado, reportó un promedio de 0.14 ± 0.06 individuos de E. michelini infestados; siendo julio donde se encontró un porcentaje mayor (24%); para agosto se reportó el porcentaje más bajo (7.1%) de todo el estudio (Fig. 6).

Figura 5. Índice de intensidad de D. crinitichelis sobre E. michelini durante el periodo de muestreo.
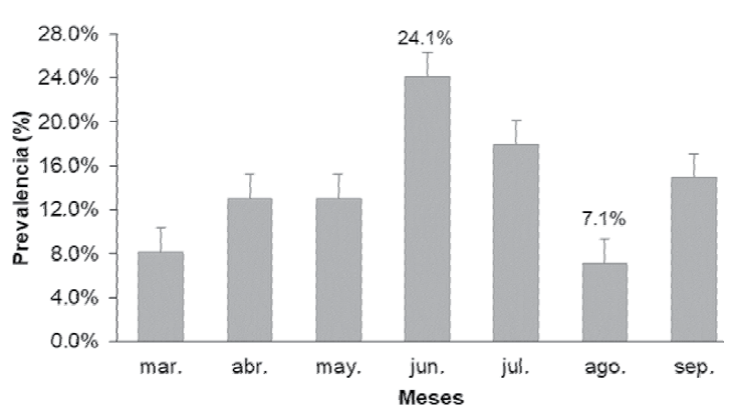
Figura 6. Porcentaje de prevalencia de E. michelini por mes de estudio. Las barras representan el error estándar.
El ACP mostró que la variación morfométrica y la abundancia de D. crinitichelis son continuas a lo largo de los distintos meses de estudio. La primera variable reunió el 39.76% de la varianza entre los grupos de datos, y la segunda el 26.93%. La variable 1 estuvo influenciada por la longitud de la lúnula posterior (Llp) y la longitud de las lúnulas ambulacrales posteriores I y V (LlAp I y LlAp V)asociada a los meses de mayo y agosto. La variable 2 estuvo influenciada por la altura de la testa (h) y longitud de las lúnulas ambulacrales anteriores II y IV (LlAa II y LlAaIV) asociada a junio y julio (Fig. 7).

Figura 7. Análisis de componentes principales teniendo en cuenta los meses, medidas a las estructuras de E. michelini y abundancia de D. crinitichelis. h: Altura del ápice; LlAa II y IV: longitud de las lúnulas ambulacrales anteriores II y IV; Llp: longitud de lúnula posterior; LlAp I y V: longitud de las lúnulas ambulacrales posteriores I y V.
Discusión
La elevada productividad de los fondos someros del sector La Ahumadera, en su mayoría caracterizados por sustrato fango-arenoso y arenoso con parches de pastos marinos puede explicar la presencia de la especie E. michelini en esta zona (Quirós-Rodríguez, 2015). La actividad de bioturbación realizada por esta especie puede ser fundamental para la oxigenación del sedimento, el aumento de la disponibilidad de materia orgánica y el reciclaje de nutrientes, procesos vitales que están ligados a la productividad de estos fondos marinos (Solan et al., 2004).
El erizo irregular E. michelini en el sector La Ahumadera presentó densidades similares a las reportadas por Cunha (2015) en las costas de Brasil, quienes registraron una densidad media de 0.27 ± 0.72 ind m-2, siendo mayo el mes con mayor valor promedio reportado (0.58 ind m-2). En el presente estudio, E. michelini registró una disminución de sus abundancias en época seca y un aumento en los meses de época de lluvias, en donde el Caribe colombiano presentó volúmenes de precipitación entre los 100 y 200 mm (IDEAM, 2017), lo cual puede favorecer la disponibilidad de nutrientes debido a la resuspensión a causa de las mareas, incrementando así la productividad primaria y por ende la oferta alimenticia de estos organismos (Yáñez-Arancibia et al., 1998).
Un factor que puede influir en las densidades de E. michelini es el aporte de agua dulce por la precipitación pluvial y la incidencia del antiguo delta del río Sinú, lo cual provoca un aumento de la tasa de sedimentación de materia orgánica que genera oferta alimenticia para estos organismos (Granja-Fernández y López-Pérez, 2008). Bentley y Cockcroft (1995), en su estudio con Echinodiscus bisperforatus en el Sur de África, observaron mayores densidades asociados a cambios en el régimen hidrodinámico local.
En cuanto a la talla media máxima registrada para E. michelini en fondos someros del sector La Ahumadera, presentaron valores superiores a los reportada por Hilber (2006) en la isla de Sanibel, Florida, quien registró una talla media de 9.03 ± 0.59 cm para esta misma especie. En el presente estudio a pesar de no reportar diferencias marcadas de tallas durante los meses de trabajo, se observaron tallas menores (9.59-9.74 cm) en los meses correspondientes a época seca y de transición, y tallas un poco más grandes (10.03-10.18 cm) en el periodo de lluvias, lo cual puede atribuirse a una mayor disponibilidad de nutrientes producto del aumento de la tasa de sedimentación de materia orgánica por las precipitaciones. Según Borzone et al. (1996), la presencia de metales pesados, principalmente magnetita, parece contribuir al aumento de la densidad corpórea de los individuos menores, ayudándolos a permanecer justo en el fondo, hasta la formación completa de las lúnulas y el crecimiento de la testa. Sin embargo, en este estudio no se evaluaron las variables químicas del medio para corroborar lo anterior.
Las medidas morfométricas realizadas en E. michelini registraron individuos de mayor tamaño en los meses de julio y septiembre, e individuos de tamaño menor en los meses de marzo y abril. Todos los individuos contabilizados a lo largo del estudio se encontraron en entre 8 y 12 cm. Teniendo en cuenta las medidas obtenidas en los meses de estudio, es posible asociar el tamaño de las estructuras de los individuos con la estacionalidad y la dinámica de las corrientes marinas. Los individuos con menor altura de la testa se encontraron en los meses de marzo y mayo, periodo comprendido por época seca y primeras lluvias, mientras que los individuos de mayor altura de testa se registraron en julio, meses de lluvias abundantes. Lawrence (1987) y Telford (1982) describen que la forma achatada de los erizos irregulares es funcional para el hábito de excavación superficial y que serviría para minimizar fuerzas como el arrastre. Por el contrario, la forma más convexa favorecería fuerzas como el empuje, que desplaza al animal. Cuanto menor la concavidad, mayor sería la resistencia del cuerpo en lugares donde hubiera gran energía de ondas. Así, tener una mayor altura de la testa sería desventajoso para los individuos residentes en esos lugares. Asociado a la resistencia al empuje, se encuentra otra característica estructural, el tamaño de las lúnulas.
Según Telford (1982), los individuos con lúnulas menos desarrolladas tienden a ser movidos más fácilmente, ya que estas estructuras promueven una entrada de la corriente de agua hacia abajo del invertebrado minimizando el empuje. En este estudio, se describieron individuos con lúnulas ambulacrales de menor longitud en comparación con la lúnula posterior. Esto demostraría la adaptación de los individuos residentes en ambientes con mayor turbulencia, los cuales serán favorecidos por la presencia de lúnulas más desarrolladas, que consecuentemente les proporciona mayor resistencia a estos organismos (García, 1996).
En cuanto a la asociación de E. michelini y D. crinitichelis, la mayor ocurrencia fue observada en hospederos entre 10 y 10.5 cm. En este trabajo no se encontró ninguna relación entre el número de cangrejos y el tamaño de los erizos irregulares; sin embargo, se observó una preferencia de los cangrejos por erizos de tallas más grandes. Guilherme et al. (2015) y Martinelli-Filho et al. (2014) obtuvieron un resultado similar en sus estudios, y a pesar de no hallar relación en sus resultados, plantean que la relación es positiva.
Algunas investigaciones sugieren que la relación entre la talla del hospedador y el número de cangrejos que éste es capaz de albergar puede verse influenciada por la capacidad de los equinoideos para cavar (Dexter, 1977). Para Werding y Sánchez (1989), los erizos de mar más grandes tienen una mayor capacidad de excavación y habitan las capas de sedimentos más profundas en comparación con las clases de menor tamaño, lo que minimiza la infestación de ectosimbiontes. Es probable que E. michelini siga un patrón de comportamiento de escape, lo cual puede demostrar la necesidad de esconderse y desplazarse hacia partes más profundas del sustrato en respuesta al estrés causado por la infestación de simbiontes; demostrando que los erizos irregulares son capaces de moverse voluntariamente y, por lo tanto, migrar a regiones más profundas para alimentarse, reproducirse o eliminar organismos asociados a su testa (Guilherme et al., 2015).
D. crinitichelis puede encontrar protección contra la depredación en sus hospederos. Debido a que E. michelini se encuentra en agregaciones densas, es posible que los cangrejos se muevan fácilmente de un hospedador a otro y presenten diferencias relacionadas con el sexo. Thiel et al. (2003) sugieren que los machos adultos tienen una alta tendencia a moverse entre sus hospedadores ya sea por aspectos reproductivos, competencia por espacio o protección contra la depredación, mientras que las hembras sexualmente maduras tienen tasas de movimiento más bajas entre los erizos de mar. Lo cual puede explicar la abundancia de machos encontrados con respecto a las hembras que en su mayoría eran ovígeras.
Martinelli-Filho et al. (2014), en su investigación con la especie congénere D. primitivus plantean que esta tiene un sistema de apareamiento polígamo donde los machos y las hembras se mueven entre los hospedadores para la búsqueda de parejas. En este caso es probable que D. crinitichelis tenga un sistema de apareamiento similar basado en la competencia interespecífica, debido a que en las observaciones las hembras adultas se encontraron individuales, mientras que los machos eran más abundantes incluso por pares en un hospedero, posiblemente durante el muestreo los machos se mantuvieron en movimiento en busca de espacio o por fines reproductivos debido a la baja abundancia de hembras disponibles para la reproducción. Sin embargo, esta es una hipótesis que se sugiere probar experimentalmente.
Los organismos con un estilo de vida simbiótico están restringidos en su distribución y abundancia por la disponibilidad de hospedadores adecuados (Thiel et al., 2003). Algunos factores como la morfología, el tamaño y los patrones de distribución del hospedador, probablemente afecten la abundancia de simbiontes por huésped (intensidad), el porcentaje de hospederos ocupados (prevalencia) y, por lo tanto, interacciones intraespecíficas entre organismos simbióticos (Tsuchiya y Yonaha, 1992). La intensidad y prevalencia de estas asociaciones de crustáceos y otros invertebrados es diversa. Muchas especies habitan en sus hospedadores de forma individual (Thiel y Baeza, 2001), mientras que otros se encuentran en pares heterosexuales (Hsueh y Huang, 1998) o en grupos de números variables (Patton et al., 1985). En este caso, se reportó una intensidad máxima de 2 huéspedes por hospedero, generalmente en pares homosexuales (5) y solo 1 par heterosexual durante los meses de estudio; respecto a la prevalencia, el 14% del total de la población estudiada sufría simbiosis.
Según Thiel y Baeza (2001), es probable que el patrón de asociación intraespecífica de crustáceos en los erizos de mar dependa del tamaño, la morfología, la distribución y la abundancia del hospedador, teniendo en cuenta estos 2 últimos aspectos los erizos de mar pueden formar agregaciones o parches formadas por numerosos individuos, que están en contacto directo entre sí (Reese, 1966); en este tipo de distribución los crustáceos pueden moverse fácilmente de un erizo de mar a otro (Bell, 1984). La hipótesis de que en estas condiciones los cangrejos simbióticos se mueven sin ningún impedimento entre diferentes galletas de mar, se vio respaldada por la observación de Baeza y Thiel (2000), en donde los grupos de cangrejos en erizos de mar individuales no muestran una estructura demográfica distinta.
El cálculo previo del coeficiente de variación mostró a la longitud de la lúnula ambulacral anterior II, la longitud de lúnula ambulacral posterior I y la altura de la testa como las variables más significativas. De acuerdo a esto se podría pensar que el tamaño y morfometría de E. michelini fueron variables, que influenciaron la abundancia del cangrejo D. crinitichelis durante los meses de estudio en el sector La Ahumadera. La variable h se correlacionó positivamente con la abundancia de D. crinitichelis en julio; dentro de este conjunto también se agruparon las medidas de longitud de lúnulas II y IV en junio, posiblemente porque compartieron las mismas características climáticas asociadas a la disminución de lluvias que se presentó en la costa Caribe (IDEAM, 2017).
De acuerdo con Lawrence (1987) y Telford (1982), la forma más convexa o alturas mayores de la testa disminuyen la capacidad de excavación superficial de los equinoideos, de tal manera que es más complicado liberarse de los ectosimbiontes de D. crinitichelis, lo cual explicaría la agrupación de las variables. Por otro lado, se observó la agrupación de las variables longitud de la lúnula posterior y longitud de las lúnulas ambulacrales posteriores I y V en mayo, posiblemente porque durante este periodo de lluvias, los equinoideos tienen la necesidad de mitigar la fuerza de empuje generada por las corrientes marinas; según García (1996), la presencia de lúnulas posteriores más desarrolladas, le proporciona mayor resistencia a estos organismos, debido a que estas estructuras permiten el desplazamiento de la corriente de agua que se genera principalmente durante estas épocas hacia abajo del animal, lo cual podría explicar la formación de este grupo en el componente.
Hasta el momento, D. crinitichelis ha sido reportado en asociación con 6 equinoideos: 5 del orden Clypeasteroida y 1 del orden Spatangoida (Tabla 3). En Colombia se ha encontrado a D. crinitichelis en asociación con Meoma ventricosa (Lima et al., 2014; Werding y Sánchez, 1989). Por lo que el presente trabajo informa la asociación entre D. crinitichelis y E. michelini por primera vez para Colombia. Aquí se sugiere que D. crinitichelis tiene una asociación simbiótica no obligatoria con E. michelini. A lo largo del estudio, D. crinitichelis mostró un patrón de comportamiento igual, siempre se encontró en la parte oral de E. michelini moviéndose y refugiándose entre las espinas y en la mayoría de los casos entre las lúnulas, lo que debe ofrecer algún refugio contra la depredación.
Tabla 3. Lista de verificación de los registros de asociación entre Equinoideos y D. crinitichelis. Modificado de Lima et al. (2014).
| Echinoidea (Hospedero) | Localidad | Referencia |
| Clypeaster subdepressus | Golfo de México | Powers (1977); Schmitt et al. (1973); Werding y Sánchez (1989) |
| Leodia sexiesperforata | Cuba; Barbados; Bahía (Brasil) | Campos y Solís-Marín (1998); Griffith (1987); Pohle y Telford (1981); Queiroz et al. (2011); Schmitt et al. (1973); Telford (1982) |
| Encope emarginata | Carolina de Norte, Florida (USA); Yucatán, golfo de México; Pernambuco, Bahía, São Paulo y Santa Catarina (Brasil) | Almeida et al. (2010); Coelho y Ramos-Porto (1995); Costa (1969); Fumis et al. (2006); Martins y D’Incao (1996); Schmitt et al. (1973); Werding y Sánchez (1989); Williams et al. (1968) |
| Encope michelini | Golfo de México | Powers (1977); Schmitt et al. (1973); Wass (1955); Werding y Sánchez (1989) |
| Mellita quinquiesperforata | Paraíba (Brasil) | Lima et al. (2014) |
| Meoma ventricosa | Santa Marta (Colombia); Espírito Santo (Brasil) | Werding y Sánchez (1989); Wirtz et al. (2009) |
Teniendo en cuenta las observaciones en campo, los cangrejos permanecieron aferrados a las espinas de E. michelini incluso después de que los erizos fueron sacados del agua. Este comportamiento es similar al reportado por Queiroz et al. (2011) y Werding y Sánchez (1989) en sus estudios con D. crinitichelis y otras especies de equinoideos. El erizo objeto de estudio parece actuar como un substrato conveniente para D. crinitichelis, que se mueve sobre la superficie del sedimento (Alexander y Ghiold, 1980).











 nueva página del texto (beta)
nueva página del texto (beta)


