Introducción
En México se cultiva fresa (Fragaria vesca L.) en 12 estados, pero solamente Baja California, Guanajuato y Michoacán generan 91.55% del total de producción nacional (Santoyo, 2009). El moho gris (Botrytis cinerea Pers. ex Fr.) es una de las principales enfermedades de la fresa; este fitopatógeno tiene la capacidad de actuar como saprófito y ha sido considerado de alta importancia, ya que afecta un amplio número de cultivos alrededor del mundo. Las pérdidas en el cultivo de fresa pueden ser severas, hasta 25% en la cosecha principal y alrededor de 37% en el segundo pico productivo, por lo que sin un control efectivo pre y poscosecha se puede ocasionar grandes mermas económicas, afectando la productividad en cantidad y calidad de la cosecha (Ceredi et al., 2009).
Para el control de B. cinerea, el empleo de fungicidas modernos que actúan sobre sitios metabólicos específicos del hongo ha traído como consecuencia la formación de razas resistentes de éste a ciertos productos químicos, en este sentido, ha surgido la necesidad de buscar otros recursos para el manejo integrado de la enfermedad (Cano, 2013).
Algunos métodos explorados en plantas para control fúngico consisten en usar antagonistas microbianos que regulan poblaciones de fitopatógenos (Chávez, 2004), también se ha implementado el uso de extractos vegetales para control de enfermedades fungosas, ya que son una rica fuente de productos químicos bioactivos (Balandrin et al., 1985). Estos métodos actualmente se pueden emplear como parte del manejo integrado de enfermedades, y recientemente, el empleo de sustancias homeopáticas es otro recurso promisorio para el biocontrol de hongos fitopatógenos y que comparado con los métodos anteriores, es atractivo por su bajo costo (Meneses, 2007).
El modelo de estudio in vitro de sustancias u organismos para control de enfermedades fungosas es un recurso metodológico útil para seleccionar lo promisorio y perfilar su evaluación in vivo. En este sentido, pruebas in vitro de sensibilidad de hongos a fungicidas ayudan a determinar si su actividad biológica es o no la que se espera, sea porque el hongo desarrolla resistencia o por aspectos relacionados con la calidad y cantidad del producto sintético utilizado (Mercier et al., 2010); por ello, la inclusión de tratamientos testigo y la verificación del efecto fungicida o fungistático son aspectos metodológicos necesarios.
En cuanto a trabajos sobre el empleo de extractos vegetales contra hongos en condiciones in vitro, son numerosas las investigaciones, pero sobre Botrytis destacan los relacionados con extractos de Larrea tridentata (Lira, 2003) y de Lippia origanoide (Taborda, 2015). En el caso de extractos de plantas de gobernadora (L. tridentata) su efecto es positivo para el control no solo de Botrytis sino también de Fusarium, Pythium y Rhizoctonia, esta fuente vegetal de metabolitos se encuentra distribuida en regiones áridas de Durango y Coahuila (Lira, 2003).
En el caso de aceites esenciales contra Botrytis, pocos son los estudios sobre Tagetes que destacan efecto de total inhibición (Romagnoli et al., 2005), aunque en otros trabajos se consigna efecto positivo contra otras especies de hongo (Barajas et al., 2011; López et al., 2018). En general, pocas son las especies de Tagetes exploradas por su efecto contra hongos y en el caso de Tagetes lemmonii, especie distribuida regionalmente en Sonora y Durango (Serrato, 2014), es escasa la investigación.
El extracto metanólico de T. lemmonii es antifúngico en Botrytis (Bojórquez, 2017) y el aceite esencial ocasiona inhibición de Fusarium oxysporun f. sp. ricini (Jarquín, 2016), este último no se ha explorado contra B. cinerea. Con respecto a Trichoderma harzianum se le refiere como antagonista de Botrytis (Merchán, 2014) y en trabajos realizados en condiciones in vitro, se evidencia la inhibición total del crecimiento del hongo (Calvo, 2012).
En relación con el efecto de sustancias homeopáticas contra enfermedades fungosas en plantas se tienen varios trabajos realizados en condiciones in vivo (Oliveira et al., 2013; Hanif y Dewar, 2015; Lorenzetti et al., 2016; Rissato et al., 2016; Oliveira et al., 2017) y solamente seis in vitro (Carneiro y Bueno, 2010; Gama et al., 2015; Lorenzetti et al., 2016; Rissato et al., 2016; Toledo et al., 2016; Serrato et al., 2018) entre estos últimos, dos de ellos se refieren a nosodes y cuatro a diversas sustancias, mostrando efecto antifúngico directo y ninguno de ellos evaluado contra B. cinerea.
De los resultados de la aplicación de sustancias homeopáticas in vitro contra hongos, destaca el principio homeopático similia similibus curentur relacionado con sustancias como el arsénico, fósforo, azufre, Arnica montana, etc. (Tichavsky, 2007), que inhiben hongos como: Aspergillus niger, Alternaria solani y Sclerotinia scleroturum (Gama et al., 2015; Toledo et al., 2016; Rissato et al., 2016) también destaca otro principio homeopático, el más similar, que corresponde a la elaboración de nosode, sustancia homeopática derivada del organismo que ocasiona la enfermedad o el daño, como en los casos de Alternaria solani, Fusarium solani y Sclerotinia scleroturum evaluados in vitro (Carneiro y Bueno, 2010; Rissato et al., 2016).
En condiciones in vivo, la aplicación de sustancias homeopáticas contra hongos presupone señales que la planta recibe preparándola para enfrentar el establecimiento del patógeno; sin embargo, la incorporación de la sustancia homeopática (sustancia dinamizada o el nosode) al medio de cultivo in vitro puede influir directamente en el patógeno; es decir, influirlo por contacto, respuesta biológica que poco se ha argumentado en el fenómeno agrohomeopático (Carneiro y Bueno, 2010; Lorenzetti et al., 2016; Rissato et al., 2016).
Aunque se reportan estudios comparativos de tratamientos químicos, orgánicos y biológicos en condiciones in vitro contra hongos fitopatógenos (Jarquín, 2016), son relativamente escasos los que incluyen sustancias homeopáticas (Oliveira et al., 2013; Gama et al., 2015; Lorenzetti et al., 2016; Serrato et al., 2018). Considerado la poca exploración que se tiene sobre el aceite de T. lemmonni como antifúngico, la escasa información sobre sustancias homeopáticas con efecto directo en hongos y su limitada inclusión en estudios comparativos de eficiencia antifúngica en el modelo in vitro, así como la importancia de reducir costos en el control de B. cinerea en fresa, en el presente trabajo se compararon tratamientos convencionales y sustancias homeopáticas in vitro contra B. cinerea con la finalidad de generar información útil para su verificación in vivo.
Materiales y métodos
La presente investigación consistió en realizar una evaluación en condiciones in vitro de: un fungicida químico, dos sustancias vegetales, un agente biológico antagónico y dos soluciones homeopáticas (Cuadro 1). El experimento se llevó a cabo en el Laboratorio de la Maestría en Protección Vegetal en la Universidad Autónoma Chapingo (UACH) en 2018.
Cuadro 1 Tratamientos para evaluación en el bioensayo con B. cinerea.
Tratamiento |
Dosis |
Variables respuesta |
PDA (testigo absoluto) |
39 g L-1 |
Velocidad de crecimiento (mm∙día-1), porcentaje de inhibición (%) y porcentaje de crecimiento (%) |
Tagetes lemmonii |
1% |
|
Arsénico homeopático |
1 gota L-1 |
|
Botrytis homeopático |
1 gota L-1 |
|
Químico (Switch®) |
1 g L-1 |
|
Extracto de gobernadora |
2 mL L-1 |
|
Trichoderma harzianum |
3.5 mm |
Aislamiento de hongos fitopatógenos
El hongo fitopatógeno B. cinerea se aisló de plantas de fresa en invernadero en el Campo Experimental de la UACH. Plantas con frutos dañados, mostrando una cubierta de color café con textura de alfombra de esporas, síntoma peculiar de presencia de Botrytis en esa frutilla, se seleccionaron como fuente de inóculo. Fragmentos de tejido infectado se establecieron en condiciones asépticas en cajas Petri con medio de cultivo de agar Papa-Dextrosa (PDA) e incubadas en una cámara de crecimiento con 17 °C y 80% de humedad relativa durante ocho días y 1 h de luz diariamente.
Sustancias y organismos para evaluación biológica
El producto químico comercial Switch® (Fludioxonil, Ciprodinil) se consiguió en una tienda de agroquímicos en el municipio de Texcoco, Estado de México. También se adquirió el producto orgánico comercial Progranic® Mega (extracto de Larrea tridentata). El organismo antagónico (Trichoderma harzianum), en micelio, lo proporcionó el Dr. Roney Vidal Solano, Departamento de Parasitología Agrícola, UACH.
A partir de plantas de T. lemmonii A. Grey. (voucher 2012-199; Herbario de la Universidad de Sonora) Var. Limón (SAGARPA-SNICS, expediente 1423, registro 1629) de una plantación establecida en el Campo Experimental de la UACH en 2015 (19° 29.547’ latitud norte, 98° 52.470’ longitud oeste y 2 267 msnm, tipo climático Cw1) se cosecharon tallos en floración en septiembre de 2018. Esta biomasa fresca en cantidad de 100 kg se sometió a un proceso de hidrodestilación mediante destilador de acero inoxidable con capacidad de destilación de 200 kg, el aceite obtenido se almacenó a 18 °C en obscuridad.
Las sustancias homeopáticas las elaboró el Dr. Felipe de Jesús Ruíz Espinoza del Centro Regional Universitario del Anáhuac de la Universidad Autónoma Chapingo (UACH), para la preparación del nosode del hongo, este último se aisló de un fruto de fresa y se preparó por trituración con azúcar. Para la elaboración se tomó 0.05 g de la muestra del hongo, la cual se puso en un mortero de 4 pulgadas de porcelana. En tres bolsitas de plástico de 6 x 10 cm, se agregó 5 g de azúcar a cada una, se etiquetaron con el nombre de Botritis cinerea T1C (bolsa 1), anotando la fecha. A la bolsa 2, B. cinerea T2C y a la bolsa 3, B. cinerea T3C.
La bolsa 1 se dividió en tres tercios, agregando el primer tercio e iniciando la trituración de la siguiente manera: se molió o trituró durante 6 min, después, con una cuchara cafetera de acero inoxidable, se raspó el majadero y el mortero durante 4 min. Esto se repitió moliendo 6 min y raspando 4 min ese tercio. Al finalizar, se agregó el segundo tercio de la primera bolsita. Se repitió moler y raspar durante 6 y 4 min, respectivamente. Al finalizar se agregó el último tercio, el cual se molió durante 6 min y raspó durante 4 min, repitiendo esta secuencia hasta completar 1 h.
De ahí se guardó lo triturado en la bolsita T1C. De la trituración T1C, se tomó 0.05 g para iniciar la bolsa 2, la cual se elaboró conforme a los tiempos de la primera y al terminar la 2a bolsa se guardó e inició la tercera bolsa, al terminar, se guardó y de ahí se tomó 0.05 g de la trituración 3C, la cual se agregó en un frasco que contenía 50 gotas de agua destilada y 50 gotas de alcohol, se agitó durante 2 min y se dejó reposar 2 min.
Al finalizar, esta preparación constituyó la dilución o potencia 4C, de ahí se elaboró la 5C, 6C y la 7 C, de acuerdo con la escala centesimal Hanamanianna, como lo menciona Sandoval (1961). Esta secuencia de operaciones se hizo para arsénico, según regla 7 de la homeopatía (Zepeda, 2002), el arsénico se obtuvo en la Farmacia Homeopática Nacional ubicada en el zócalo de la Ciudad de México y las características de esta sustancia se describen en la obra de García (1984).
Preparación y evaluación en cajas Petri
Para el bioensayo se empleó el método de agar envenenado que consiste en integrar al medio de cultivo las sustancias tratamiento. El medio de cultivo PDA se preparó en siete matraces Erlenmeyer de 250 mL de capacidad. Para su esterilización, se sometieron durante 20 min en autoclave a 120 °C y 15 lb de presión. Cuando la temperatura y presión de la autoclave disminuyó alrededor de 40 °C, se sacaron los matraces. El medio PDA más las sustancias correspondientes a los tratamientos se agitaron antes de que se vertieran en las cajas Petri con el objetivo de homogenizar la mezcla.
El preparado se vacío en cajas Petri de 90 mm estériles, en condiciones asépticas y se dejaron enfriar y solidificar a temperatura ambiente durante 24 h. Al siguiente día se depositó un disco de PDA con el inóculo de B. cinerea obtenido con un sacabocado estéril de 3.5 mm de diámetro que se colocó invertido en el centro de la caja. Las cajas Petri se incubaron a 18 ±2 °C dentro de una estufa. Desde la siembra del hongo en la caja Petri y durante 8 días, se midió el diámetro del micelio con un vernier digital.
Preparación de tratamientos
La preparación dual con T. harzianum se realizó sobre medio de cultivo estéril y colocando un disco de 3.5 mm de diámetro en un extremo de la caja Petri previamente dividida a la mitad para después ubicar al otro extremo el micelio de B. cinerea. El aceite esencial de T. lemmonii puro se preparó al 1%, para lo cual se agregó 0.1 mL de surfactante Tween 20 agitando circularmente para obtener una emulsión y enseguida se disolvió homogéneamente en 100 mL de PDA, posteriormente se vertió en un matraz de 250 mL. El mismo procedimiento se utilizó para preparar el extracto de gobernadora, donde se preparó la solución de 100 mL de medio de cultivo con 2 mL del producto orgánico.
Para el producto sintético Switch®, se agregó 1 g del producto en un litro de agua y se esperó hasta que se disolviera agitándolo, traspasando 100 mL de mezcla al matraz para ser esterilizado. En el caso de las sustancias homeopáticas, en un litro de agua destilada se agregó una gota de cada solución homeopática, Botrytis 7 CH y arsénico 6 CH, por separado, para después sucusionar enérgicamente la botella durante 2 min. Posteriormente se depositó la cantidad requerida (100 mL) en los matraces Erlenmeyer de 250 mL.
Diseño experimental
El experimento se analizó por un diseño experimental completamente al azar con seis tratamientos cada uno con cinco repeticiones y un testigo absoluto, la unidad experimental consistió en una caja Petri de 90 mm de diámetro con medio de cultivo PDA incorporando los tratamientos a evaluar.
Variables registradas
El crecimiento radial del hongo se midió con una frecuencia de 24 h, finalizando hasta que la caja Petri sin tratamiento (testigo) se cubrió completamente con micelio (8 días), tomando como base este tiempo también se realizaron las evaluaciones del crecimiento dual Trichoderma-Botrytis. Las mediciones se realizaron con vernier digital. La velocidad de crecimiento del micelio (VC) se calculó con la fórmula de Sinclair y Cantero (1989).
Donde: VC= velocidad de crecimiento (mm día-1); Df= diámetro final de crecimiento (mm); Di= diámetro inicial de crecimiento (mm); Ti= tiempo inicial de crecimiento (días); Tf= tiempo final de crecimiento (días).
El porcentaje de inhibición (% I) se determinó aplicando la fórmula de Fokkema (1973), citado por Kagezi et al. (2015).
Donde: %I= porcentaje de inhibición del crecimiento micelial; D1= diámetro del crecimiento micelial del testigo (mm); D2= diámetro del crecimiento micelial del influenciado (mm).
Para calcular el porcentaje de crecimiento se empleó la fórmula.
Donde: %C= porcentaje de crecimiento micelial; CI= crecimiento influenciado (mm); CT= crecimiento del testigo (mm).
Para determinar la clase de antagonismo en condiciones de crecimiento dual, se tomó en cuenta la escala propuesta por Bell et al. (1982): 1. El antagonista sobrecrece al fitopatógeno y cubre 100% de la caja Petri; 2. El antagonista cubre 75% de la caja Petri, detiene al fitopatógeno y puede sobrecrecerlo y esporular sobre él; 3. Ningún organismo es dominante, cada uno cubre 50% de la superficie (antagonista y patógeno); 4. El fitopatógeno cubre 75% de la caja Petri y detiene el crecimiento del antagonista y lo puede sobrecrecer y esporular sobre este; y 5. El fitopatógeno sobrecrece al antagonista y cubre 100% de la caja Petri.
Análisis estadístico
Para la evaluación estadística del experimento, los datos se sometieron a un análisis de varianza combinado y prueba de comparación de medias de Tukey (p≤ 0.05) correspondientes a un diseño experimental completamente al azar con cinco repeticiones. Este análisis se efectuó mediante el software Statistical Analysis System (SAS 9.0) con el procedimiento Proc Anova.
Resultados
El agente antagónico T. harzianum controló el crecimiento del micelio de B. cinerea inhibiéndolo en 36%, aunque su velocidad de crecimiento fue menor (7.44 mm día-1) que la del patógeno en el tratamiento testigo (9.80 mm día-1) (Cuadro 2), en el tratamiento Botrytis-Trichoderma, Trichoderma logró detener el desarrollo de Botrytis al momento del contacto (Figura 1). Los coeficientes de variación fueron 6 a 17%.
Cuadro 2 Comparación de respuestas de crecimiento de T. harzianum vs B. cinerea.
Tratamiento |
Dosis |
||||
Botrytis |
0 |
9.8 |
3.28 az |
0 b |
100 a |
Trichoderma + Botrytis |
- |
7.44 |
2.9 b |
36.25 a |
63.75 b |
- |
14.5 |
6.4 |
17 |
5.9 |
|
- |
1.83 |
0.29 |
7.14 |
7.14 |
VCD= velocidad de crecimiento diametral (mm día-1); t(VCD)= transformación de datos de VCD; INH= porcentaje de inhibición del crecimiento; CREC= porcentaje de crecimiento diametral; DMS= diferencia mínima significativa (Tukey, p≤ 0.05); CV= coeficiente de variación; Z= Medias con la misma letra dentro de la columna son estadísticamente iguales. Los valores son medias de cinco repeticiones a los 8 días después de la siembra.
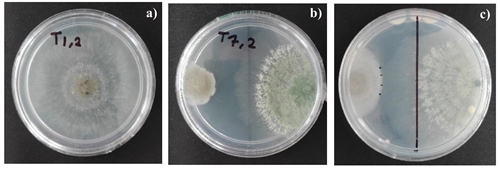
Figura 1 Antagonismo T. harzianum vs Botrytis cinerea. a) testigo absoluto con B. cinerea; b) y c) T. harzianum (derecha) y B. cinerea (izquierda).
El contacto hifal entre los dos patógenos se dio al sexto día. Trichoderma tuvo un crecimiento exponencial a partir del segundo día, sobrepasando la mitad de la caja Petri primero que Botrytis, deteniendo su crecimiento y al mismo tiempo causando la muerte de hifas en la zona de interacción con B. cinerea (Figuras 1 b y c). La prueba dual con estos hongos destacó un antagonismo tipo dos, el cual se caracteriza porque T. harzianum invadió 75% de la caja Petri, además de sobrecrecer y esporular sobre el fitopatógeno, T. harzianum invadió el crecimiento paulatinamente de Botrytis hasta cubrirlo por completo.
Los tratamientos con sustancias mezcladas en el medio de cultivo influyeron la respuesta de B. cinerea y se registraron coeficientes de variación de 2 a 31% (Cuadro 3). El micelio de Botrytis tuvo crecimiento 100% en PDA, la mayor la velocidad de crecimiento (VCD) (9.8 mm día-1) y sin inhibición micelial; en cambio, con el fungicida químico el crecimiento y la VCD fueron nulos, y la inhibición micelial 100%. Con aceite de T. lemmonii, desde las 24 h de la inoculación del hongo hasta el término del experimento, no se modificó el diámetro del inóculo micelial, por lo tanto, nula VCD y 100% de inhibición del patógeno, una respuesta similar a la obtenida con el producto fungicida.
Cuadro 3 Comparación múltiple de medias para las variables respuesta del bioensayo.
Tratamiento |
Dosis |
||||
Testigo |
0 |
9.8 |
3.28 az |
0 e |
100 a |
Tagetes lemmonii |
1 % |
0 |
1 d |
100 a |
0 cd |
Arsénico homeopático |
1 gota L-1 |
8.56 |
3.08 ab |
11.85 ed |
88.15 a |
Botrytis homeopático |
1 gota L-1 |
6.76 |
2.77 b |
31.24 cd |
68.76 ab |
Switch® |
1 g L-1 |
0 |
1 d |
100 a |
0 d |
E. Gobernadora |
2 mL L-1 |
2.82 |
1.95 c |
65.8 b |
34.2 cb |
- |
2.82 |
7.81 |
13.94 |
30.96 |
|
- |
2.01 |
0.33 |
14.03 |
43.22 |
VCD= velocidad de crecimiento diametral (mm día-1); t(VCD)= transformación de datos de VCD; INH= porcentaje de inhibición del crecimiento; CREC= porcentaje de crecimiento diametral; DMS= diferencia mínima significativa (Tukey, p≤ 0.05). CV= coeficiente de variación. Z= Medias con la misma letra dentro de la columna son estadísticamente iguales.
Con extracto de gobernadora (L. tridentata) el hongo creció 34%, VCD de 2.82 mm día-1 e inhibición micelial de 65.8%. Con arsénico homeopático, la VCD fue 8.56 mm día-1 e inhibición 11.8%, respuesta estadísticamente igual que el testigo absoluto. Con nosode de Botrytis la VCD fue 6.76 mm día-1 y 31.24% de inhibición, diferente estadísticamente del tratamiento control. Tanto en las sustancias homeopáticas como en el testigo PDA, Botrytis tuvo el mayor porcentaje de crecimiento (68 a 100%).
En general, el fungicida Switch® y el aceite esencial de T. lemmonii resultaron inhibitorios del crecimiento del micelio y en el caso del agente biológico T. harzianum hubo antagonismo contra B. cinerea, estos tratamientos fueron de alto efecto antifúngico comparados con los de inhibición media del extracto de gobernadora (65%) y los de baja inhibición (11 y 31%) de las sustancias homeopáticas (Cuadro 3; Figura 2).
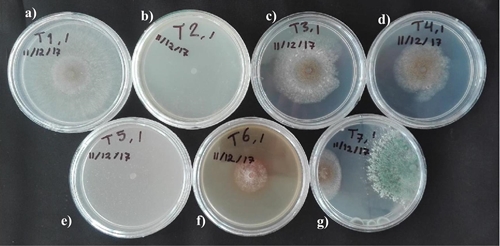
Figura 2 Final del bioensayo a 8 días cuando el testigo absoluto cubrió por completo la caja Petri, a) testigo absoluto; b) T. lemmonii; c) arsénico homeopático; d) Botrytis homeopático; e) Switch®; f) gobernadora; y g) antagónico Trichoderma harzianum.
Considerando la velocidad de crecimiento diametral (usando la transformación) en el octavo día, destacó la alta velocidad de crecimiento del micelio en PDA (9.8 mm día-1) y en arsénico homeopático (8.56 mm día-1); la respuesta fue intermedia con nosode de Botrytis (6.76 mm día-1), de baja velocidad con el extracto de gobernadora (2.82 mm día-1) y nula con T. lemmonii o con Switch® (Cuadro 3).
La dinámica de la velocidad de crecimiento del micelio en contacto con las sustancias evaluadas orgánicas y homeopáticas evaluadas durante los ocho días (Figura 3) presentó tendencias particulares. Hasta el segundo día todos los tratamientos tuvieron similar respuesta (10 mm día-1), pero en el tercer día la velocidad de crecimiento del hongo en los tratamientos homeopático y testigo PDA fue aumentando desde 19 hasta 31 mm día-1 en el 5o día. Con el extracto de L. tridentata el crecimiento del hongo se mantuvo estable desde el día 2 hasta el 4 (10 mm día-1), pero al 5o día subió ligeramente (14 mm día-1) y siguió aumentado con tendencia lenta durante los tres días subsecuentes (19, 21 y 26 mm día-1).
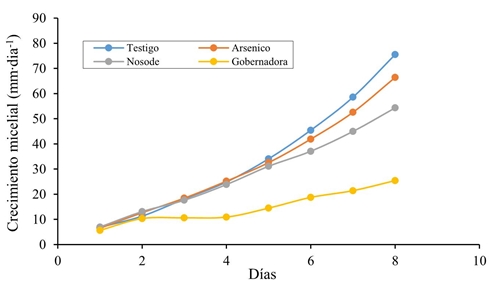
Figura 3 Crecimiento diametral del micelio (mm∙día-1) de Botrytis cinerea durante el período de evaluación in vitro de los tratamientos: testigo (PDA), extracto de gobernadora, arsénico homeopático y nosode de B. cinerea. Las sustancias T. lemmonii y Switch® no aparecen porque el hongo no presentó crecimiento.
En el testigo y en los homeopáticos arsénico y nosode, en el día cinco se observó que el micelio adquiría diferente velocidad de crecimiento (35, 33 y 31 mm día-1, respectivamente), tendencia más definida en los días 6 (46, 42 y 38 mm día-1, respectivamente), 7 (59, 53 y 45 mm día-1, respectivamente) y 8 (76, 66, 54 mm día-1, respectivamente), separándose más el nosode de Botrytis en esos cuatro últimos días, al reducir la velocidad de crecimiento del micelio con respecto al testigo (disminución de la VCD de 4, 8, 14 y 22 puntos, respectivamente) y al arsénico homeopático (disminución de la VCD de 2, 4, 8 y 12 puntos, respectivamente).
Discusión
El efecto antagónico de T. harzianum contra el moho gris de la fresa en el modelo de estudio in vitro confirma otros antecedentes al respecto (Calvo, 2012). Probablemente la temperatura de 18 oC no favoreció una mayor velocidad de crecimiento de Trichoderma en los primeros días en relación con el alcanzado por Botrytis al respecto, se indica que la temperatura óptima para Trichoderma es de 25 oC (Merchán, 2014). El resultado del antagonismo Trichoderma-Botrytis confirma el uso directo del agente biológico en las etapas de fructificación y en poscosecha de fresa (Merchán, 2014).
No obstante, que este resultado es favorable para disminuir o sustituir productos fungicidas, la producción o compra de Trichoderma representa un costo de inversión, quizá menor que la adquisición del propio fungicida. Por su parte, el agroquímico tuvo efecto inmediato, reportado tanto in vitro como in vivo en fresa (Mercier et al., 2010); sin embargo, la implicación negativa al humano y al ambiente son tema de reflexión. En cuanto a las sustancias orgánicas, el efecto inhibitorio del extracto de gobernadora coincide con lo observado en otros estudios donde a esta sustancia vegetal se le atribuye la propiedad de fungistasis en Botrytis (Lira, 2003).
En cuanto al sobresaliente efecto antifúngico del aceite de T. lemmonni, similar al producido por el producto Switch (Cuadro 3), ya se había referido contra Fusarium oxyosporum (Jarquín, 2016), pero no con la misma intensidad con la que ocurrió contra Botrytis, resultado que por vez primera se reporta; la presencia de dihidrotagetona, (E) tagetona y (E) ocimenona en el aceite esencial (Tucker y Marciarello, 1996) posiblemente sean las sustancias responsables de la actividad biológica descrita. Por la similitud de la respuesta del micelio sometido a Switch® y al aceite de T. lemmonni, se sugiere que el aceite esencial de esta especie de Tagetes tiene propiedad biocida. Una investigación en curso pretende explorar otras concentraciones y establecer la concentración de inhibición, además de su evaluación toxicológica in vivo.
El resultado obtenido sobre el efecto de inhibición micelial de B. cinerea ocasionado por el nosode del mismo patógeno (Cuadro 3; Figura 1) reviste especial importancia porque sería la séptima experiencia que evidencia efecto directo de sustancias homeopáticas en el crecimiento de hongos fitopatógenos (Gama et al., 2015; Rissato et al., 2016; Toledo et al., 2016; Hanif y Dewar, 2017; Oliveira et al., 2017; Serrato et al., 2018).
Bioensayos in vitro de aplicación por fumigación con nosode directamente sobre micelio o esporas podrían confirmar con solidez algunos resultados publicados y también los del presente trabajo. Por otro lado, el nosode de Botrytis 7 CH fue mejor que el arsénico homeopático 6 CH (Figura 1), cuando este último en esa misma potencia, en condiciones in vitro inhibe la germinación de esporas de Alternaria (Trebbi et al., 2016), esta comparación sugiere especificidad del homeopático según la dinamización o especificidad por origen biológico de la sustancia homeopática.
Los resultados exitosos relacionados con aplicación de sustancias homeopáticas contra problemas fúngicos en plantas indican que el hongo no se establece en la planta (Hanif y Dewar, 2015) o bien, crece de manera restringida sin daño a la planta (Rissato et al., 2016; Hanif y Dewar, 2017; Oliveira et al., 2017) además, no resulta claro si el nosode u otras sustancias homeopáticas tienen el mismo efecto inhibitorio, ni tampoco se establece si su acción es directa contra el organismo patógeno. Por lo anterior, el modelo in vitro ha favorecido responder parcialmente las preguntas anteriores.
En este caso, se evidenció que el hongo es influido en su crecimiento por el producto homeopático. Tomando en cuenta trabajos publicados sobre la acción de sustancias homeopáticas aplicadas al follaje de plantas para control de enfermedades fúngicas, se deduce que el estímulo homeopático, sea por sustancias derivadas del organismo patógeno o de cualquier otro origen, disparan mecanismos de respuesta de la planta para su protección. Recientemente se ha evidenciado que con el proceso de dinamización y sucusión de sustancias se generan nanopartículas con mayor actividad biológica que con macromoléculas (Rajendran, 2017).
Desde la perspectiva ecológica, los tratamientos orgánico, biológico y homeopático ofrecen ventajas, comparados con el fungicida sintético. La posibilidad de reducir la concentración de aceite esencial de T. lemmonii se considera importante para fortalecer el umbral de uso de esta sustancia, sobre todo en una estrategia preventiva, adicionalmente se valoraría su viabilidad económica. El aceite de rudilla es de acción remediadora, mientras que el extracto de gobernadora, Trichoderma y las sustancias homeopáticas son lentos y su mejor actuación podría ser de manera preventiva.
Especialmente el bajo costo del nosode de Botrytis representa una ventaja promisoria que estimula la investigación para seguir explorando dinamizaciones diferentes de las ensayadas o bien, probar otras sustancias homeopáticas, toda vez que haya acompañamiento de trabajos in vivo, que en general son pocos en el tema de la agrohomeopatía.











 texto en
texto en 


