Introducción
En los últimos años se han desarrollado técnicas moleculares para la identificación de la especie origen de la carne y sus subproductos1,2. Especialmente, el empleo de técnicas de polimorfismo de secuencias repetidas y la reacción en cadena de la polimerasa (PCR) que han sido efectivas para diferenciar entre carne de asno asiático salvaje (Equus hemionus) y el caballo doméstico (Equus domesticus) provenientes de mercados en la ciudad de Ulaanbatar, Mongolia3. También, la técnica de PCR se ha utilizado para determinar el origen de diferentes especies animales en concentrados, harinas o subproductos cárnicos destinados a la alimentación animal o humana4,5,6.
Por lo anterior, es importante señalar que la carne es considerada una de las principales fuentes de nutrientes para satisfacer los requerimientos nutricionales en la alimentación humana; debido a su alto contenido de proteína de elevado valor biológico, su aporte de minerales, vitaminas7, ácidos grasos esenciales y vitaminas liposolubles8. En este sentido, la carne para consumo humano proviene mayormente de las especies bovina, porcina y aviar, y en una menor cantidad la carne de ovinos, caprinos, piscícola y algunas especies silvestres9. Pero, las tendencias socioeconómicas, ambientales y nutricionales, han generado en la última década un creciente interés en alternativas para sustitución de carne de bovino10. Respecto a lo anterior, una alternativa que se ha utilizado para sustituir la carne de bovino, es la carne equina, la cual abastece el 0.25 % de la producción mundial de carne11.
México es uno de los principales países productores de carne equina y durante el 2013 aportó 11.2 % (83,500 t) de la producción mundial (745,966 t), exportando el 17.3 % de la producción nacional12. Mientras que el 82.7 % de la producción de carne equina se queda en el país y se utiliza principalmente para abastecer la industria de alimentos para mascotas y para animales de zoológicos. No obstante, el nivel de aceptación y consumo de carne equina para los seres humanos no es favorable, debido a que su comercialización no es del conocimiento del consumidor13. Esto permite una vía de comercialización fraudulenta que podría promover la sustitución de carne bovina por equina y un sobre precio, ya que el costo económico de venta de la carne equina está muy por debajo de la carne bovina en las carnicerías, y expendios de este rubro en las grandes ciudades del país14.
Por otra parte, la carne equina cuenta con valores nutricionales equivalentes a otras carnes convencionales15. Sin embargo, puede presentar riesgos claros a la salud humana, ya que no son criados para la producción de alimento, son tratados o inyectados con varias sustancias químicas, peligrosas para los humanos, muchas de las cuales se encuentran prohibidas para su uso en animales de crianza16. Por ello, es importante que el consumidor esté informado sobre la procedencia de la carne, calidad nutrimental y el precio en el mercado. Por lo tanto, es importante evaluar el grado de sustitución de carne bovina por carne equina en distintos puntos de venta de las diferentes delegaciones de la Ciudad de México e identificar las bondades o similitudes con la carne bovina como una fuerte alternativa de nutrientes.
Material y métodos
Sitios de muestreo
Las muestras de carne se colectaron en 69 centros de comercialización incluidos los principales centros de distribución como son la Merced, Calle 7, Rastro Viejo, Central de Abastos y Ferrería, ubicados en las diferentes delegaciones de la Ciudad de México.
Diseño de Muestreo
Se colectaron 161 muestras de carne de bovino; 23 muestras fueron de carnicerías de grandes centros de distribución y 138 de mercados delegacionales, muestreando un total de 69 carnicerías que corresponde al 22.5 % del total de carnicerías de la Ciudad de México (307). Los puntos de comercialización de carne bovina muestreados fueron identificados en el portal del Instituto de Acceso a la Información Pública y Protección de Datos Personales (IPPDP) de la Ciudad de México. Considerando los siguientes supuestos: (a) el nivel económico (alto, medio y bajo) de la región y (b) que el muestreo se realizará de forma al azar distribuidas de manera homogénea en todas las regiones de las Alcadías (Norte, Sur, Este y Oeste). La cantidad de muestras se determinaron con el teorema de límite central (TLC) con una desviación estándar de 8.9 % de acuerdo a las pruebas preliminares17, siendo aleatoria la selección del mercado. Asimismo, el de los establecimientos, se seleccionaron dos mercados por cada delegación (Cuadro 1), siendo representativos del número total de puntos de venta bajo el TLC a una desviación estándar de 7.3 % en las variables de muestreo.
Cuadro 1 Número de mercados, mercados muestreados y número de muestras por Alcaldía de la ciudad de México
| Alcaldía | Carnicería | Muestras colectadas |
|
|---|---|---|---|
| Total | Muestreadas | ||
| Álvaro Obregón | 15 | 3 | 6 |
| Azcapotzalco | 20 | 5 | 10 |
| Benito Juárez | 16 | 4 | 8 |
| Coyoacán | 17 | 4 | 8 |
| Cuajimalpa | 5 | 1 | 2 |
| Cuauhtémoc | 34 | 8 | 16 |
| Gustavo A. Madero | 49 | 11 | 22 |
| Iztacalco | 17 | 4 | 8 |
| Iztapalapa | 20 | 5 | 10 |
| La Magdalena | 5 | 1 | 2 |
| Miguel Hidalgo | 19 | 4 | 8 |
| Milpa Alta | 9 | 1 | 2 |
| Tláhuac | 19 | 4 | 8 |
| Tlalpan | 18 | 4 | 8 |
| Venustiano Carranza | 33 | 8 | 16 |
| Xochimilco | 11 | 2 | 4 |
| Centros de comercialización | - | - | 23 |
Tamaño de muestras
La muestra de carne cruda fue de 250 g obtenida del corte llamado bistec de aguayón (Biceps femoris) y simulando las condiciones habituales de los consumidores. Para disminuir el riesgo de contaminación durante el período de obtención de muestras, éstas se conservaron en bolsas de plástico identificadas y selladas, las cuales se mantuvieron dentro de un envase isotérmico a una temperatura de 4 ºC. Una vez colectadas las muestras de un día de muestreo se llevaron al Laboratorio del Posgrado en Producción Animal para su separación en submuestras para los diferentes análisis y almacenaje en congelación a -20 oC hasta su análisis.
Composición nutrimental de la carne
Los contenidos de humedad, proteína, grasa, y colágeno de la carne se determinaron por espectroscopia de reflectancia en el infrarrojo cercano (NIR´s) en el Foodscan Meat Analyzer (FOSS®, Dinamarca). Se pesaron 180 g de muestra y se realizó una molienda con un procesador de alimentos Picalica (Moulinex®, Francia) durante 30 seg (dos series de 15 seg) de acuerdo a la metodología propuesta por la AOAC18.
Determinación del color de la carne
El color de la muestra de carne se determinó en el Miniscan (Hunterlab®, USA), realizando cinco lecturas por muestra en un cuadrante superior, inferior, derecho, izquierdo y centro de acuerdo a la metodología propuesta por la Comisión Internacional de L´Eclairage (1976)19.
Extracción de ADN de tejido cárnico
Para la identificación de especie de la carne bovino o equino se realizó la extracción del ácido desoxirribonucleico (ADN) de la muestra inicial de 250 g, se tomaron 500 mg de carne que se colocaron en microtubos y se congelaron a -80 °C por 48 h en ultracongelación (ThermoSientific®, modelo 2186). Posteriormente, las muestras se liofilizaron (Labconco®, modelo Freezone 4.5) durante cinco días y se molió el tejido seco con la ayuda del disruptor celular TissueLyser II® (Qiagen, Alemania). Una vez molida la muestra, se realizó procedimiento de extracción de ADN, colocando en cada microtubo 1 ml de solución lisis [Tris base (C4H11NO3) 50mM pH8, EDTA (C10H16N2O8) 0.1M, SDS (NaC12H25SO4) 0.5%, 7 µl de proteinasa K] y se incubaron a 50 °C por 2 h continuas. Después, se agregaron 500 µl de Fenol:Cloroformo:Isoamílico (C6H5OH: CHCl3: C5H12O) (12:24:1) y se centrifugó a 10,000 rpm durante 10 min (Centrifugue eppendorf 5810 R). El sobrenadante se transfirió a otro microtubo, adicionando 1 ml de etanol (C2H5OH) al 70% a una temperatura de -20 °C, mezclándose por inversión hasta que el ADN precipitó. Por último, se centrifugó a 10,000 rpm durante 10 min, se formó un pellet y se secó en una centrífuga de vacío (Vacufuge plus). Para re-suspender el pellet de ADN se utilizaron 50 μl de H2O grado molecular.
Prueba de PCR para determinación de especie de la carne
Previo a la amplificación del ADN por PCR, se comprobó que el ADN extraído fuera lo suficientemente puro y libre de contaminaciones de proteínas. Para medir la concentración del ADN se utilizó un espectrofotómetro Nanodroop® (Thermo Scientific, modelo ND-100) bajo los siguientes indicadores: el ADN presenta un máximo de absorbancia a 260 nm (50 μg/ml tienen una OD a 260=1), mientras que las proteínas lo tienen a 280 nm. La pureza del ADN se calculó, tomando en cuenta la absorción entre A260/A280 (1.9 y 1.7).
En el Cuadro 2 se muestran las secuencias seleccionadas a partir de la literatura de los oligonucleótidos utilizados para la amplificación de fragmentos de ADN específicos por especie animal14; estos consistieron en un primer forward universal y los oligonucleótidos reverse específicos de especie equina y bovina. La amplificación de los fragmentos específicos se realizó por PCR convencional. La amplificación del ADN por PCR, se llevó a cabo considerando un volumen final de 50 µl [5µl de10x PCR buffer, 1µl de 20µM de dNTPs, 2 µl de oligonucleótido universal [10 pmol/µl], 2 µl de oligonucleótido equino [10 pmol/µl], 2 µl de oligonucleótido bovino [10 pmol/µl], 0.25 µl de Taq polimerasa (Roche®), 250 ng de ADN y 32.75 µl de agua grado PCR libre de nucleasas]. Para la amplificación de las secuencias seleccionadas se utilizó un programa de termociclado Maxygen (Axygene®) el cual consistió en: una etapa de desnaturalización inicial, en la que se mantuvo la mezcla de reacción a 94 °C durante 30 seg para que las dos cadenas de ADN molde se separaran. Posteriormente se sometieron las mezclas de reacción a 35 ciclos de tres etapas cada uno [alineamiento (60 °C durante 30 seg), extensión (72 °C durante 30 seg) y refrigeración (4 °C)].
Cuadro 2: Secuencia de los pares de oligonucleótidos para la determinación cortes de carne fresca para bovino y equino de diferentes mercados delegacionales de la ciudad de México
| Especie | Primer | Secuencia | Tamaño |
|---|---|---|---|
| Universal | Forward | GAC CTC CCA GCT CCA TCA AAC ATC TCA TCT TGA TGA AA | NA |
| Bovino | Reverse | CTA GAA AAG TGT AAG ACC CGT AAT ATA AG | 274bp |
| Equino | Reverse | CTC AGA TTC ACT CGA CGA GGG TAG TA | 439bp |
NA=No reportado
Gel de electroforesis
Finalizado las reacciones, se procedió a tomar 5 µl fragmentos amplificados (amplicones) de los productos PCR de las muestras para ser analizados por electroforesis convencional. Se mezclaron 5 µl del amplicon con 3 µl de buffer de carga 5x, colocando 8 µl en cada pozo del gel de agarosa [Seakem (Lonza®) al 3% (P/V) en 1,500 ml TAE 1x, con 25 µl de Bromuro de Etidio (Invitrogen®)]. Se corrió a 100 Volts durante 45 min para posteriormente realizar la lectura de amplicones en un fotodocumentador de luz UV. La similitud de las secuencias seleccionadas se analizó aplicando el programa informático BLAST® (http://www.ncbi.nlm.nih.gov/BLAST).
Análisis estadístico
Las variables de calidad nutritiva de la carne de bovino y equino (humedad, proteína, grasa, colágeno y color) se analizaron mediante un diseño completamente al azar20, los tratamientos fueron el factor tipo de carne, la carne equina tuvo 9 repeticiones y la carne de bovino 152 repeticiones. Se utilizó un modelo lineal general con el paquete estadístico SAS21. Las medias de los tratamientos se analizaron mediante la prueba de comparaciones múltiples de Tukey, y los resultados se consideraron significativos cuando P<0.0520. Se utilizó el siguiente modelo matemático: Yij= μ + Ti + Eij
Donde:
Yij fueron las características nutritivas;
μ corresponde al valor de la media de las respectivas variables;
Tj representa el efecto de la especie;
Eij representa el error experimental.
También, se realizó una prueba de Ji-cuadrada (X2) con la finalidad de comparar los resultados de los amplicones de ADN de carne respecto a los esperados, por lo que la hipótesis que todas las muestras de carne adquiridas de carnicerías serán de la especie bovina.
Resultados
Identificación de especie
Los amplicones, producto de las pruebas de PCR convencional tuvieron fragmentos de 439 y 274 pares de bases (pb) que corresponden al peso molecular del ADN de la carne de bovino y equino, respectivamente (Figura 1). Resultando, un total de 152 muestras positivas para carne de bovino y 9 de las muestras fueron positivas para carne de equino (Figura 2).
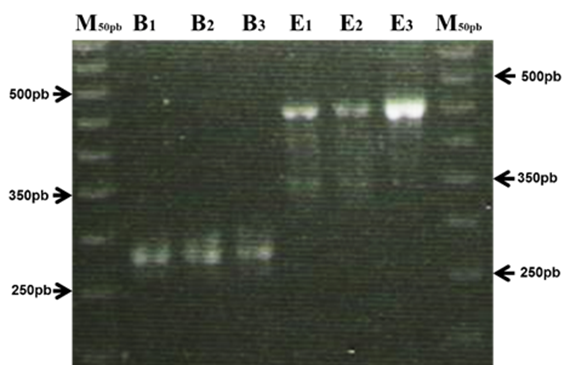
M50pb = Estandar de 50pb; +B1-3 Control positivo de bovino (274pb); +E1-3 Control positivo de equino (439pb).
Figura 1 Gel de electroforesis de la prueba de PCR de muestras de carne de bovino y equino de expendios de la Ciudad de México
Composición nutrimental
Se observó un ligero incremento (P<0.05) en la concentración de humedad y proteína en la carne de bovino respecto a la carne de equino (Cuadro 3). Mientras que el contenido de grasa y colágeno no mostró diferencias (P>0.05) entres las especies y fluctuaron de 22.0 a 23.5 %, de 2.0 a 2.3 %, de 73.1 a 75.1 % y de 1.3 a 1.4 mg g-1. Por otra parte, el color de la carne de bovino fue mayor (P<0.05) respecto a la carne equina en cuanto a la luminosidad (L) (Cuadro 4); mientras que no se observó diferencias (P>0.05) en los colores de la carne de a* (rojo a verde) y b* (amarillo a azul) y fluctuaron de 29.80 a 37.50 y 15.00 a 16.20, respectivamente.
Cuadro 3 Composición química nutricional de las muestras de carne de equino y bovinos de expendios de la ciudad de México
| Especie | Proteína a | Grasa a | Humedad a | Colágeno b |
|---|---|---|---|---|
| Bovino | 23.51 ± 0.11 | 2.3 ± 0.05 | 75.13 ± 0.19 | 1.46 ± 0.02 |
| Equino | 22.00 ± 0.50 | 2.0 ± 0.44 | 73.16 ± 0.69 | 1.38 ± 0.09 |
| Pr>F | 0.001 | 0.25 | 0.01 | 0.32 |
a Valores expresados en porcentaje; b valores expresados en mg g-1.
Cuadro 4 Indicadores de color (L, a y b) de las muestras de carne de equino y bovinos de expendios de la ciudad de México
| Especie | L | a | b |
|---|---|---|---|
| Bovino | 37.50 ± 0.22 | 16.20 ± 0.01 | 14.90 ± 0.01 |
| Equino | 29.80 ± 0.88 | 15.00 ± 0.11 | 13.40 ± 0.11 |
| Pr>F | 0.0001 | 0.27 | 0.26 |
L=luminosidad; A= color rojo/ verde; B=color amarillo/azul.
Discusión
Identificación de carne equina en diferentes puntos de venta de la Ciudad de México
La técnica de PCR y la secuencia de los pares de oligonucleótidos reportados por Matsunaga4 fueron útiles para la identificación en cortes de carne fresca para bovino y equino en el presente estudio22, y detectar que el 5.59 % de la carne muestreada en expendios de la Ciudad de México perteneció a la especie equina. La sustitución de la carne bovina por carne equina representa un fraude para el consumidor, ya que el precio de una carne y otra a nivel nacional difiere en casi un 100 %, lo cual no es aceptable desde el punto de vista ético, ni comercial23. Aunque, la carne equina resulta una alternativa viable para el consumo humano, similar a otros tipos de carne obtenidas de especies tradicionales como la bovina, porcina y aviar10, su aceptación en México es limitada debido a razones de índole cultural9, ya que en otros países como Italia, Bélgica, Rusia y Alemania es perfectamente aceptada. Por otro lado, la venta de carne equina en el mercado nacional representa un riesgo potencial a la salud, ya que esta actividad no está regulada por las instancias gubernamentales, y puede haber presencia de fármacos utilizados en producción que pueden dejar residuos peligrosos en carne, como lo demuestra el estudio de Rubio23 en donde encontraron que un 9.93 % de muestras de carne analizadas en diferentes estados de México dieron positivas para carne de caballo y el 93.10 % de las muestras seleccionadas excedieron los límites máximos de residuos (LMR) para el clembuterol -establecido por la FAO24- y 100% -según el límite de tolerancia cero de las leyes mexicanas, lo que confirma que si hay un riesgo latente en salud para los consumidores nacionales.
Composición nutrimental de la carne de bovino y equino
La composición nutricional de la carne equina es similar a la carne bovina25,26. La humedad constituye cerca del 70 %, la proteína 22 %, la grasa intramuscular oscila entre 0.5 y 6 %, y los minerales representan cerca del 1.5 %27. En este sentido, los hallazgos sobre el contenido de humedad fueron mayores (P<0.05) para la carne de bovino comparados a la carne de equina, y podría estar relacionado al tipo de musculo, la edad al sacrificio y el sexo de los animales9. El tipo de músculo influye significativamente en el contenido de humedad de la carne bovina y equina, siendo mayor en el músculo semimembranoso27. Estos resultados fueron similares a los reportados por Lorenzo y Pateiro28 quienes, al evaluar la influencia del tipo de músculos sobre el valor nutricional de la carne de ternero, observaron valores de contenido de humedad de 53 a 77 %, respectivamente. Mientas que Tateo et al29 presentaron muestras de carne de machos y hembras de raza “Heavy Draft Italian” con valores de humedad similares a los reportados en el presente estudio (70 y 73 %, respectivamente).
Por otra parte, la concentración de proteína en la carne de bovino y equino se encuentran en los valores reportados como ideales (15 a 23 %) para el consumo humano11,29. La carne de bovino mostró un incremento en la concentración de proteína que podría relacionarse principalmente a los factores como el sexo, edad, tipo de músculo y sistema de producción8,9. Mientras que la concentración de proteína de la carne de equino fue similar a los reportados por otros autores9,27,29, que observaron niveles que varían entre 20 y 22 % y que concluyen que los factores que influyen en la concentración de proteína son similares a los que afectan el ganado bovino.
Es importante señalar que la relación grasa / proteína es una característica clave de las cualidades saludables de la carne para consumo humano30. El bajo contenido de grasa intramuscular de la carne equina, es debido a que presentan tendencia a almacenar tejido adiposo de forma subcutánea31. Por ello, algunos autores la denominan “carne saludable”32. Esta característica es incluida en las estrategias de comercialización. Principalmente para las personas que intentan mantener su peso bajo control33; ya que la Organización Mundial de la Salud34, recomienda que sólo el 30 % de la ingesta diaria de energía del ser humano proveniente de la dieta debe de ser originada por la concentración de grasa, por lo que la carne de equino parece ser una buena fuente de proteínas con bajo contenido de grasa10.
La importancia del color como una característica de valoración física y de calidad de la carne, permite mostrar las variaciones del estado químico (grado de oxidación) del pigmento de un determinado momento de la carne y el estado físico de la carne, la estructura de las fibras musculares y la cantidad de luz reflejada (L*a*b)19. En este sentido, la menor luminosidad (L) de la carne equina puede ser debido a la cantidad de oxigenación de la mioglobina que está relacionada con el valor de a*35. En este sentido, la carne de equino tiene mayor concentración de mioglobina en su vida adulta36. Además, aumenta el valor de a* y se reduce el valor de L*, y tiende a un color más oscuro37, lo que explica los valores de similitud del color de la carne para las especies en el presente estudio.
Conclusiones e implicaciones
El grado de sustitución de la carne bovina por la carne equina (5.59 %) en los centros de comercialización en la Ciudad de México es bajo. Sin embargo, si la carne equina es producida y se maneja de acuerdo a la normatividad aplicada para la carne bovina, tiene un gran potencial como carne alternativa para el consumidor nacional, ya que la composición nutricional fue similar a la carne bovina.











 texto en
texto en 



