Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Chapingo serie ciencias forestales y del ambiente
versión On-line ISSN 2007-4018versión impresa ISSN 2007-3828
Rev. Chapingo ser. cienc. for. ambient vol.18 no.2 Chapingo may./ago. 2012
https://doi.org/10.5154/r.rchscfa.2011.02.017
Taxoides: metabolitos secundarios del árbol del tejo (Taxus spp.)
Taxoids: secondary metabolites of the yew tree (Taxus spp.)
Hebert J. Barrales–Cureño1*; Ramón M. Soto–Hernández
Postgrado en Botánica, Colegio de Postgraduados, Campus Montecillo. km. 36.5 Carretera México–Texcoco, Montecillo, Estado de México. C. P. 56230. (*Autor para correspondencia) Correo–e: barrales.hebert@colpos.mx
Recibido: 17 de febrero, 2011
Aceptado: 2 de mayo, 2012
RESUMEN
El árbol del tejo (Taxus spp.) es una gimnosperma dicotiledónea que pertenece a la familia Taxaceae; se distribuye en America, Europa y Asia. Taxus spp. contiene en la corteza y en las hojas, alcaloides diterpénicos conocidos como taxoides. éstos se caracterizan químicamente por la presencia de un esqueleto de taxano y un anillo de oxetano, tal como el taxol, que es utilizado en el tratamiento del cáncer de ovario, seno, próstata y pulmón; enfermedad que actualmente es una de las principales causas de muerte a nivel mundial. El contenido de taxol es bajo en los árboles, por tanto, es necesario el uso de alternativas biotecnológicas como lo es el cultivo in vitro de tejidos vegetales para incrementar la cantidad de taxoides y preservar el recurso natural. En esta revisión científica se reportan las características químicas de los taxoides, el mecanismo de acción biológico y semisíntesis orgánica del taxol, se detalla también la ruta biosintética de los principales taxoides, así como las principales enzimas involucradas para la obtención de éstos a nivel bioquímico y, finalmente, se indica de manera general la producción de taxoides en cultivos in vitro.
Palabras clave: Taxol, biosíntesis, cáncer, cultivo in vitro.
ABSTRACT
The yew tree (Taxus spp.) is a dicot gymnosperm belonging to the Taxaceae family and it can be found in America, Europe and Asia. These trees have in their bark and leaves diterpenic alkaloids known as taxoids, which are chemically characterized by the presence of a taxane skeleton and an oxetane ring such as taxol, which is used in the treatment of ovarian, breast, prostate and lung cancer; disease that is currently one of the leading causes of death worldwide. Taxol content is low in trees, so it is necessary to use biotechnology alternatives such as in vitro cultivation of plant tissue to increase the amount of taxoids and preserve the natural resource. The chemical characteristics of taxoids, the mechanism of the biological action and the semi–synthetic organic of taxol were reported in this scientific review; as well as, the biosynthetic pathway of major taxoids and the main enzymes involved in obtaining taxoids at biochemical level and, finally the production of taxoids in vitro cultures is indicated.
Key words: Taxol, biosynthesis, cancer, in vitro culture.
INTRODUCCIÓN
El tejo (Taxus spp.) es una gimnosperma dicotiledónea, perteneciente a la familia Taxaceae. Tiene nueve especies distribuidas alrededor del mundo: Taxus baccata, Taxus canadensis, Taxus brevifolia, Taxus floridana, Taxus mairei, Taxus globosa, Taxus chinensis, Taxus sumatrana y Taxus wallichiana. La especie representativa en México es T. globosa; su taxonomía se apoya en la distribución geográfica, de manera discontinua, desde el norte de México (Tamaulipas y Nuevo León) hasta Honduras en Centroamérica; florece de enero a marzo y fructifica de mayo a noviembre; su regeneración natural se basa en las semillas, que no son tóxicas para las aves cuando están cubiertas por un arilo de color rojo (Zavala, Soto, & Rodríguez, 2001).
Los taxoides son metabolitos secundarios que son sintetizados por Taxus spp. y se encuentran en el follaje y la corteza de éste. El principal taxoide de interés farmacológico es el taxol; un alcaloide diterpénico polioxigenado aprobado por la Oficina de la Administración de Fármacos y Alimentos (Wickremesinhe & Arteca, 1994). Este taxoide se utiliza en el tratamiento del cáncer de seno, ovario, pulmón y sarcoma de Kaposi relacionado con el VIH (Soto, Sanjuijo, González, Cruz, & Giral, 2000). En el año 2002, se estimó que había 10.9 millones de casos nuevos de cáncer, 6.7 millones de muertes y 24.6 millones de personas viviendo con esta enfermedad alrededor del mundo (Parkin, Bray, Ferlay, & Pisani, 2005). Además, el taxol se está probando en el tratamiento de taupatías (afecciones en las proteínas tau), tales como, el Alzheimer's o el Parkinson ligado al cromosoma 17 (Zhang et al., 2005). La cantidad estimada necesaria del fármaco taxol purificado para tratar sólo a 500 pacientes con cáncer es de 1 kg, equivalente al rendimiento de cerca de 10 toneladas de corteza o la tala de 700 árboles. Por consiguiente, el árbol del tejo está expuesto al riesgo de la extinción debido a su tala y uso excesivo (Liao, Chen, Sun, & Tang, 2006).
Los fármacos quimioterapéuticos actúan fundamentalmente inhibiendo el ciclo de la división celular. El taxol, debido a su actividad biológica, se clasifica dentro del grupo de los fármacos antimitóticos. El principal mecanismo de acción de este taxoide consiste en promover la polimerización de microtúbulos, estabilizando los haces con la consiguiente paralización de la mitosis. Así, queda bloqueado el ciclo celular en la transición metafase–anafase induciéndose la apoptosis (Centelles & Imperial, 2010).
Actualmente, algunas alternativas biotecnológicas como la técnica de cultivo in vitro de tejidos vegetales es una fuente promisoria para la inducción de callos y cultivos de células in vitro a partir de hojas de la especie mexicana T. globosa (Barrales et al., 2011; Barrios, Zhang, Sandoval, & Liao, 2009). En esta revisión se describen la actividad biológica del taxol a nivel celular; las principales características químicas; la semisíntesis orgánica y bioquímica de formación de los taxoides, únicos en la familia Taxaceae; así como las enzimas involucradas en la ruta biosíntetica, y se presenta de manera general la producción de taxoides en cultivos in vitro.
Aislamiento e identificación del taxol
En 1958, el Instituto Nacional del Cáncer (INC) de Estados Unidos encargó a botánicos del Departamento de Agricultura de Estados Unidos, la recolección de muestras de plantas para comprobar sus propiedades anticancerígenas. Uno de los botánicos, Arthur S. Barclay, recolectó 15 libras de ramas, agujas y corteza de T. brevifolia en un bosque cercano al Monte Saint Helens (Baloglu & Kingston, 1999). En 1963, Wall descubrió que las extracciones realizadas a partir de la corteza de esta especie tenían actividad citotóxica contra cánceres humanos (Baloglu & Kingston, 1999). En 1968, el taxol fue descubierto y aislado por Wani y Wall en el Research Triangle Institute (RTI) en Carolina del Norte, a partir de la corteza de T. brevifolia conocido comúnmente como tejo del Pacífico. Wani y Wall publicaron los resultados en 1971, incluyendo la estructura química (Wani, Taylor, & Wall, 1971) et al., 1971). Actualmente, el fármaco se vende con el nombre comercial de Taxol® por Bristol–Myers Squibb, desde 1993. El término paclitaxel se refiere al nombre genérico.
Características químicas del taxol
La determinación de la estructura química se realizó en 1971 (Jaziri et al., 1996) a partir de los análisis mediante difracción por rayos X. Fue todo un reto para los científicos de la época; así como posteriormente lo fue también, su síntesis total publicada en 1994 (Guo, Kai, Jin, & Tang, 2006). El nombre común para este taxoide ahora es paclitaxel y por lo tanto taxol es una marca registrada. El taxol tiene una estructura química compleja (Figura 1) en la que destaca un esqueleto hidrocarbonado formado por tres ciclos de 6, 8 y 6 carbonos polisustituidos con cuatro metilos y ocho funciones oxigenadas (entre ellas, una de β–fenilisoserina que esterifica la posición C13). La molécula posee un total de 11 estereocentros.
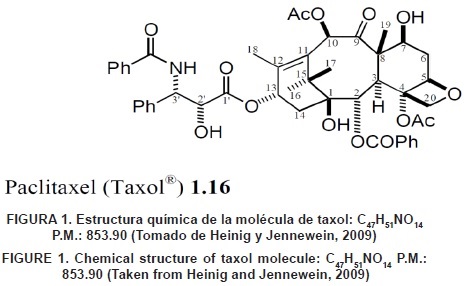
Semisíntesis
La síntesis química total del taxol no ha tenido éxito y la síntesis parcial requiere a baccatina III como el material de partida, que debe ser extraído del material vegetal; no obstante, se encuentra en niveles bajos en los tejidos vegetales. La síntesis total del paclitaxel fue obtenida, finalmente, por Holton et al. (1994) y por Nicolaou, Yang, y Liu (1994), casi simultáneamente, pero siguiendo secuencias distintas. Sin embargo, este proceso resulta impráctico porque requiere de al menos 28 pasos químicos para la obtención del taxol y el rendimiento es muy bajo. Tanto el taxol como su análogo el docetaxel, se producen semi–sintéticamente a través de la acilación de 10–diacetilbaccatina III aislado de las hojas de diferentes especies de Taxus, pero conlleva a contraindicaciones o efectos secundarios no deseados en los pacientes.
Actividad biológica del taxol
El taxol actúa a nivel del huso mitótico, funcionando como un potente agente quimioterapéutico aprovechado en el tratamiento de una gran variedad de tipos de cáncer: seno, pulmón y ovario, principalmente. Este metabolito vegetal secundario tiene un mecanismo de acción biológico, único y específico, debido a que se encarga del ensamblaje de los microtúbulos e inhibe el proceso del desensamblamiento de la tubulina. El detenimiento del ciclo puede efectuarse en la interfase o en la mitosis (Centelles & Imperial, 2010).
Para entender el efecto del taxol es importante conocer cómo se forma y degrada el huso mitótico, puesto que esta estructura celular es de gran importancia durante la proliferación celular. Si no es posible formar el huso, las células no podrán duplicarse, evitando así su proliferación. El huso mitótico está formado por microtúbulos, que son tubos formados por la combinación de dos tipos de proteína: α–tubulina y β–tubulina. Estas proteínas forman heterodímeros αβ capaces de agruparse en polímeros (microtúbulos), en presencia de otras proteínas denominadas proteínas asociadas a microtúbulos (MAPs, microtubul associated protein) de GTP y de Mg2+. Los microtúbulos son estructuras dinámicas y poseen dos extremos; uno de ellos identificado con un signo matemático (–) donde se inicia la nucleación y el segundo (+) donde el microtúbulo va creciendo. El microtúbulo, cuando inicia su crecimiento, adopta un aspecto cilíndrico de unos 25 nm de diámetro con 13 protofilamentos que forman el círculo (Centelles & Imperial, 2010).
El microtúbulo estabilizado con taxol posee 12 protofilamentos (en lugar de los 13 protofilamentos normales) y un diámetro inferior al normal (22 nm). La estabilización de los microtúbulos provoca la pérdida de función del huso, la consiguiente parada del ciclo celular en la transición metafase–anafase y, Analmente, la muerte celular (Centelles & Imperial, 2010).
Metabolismo secundario del tejo
En las plantas se sintetiza un gran número de compuestos secundarios que proveen un reservorio para la generación de agentes activos farmacéuticos. Algunas de las funciones ecológicas de los metabolitos secundarios: sirven a las plantas para su adaptación al ambiente y su interrelación con otros organismos; sirven de protección contra la luz UV, el ozono, los herbívoros y contra microorganismos patógenos. Los roles defensivos de los metabolitos secundarios son experimentalmente confirmados por el uso de métodos moleculares modernos (Zulak y Bohlmann, 2010).
Los isoprenoides constituyen una familia compleja de compuestos (más de 35,000 identificados hasta el momento) que presentan una gran variedad de estructuras y funciones. En muchos organismos vegetales existe una dicotomía respecto a la biosíntesis de los precursores de los terpenoides. No obstante, a pesar de su gran diversidad, todos los isoprenoides derivan de dos precursores estructurales comunes de cinco átomos de carbono, el isopentenil difosfato (IPP) y su isómero, el dimetilalildifosfato (DMAPP) (Zulak & Bohlmann, 2010).
El taxol es un compuesto de naturaleza isoprenoide. En el citosol, la ruta clásica del mevalonato produce IPP de acetil coenzima A para la biosíntesis de los sesquiterpenos y triterpenos. Los plastidios son el sitio de la ruta alternativa del nomevalonato que produce IPP y DMAPP a partir de piruvato y gliceraldehido–3–fosfato comenzando con los isoprenoides plastídicos: monoterpenos, diterpenos y tetraterpenos (Azcon & Talón, 2008; Cusidó et al., 2007). El esqueleto central de la molécula de taxol es un anillo de taxano de naturaleza isoprenoide y deriva del geranilgeranil difosfato (GGPP), el precursor común de los isoprenoides de 20 átomos de carbono llamados diterpenos. Entre éstos se encuentran compuestos, tales como; los carotenoides, la cadena de fitol de las clorofilas o las giberelinas, el ácido abscísico, la cadena isoprenoide de algunas citoquininas que participan en el crecimiento y desarrollo de las plantas, la plastoquinona, la ubiquinona y los fitoesteroles esenciales para la integridad de las biomembranas y los dolicoles (Azcon & Talón, 2008).
Biosíntesis de los taxoides
Actualmente, se han realizado muchos avances con respecto a la identificación de los genes responsables de la biosíntesis del taxol o paclitaxel (Cuadro 1). En este proceso se requieren conocer, principalmente, las reacciones enzimáticas que involucran la construcción del esqueleto tetracíclico y la adición de varios oxígenos y grupos funcionales acilo.
Existe una gran variación en el contenido de taxoides, que se debe principalmente a las diferentes especies y variedades. Hasta el momento, se conoce la estructura química de más de 300 taxoides. éstos se empezaron a clasificar de acuerdo a la oxigenación del C20 y a la presencia o no de cadenas laterales. Los taxoides más importantes sin la cadena lateral C13 son baccatina III y sus compuestos derivados; mientras que los principales taxoides con la cadena lateral C13 son el taxol, cefalomanina y compuestos relacionados (Cusidó et al., 2007).
El taxol es un protoalcaloide (el nitrógeno se encuentra en una cadena alifática y no en un sistema heterocíclico) diterpénico cíclico polioxigenado caracterizado por un sistema de anillo de taxano; es portador de una cadena lateral derivada de la fenilalanina, la N–benzoil–(2R–3S)–3–fenilisoserina. La síntesis del taxol implica una descarboxilación del aminoácido precursor que da lugar a las respectivas aminas simples, de las que, mediante modificaciones estructurales, se origina el protoalcaloide (Azcón & Talón, 2008); su biosíntesis en las plantas de Taxus spp. no se conoce completamente. El anillo de oxetano es principalmente encontrado en las especies de Taxus spp. La formación de este anillo en la biosíntesis del taxol (Figura 2) involucra dos enzimas: 1) CitP450 C4–C20 epoxidasa y 2) isomerasa (oxomutasa) (Frense, 2007). Los estudios sobre la biosíntesis de taxol muestran que el sistema de anillo de los taxoides no se sintetiza vía mevalonato, sino por la ruta plastídica del nomevalonato o ruta del metil–4–eritritol–fosfato (MEP), lo cual es coherente con su naturaleza de diterpenos (Eisenreich, Mewnhard, Hylands, Zenk, & Bacher, 1996).

El primer paso en la biosíntesis de taxol (Figura 3) es la ciclización de geranilgeranil difosfato (GGPP), el cual comienza con la formación de taxa–(4,5), (11,12)–dieno, que es el primer compuesto en la ruta biosintética del taxol que presenta el esqueleto de taxoide. Esta reacción es catalizada por la enzima taxadieno sintasa (TS), una enzima formada por una proteína monomérica de 79 kDa con propiedades similares a otras ciclasas de terpenoides. La enzima fue purificada y caracterizada por Hezari, Lewis, Croteau (1995) y los genes que codifican para la TS fueron identificados y clonados por Wildung y Croteau (1996). El producto de la reacción es la hidroxilación de la posición del C5 por la enzima Cit P450 taxadieno–5α–hidroxilasa (T5αH) para formar taxa–4(20),11(12)–dien–5α–ol. Esta enzima, aparte de su actividad hidroxilativa, tiene condiciones de migración del doble enlace de 4(5) a 4(20). Estos dos pasos metabólicos, ciclización e hidroxilación, son bajos y no se observan por ser limitantes en la velocidad de la biosíntesis del taxol (Hefner et al., 1996). El próximo paso en la ruta de biosíntesis que comienza a formar el taxol es catalizado por una enzima específica: taxadieno–5α–ol–O–acetil transferasa (TDAT) que acila taxa–4(20),11(12)–dien–5α–ol a la posición del C5 para formar taxa–4(20), 11(12)–dien–5α–yl–acetato. Este taxoide se hidroxila por una P450–dependiente monooxigenasa, encontrada en T. cuspidata (tejo japonés), la cual cataliza la hidroxilación a la posición C10 para producir taxa–4(20),11(12)–dien–5α, 10β–diol 5–acetato. La enzima que controla este paso, la taxoide 10β–hidroxilasa (T10pH), fue clonada y caracterizada funcionalmente en levaduras (Schoendorf, Rithner, Williams, & Csroteau, 2000).
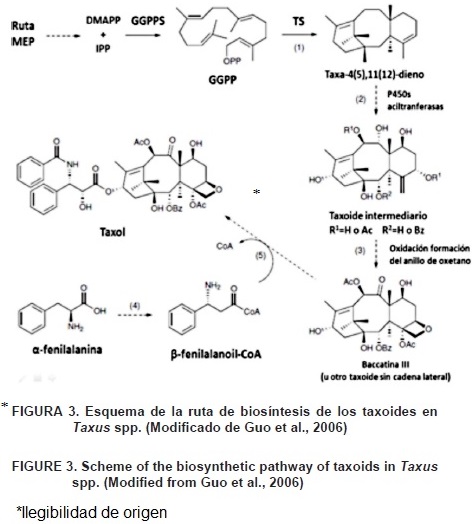
Jennewein, Rithner, Williams, y Croteau (2001) encontraron una Cit P450–dependiente hidroxilasa usando taxa–4(20),11(29)–dien–5α–ol como sustrato, comenzando con ello la formación de taxa–4(20),11(12)–dien–5α–13α–diol. La enzima taxol 13α–hidroxilasa (T13αH) presenta 63 % de identidad y 67 % similitud con la hidroxilasa responsable para la hidroxilación en la posición C10. Al mismo tiempo, el hecho de que esta enzima use el mismo sustrato, como taxa–4(20),11(12)–dien–5α–ol (TDAD), sugiere que la biosíntesis del taxol no es una ruta lineal y que algunas ramas de la ruta pueden dar comienzo a otros taxoides relacionados. Se ha observado que este paso alternativo fue especialmente frecuente en cultivos de células elicitadas con metil jasmonato (Wheeler et al., 2001). Posteriormente, se encontró otra Cit P450–dependiente de hidroxilasa (taxoide 14β–hidroxilasa; T14βH) responsable para la producción de taxa–4(20),11(12)–dien–5α–acetoxi–10β–14β–diol (Jennewein, Rithner, Williams, & Croteau, 2003). Esta enzima utiliza sustratos hidroxilando a la posición del C10, pero no los hidroxila a la posición C13, sugiriendo que podría estar involucrada en la producción del taxol desde este compuesto sin presentar alguna hidroxilación a la posición C14. Después de la formación de taxa–4(20),11(12)–dien–5α,10β–diol 5–acetato se originan hidroxilaciones en las posiciones de C1, C2, C4 y C7, oxidación de C9 y epoxidación en el doble enlace C4C5 en la ruta biosintética del taxol. El orden de las hidroxilaciones mediadas por enzimas Citocromo P450 no es completamente conocido; pero sobre la base de la frecuencia de la oxidación de los taxoides se ha encontrado en cultivo de células, una secuencia probable que podría ser: C5, C10, C2, C9, C13 y Analmente C1. Se debe tomar en cuenta que algunos de los taxoides considerados podrían no participar en la formación del taxol o podrían ser artefactos de los cultivos in vitro. Esta secuencia de oxidación se ha validado por análisis filogenéticos de enzimas taxoide oxigenasas P450 clonadas previamente (Vongpaseuth & Roberts, 2007).
Sin embargo, la formación del anillo de oxetano es también muy importante, ya que es esencial para la actividad anti–cáncer de la molécula del taxol. Se han propuesto diferentes mecanismos para su formación. En la actualidad se acepta que tal proceso involucra la epoxidación del puente doble 4(20) seguido por una migración del grupo α–acetoxi del C5 a la posición C4, junto con la expansión del oxirano al grupo oxetano. Es posible que la formación de oxirano–oxetano preceda a la hidroxilación del C1 en la biosíntesis del taxol, y en este caso el intermediario polihi–droxilado hipotético podría ser más bien un taxadien–hexaol que un heptaol hidroxilado a C1 (Croteau, Ketchum, Long, Kospera, & Wildung, 2006). La enzima que epoxida el doble enlace C4–C20 aún no se ha caracterizado funcionalmente y la expansión del anillo de oxirano–oxetano es también un paso incompletamente conocido.
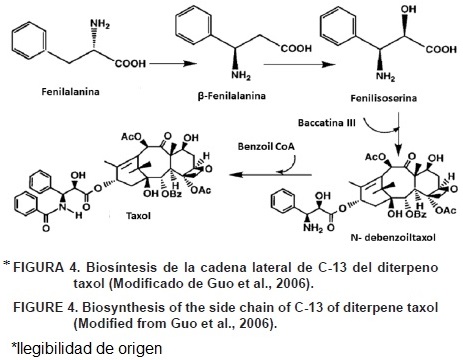
Después de la formación del precursor polihidroxilado hipotético por la actividad de la enzima 2α–O–benzoyl transferasa (DBT), el próximo compuesto obtenido es 10–diacetil baccatina III. La enzima 10–deacetil–baccatinIII–10–O–acetyl transferasa (DBAT) acila el grupo hidroxilo a la posición del C10 para formar baccatina III. Un paso esencial en la biosíntesis del taxol es la esterificación del C13 del grupo hidroxilo de la baccatina III con la cadena lateral β–fenilalanoil–CoA. La cadena lateral es obtenida del aminoácido a–fenilalanina por la acción de la fenilalanina aminomutasa (PAM) (Walker, Klettke, Akiyama, & Croteau, 2004). La enzima C13–fenilpropanoil–CoA transferasa (BAPT) cataliza la conjugación de la cadena lateral de la β–fenilalanoyl–CoA a baccatina III, mejorando o produciendo el compuesto 3'–N–debenzoil–2'–deoxitaxol (Figura 4). Este compuesto hidroxila la posición C2 por la acción de una enzima desconocida Cit P450–dependiente hidroxilasa, y la enzima 3'–N–debenzoil–2'–deoxitaxol N–benzoil transferasa (DBTNBT) conjuga a benzoil–CoA a 3'–N–debenzoil–2'–deoxitaxol produciendo taxol como un compuesto Anal (Walker, Long, & Croteau, 2002).
Producción de taxoides en cultivos in vitro
Christen, Biand, y Gibson (1989) reportaron por primera vez la producción de taxol usando cultivos celulares de Taxus. Después, muchos científicos empezaron a optimizar las condiciones para el crecimiento prolífico de las células e incrementar la producción de taxoides en varios sistemas de cultivo in vitro, tales como, células, raíces, tallos y cultivos embriogénicos de diferentes especies de Taxus (Mirjalili & Linden, 1996). El cultivo de células de Taxus en suspensión a partir de callos in vitro es considerada una herramienta promisoria para producir taxol y taxoides relacionados. Por tal motivo, se ha investigado extensamente el contenido de taxol en diferentes cultivos de Taxus spp., tanto para optimizar la tasa de producción como para incrementarlo (Barrales et al., 2009, 2011; Khosroushahi et al., 2006; Nguyen, Eshraghi, Gonyea, Ream, & Smith, 2001; Tabata, 2006; Zhong, 2002). Los medios de cultivo utilizados in vitro para la iniciación, proliferación y mantenimiento de los callos y cultivos de células en suspensión de Taxus spp., son el medio basal Gamborg's (B5), MS (Murashige & Skoog, 1962) y Medio vegetal Woody (WPM) (Frense, 2007). En pocas especies de Taxus se han detectado otros taxoides tales como: baccatina III (Agrawal et al., 2000), epitaxol y 7–epi–10–diacetil taxol (KetchumTandon, Gibson, Begley, & Shuler, 1999), y 10–diacetil taxol en T. baccata (Vander et al., 1994), entre otros. En el Cuadro 2 se presenta la tasa de producción de taxol en cultivos in vitro de células de Taxus spp. en sistemas de matraces y biorreactores. El tamaño de inóculo, periodo de subcultivo, intensidad de luz y fotoperiodo, son factores decisivos para la multiplicación, apariencia fenotípica, producción de taxol y proliferación de células de Taxus spp. (Hirasuna, Pestchanker, Srinivasan, & Shuler, 1996; Navia–Osorio et al., 2002). Además, la suplementación de sustancias orgánicas tales como: caseína hidrolizada, polivinil pirrolidona (PVP), ácido ascórbico y aminoácidos esenciales como glutamina, ácido aspártico, prolina, fenilalanina y vitaminas en el medio, puede incrementar el crecimiento celular de los callos y células de Taxus spp. (Navia–Osorio et al., 2002).
CONCLUSIONES
Los taxoides son de gran importancia comercial debido a la actividad anti–cáncer que presentan. Estos taxoides se aíslan a partir de la corteza y follaje de árboles de Taxus. Las técnicas de cultivo in vitro de callos y células vegetales se explotan para el aislamiento de líneas celulares productoras de taxol. El cultivo in vitro de Taxus no sólo ayuda a la conservación de este valioso recurso natural, sino que se considera una alternativa biotecnológica viable; además tiene un amplio uso sustentable en la producción del fármaco taxol y taxoides relacionados. Aunque la ruta biosintética no se conoce completamente; el conocimiento de las enzimas clave en la biosíntesis del taxol es importante para hacer experimentos de biología molecular e identificar los genes que expresen una producción mayor de éste y otros taxoides relacionados con las especies de Taxus, mediante estrategias de elicitación de tipo biótico o abiótico.
AGRADECIMIENTOS
El autor agradece a la M.C. Petra Andrade–Hoyos por sus valiosas sugerencias al presente artículo y al Colegio de Postgraduados por el Fideicomiso Institucional Núm. 167304 otorgado para el desarrollo del proyecto de investigación.
REFERENCIAS
Agrawal, S., Banerjee, S., Chattopadhyay, S. K., Kulshreshtha, M., Musudanan, K. P., Mehta, V. K., & Kumar, S. (2000). Isolation of taxoids from cell suspension cultures of Taxus wallichiana. Plant Medica, 66, 1–3. doi: 10.1055/s–2000–9782. [ Links ]
Azcón, B. J., & Talón, M. (2008). Fundamentos de Fisiología Vegetal. España: McGraw–Hill. [ Links ]
Baloglu, E., & Kingston, D. G. I. (1999). The taxane diterpenoids. Journal of Natural Products, 62, 1448–1472. doi: 10.1021/np990176i [ Links ]
Barrales, C. H. J., Soto, H. M., Ramos, V. A. C., Luna, P. R. G., Trejo, T. L. I., Martínez, V. M., & Ramírez, G. M. E. (2009). Inducción de callos in vitro de Taxus globosa a partir de acículas. Revista Latinoamericana de Química, Suplemento especial ISNN 0370–5943. pp. 89. [ Links ]
Barrales, C. H. J., Soto, H. R. M., Ramos, V. A. C., Trejo, T. L. I., Martínez, V. M., Ramírez, G. M. E., López, U. J. (2011). Extracción y cuantificación de taxoides por HPLC en hojas in situ y en callos inducidos in vitro de Taxus globosa Schlecht. Spanish Journal of Rural Development, 2, 103–114. [ Links ]
Barrios, H., Zhang, Y., Sandoval, C., & Xiao, Z. (2009). Increase of taxol production in Taxus globosa Shoot callus by Chlorocholine Chloride. Open Natural Products Journal, 2, 33–37. doi: 10.2174/1874848100902010033 [ Links ]
Bentebibel, S., Moyano, E., Palazón, J., Cusidó, R. M., Bonfill, M., Eibl, R., & Pinol, M. T. (2005). Effects of inmobilization by entrapment in alginate and scale–up on paclitaxel and baccatin III production in cell suspension cultures of Taxus baccata. Biotechnology and Bioengineering, 89, 647–655. doi: 10.1002/bit.20321 [ Links ]
Centelles, J., & Imperial, S. (2010). Paclitaxel, descubrimiento, propiedades y uso clínico. Fitoterapia, 29, 69–75. [ Links ]
Christen, A. A., Bland, J., & Gibson, D. M. (1989). Cell cultures as a means to produce taxol. Proceedings of the American Association for Cancer Research, 30, 566. [ Links ]
Croteau, R. B., Ketchum, R. E. B., Long, R. M., Kaspera, R., & Wildung, M. R. (2006). Taxol biosynthesis and molecular genetics. Phytochemistry Reviews, 5, 75–97. doi: 10.1007/s11101–005–3748–2 [ Links ]
Cusidó, R. M., Palazón, J., Bonfill, M., Expositó, O., Moyano, E., & Piñol M. T. (2007). Source of isopentenyl diphosphate for taxol and baccatin III biosynthesis in cell cultures of Taxus baccata. Biochemical Engineering Journal, 33, 159–167. doi: 10.1016/j.bej.2006.10.016 [ Links ]
Cusidó, R. M., Palazón, J., Bonfill, M., Navia, O. A., Morales, C., & Piñol, M. T. (2002). Improved paclitaxel and baccatin III production in suspension cultures of Taxus media. Biotechnology Progress, 18, 418–423. doi: 10.1021/bp0101583 [ Links ]
Eisenreich, W., Mewnhard, B., Hylands, P. J., Zenk, M. H., & Bacher, A. (1996). Studies on the biosynthesis of taxol: The taxane carbon skeleton is not of mevalonoid origin. Proceedings of the National Academy of Sciences, 93, 6431–6436. [ Links ]
Frense, D. (2007). Taxanes: Perspectives for biotechnological production. Applied Microbiology and Biotechnology, 73, 1233–1240. doi: 10.1007/s00253–006–0711–0 [ Links ]
Guo, B. H., Kai, G. Y., Jin, H. B., &. Tang, K. X. (2006). Taxol synthesis. African Journal of Biotechnology, 5(1), 15–20. [ Links ]
Hefner, J., Rubenstein, S. M., Ketchum, R. E. B., Gibson, D. M., Williams, R. M., & Croteau, R. (1996). Citochrome p450–catalyzed hydroxylation of taxa–4(5), 11(12)–dien to taxa–4(20),11(12)–dien–alpha–ol. The first oxygenation step in taxol biosynthesis. Chemistry & Biology, 3, 479. doi: 10.1016/S1074–5521(96)90096–4 [ Links ]
Heinig, U., & Jennewein S. (2009). Taxol: A complex diterpenoid natural product with an evolutionarily obscure origin. African Journal of Biotechnology, 8(8), 1370–1385. [ Links ]
Hezari, M., Lewis, N. G., & Croteau, R. (1995). Purification and characterization of taxa–4(5), 11(12)–diene synthase from pacific yew (Taxus brevifolia) that catalyzes the first commited step of taxol biosynthesis. Archives of Biochemistry and Biophysics, 322, 437 [ Links ]
Hirasuna, T. J., Pestchanker, L. J., Srinivasan, V., & Shuler M. L. (1996). Taxol production in suspension cultures of Taxus baccata. Plant Cell, Tissue and Organ Culture, 44, 95–102. doi: 10.1007/BF00048185 [ Links ]
Holton, R. A., Somoza, C., Kim, H. B., Liang, F., Biediger, R. J., & Boatman, P. D. (1994). First total synthesis of taxol 1. Functionalization of the B ring. Journal of American Chemical Society, 116, 1599–1600. doi: 10.1021/ja00083a066 [ Links ]
Jaziri, M., Zhiri, A., Guo, Y., Dupont, J., Shimomura, K., Hamada, H., ... Homes, J. (1996). Taxus sp. cell, tissue and organ cultures as alternative sources for taxoids production: A literatura survey. Plant Cell, Tissue and Organ Culture, 46, 59–75. doi: 10.1007/BF00039697 [ Links ]
Jennewein, S., Rithner, C. H. D., Williams, R. M., & Croteau, R. (2003). Taxol metabolism: Taxoid 14β–hydroxylase is a Citochrome p450–dependent monooxygenase. Archives of Biochemistry and Biophysics, 413, 262–270. doi: 10.1016/S00039861(03)00090–0 [ Links ]
Jennewein, S., Rithner, CH. D., Williams, R. M., & Croteau, R. B. (2001) Taxol biosynthesis: Taxane 13α–hidroxilase is a Citochrome P450–dependent monooxygenase. Proceedings of the National Academy of Sciences, 98, 13595–13600. doi: 10.1073/pnas.251539398 [ Links ]
Ketchum, R. E. B., Tandon, M., Gibson, D. M., Begley, T., & Shuler, M. L. (1999). Isolation of labeled 9–Dihydrobaccatin III and related taxoids from cell cultures of Taxus canadensis elicited with methyl jasmonate. Journal of Natural Products, 62, 1395–1398. doi: 10.1021/np990201k [ Links ]
Khosroushahi, A. Y., Valizadeh, M., Ghasempour, A., Khosrowshahli, M., Kim, B. J., Gibson, D. M., & Shuler, M. L. (2006). Improved Taxol production by combination of inducing factors in suspension cell culture of Taxus baccata. Cell Biology International, 30, 262–269. doi: 10.1016/j.cellbi.2005.11.004 [ Links ]
Kim, B. J., Gibson, D. M., & Shuler, M. L. (2006). Effect of the plant peptide regulator, phytosulfokine–alpha, on the growth and taxol production from Taxus sp. suspension cultures. Biotechnology and Bioengineering, 95, 8–14. doi: 10.1002/bit.20934 [ Links ]
Kim, S. I., Choi, H. K., Kim, J. H., Lee, H. S., & Hong, S. S. (2001). Effect of osmotic pressure on paclitaxel production in suspension cell cultures of Taxus chinensis. Enzyme and Microbial Technology, 28, 202–209. doi: 10.1016/S0141–0229(00)00292–1 [ Links ]
Liao, Z., Chen, M., Sun, X., & Tang, K. (2006). Micropropagation of endangered plant species. Methods Molecular Biology, 318, 179–185. doi: 10.1385/1–59259–959–1:179 [ Links ]
Mirjalili, N., & Linden, J. C. (1996). Methyl jasmonate induced production of taxol in suspension cultures of Taxus cuspidata: Ethylene interaction and induction models. Biotechnology Progress, 12, 110–118. doi: 10.1021/ bp9500831 [ Links ]
Mulabagal, V., & Tsay, H. S. (2004). Plant Cell Cultures–an alternative and efficient source for the production of biologically important secondary metabolites. International Journal of Applied Science and Engineering, 2, 29–48. [ Links ]
Murashige, T., & Skoog F. (1962). A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiologia Plantarum, 15, 473–497. doi: 10.1111/j.1399–3054.1962.tb08052.x [ Links ]
Navia–Osorio, A., Garden, H., Cusido, R. M., Palazon, J., Alfermann, A. W., & Piñol, M. T. (2002). Taxol and baccatin III production in suspension cultures of Taxus baccata and Taxus wallichiana in an airlift bioreactor. Journal of Plant Physiology, 159, 97–102. doi: 10.1078/01761617–00576 [ Links ]
Nguyen, T., Eshraghi, J., Gonyea, G., Ream, R., & Smith, R. (2001). Studies on factors influencing stability and recovery of paclitaxel from suspension media and cultures of Taxus uspidate cv Densiformis by Highperformance liquid chromatography. Journal of Chromatography A, 911, 55–61. doi: 10.1016/S00219673(00)01272–3 [ Links ]
Nicolaou, K. C., Yang, Z., & Liu, J. J. (1994). Total synthesis of taxol. Nature, 367, 630–634. doi: 10.1038/367630a0 [ Links ]
Parkin, D. M., Bray, F., Ferlay, J., & Pisani, P. (2005). Global cancer statistics 2002. CA: A Cancer Journal for Clinicians, 55, 74–108. [ Links ]
Schoendorf, A., Rithner, C. H. D., Williams, R., & Croteau, R. B. (2000). Molecular cloning of a Citochrome p450 taxane 10β–hydroxylase cDNA from Taxus and functional expression in yeast. Proceedings of the National Academy of Sciences. 98, 1501–1506. doi: 10.1073/pnas.98.4.1501 [ Links ]
Son, S. H., Choi, S. M., Lee, Y. H., Choi, K. B., Yun, S. R., Kim, J. K.,. Park, Y. G. (2000). Large–scale growth and taxane production in cell cultures of Taxus cuspidate (Japanese yew) using a novel bioreactor. Plant Cell Reports, 19, 628–633. doi: 10.1007/s002990050784 [ Links ]
Soto, M., Sanjurjo, M., González, M., Cruz, D., & Giral, F. (2000). El tejo mexicano (Taxus globosa Sch.). Potencial de su aprovechamiento en taxol. Ciencia Ergo Sum, 7, 277–279. [ Links ]
Tabata, H. (2006). Production of paclitaxel and the related Tax–anes by cell suspension cultures of Taxus species. Current Drug Targets, 7, 453–461. doi: 10.2174/138945006776359368 [ Links ]
Vander, V. D. G., George, G. I., Gollapudi, S. R., Jampani, H. B., Liang, X. Z., Mitscher, L. A., & Ye, Q. M. (1994). Wallifoliol, a taxol congener with a novel carbon skeleton, from Himalayan Taxus wallichiana. Journal of Natural Products, 57(6), 862–867. doi: 10.1021/np50108a032 [ Links ]
Vongpaseuth, K., & Roberts, S. C. (2007). Advancements in the understanding of paclitaxel metabolism in tissue culture. Current Pharmaceutical Biotechnology, 8, 219–236. doi: 10.2174/138920107781387393 [ Links ]
Walker, K., & Croteau R. (2001). Taxol biosynthetic genes. Phytochemistry, 58, 1–7. doi: 10.1016/S00319422(01)00160–1 [ Links ]
Walker, K., Long, R., & Croteau, R. (2002). The final acylation step in taxol biosynthesis: Cloning of the taxoid C13–side–chain N–benzoyltransferase from Taxus. Proceedings of the National Academy of Sciences, 99, 9166–9171. doi: 10.1073/pnas.082115799 [ Links ]
Walker, K., Klettke, K., Akiyama, T., & Croteau, R. B. (2004). Cloning, heterologous expression, and characterization of a phenylalanine aminomutase involved in taxol biosynthesis. The Journal of Biological Chemistry, 279, 53947–53954. doi: 10.1074/jbc.M411215200 [ Links ]
Wang, C., Wu, J., & Mei, X. (2001). Enhancement of taxol production and excretion in Taxus chinensis cell culture by fungal elicitation and medium renewal. Applied Microbiology and Biotechnology, 55, 404–410. doi: 10.1007/s002530000567 [ Links ]
Wani, M. C., Taylor, H. L., & Wall, M. E. (1971). Plant antitumor agents VI. The isolation and structure of taxol, a novel antileukemic and antitumor agent from Taxus trevifolia. Journal of the American Chemical Society, 93, 2325–2327. doi:10.1021/ja00738a045 [ Links ]
Wheeler, A. L., Long, R. M., Ketchum, R. E., Rithner, C. D., Williams, R. M., & Croteau, R. (2001). Taxol biosynthesis: Differential transformations of taxadien–5α–ol and its acetate ester by Citochrome p450 hydroxylases from Taxus suspension cells. Archives of Biochemistry and Biophysics, 390, 265–278. doi: 10.1006/ abbi.2001.2377 [ Links ]
Wickremesinhe, E. R. M., & Arteca, R. N. (1994). Taxus cell suspension cultures: Optimizing growth and taxol production. Journal of Plant Physiology. 144, 183–188. doi: 10.1016/S0176–1617(11)80541–9} [ Links ]
Wildung, M. R., & Croteau, R. (1996). A cDNA clone for taxadiene synthase, the diterpene cyclase that catalyzes the committed step of taxol biosynthesis. The Journal of Biological Chemistry, 271, 9201–9204. doi: 10.1074/ jbc.271.16.9201 [ Links ]
Zavala, C. F., Soto, H. M., & Rodríguez, M. T. (2001). El romerillo (Taxus globosa Schlecht.): Biología, dificultades y perspectivas de uso. Revista Chapingo Serie Horticultura, 7(1), 77–94. [ Links ]
Zhang, B., Maiti, A., Shively, S., Lakhani, F., McDonald, J. G., & Bruce, J. (2005). Microtubule–binding drugs offset tau sequestration by stabilizing microtubules and reversing fast axonal transport deficits in a tauopathy model. Proceedings of the National Academy of Sciences, 102(1), 227–231. doi: 10.1073/pnas.0406361102 [ Links ]
Zhang, C. H., Wu, J. Y., & He, G. Y. (2002). Effects of inoculum size and age on biomass growth and paclitaxel production of elicitor–treated Taxus yunnanensis cell cultures. Applied Microbiology and Biotechnology, 60, 396–402. doi: 10.1007/s00253–002–1130–5 [ Links ]
Zhong, J. J. (2002). Plant cell culture for production of paclitaxel and other taxanes. Journal of Bioscience and Bioengineering, 94, 591–599. doi: 10.1016/S13891723(02)80200–6 [ Links ]
Zulak, K. G., & Bohlmann, J. (2010). Terpenoid biosynthesis and specialized vascular cells of conifer defense. Journal of Integrative Plant Biology, 52(1), 86–97. doi: 10.1111/j.1744–7909.2010.00910.x [ Links ]














