A pesar de la importancia de los pastizales, éstos enfrentan una problemática en su estructura y funcionalidad ecológica (Evans et al. 2011). En el estado de Chihuahua, estos problemas incluyen cambios de uso de suelo (Pool et al. 2014), fragmentación (Curtin et al. 2002, Manjarrez-Domínguez et al. 2015), invasión de plantas exóticas (Ortega-Santos et al. 2013), sobrepastoreo (Melgoza-Castillo et al. 2014), entre otros. Aunado a estos problemas, todos los ecosistemas están sujetos a los efectos del cambio climático (Zanin & Mangabeira-Alberna 2016, Yao et al. 2019). Los cambios rápidos en temperatura y la reducción de precipitación darán como resultado importantes recambios en la estructura vegetal e indudablemente cambios en la funcionalidad de los ecosistemas (Evans et al. 2011). Así, los servicios del ecosistema se verán afectados tanto en cantidad como en calidad, con repercusiones en la calidad de vida del ser humano (Havstad et al. 2007, Ceballos et al. 2010).
En la restauración de la funcionalidad de los ecosistemas, solo en el oeste de los Estados Unidos de América se requieren anualmente cientos de toneladas de semilla de plantas nativas que representan un gasto de millones de dólares (Knutson et al. 2009, Kildisheva et al. 2016). La riqueza florística de México representa un potencial para evaluar, así como nuevos mercados por explorar. En el caso específico de gramíneas, a nivel nacional se han reportado 1,416 taxones (Sánchez-Ken 2019) y en el estado de Chihuahua 421 (Herrera & Peterson 2018). Un primer paso es tener el conocimiento sobre la biología de la semilla de plantas potenciales para la restauración e información básica para incrementar sus probabilidades de éxito (Panchal et al. 2011, Aires et al. 2013, Mummey et al. 2016, Kildisheva et al. 2018). Además, esta información puede apoyar al entendimiento de comportamientos invasivos de algunas especies de plantas (Wilsey & Polley 2006, Xu et al. 2019).
La germinación de semillas y el establecimiento de plántulas son etapas críticas en las plantas, especialmente en ambientes áridos (Bewley et al. 2013, Baskin & Baskin 2014). Entre otros factores, el porcentaje de germinación de las semillas depende de: la etapa fenológica de la planta al momento de colecta, las condiciones ambientales locales y tiempo de cosecha, así como las condiciones de almacenamiento (Panchal et al. 2011; Bewley et al. 2013). Por otra parte, características como la velocidad y la uniformidad de la germinación y un rápido desarrollo de las plántulas están relacionadas con características adaptativas de las poblaciones (Bewley et al. 2013; Baskin & Baskin 2014, Mummey et al. 2016, Duchini et al. 2018).
En plantas silvestres de Australia, Jurado & Westoby (1992) clasificaron en tres categorías la germinación de 150 especies. Dentro de estas, la germinación rápida ocurre cuando el 50 % de la semilla germina en los primeros tres días, media cuando este porcentaje se presentaba entre el día cuatro y seis, y lenta del día siete al nueve. De este trabajo se concluye que las especies con rápida germinación aprovechan los periodos cortos de humedad; sin embargo, las de lenta germinación mantienen bancos de semilla en el suelo debido a la incertidumbre de la humedad suficiente para lograr el establecimiento. Liu et al. (2014), en 70 especies de herbáceas del desierto de Gurbantunggut en China, encontraron que el primer día de germinación varió de 1 a 27 días; si bien alrededor de la mitad germinó en los primeros días. Otras evaluaciones de plantas de zonas áridas de México (Contreras-Quiroz 2012) y Australia (Commander et al. 2009) han reportado la germinación en los primeros días.
Un aspecto importante en el establecimiento de plántulas de gramíneas, especialmente en zonas áridas, es la rapidez con la que la radícula se desarrolla para utilizar la humedad disponible (Prado-Tarango et al. 2019). En estas zonas, aun durante la época de lluvias, se han reportado entre 19 y 25 días sin humedad y lluvias ligeras de 8 a 10 mm (Esqueda-Coronado et al. 2005, Prado-Tarango et al. 2019). Mummey et al. (2016) probaron varias poblaciones de la gramínea Poa secunda para reestablecerla en áreas invadidas con Bromus tectorum, con base en los resultados, la población identificada como High Plains fue seleccionada para programas de restauración debido a su rápida germinación de semillas y crecimiento de raíz. Schantz & Espeland (2016) encontraron que la gramínea invasora Bromus inermis germinó dos días antes y cinco veces más que la nativa Pascopyrum smithii. Bajo este esquema, una restauración de la gramínea nativa no tendría éxito, por lo que se deben de seleccionar otras especies que puedan desarrollarse más rápidamente u otras prácticas para reducir la presencia de la especie invasora.
El conocimiento de la biología de la germinación de gramíneas del Desierto Chihuahuense puede ser utilizada tanto para programas de propagación como en el control de gramíneas exóticas invasoras. La hipótesis de esta investigación es que cada especie tiene características de germinación que determinan el éxito de su establecimiento en pastizales naturales. El objetivo de este trabajo es evaluar algunas características de germinación de semillas y de desarrollo de plántulas en 22 especies de gramíneas presentes en el Desierto Chihuahuense bajo condiciones de humedad controlada.
Materiales y Métodos
Especies estudiadas. Las especies evaluadas se muestran en la Tabla 1, con información sobre el origen (nativo o introducido) y el ciclo de vida (anual o perenne). Se recolectaron de 10 a 50 gramos de semillas de por lo menos 20 plantas de cada especie durante la etapa de madurez de las gramíneas, etapa en la que se considera que la semilla se encuentra en madurez fisiológica y lista para reproducirse. La fecha de colecta se inició durante el mes de octubre del año 2016 en diferentes predios ganaderos del estado de Chihuahua y concluyó durante el mes de noviembre del 2017; por lo que al momento de ser realizados los experimentos las semillas tenían de 2 a 3 años. Durante este tiempo, las semillas se almacenaron en bolsas de papel bajo condiciones de laboratorio a una temperatura de 24 °C. Antes de las evaluaciones, las semillas se limpiaron para obtener sólo la cariópside.
Tabla 1 Especies utilizadas en las pruebas de germinación y algunas de sus características
| Especie | Origen* | Ciclo# |
|---|---|---|
| Bouteloua curtipendula (Michx.) Torr. | N | P |
| Bouteloua dactyloides (Nutt.) Columbus | N | P |
| Bouteloua eriopoda (Torr.) Torr. | N | P |
| Bouteloua gracilis (Kunth) Lag. ex Griffiths | N | P |
| Bouteloua hirsuta Lag. | N | P |
| Bouteloua repens (Kunth) Scribn. & Merr. | N | P |
| Bouteloua rigidiseta (Steud.) Hitchc. | N | P |
| Digitaria californica (Benth.) Henrard | N | P |
| Heteropogon contortus (L.) P. Beauv. ex Roem. & Schult. | N | P |
| Hilaria mutica (Buckley) Benth. | N | P |
| Leptochloa dubia (Kunth) Nees | N | P |
| Muhlenbergia emersleyi Vasey | N | P |
| Muhlenbergia macroura (Humb., Bonpl. & Kunth) Hitchc. | N | P |
| Muhlenbergia rigida (Kunth) Kunth | N | P |
| Pappophorum bicolor E. Fourn. | N | P |
| Chloris virgata Sw. | N | A |
| Eragrostis curvula (Schrad.) Nees | I | P |
| Eragrostis echinochloidea Stapf | I | P |
| Eragrostis lehmanniana Nees | I | P |
| Eragrostis superba Peyr. | I | P |
| Pennisetum ciliare (L.) Link | I | P |
| Melinis repens (Willd.) Zizka | I | A/P |
*Origen: N = Nativo, I = Introducido. #Ciclo: A = Anual, P = Perenne.
Trabajo de laboratorio. Para cada especie se utilizaron cuatro cajas Petri con 25 semillas en un sustrato de algodón y papel filtro. Las cajas Petri fueron colocadas en una germinadora marca Precision Scientific modelo 6M a una temperatura constante de 27 ± 2 °C y en obscuridad. Las semillas se mantuvieron a humedad constante con agua destilada. Diariamente se realizaron observaciones para cuantificar semillas germinadas. Se consideró una semilla germinada cuando la radícula presentaba al menos 2 mm de largo. Una vez cuantificada, la semilla germinada después de siete días fue eliminada de la caja Petri para facilitar posteriores conteos. La prueba de germinación se realizó durante un período de 28 d.
Variables evaluadas. El porcentaje de germinación estándar se obtuvo con la siguiente fórmula.
Los rangos de germinación (RG) se clasificaron en rápida, media y lenta con relación al tiempo que la semilla es expuesta a la humedad (Jurado & Westoby 1992). La germinación rápida (R) ocurre cuando al menos el 50 % de las semillas germinan durante los primeros tres días con humedad. Media (M) cuando el 50 % germina entre el cuarto y séptimo día y lenta (L) cuando el 50 % de la germinación se presenta después del día siete.
La velocidad de germinación (VG) se obtuvo con base en la fórmula de Maguire (1962):
Donde:
Gi: |
Representa el número semillas germinadas en el día i-ésimo. |
Ni: |
Representa el número de días desde el inicio del ensayo de germinación. |
El índice de germinación (IG) se calculó utilizando la fórmula propuesta por Scott et al. (1984).
Donde:
Ti: |
Representa el número de días desde el inicio del ensayo de germinación. |
Ni: |
Representa el número semillas germinadas en el día i-ésimo. |
S: |
Representa el número total de semillas utilizadas |
El tiempo de germinación se cuantificó con base en las observaciones diarias. El tiempo total promedio que la semilla de cada especie tarda para germinar (TG) se calculó a partir del primer día de germinación (PDG) y el último día que se observó semillas germinadas (UDG). En al menos tres plántulas con una semana de crecimiento se midió con una regla milimétrica el largo de raíz y plúmula (tallo) para obtener la proporción Raíz:Tallo (R:T).
Análisis estadístico. En el desarrollo del trabajo se utilizó un diseño completamente al azar con cuatro repeticiones por especie. Los datos se sometieron a un análisis de varianza. Para el análisis de VG, IG, PDG, UDG, TG y proporción R:T se utilizó el modelo lineal general (GLM) y para la separación de medias con la prueba de Tukey del paquete estadístico SAS versión 9.3 (SAS 2006).
Resultados
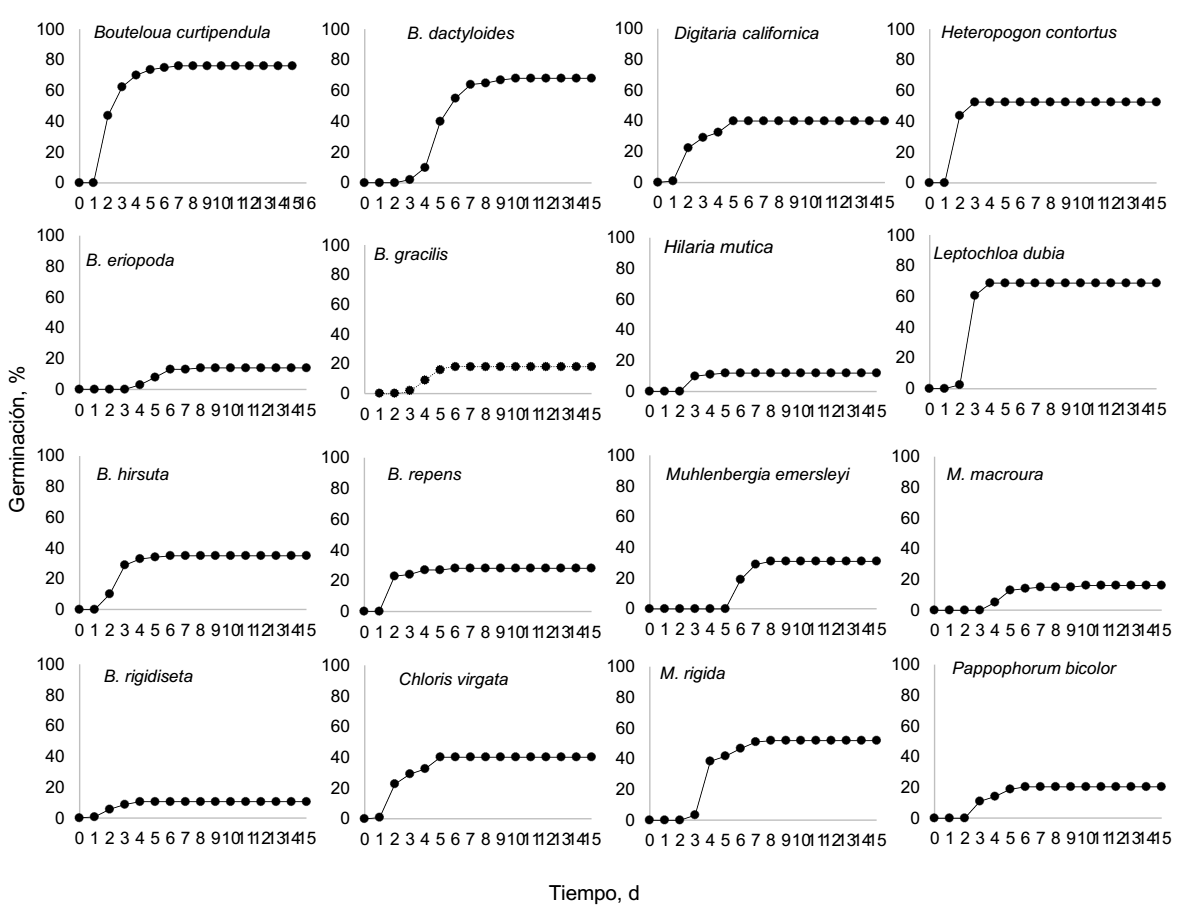
Germinación estándar. El porcentaje de germinación presentó una amplia variación entre las especies, sin un patrón claro entre las nativas y las exóticas. Las Figuras 1 y 2 muestran la germinación acumulada para las especies nativas y exóticas, respectivamente. El porcentaje de germinación varió de 3.75 % en Eragrostis lehmanniana hasta 76.3 % en Bouteloua curtipendula. No se presentaron valores de germinación de 100 % para ninguna de las especies evaluadas. Para ambos tipos de gramíneas utilizadas, exóticas y nativas, alrededor de la mitad de las especies presentaron valores superiores al 50 %.
Rango de Germinación (RG). Con base en el método de Jurado & Westoby (1992), en este estudio la mitad de las especies exóticas y nativas presenta germinación rápida. La otra mitad presentó germinación media y ninguna germinación lenta (Tabla 2).
Tabla 2 Análisis de comparación de medias (± EE) de diferentes parámetros de germinación y crecimiento en gramíneas presentes en el Desierto Chihuahuense
| Especies | RG | VG, semillas día-1 |
IG | PDG, días | UDG, días | TG, días | R:T | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Bouteloua curtipendula | R | 7.8 | ± | 0.8 | a | 2.1 | ± | 0.2 | bc | 2.0 | ± | 0.0 | d | 5.0 | ± | 1.0 | bcde | 4.0 | ± | 0.7 | abcde | 0.6 | ± | 0.1 | def |
| B. dactyloides | M | 3.2 | ± | 0.3 | ef | 3.3 | ± | 0.3 | a | 4.0 | ± | 0.5 | abcd | 9.0 | ± | 1.0 | a | 6.0 | ± | 0.7 | a | 0.9 | ± | 2.0 | cdef |
| B. eriopoda | M | 0.7 | ± | 0.1 | h | 0.8 | ± | 0.2 | efgh | 5.0 | ± | 0.3 | abc | 6.0 | ± | 1.0 | abcd | 3.0 | ± | 0.9 | cde | 1.8 | ± | 0.2 | bcd |
| B. gracilis | M | 1.0 | ± | 0.1 | h | 0.8 | ± | 0.2 | efgh | 4.0 | ± | 0.4 | bcd | 5.0 | ± | 1.0 | abcd | 3.0 | ± | 0.5 | cde | 1.4 | ± | 0.2 | bcdef |
| B. hirsuta | R | 1.4 | ± | 0.6 | fgh | 0.7 | ± | 0.3 | efgh | 3.0 | ± | 0.9 | bcd | 4.0 | ± | 1.0 | de | 2.0 | ± | 0.4 | de | 0.6 | ± | 0.2 | def |
| B. repens | R | 3.2 | ± | 0.4 | ef | 0.7 | ± | 0.1 | efgh | 2.0 | ± | 0.0 | d | 5.0 | ± | 1.0 | bcde | 4.0 | ± | 0.5 | abcde | 0.4 | ± | 0.0 | ef |
| B. rigidiseta | R | 1.2 | ± | 0.2 | gh | 0.3 | ± | 0.0 | fgh | 2.0 | ± | 0.3 | d | 4.0 | ± | 0.0 | cde | 3.0 | ± | 0.4 | bcde | 0.4 | ± | 0.1 | ef |
| Digitaria californica | M | 1.5 | ± | 0.2 | fgh | 0.9 | ± | 0.1 | efgh | 3.0 | ± | 0.0 | bcd | 6.0 | ± | 1.0 | abcd | 4.0 | ± | 0.5 | abcde | 2.0 | ± | 0.3 | bc |
| Heteropogon contortus | R | 6.2 | ± | 0.6 | ab | 1.1 | ± | 0.1 | efgh | 2.0 | ± | 0.0 | d | 3.0 | ± | 0.0 | de | 2.0 | ± | 0.0 | de | 0.8 | ± | 0.1 | cdef |
| Hilaria mutica | R | 1.0 | ± | 0.2 | h | 0.4 | ± | 0.1 | fgh | 3.0 | ± | 0.0 | bcd | 4.0 | ± | 1.0 | cde | 2.0 | ± | 0.5 | de | 1.0 | ± | 0.2 | cdef |
| Leptochloa dubia | R | 5.7 | ± | 0.3 | bc | 2.1 | ± | 0.1 | bc | 2.0 | ± | 0.3 | cd | 4.0 | ± | 0.0 | cde | 3.0 | ± | 0.3 | cde | 1.2 | ± | 0.1 | cdef |
| Muhlenbergia emersleyi | M | 1.2 | ± | 0.3 | gh | 1.5 | ± | 0.2 | cde | 6.0 | ± | 0.0 | a | 8.0 | ± | 0.0 | ab | 3.0 | ± | 0.3 | cde | 1.8 | ± | 0.4 | bcde |
| M. macroura | M | 0.8 | ± | 0.2 | h | 0.8 | ± | 0.2 | efgh | 5.0 | ± | 0.8 | ab | 6.0 | ± | 1.0 | abcd | 3.0 | ± | 0.6 | cde | 0.3 | ± | 0.0 | f |
| M. rigida | M | 3.0 | ± | 0.3 | efg | 2.1 | ± | 0.2 | bc | 3.0 | ± | 0.3 | bcd | 7.0 | ± | 0.0 | abc | 5.0 | ± | 0.3 | abc | 4.0 | ± | 0.6 | a |
| Pappophorum bicolor | M | 1.4 | ± | 0.4 | fgh | 0.8 | ± | 0.2 | efgh | 4.0 | ± | 0.5 | bcd | 5.0 | ± | 1.0 | bcde | 2.0 | ± | 0.4 | de | 0.7 | ± | 0.1 | def |
| Chloris virgata | R | 4.1 | ± | 0.8 | cde | 1.2 | ± | 0.3 | def | 2.0 | ± | 0.3 | d | 5.0 | ± | 0.0 | bcde | 4.0 | ± | 0.3 | abcd | 0.6 | ± | 0.1 | def |
| Eragrostis curvula | R | 5.3 | ± | 0.2 | bcd | 2.6 | ± | 0.1 | ab | 3.0 | ± | 0.0 | bcd | 7.0 | ± | 1.0 | abc | 5.0 | ± | 0.6 | abc | 1.1 | ± | 0.1 | cdef |
| E. echinochloidea | R | 0.5 | ± | 0.2 | h | 0.1 | ± | 0.1 | h | 2.0 | ± | 0.5 | d | 2.0 | ± | 0.0 | e | 2.0 | ± | 0.3 | e | 0.4 | ± | 0.2 | ef |
| E. lehmanniana | M | 0.3 | ± | 0.2 | h | 0.2 | ± | 0.2 | gh | 4.0 | ± | 1.4 | abcd | 5.0 | ± | 1.0 | bcde | 2.0 | ± | 0.5 | de | 0.8 | ± | 0.3 | cdef |
| E. superba | M | 3.7 | ± | 0.2 | de | 1.9 | ± | 0.1 | bcd | 2.0 | ± | 0.3 | cd | 6.0 | ± | 0.0 | abcd | 4.0 | ± | 0.5 | abcd | 1.2 | ± | 0.1 | cdef |
| Pennisetum ciliare | M | 3.1 | ± | 0 | efg | 2.4 | ± | 0.3 | bc | 3.0 | ± | 0.0 | bcd | 8.0 | ± | 0.0 | ab | 6.0 | ± | 0.3 | ab | 1.0 | ± | 0.1 | cdef |
| Melinis repens | R | 1.3 | ± | 0.4 | fgh | 0.5 | ± | 0.1 | fgh | 3.0 | ± | 0.3 | bcd | 5.0 | ± | 1.0 | bcde | 4.0 | ± | 1.0 | abcde | 2.7 | ± | 0.6 | ab |
RG= Rango de Germinación: Rápida (R), Mediana (M) y Lenta (L) (Jurado & Westoby, 1992); VG = Velocidad de Germinación; PDG = Primer Día de Germinación; UDG = Último Día de Germinación; TG = Tiempo de Germinación; R:T = Proporción Raiz:Tallo, abc Literales diferentes denotan diferencia estadística dentro de columnas (P < 0.05).
Velocidad de Germinación (VG). Los mayores valores de VG (P < 0.05) se presentaron en las especies nativas Bouteloua curtipendula con 7.72, Heteropogon contortus con 6.6 y Leptochloa dubia con 5.66, así como la exótica Eragrostis curvula con 5.3 semillas germinados por día. Las especies nativas con menores VG (P < 0.05) fueron Bouteloua eriopoda con 0.68, Muhlenbergia macroura con 0.81 e Hilaria mutica con 0.95 semillas germinadas día-1; las exóticas fueron Eragrostis echinochloidea con 0.54 y E. lehmanniana con 0.31 semillas germinados por día.
Índice de Germinación (IG). Los mayores IG en especies nativas se obtuvieron en B. curtipendula, B. dactyloides, L. dubia y M. rigida, con 2.09, 3.28, 2.12 y 2.13, respectivamente (Tabla 2). Las especies exóticas con mayores IG fueron E. curvula y Pennisetum ciliare, con 2.86 y 2.37, respectivamente. Las especies nativas con bajos IG fueron B. rigidiseta e Hilaria mutica con 0.28 y 0.39, respectivamente. Las especies exóticas con bajos IG fueron E. curvula, E. lehmanniana y Melinis repens con 0.12, 0.24 y 0.48, respectivamente.
Tiempo de Germinación (TG). Esta variable indica la extensión en días desde que se observó la primera germinación (PDG) y último día que una semilla germinó (UDG), dentro del período de la prueba (Tabla 2). El rango de días en que germinaron las semillas varió de 2 a 6 días. Ocho de las especies inciaron la germinación al segundo día y sólo una hasta el día 6; el resto germinó entre el rango de 2 a 6 días. El último día de germinación fue entre los 5 y 9 días.
Proporción Raiz:Tallo (R:T). Las proporciones de R:T variaron de 0.33 en Muhlenbergia macroura a 4.01 en M. rigida (Tabla 2). Seis especies nativas y tres exóticas presentaron proporción R:T mayor de 1, lo que representa una mayor inversión en la longitud de raíces con relación a la parte aérea.
Discusión
Con base en las variables evaluadas de germinación estándar, velocidad, tiempo y rango de germinación, no se observó algún patrón diferente de germinación entre especies nativas y exóticas. La variación en germinación es debida a múltiples factores, desde condiciones donde se produjo la semilla hasta el manejo de ésta una vez cosechada (Boeken et al. 2004, Panchal et al. 2011). La germinación reportada para algunas de las especies aquí evaluadas es similar a otros trabajos. Altos valores para las nativas Bouteloua curtipendula y Leptochloa dubia, 50 a 90 % (Tinsley et al. 2006, Ferrari & Parera 2015, Gallagher & Wagenius 2016) y bajos valores, de 3 a 30 %, en las especies exóticas Eragrostis lehmanniana y Melinis repens (Carrillo-Saucedo et al. 2009, Stokes et al. 2011). La cuantificación de la germinación es una variable de suma importancia en programas de restauración, ya que refleja la calidad de la semilla en un tiempo dado y, por lo tanto, cuanta semilla utilizar al momento de la resiembra (Shaban 2013, Rantala-Sykes & Campbell 2019).
El IG es una tasa y no un valor específico en porcentaje. Los valores bajos de IG se interpretan como períodos cortos de germinación y valores altos como periodos más largos (Scott et al. 1984). Los bajos valores le dan a la plántula la oportunidad de aprovechar períodos cortos de humedad, aunque la adaptación de las plantas en zonas áridas no depende de sólo una característica, sino de la combinación de varias estrategias.
Por otro lado, el tiempo y uniformidad de la germinación son características que dependen de la biología de las especies, no de las condiciones ambientales en un tiempo dado (Ranal & Garcia de Santana 2006, Bewley et al. 2013). Estas características son relevantes para entender el comportamiento de la germinación ante períodos cortos de humedad; algo común en zonas áridas. Así los valores altos de VG, proporción R:T y bajos en TG, especialmente, PDG se presentan en especies con ventajas competitivas en períodos cortos de humedad. Por otro lado, las especies que no presentan estas características pueden presentar otras estrategias como el mantener bancos de semilla en el suelo (Christoffoleti & Caetano 1998, Mayfield et al. 2014). La VG presentada por Bouteloua curtipendula (7.72 semillas germinadas día-1) podría ser aprovechada en eventos de humedad cortos y competir por nutrientes y espacio en el suelo. Para Eragrostis lehmanniana los valores de 0.31 le permitirían mantener bancos de semilla en el suelo, esto podría contribuir a su comportamiento invasivo ante eventos de precipitación incierta. Los resultados de proporción R:T concuerdan con lo reportado en otros estudios para especies como Eragrostis lehmanniana con 0.80, E. curvula con 1.05, Pennisetum ciliare con 1.72 a 2.00, Bouteloua dactyloides con 0.98, B. curtipendula con 0.86 y B. gracilis con 0.83 (Detling et al. 1979, Farooq et al. 2003, Wilsey & Polley 2006, Khan et al. 2009, Álvarez-Holguín et al. 2018). Las plantas con mayores proporciones R:T indican que pueden explorar más áreas en busca de humedad en suelo (Prado-Tarango et al. 2019).
La especie exótica Eragrostis curvula y las especies nativas Bouteloua curtipendula, Leptochloa dubia y Digitaria californica presentan una o más variables que las ubican con potencial para su rápido establecimiento. Estas especies tienen un buen valor forrajero y los patrones de germinación les dan ventajas competitivas para su uso en programas de resiembra de pastizales (Gutiérrez-Gutiérrez et al. 2019). Entre las variables que les dan este potencial está el alto número de semillas que germinaron por día y la rápida velocidad con que lo hicieron. Por otro lado, las exóticas consideradas invasoras en el Desierto Chihuahuense, Eragrostis echinochloidea, E. lehmanniana y Melinis repens, presentan en general valores en las variables evaluadas que no favorecen su rápido establecimiento. En especies invasoras se ha detreminado que la cantidad de semilla (Carrillo-Saucedo et al. 2009), la eficiencia fotositética (Heberling & Fridley 2013), el tamaño pequeño de la semilla, la poca profundidad de ésta en el suelo (Sonkoly et al. 2020), procesos evolutivos de la germinación (Xu et al. 2019), entre otros, contribuyen al comportamiento invasivo.
Este trabajo representa una línea base para el conocimiento de algunas especies silvestres, en algunas de ellas se evalúa su germinación por primera vez, y estos datos servirán para su posible uso en programas de restauración. Un siguiente paso es la evaluación de estas especies a rangos de temperatura y humedad. Además, es importante continuar con este tipo de estudios e incluir otras variables y sus interacciones para entender el éxito en el establecimiento o control de este grupo de plantas. Por otro lado, aún existe un gran número de especies nativas por evaluar y así contar con más opciones en programas de restauración.











 nueva página del texto (beta)
nueva página del texto (beta)